雄激素受体剪接突变体AR-V7的免疫荧光检测试剂盒及应用的制作方法
本发明涉及一种医用检测方法,特别涉及体液中的肿瘤细胞的检测,具体涉及人雄激素受体剪接突变体ar-v7免疫荧光检测试剂盒。适用于不同类型样本雄激素受体剪接突变体ar-v7检测,还涉及该试剂盒在检测雄激素受体剪接突变体ar-v7中的用途。
背景技术:
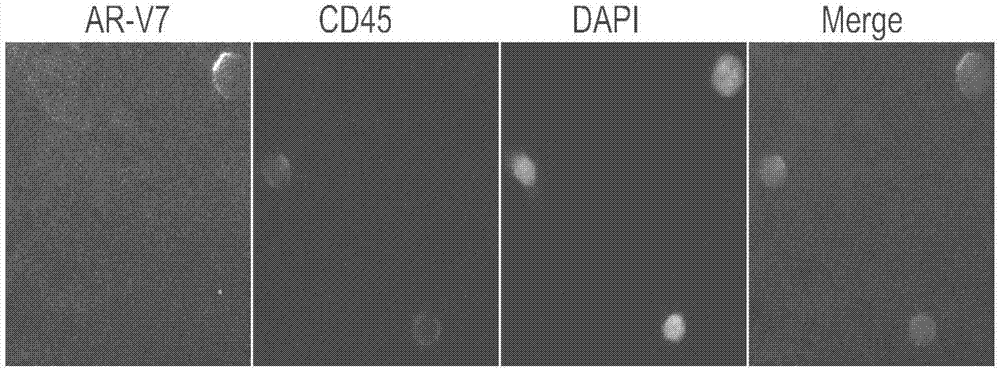
:前列腺癌指发生在前列腺的上皮性恶性肿瘤,被列为全球造成男性死亡的五大癌症之一。目前治疗前列腺癌的重要手段是雄激素剥夺治疗,即使用某些特异性的抑制剂阻断雄激素受体及其信号通路,从而延长患者存活。然而,多数患者在治疗后两年内会发展为去势抵抗性前列腺癌(castration-resistantprostatecancer,crpc),预后较差。ar-vs(androgenreceptorsplicevariants,ar-vs)是指在雄激素受体mrna的异常剪接或基因重组过程中产生的、在没有雄激素的情况下仍能促进靶基因转录的剪接突变体。在去势抵抗性前列腺癌患者中,ar-vs的出现,使得患者对抗前列腺癌药物产生耐药性,增加治愈难度。研究显示,ar-v7是目前已知的表达最为广泛的剪接突变体。taxynergy研究(antonarakises,etal.jclinoncol.2017)显示,在ar-v7阳性特别是定位于细胞核的阳性患者中,紫杉烷化疗比靶向雄激素受体的药物(enzalutamide或abiraterone)治疗更加有效;而在ar-v7阴性患者中,对靶向雄激素受体的药物enzalutamide和abiraterone的治疗更加敏感(antonarakises,etal.nengljmed.2014)。目前临床对肿瘤治疗的监测主要依赖于病理学、影像学和血清学三种方法。病理学是肿瘤诊断的金标准,但是组织取样具有一定的创伤性,且受限于取材部位,同时由于肿瘤组织的异质性,单点组织取样不足以反应整体肿瘤状态,且难以重复取样动态监测。影像学方法应用较广泛,但是影像学一般存在辐射伤害。而且,影像学通常只反应肿瘤大小等信息,难以判断肿瘤的恶性程度。更重要的一点,影像学通常只能检测2mm以上的肿瘤组织,对于较小的肿瘤组织诊断敏感性较差,存在滞后性。血清学检测取样较为方便,但是灵敏度和特异性较差,且与病理生理相关性差。同样的,在治疗方面,目前临床上也存在一定的局限性。对于肿瘤患者,特别是发生转移的患者,目前通常只依据原发灶的信息来判断治疗方案,忽略了对转移灶甚至微转移灶的检测与治疗。治疗过程中通过影像学或血清学来判断治疗疗效,在疗效判断的精准性等方面存在一定的局限。目前针对ar-v7的检测多在患者组织样本或外周血样中,利用pcr方法对其mrna水平进行测定(antonarakises,etal.nengljmed.2014;seitzak,etal.eururol.2017),然而部分研究(takeuchit,etal.resrepurol,2016)发现:在正常造血细胞中亦能检测到ar-v7的mrna,因此ar-v7mrna水平的变化与患者的药物反应并不完全一致。组织中ar-v7的免疫组化检测是在不同组织切片上进行的,然而由于肿瘤细胞异质性的原因,单张片子上ar-v7并不能反映患者整体的ar-v7表达水平。因此需要一种新的方法对与疾病复发、转移相关的肿瘤细胞的ar-v7表达水平进行检测,用于预测特定药物对患者的治疗作用,为疾病治疗方案的选择提供参考。以循环肿瘤细胞(circulatingtumorcell,ctc)为主的体液肿瘤细胞的检测可为上述局限性提供一些解决方案。ctc是指在肿瘤形成或进展过程中从原发灶或转移灶脱落进入血液循环的肿瘤细胞,ctc的检出提示体内原发灶或转移灶的存在,或癌前病变细胞的存在,是转移病灶形成的“种子”细胞,是肿瘤发生发展的直接证据。近年来不断有证据显示:在肿瘤发生发展的早期,甚至是影像学可见病灶形成之前肿瘤就播散入血了,这种播散可能存在于肿瘤发展的整个过程中。所以,对ctc进行检测有利于早期发现肿瘤、辅助诊断或为选择治疗方案提供参考。同时,对ctc进行动态检测可了解患者对治疗药物的敏感性,及早发现耐药信号。体液性有核细胞指生物体液内含有的有核细胞,也包括这些细胞在病理情况下的渗出或漏出,如血液、炎性渗出液中的各种白细胞;非体液性稀有有核细胞是指体液内出现的非正常的稀有有核细胞,包含ctc、循环肿瘤干细胞(circulatingtumorcell,csc),胸/腹腔积液、灌洗液、心包积液、脑脊液、尿液、引流液、痰液、前列腺液、精液、骨髓、脐带血、羊水等来源的肿瘤细胞,以及血中的胎儿细胞。对非体液性稀有有核细胞进行检测,可为患者诊断、治疗提供更全面的信息。发明目的:本发明中的试剂盒可检测前列腺癌非体液性稀有有核细胞中ar-v7的表达水平来对前列腺癌患者的用药提供参考性的意见。通过针对ar-v7的特异性抗体来对患者非体液性稀有有核细胞进行分型,通过对ar-v7阳性细胞的数量和其ar-v7的表达水平、细胞内定位来对前列腺癌的用药提供参考性的意见。目前肿瘤患者的病理检测,主要是进行组织学检测,面临着反复取样困难,不能动态监测,单个组织样本不足以反映整体肿瘤负荷等不足,不能实时有效的反映进入体液的非体液性稀有有核细胞变化。本发明中通过免疫荧光染色对患者的非体液性稀有有核细胞中ar-v7的蛋白表达水平进行检测,实时监测其动态变化,可以更精准的反映患者的疾病负荷。从而为采取不同的治疗方案提供更多的依据。本发明在对非体液性稀有有核细胞计数的基础上可同时对此类细胞中ar-v7的蛋白表达水平进行检测,并分析ar-v7的细胞定位。本发明可对包括组织、血液、细胞系、积液、灌洗液、前列腺液、尿液、引流液等来源的非体液性稀有有核细胞进行检测。技术实现要素:针对现有技术的不足,本发明提供一种检测人雄激素受体剪接突变体ar-v7的方法及其试剂盒。现有技术尚无采用免疫荧光方法检测非体液性稀有有核细胞中ar-v7表达的报道。本发明所述方法,检测原理如下:首先采用已知的方法富集非体液性稀有有核细胞,其中所述富集方法可以采用中国专利200810097889.4、201310057307.0、2015104411229中描述的方法。然后根据抗原抗体反应原理,采用已知的免疫荧光检测方法,检测富集的细胞中目的蛋白在细胞中的表达。本试剂盒通过对靶标细胞和白细胞共同抗原cd45进行荧光标记,通过筛选目的蛋白阳性、cd45阴性的细胞,从而对血液中特定蛋白阳性的非体液性稀有有核细胞进行判读和计数。在此基础上,将靶蛋白阳性、cd45阴性的候选非体液性稀有有核细胞按照目的蛋白荧光强度将其表达按照高、中、低表达进行分类。但将免疫荧光检测方法用于检测非体液性稀有有核细胞中ar-v7表达在实践中遇到诸多困难,包括:细胞容易从玻片脱落、荧光较弱、非特异染色、基质背景高等。本发明经过多次筛选研究,最终得到一种适合的方法,解决了上述困难,同时在实践过程中,意外的发现,本发明的检测结果和现有技术相比检测精度和准确率大大提高。本发明的检测方法,步骤如下:2)稀有有核细胞的富集取血液和其他体液样品,对其中的非体液性稀有有核细胞可进行富集,其中所述富集,方法可选用任何一种稀有有核细胞的分离富集方法,选自:红细胞去除、阴性富集、阳性富集、密度梯度分离法、膜过滤法、微流控法、流式细胞技术等;也可以不经富集将血标本涂于多张载玻片。其中所述稀有有核细胞:是一种非正常生理状态下出现的稀有有核细胞,通常使用流式细胞仪分选、磁珠阳性分选方法富集得到,优选的使用阴性富集方法得到,本发明最佳方法如下:使用去除血浆、红细胞、白细胞的阴性富集方法获得各种亚型的异常细胞;使用室温或类似条件使玻片自然干燥;使用固定剂固定细胞及抗原。富集后的样本采用固定液固定,所述固定液选自:乙醇、甲醇、福尔马林、丙酮、冰醋酸、甲醛、多聚甲醛、戊二醛、丙烯醛、苦味酸、plp液(过碘酸盐-赖氨酸-多聚甲醛固定液)、ecd-g液(碳二亚酰胺-戊二醛)等。在后续检测步骤中也可以采用这些试剂进行后固定。2)将富集的稀有有核细胞进行免疫荧光检测,免疫荧光检测方法步骤如下:2.1cyp1洗载玻片3min×3次,每次100~150μl,确保覆盖满整个标本区;2.2吸去载玻片上多余液体,加入cypp作用5min,cyp1同上洗片3min×1次;吸去多余液体,加200μl冰丙酮∶甲醇(7∶3)作用5min,cyp1洗片3min×3次,吸去多余水分;2.3加100~150μl封闭液室温封闭20~30min。吸去多余封闭液,加100~150μl稀释好的ar-v7抗体和cd45抗体,室温湿盒内避光孵育1~2h;(cd45抗体也可在2.5加入)。2.4避光,取cyp2100~150μl/片洗片3min×3次,吸去多余水分;2.5加100~150μl稀释好的荧光二抗,湿盒内避光孵育(37℃,25~30min或室温30~60min)。cyp2洗3min×4次,吸去多余水分。2.6复染:取10μldapi染液,加至标本区。2.7盖上盖玻片,并吸去周边液体。镜下观察或置于2~8℃或-20℃环境下避光保存。3)对样本进行镜检观察将标本置于荧光显微镜下,扫描整个标本区。若发现片状或者圈状信号时,切换至高倍镜下进一步鉴定。记录每个阳性细胞的坐标,并且40×物镜分别在不同通道下拍照。必要时可使用油镜观察。4)结果判断阳性细胞:目的蛋白荧光信号阳性且无血源性白细胞表面抗原荧光信号的有核细胞,记为一个阳性细胞。同时记录阳性信号的细胞定位。阴性细胞:细胞有血源性白细胞表面抗原荧光信号,不论目的蛋白是否有荧光均记为阴性。以上步骤中,需要使用到荧光素,其可以直接标记在抗体上或者通过荧光标记的第二抗体进行检测;标记抗体的荧光素具有不同的发射光谱,优选绿色荧光(如alexafluor488)、橘色荧光(如alexafluor555)、红色(如alexafluor594)或深红色荧光(如alexafluor647)的组合;标记抗体的荧光素不限于alexafluor系列荧光素,同样可以采用dylight、华青染料、异硫氰酸荧光素(fluoresceinisothiocynate,fitc)、生物素(biotin)、量子点、texasred、藻红蛋白(pe)、藻蓝蛋白(apc)、罗丹明(rhodamine)等系列的荧光素标记抗体,或者不同系列的荧光素标记抗体联用。cd45抗体是针对白细胞通用抗原的抗体,用于排除血源性细胞,也可以选自以下细胞表面抗原的抗体:cd3、cd11b、cd14、cd16、cd19、cd34、cd35、cd36、cd38、cd41、cd58、cd61、cd66b、cd235a;在组织或者细胞系上进行免疫荧光检测可以省略cd45抗体。本发明的检测方法包含手工和自动化设备的操作。本发明的检测方法可以与荧光原位杂交(fish)技术联用,步骤为以下任一种:(i):先用免疫荧光检测再进行荧光原位杂交;(ii):先用荧光原位杂交再进行免疫荧光检测;(iii):同时进行免疫荧光检测和荧光原位杂交。本检测过程使用的缓冲液cyp1、cyp2、cypp中含有表面活性剂和蛋白保护剂,这些表面活性剂可以采用0~10%的tritonx-100、saponin、tween、np-40、sds、聚乙二醇;蛋白保护剂可采用0~10%的bsa、海藻糖(trehalose)、蔗糖。作为本领域技术人员公知的,本检测过程使用的封闭液也可以选用:动物血清、0.5%~10%bsa、fc受体抗体。作为本领域技术人员公知的,本检测过程可使用修复方法对样品进行处理,包含酶消化修复、edta修复、高压修复、微波修复等。本检测过程使用的核染料不限于dapi,同样可以采用hoechst、碘化丙啶等。作为本领域技术人员公知的,免疫荧光检测中特异抗体与细胞的孵育过程可分为液体染色和固体染色。液体染色是将细胞制备成细胞悬液,在悬液中进行细胞透化、抗体孵育等操作,然后将细胞转移至载玻片固定、封片;而固体染色是先将细胞转移至载玻片固定,再进行细胞透化、抗体孵育等操作。本发明为进行上述免疫荧光检测,设计了一种便于操作的试剂盒,所述试剂盒中包括了上述免疫荧光检测步骤中的主要试剂,如以下试剂:缓冲液cyp1、cyp2、cypp、封闭液,ar-v7特异性抗体以及相应的荧光二抗,荧光标记的cd45抗体,抗体稀释液,细胞核染色液,操作过程中所涉及的对照细胞可以包含或者不包含在试剂盒中。本发明所述试剂盒优选以下组分:名称数量单位总体积/质量cyp11瓶80mlcyp21瓶15mlcypp1管1.5ml封闭液1管1mlar-v7抗体1管100μlcd45抗体1管100μl荧光二抗1管100μl抗体稀释液1管1mldapi1管100μl以下对本发明试剂进行名称术语的解释:本试剂盒中ar-v7抗体针对的ar-v7序列,属于已知序列,公开在guoz,etal..cancerres.2009mar15;69(6):2305-13.文献中名称为ar3。本发明的核心技术在于步骤2)将富集的稀有有核细胞进行免疫荧光检测,其中的涂片方法是本发明人经过多次实验和数据筛选获得的,有关条件的筛选过程如下:步骤2.2中,吸去载玻片上多余液体,加入cypp作用5min,加100~150μl封闭液室温封闭20~30min;筛选过程如下:测试不同类型和不同浓度梯度的穿透试剂,不同的后固定试剂、封闭时间最终筛选到适合的反应条件。步骤2.3中,加100~150μl稀释好的ar-v7抗体和cd45抗体,室温湿盒内避光孵育1~2h;筛选过程如下:测试不同抗体浓度、孵育温度、孵育时间、洗片液,最终筛选到适合的反应条件。步骤2.5中加100~150μl稀释好的荧光二抗,湿盒内避光孵育(37℃,25~30min或室温30~60min)。筛选过程如下:测试不同抗体浓度、孵育温度、孵育时间、洗片液,最终筛选到适合的反应条件。经过上述筛选,得到本发明的涂片条件和方法,所得结果检测精度和准确率大大提高。本发明的试剂盒主要用于检测血液、灌洗液、前列腺液、精液、尿液、引流液等中的非体液性稀有有核细胞。也可应用于细胞片如涂片/爬片、组织的免疫荧光检测等。本发明的试剂盒,可以适用于多种癌症细胞。癌症可包括以下至少一种:乳腺癌、食管癌、胃癌、结肠癌、肺癌、子宫内膜癌、前列腺癌、睾丸癌、脑癌、皮肤癌、直肠癌、肉瘤、气管癌、头颈癌、胰腺癌、肝癌、卵巢癌、淋巴癌、宫颈癌、外阴癌、黑素瘤、间皮瘤、肾癌、膀胱癌、甲状腺癌、骨癌、癌、肉瘤和软组织癌。以下通过实验数据进一步说明本发明的有益效果:本发明的有益效果:与现有技术根据肿瘤组织中mrna表达情况来指导用药相比,本发明的检测结果可以对用药进行实时指导,不仅能够反映整体肿瘤(包括原位癌和可能存在的不可见的微小转移灶)负荷,同样可以反映体液中易发生转移的非体液性稀有有核细胞中ar-v7的表达情况,从而更精准的用于用药指导。与现有技术对肿瘤组织中ar-v7进行免疫组化检测相比,对非体液性稀有有核细胞中ar-v7细胞进行计数和表达量、细胞定位进行区分,能够更精准的反映ar-v7与临床参数的相关性和指导用药。与现有技术相比较,本发明所采用的样本是各种体液来源的细胞,在取材上比基于肿瘤组织的检测技术更加方便。与现有技术在肿瘤组织中检测蛋白表达相比,采用免疫荧光对非体液性稀有有核细胞中ar-v7的表达水平、细胞定位加以检测,可以对这些细胞进行表型分析。附图说明:图1为同一样品的4种荧光显示图,分别为靶蛋白ar-v7、白细胞通用抗原cd45、细胞核染料dapi、合图。具体实施方式:实施例1材料:阴性富集的血液样本涂片、对照细胞可用22rv1涂片。实验步骤:1.抽取3.5ml外周血于acd(柠檬酸钠)抗凝管中。用的人外周血白细胞去除试剂盒阴性富集肿瘤细胞,并固定于载玻片;2.cyp1洗载玻片3min×3次,每次100~150μl,确保覆盖满整个标本区;3.吸去载玻片上多余液体,加入cypp作用5min,cyp1同上洗片3min×1次;吸去多余液体,加200μl冰丙酮∶甲醇(7∶3)作用5min,cyp1洗片3min×3次,吸去多余水分;4.加100~150μl封闭液室温封闭25~30min。吸去多余封闭液,加100μl稀释好的ar-v7抗体和cd45抗体,室温湿盒内避光孵育1.5~2h:5.避光,取cyp2100~150μl/片洗片3min×3次,吸去多余水分;6.加100μl稀释好的二抗,湿盒内避光孵育(37℃,25~30min)。cyp2洗3min×4次,吸去多余水分。7.复染:将dapi管瞬时离心后,液面处取10μldapi染液,加至标本区。8.盖片:盖上盖玻片,镜下观察。将ar-v7表达阳性、cd45抗体阴性的细胞视为阳性细胞(图1),并记录ar-v7阳性细胞的靶蛋白定位。实施例2材料:适量抗凝血液1管,采用膜过滤方法富集后对其进行蛋白检测实验步骤:1.抽取适量外周血放入含有抗凝剂采血管中,轻微震荡混匀。2.将混悬液加入膜过滤分离肿瘤细胞技术装置中,缓慢通过滤器和滤膜。3.待过滤完毕后,继续在膜过滤装置中加入50ml0.01mpbs,将管壁周围附着的细胞混悬液冲入膜过滤装置内,让其通过滤器和滤膜;4.固定滤膜上的细胞;5.同实施例1操作检测蛋白。实施例3材料:适量抗凝血液1管,采用微流控方法富集后对其进行蛋白检测实验步骤:1.抽取的适量血液采用各种原理的微流控芯片进行富集。2.富集后样本进行蛋白免疫荧光检测。实施例4材料:冰冻组织切片实验步骤:1.由冰冻切片机中取出载有切片的载玻片,放入湿盒中。2.待载玻片达到室温且未干时,加cyp1于切片上洗载玻片3~5次;3.吸去多余液体,加cypp孵育,cyp1洗片;4.吸去多余液体,加封闭液室温封闭;5.吸去多余封闭液,加稀释好的ar-v7抗体,室温避光孵育适当时间;6.避光,cyp2洗片,吸去多余水分;7.加稀释好的二抗,避光孵育适当时间。8.cyp2洗片,吸去多余水分。9.加10μldapi,封片镜检。根据细胞形态和ar-v7表达判断是否为阳性细胞。实施例5材料:阴性富集的血液样本涂片,荧光原位杂交试剂盒实验步骤:1.富集后的涂片采用37℃预热的2×ssc洗涤;2.梯度乙醇脱水;3.在载玻片上滴加10μl的荧光探针,盖上盖玻片,四周加封片胶封片;4.杂交,76℃变性10min,37℃杂交1.5h;5.撕去封片胶,在43℃预热的甲酰胺中甩掉盖玻片;6.依次采用预热的甲酰胺和2×ssc洗涤;7.按照实施例1步骤进行免疫荧光检测。8.显微镜读片,分别记录ftsh信号多体、cd45表达阴性的细胞和目的蛋白表达阳性、cd45表达阴性的细胞。结果说明:实施例6材料:阴性富集的血液样本涂片,荧光原位杂交试剂实验步骤:1.按照实施例1进行免疫荧光检测,读片;2.免疫荧光检测后在2×ssc中甩去盖玻片,按照实施例5进行fish杂交;3.fish杂交、洗涤后,dapi封片,镜检,分别记录fish信号多体、cd45表达阴性的细胞和目的蛋白表达阳性、cd45表达阴性的细胞。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1