一种用于质谱流式技术的检测方法与流程
本发明涉及生物医药领域,具体涉及一种用于质谱流式技术的检测方法。
背景技术:
质谱流式技术(masscytometry)集成了质谱和流式细胞仪的原理,实现了对单细胞进行多参数检测。它继承了传统流式细胞仪的高速分析的特点,又具有质谱检测的高分辨能力以及多样化数据处理等技术优势,是近年发展起来的一种新型单细胞分析技术。质谱细胞仪较传统荧光流式细胞仪测量的参数多且通道之间没有干扰,并且不需要进行荧光补偿计算,大幅拓展了单样本的数据产出量和检测范围,使数据更全面,结果更可靠,已成为单细胞分析的一个新方向。
质谱流式技术可以用来对细胞亚群进行精细的免疫分型,全面分析细胞内的信号通路,对样本能进行高通量多参数的检测,目前已在血液、干细胞、免疫、癌症及药物筛选等领域有着广泛的应用。
技术实现要素:
本发明目的在于提供一种用于质谱流式技术的检测方法。所述的检测方法把不同barcode编码的细胞混合在一起进行抗体染色,具有良好的染色效果,且方法简便、经济、实用性强、实验效率和可靠性较高。
为实现上述发明目的,本发明采用的技术方案是:
一种用于质谱流式技术的检测方法包括以下步骤:
a.取待检测的细胞至ep管中,离心洗涤细胞,弃上清;
b.区分细胞死活:加入染死活试剂,4℃孵育5分钟;
c.洗涤:加入流式缓冲液重悬细胞,离心洗涤细胞,弃上清;
d.固定:加入固定液重悬细胞,室温孵育10分钟;
e.洗涤:加入流式缓冲液重悬细胞,离心洗涤细胞,弃上清;
f.用冻存液重悬细胞,转移至冻存管中,放入梯度冻存盒中,-80℃冰箱保存;
g.复苏细胞:从-80℃冰箱取出后复苏细胞;
h.将细胞转入ep管中,流式缓冲液离心洗涤细胞,弃上清;
i.barcode:配置barcodemix,每个ep管的样品加入一种barcodingmix重悬细胞,各样品中所加barcodingmix各不相同;
j.洗涤:加入流式缓冲液重悬细胞后,离心洗涤细胞,弃上清;
k.将不同样品混在一起后,离心洗涤细胞,弃上清;
l.封闭:加入封闭液后,4℃孵育20分钟;
m.胞外染色:加入细胞表面抗原的金属标记抗体,4℃孵育30分钟;
n.洗涤:加入流式缓冲液,离心洗涤细胞,弃上清;
o.配置固定试剂,固定染dna,放入4℃冰箱过夜;
p.洗涤:加入通透液,离心洗涤细胞,弃上清;
q.重悬:加入foxp3buffer重悬细胞,室温孵育20分钟;
r.洗涤:加入通透液,离心洗涤细胞,弃上清;
s.胞内染色:加入胞内抗原的金属标记抗体,4℃孵育30分钟;
t.洗涤:加入流式缓冲液,离心洗涤细胞,弃上清;
u.上机:用双蒸水洗涤后将样品放入质谱细胞仪中进行检测并分析。
上述技术方案中,所述的流式缓冲液配方为含质量浓度分别为0.5%bsa和0.02%叠氮钠的1×pbs。
在步骤a、c中,所述离心转速为400g,离心时间均为5分钟;步骤e、h、j、k、n、p、r、t中,所述离心转速为800g,离心时间为5分钟。
所述步骤i中barcodemix选自104pd/105pd,104pd/106pd,104pd/108pd,104pd/110pd,105pd/106pd,105pd/108pd,105pd/110pd,106pd/108pd,106pd/110pd,108pd/110pd。
所述步骤l,封闭液含有humanigg,mouseigg,hamsterigg和ratigg。
与现有技术相比,本发明具有的有益效果为:本申请提供的质谱流式技术的检测方法,通过将细胞先进行固定处理后再抗体染色处理,并且将不同的样品混合后同时进行抗体染色,可实现检测通量大,精确度高,且人为因素影响较小。具有以下创新点:
1)与常规的质谱流式检测方法相比,需要更少的细胞数,并且有效减少了由于连续操作过程中细胞的损失;
2)一份抗体可以对几组样品同时染色,大幅减少了抗体的使用量,降低实验成本;
3)有效避免了不同时间点染色造成的实验差异。
综上,本发明通过对细胞固定,barcode等关键技术细节进行优选限定,建立了稳定规范的技术流程。该方法大大提高了样本单次实验可以检测标志物的数量,传统方法需要多次才能完成的染色操作,现在将不同barcode样品混在一起,一次性完成染色,高效的对单细胞进行多参数分析,以最少的细胞数,产出了最大的数据量。在提高样本信息量的同时,既节约了珍贵的生物样本,又去除了管间变异,并且简化了工作流程,大幅缩短手动操作时间。
因此,本发明方法具有良好的应用前景和推广价值,具有突出的实质性特点和显著的进步。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明进一步的详细描述:
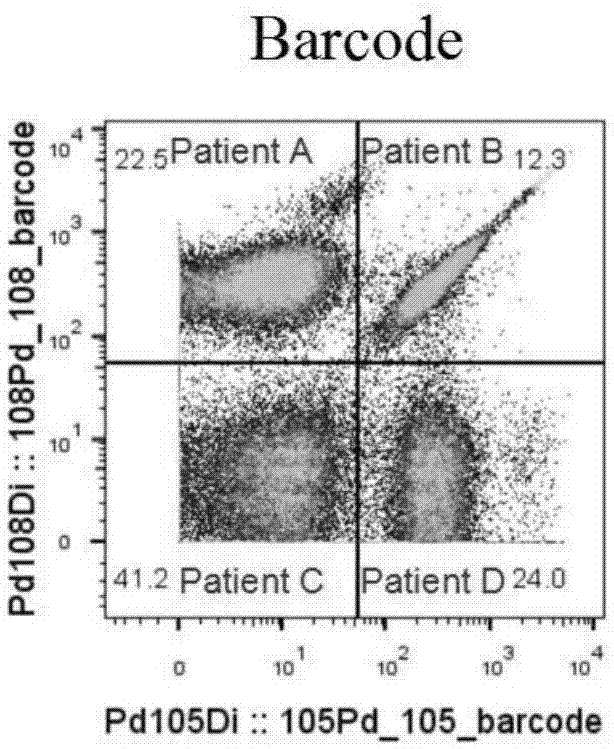
图1是采用本发明方法barcode分析图;
图2是采用本发明方法染色的pbmc细胞的质谱流式图;
图3是采用fluidigm公司方法染色的pbmc细胞的质谱流式图。
具体实施方式
下面结合附图和实施例对本发明作进一步说明,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本实施例采用本发明的质谱流式技术的检测方法对人的pbmc细胞进行cd3、ki67和cd19染色,采用质谱流式细胞仪检测,并与fluidigm公司方法进行比较。
实验对象:志愿者的外周血
实验试剂:固定液,固定/通透液,通透液,barcode试剂,固定试剂均为fluidigm公司产品。foxp3buffer为ebioscience公司产品。
实验设备:质谱流式仪为fluidigm公司产品。
实验方法包括以下步骤:
a.edta或肝素钠抗凝管静脉全血,ficoll密度梯度离心法分离外周血单个核细胞(peripheralbloodmononuclearcell,pbmc),并计数,取适量的细胞至ep管中,离心洗涤细胞,弃上清;
b.区分细胞死活:加入染死活试剂,4℃孵育5分钟;
c.洗涤:加入流式缓冲液重悬细胞,离心洗涤细胞,弃上清;
d.固定:加入固定液重悬细胞,室温孵育10分钟;
e.洗涤:加入流式缓冲液重悬细胞,离心洗涤细胞,弃上清;
f.用冻存液重悬细胞,转移至冻存管中,放入梯度冻存盒中,-80℃冰箱保存;
g.复苏细胞:从-80℃冰箱取出后复苏细胞;
h.将细胞转入ep管中,流式缓冲液离心洗涤细胞,弃上清;
i.barcode:配置barcodemix,每个样品加入一种barcodingmix重悬细胞;
j.洗涤:加入流式缓冲液重悬细胞后,离心洗涤细胞,弃上清;
k.将不同样品混在一起后,离心洗涤细胞,弃上清;
l.封闭:加入封闭液后,4℃孵育20分钟;
m.胞外染色:加入细胞表面抗原的金属标记抗体cd3和cd19,4℃孵育30分钟;
n.洗涤:加入流式缓冲液,离心洗涤细胞,弃上清;
o.配置固定试剂,固定染dna,放入4℃冰箱过夜;
p.洗涤:加入通透液,离心洗涤细胞,弃上清;
q.重悬:加入foxp3buffer重悬细胞,室温孵育20分钟;
r.洗涤:加入通透液,离心洗涤细胞,弃上清;
s.胞内染色:加入胞内抗原的金属标记抗体ki67,4℃孵育30分钟;
t.洗涤:加入流式缓冲液,离心洗涤细胞,弃上清;
u.上机:用双蒸水洗涤后将样品放入质谱细胞仪中进行检测并分析。
实验结果:采用本发明方法,通过barcode,可以有效的区分不同样本的来源,图1所示,patienta,b,c,d代表四个病人的细胞群体,本方法与fluidigm公司方法(即常规的质谱细胞仪检测方法)染色的pbmc的质谱流式细胞图分别见图2、图3,如图所示,两种方法检测结果基本一致。
表1采用本发明方法与fluidigm公司方法染色的检测结果比较
结论:本发明方法通过barcode编码不同人的细胞,在数据分析时可以很好的区分不同病人,并且具有良好的染色效果,可以用于胞外和胞内染色。
以上说明是对具体的实施例来说明和描述本发明,用于帮助理解本发明的方法及思想。在本发明的精神和权利要求的保护范围内,对本发明作出的任何修改和改变,都落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!