一种检测赤霉素发酵液中藤仓赤霉菌活性菌体量的方法与流程
本发明涉及发酵技术领域,具体涉及一种检测赤霉素发酵液中藤仓赤霉菌活性菌体量的方法。
背景技术:
赤霉素作为一类天然的植物生长调节剂,经受过了长时间的验证,在农业、林业、园艺等生产中得到了广泛应用,具有很高的经济价值和商业前景。目前,商品化的赤霉素主要为ga3,ga4和ga7三种,其中ga3是国内外应用最广泛的赤霉素产品。我国是赤霉素生产与出口大国,对赤霉素相关的科研投入持续了半个多世纪。藤仓赤霉菌(fusariumfujikuroi)是赤霉素工业生产用的唯一菌种。目前的生产水平赤霉素的效价达到2000μg/ml左右。
有效的生物量测量方法是发酵生产监控、过程分析以及科学研究的重要工具,传统的生物量测量方法主要有干重法、浊度法和细胞计数法。但是,目前赤霉素工业生产的发酵培养基主要包括淀粉、米粉、豆粕、花生粉等粮食作物的混合物,由于配方中存在大量的淀粉,花生粉、豆粕等不溶物质,它们跟藤仓赤霉菌混在一起很难分开,消亡的细胞对测量也会有影响,同时鉴于其本身丝状真菌的物理性状,上述方法均不适用测量发酵液中藤仓赤霉菌的生物量。
赤霉素是藤仓赤霉菌发酵生产的独有的关键产品,因藤仓赤霉菌本身的形态以及赤霉素发酵生产条件的特殊性,至今尚未有有效的、适用的生物量检测方法。
四唑盐2,3-双(2-甲氧基-4-硝基-5-磺基苯基)-2h-四唑-5-甲酰苯胺(xtt)能够迅速渗透到完整的细胞中,在线粒体脱氢酶和电子偶联剂作下,转化为黄红色水溶性的甲瓒化合物。该方法被用于定量检测悬浮细胞的生物量、生物膜的形成、微生物的抗生素耐药性等等。尽管xtt检测法已有报道,但是不同菌种对xtt试剂存在着较大的差异性,因此针对不同的检测菌种,有针对性地进行方法优化与建立是极有必要的。截止目前,针对藤仓赤霉菌的xtt检测法尚未见报道。
技术实现要素:
本发明的目的在于提供一种检测赤霉素发酵液中藤仓赤霉菌活性菌体量的方法,以解决因赤霉素发酵培养基中包含大量不溶性物质,成分复杂以及藤仓赤霉菌本身丝状真菌的物理性状导致的难以有效准确检测发酵生产过程中生物量的问题。
为实现上述目的,本发明采用如下技术方案:
一种检测赤霉素发酵液中藤仓赤霉菌活性菌体量的方法,包括以下步骤:
(1)取待测发酵液与预配的xtt-甲萘醌显色试剂混合形成反应体系,经温育制得待测液;
(2)利用分光光度计测量待测液在450nm处的光密度od450;
(3)测得的od450数值直接用于表征待测发酵液中的藤仓赤霉菌活性菌体量;
或者根据公式w=5.57×10-6e1.3816m+4.5×10-6,其中w为细胞干重,单位为g、m为od450读数,计算待测发酵液中的细胞干重,表征藤仓赤霉菌活性菌体量。
所述藤仓赤霉菌为保藏号为cgmccno.11101的藤仓镰刀菌(fusariumfujikuroi)。其发酵培养基中包括玉米粉7.5%;米粉8.75%;豆粕0.5%;花生粉0.5%;kh2po40.05%;mgso40.05%;k2so40.05%。
本发明研究表明xtt-甲萘醌检测法测得的光密度od450数值与发酵液中的藤仓赤霉菌生物量呈良好的线性关系,因此,可以利用检测的od450直接用于表征发酵液中生物量,为发酵生产过程提供有效的分析数据。比如在发酵生产过程中连续取样检测od450,即可得出发酵过程中生物量的变化趋势。
作为优选,步骤(1)中,反应体系中xtt的终浓度为100-500μg/ml,甲萘醌终浓度为1-25μm。
更为优选,步骤(1)中,反应体系中xtt的终浓度为200μg/ml,甲萘醌终浓度为5μm。本发明根据数值的稳定性、检测的敏感度、时效性和性价比筛选得到上述配比,在该条件下的读数均没有超出一般分光光度计(如moleculardevice,spectramaxm5)的线性测量极限(od值等于3)。
作为优选,待测发酵液与预配的xtt-甲萘醌显色试剂等体积混合。具体地,将100μl待测液与100μlxtt-甲萘醌显色试剂在96孔平底微量滴定板中混合。本发明提供的测定方法综合利用多孔板、酶标仪等高通量仪器,属于高通量检测范畴,可以加快菌体量的测定。
作为优选,所述温育的条件为25-30℃下温育15-180分钟。
更为优选,所述温育的条件为28℃下温育60分钟。
作为优选,步骤(1)中,所述待测液先进行离心后取上清液再测定光密度值,所述离心的条件为转速3000-4000rpm,离心时间为1-3分钟。通过离心可完全清除可视范围内的不溶性物质,检测到的光密度值能够更准确地反映出菌体生物量。更为优选,离心条件为3500rpm离心1分钟。
与现有技术相比,本发明的有益效果主要体现在:
(1)本发明提供了一种能够快速测定发酵液中藤仓赤霉菌菌体量的方法,利用在一定条件下,四唑盐2,3-双(2-甲氧基-4-硝基-5-磺基苯基)-2h-四唑-5-甲酰苯胺(xtt)能够迅速渗透到完整的细胞中并转化为水溶性的物质,并且在电子偶联剂存在下,线粒体脱氢酶作用于xtt,产生黄红色的化合物,该方法只针对活性生物量进行,大大降低了赤霉素发酵液中不溶性物质、死细胞残体、丝状菌体的物理性质对检测的干扰,能够准确反映赤霉素发酵液中藤仓赤霉菌菌体量。
(2)本发明提供的检测方法操作简便易行,无需洗涤细胞,检测敏感度高,且可重复,适用于藤仓赤霉菌发酵生产以及科学研究过程中所需的活性菌体量测定。
附图说明
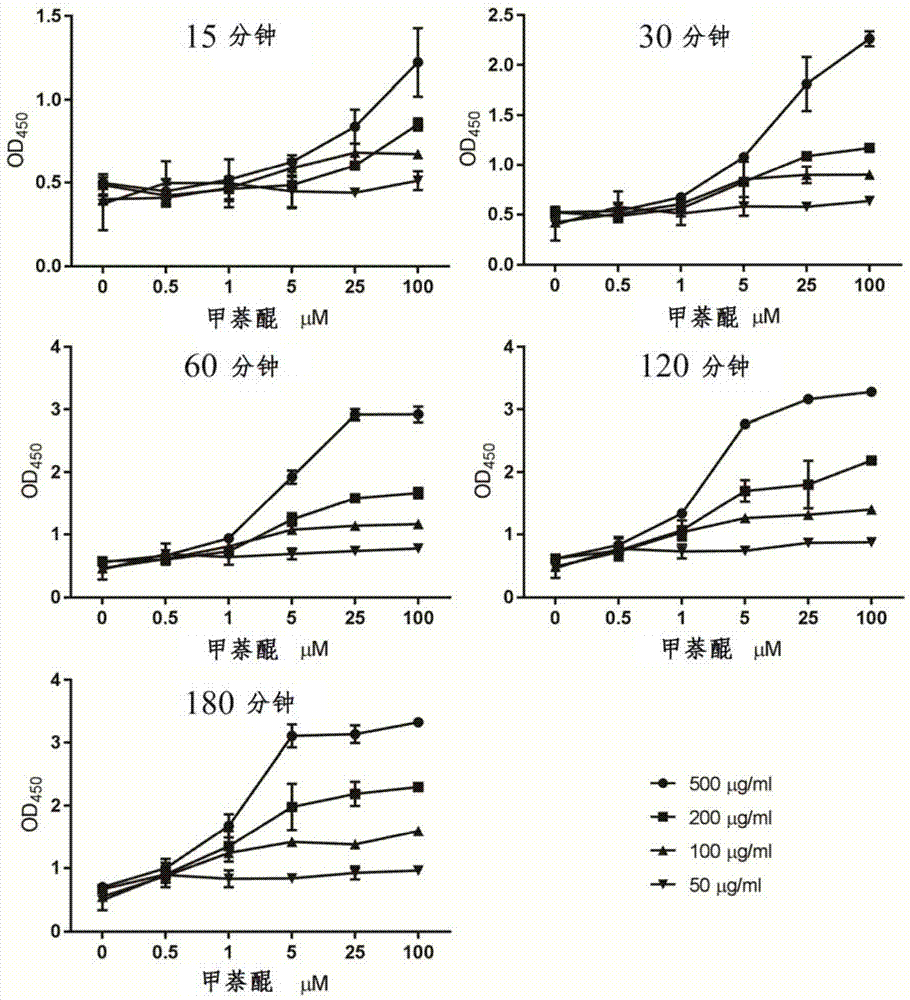
图1为不同反应时间、不同xtt浓度及不同甲萘醌浓度下的od450吸光值。
图2为不同稀释倍数与od450(a)、稀释倍数与菌体干重(b)之间的关系曲线。
图3为藤仓赤霉菌生长9天中xtt法测定的的菌体量od450曲线图,其中(a)为发酵菌液,(b)为发酵菌液离心后取上清液。
图4为发酵9天内发酵培养基中还原糖含量变化曲线。
图5为发酵9天赤霉素ga3的产量曲线。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
藤仓镰刀菌(fusariumfujikuroi),保藏号:cgmccno.11101,专利公开号:cn107177659a。
实施例1xtt-甲萘醌试剂显色法快速测定菌体量
1、培养基的配制:
1)pda配方:200g的马铃薯,20g葡萄糖(蔗糖),20g琼脂,1000ml水,ph6.5(加琼脂可配固体培养基,水都为超纯水)。
配置pda过程:首先将马铃薯去皮去芽,切成玉米大小片块状,称取200g,加入1000ml的水,煮沸15min左右至呈土豆糊状。用双层纱布过滤得到滤液,取滤液补足至1000ml(若配固体培养基,加琼脂,熔化),加入其它营养分子物质,调节ph值至6.5左右,保持中性,分类装于试管,塞上棉塞,捆扎后灭菌,制成斜面培养基,随后检查灭菌效果。
2)ypd:酵母提取物10g/l;蛋白胨20g/l;葡萄糖20g/l。
配置:加入1g酵母提取物,2g蛋白胨,2g葡萄糖,再加入95ml超纯水,之后包扎完成在灭菌锅灭菌(115℃,30分钟),常温保存即可。
2、预先配制xtt-甲萘醌显色试剂
设计不同比例的xtt,甲萘醌,其中xtt浓度(μg/ml)采用:1000、400、200、100;甲萘醌浓度采用(μm)200、50、10、2、1、0。
3、测定步骤:
细胞在ypd培养基中于28℃培养24小时。在96孔平底微量滴定板中加入100μl细胞培养物和100μl不同浓度的xtt-甲萘醌显色实际,然后将微量滴定板在28℃温育至3小时。
其中在温育15、30、60、120、180分钟后,分别通过分光光度计测量450nm处的光密度(od450)。xtt测定一式三份进行,并计算出平均值。
4、显色体系的优化:
设计不同比例的xtt,甲萘醌和反应时间,其中xtt最终浓度(μg/ml)采用:500、200、100、50,甲萘醌浓度采用(μm)100、25、5、1、0.5、0,反应时间(分钟)采用15、30、60、120、180,结果如图1所示。
测试反应液的od450吸光值,确定最佳xtt-甲萘醌配比以及反应时间分别为200μg/mlxtt、5μm甲萘醌和1小时(见图1)。
5、显色法读数与细胞干重的线性关系:
细胞在ypd培养基中于28℃条件下生长2天,并进行2倍梯度,稀释按稀释梯度:2、4、8、16、32倍稀释。预先制备含有400μg/mlxtt和10μm甲萘醌的xtt-甲萘醌显色试剂。将100μl稀释的细胞与100μlxtt-甲萘醌试剂在96孔平底微量滴定板中混合。在28℃温育15、30或60分钟后,通过分光光度计(moleculardevice,spectramaxm5)测量450nm波长下的光密度(od450)。
细胞干重测量:取20ml稀释后的各浓度菌液通过滤膜离心,并放在滤膜上,在恒温箱内干燥后测其重量,减去滤纸质量即为细胞干重。
所得od450光密度与稀释倍数,及稀释倍数与干重均成良好的线性关系。r2揭示线性拟合度良好,并且随着温浴时间的增加,线性斜率增加,反应敏感性增加(见图2)。
干重与稀释倍数之间的关系式为:w=0.0523t+0.0009;稀释倍数与od450读数的关系方程为:t=0.0213e1.3816m,因为干重样本与od450样本存在200(20ml与100μl)倍的差异,因此替代后,方程式为:w=5.57×10-6e1.3816m+4.5×10-6,其中w为细胞干重(g),t为稀释倍数,m为od450读数。
实施例2发酵过程中活性菌体量、赤霉素含量及还原糖含量的测定
1、培养液的配制
1)种子液:玉米粉2%;蔗糖1.5%;花生粉1.5%;豆粕0.1%;k2po40.1%;mgso40.1%;ph自然灭菌条件:121℃,30分钟。
配置:将所有的试剂按配比配置后,放入灭菌锅灭菌,自然冷却之后在超净台接种,在28℃恒温培养室的摇床内放置48小时。
2)发酵液:玉米粉7.5%;米粉8.75%;豆粕0.5%;kh2po40.05%;mgso40.05%;k2so40.05%;ph自然灭菌条件;121℃,30分钟。
配置:将玉米淀粉和米粉按配方配好后,加入千分之一淀粉酶,在80℃水浴锅内水浴30分钟,取出后待冷却后加入剩下试剂(按配方),搅拌均匀之后包扎完毕灭菌锅灭菌,常温保存即可。
2、菌种活化和发酵培养
(1)从甘油管中接种藤仓镰刀菌至pda斜面培养基,28℃恒温培养箱培养3~5天。
(2)种子液的培养:从步骤(1)中的pda斜面培养基取一块菌落接种至种子培养基中,并于28℃、220rpm培养2天;
(3)发酵培养:将步骤(2)中的菌悬液吸取2.5ml到发酵培养基中,并于28℃、220rpm培养9天,并每天取样获得待测菌液,取部分菌液以转速12000rpm离心1分钟,吸取上清液;
3、xtt活性菌体量的测定
预先制备含有400μg/mlxtt和10μm甲萘醌的xtt-甲萘醌显色试剂。取步骤2中获得的菌液,显色试剂:菌液=100μl:100μl混合于96孔平底微量滴定板中,在28℃条件下温育60分钟后,通过分光光度计检测od450的光密度为“粗读数”,读完后立刻以转速3500rpm离心1分钟,取100μl上清液,置于新的96孔平底微量滴定板中检测od450的光密度为“精读数”(见图3)。
“粗读数”与“精读数”两种读数趋势相近,但“粗读数”背景值偏高,可分别作定性与定量检测使用。
“精读数”读取的操作过程可以完全排除不溶性组份(包括菌丝体、死细胞残体、淀粉与豆粕等残渣)对吸光值测量的误差。测量结果显示,“精读数”的背景吸光值十分低,也证明了这一点。“粗读数”与“精读数”两种读数趋势相近,说明了“粗读数”有一定的借鉴意义。鉴于“精读数”需要额外的离心、转移步骤,“粗读数”仍然可作为发酵状态的一个估值使用。然而,在发酵后期“粗读数”与“精读数”的演变趋势有所差异,可能是后期的菌丝残体与其他不溶性组份的复杂变化对光学吸收的影响所致,因此“粗读数”存在一定的使用限制,而“精读数”排除了以上因素,可以提供与菌体量变化相一致的绝对值。此外xtt反应依赖于活性线粒体脱氢酶,可以排除凋亡细胞对本反应的影响,使读数进一步精确化。
作为参照,未接种的培养基在相同条件下与xtt-甲萘醌预制剂进行配比、混合并温浴足够长的时间(3小时,远超设定的反应时间),混合液未见颜色变化,可以排除培养基中植物来源的玉米粉,花生粉,豆粕等不同成份对xtt反应的影响。
4、还原糖含量的测定
取步骤2中的上清,用葡萄糖测定试剂盒(产品号e1010,applygentechnologiesinc.北京)测定每天发酵液中还原糖的含量。具体测定方法如下:
1)首先配置工作液:按4:1比例,取8ml试剂r1与2ml试剂r2混合得到10ml工作溶液。
2)标准品稀释:10mm葡萄糖标准品用蒸馏水稀释为2000、1000、500、250、125μm。
3)样品和稀释后标准品的测定:①参见下表1加样。先加标准品或待测样品,后加工作溶液。②37℃反应20分钟(15~30分钟)或25℃室温反应30分钟但灵敏度略降。反应平衡后颜色在60分钟内稳定。③先用蒸馏水+工作液空白管调零,然后测定各管od550。
表1
4)绘制标准曲线并计算葡萄糖浓度:各标准管od值为y轴,浓度为x轴。通过microsoftofficeexcel软件绘制图表,并根据线性趋势线获得线性方程及拟合度参数r2。根据所得到的标准曲线计算样品溶液中还原糖的含量(见图4);
藤仓赤霉菌只有通过水解淀粉为还原糖后才能实现对淀粉的吸收和利用,因此还原糖(此处以葡萄糖进行计数)的变化趋势从侧面反映了菌体量的变化。如图4所示,葡萄糖含量在发酵第二天达到最高值,结合发酵过程中的菌体量检测,在发酵在第二天完成了指数增长,菌体量达到最大值,此时的淀粉水解酶活性最高,因此,菌体量与所测得的葡萄糖含量变化完全吻合。而在发酵进行到第三天以后,淀粉基本耗尽,同时也因为其他营养物质的耗尽,使得菌体量增长停滞进入稳定期,此处与菌体量变化在此吻合。
5、赤霉素含量的测定:取步骤2中保存的上清液,用hplc法检测赤霉素含量(见图5),具体检测方法如下:
1)标准样的配置及稀释:取0.05gga3标准品溶于50ml色谱级甲醇中,得到1g/l的原液,然后取原液用超纯水稀释20倍至0.05g/l,然后用稀释20倍后的溶液依次稀释至0.04、0.03、0.02、0.01g/l,分别用0.55μm滤膜过滤。
2)样品的稀释:取步骤2中保存的9天的发酵上清液于室温下解冻,用超纯水稀释50倍,然后分别用0.55μm滤膜过滤。
3)hplc检测参数:流动相:甲醇/磷酸水溶液(40:60);磷酸水溶液:0.5ml磷酸用水稀释到1l;流量:1ml/min;柱温:40℃;波长:210nm;进样体积:20μl;保留时间:通过unitaryc18,5μm,100a(4.6mmx250mmcolumn)柱子约8分钟。
赤霉素是典型的次级代谢产物,通常在细胞生长进入稳定期以后产生,伴随或者本身作为一种细胞毒素产生。如图5所示,hplc检测发现在发酵第二天以后检测出少量的赤霉素,在第六至第七天达到最高生产量,并在此后保持相似水平。根据xtt菌体量数据,菌体量在发酵第二天以后达到稳定期,在第六、七天左右出现细胞消亡趋势,达到后稳定期。因此,xtt检测法测得赤霉素菌体量与赤霉素发酵过程中赤霉素生产完全吻合。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!