一种快速检测微生物群落的系统及方法与流程
本发明属于专门适用于特定应用的数字计算或数据处理的设备或方法技术领域,尤其涉及一种快速检测微生物群落的系统及方法。
背景技术:
目前,业内常用的现有技术是这样的:大曲是大曲酒酿造生产中的重要物质,是酿酒生产的糖化、发酵、酒化和生香剂,大曲是一种富含多酶多菌的微生物发酵剂,含有多种微生物及其产生的多种酶类,是传统固态发酵蒸馏大曲酒的重要物质保障,其品质对曲酒的出酒率和优级品率有较大的影响。大曲是一种以生料小麦(或配伍大麦、豌豆)为原料自然网罗制曲环境中的微生物接种发酵,微生物在曲坯中彼消此长,自然积温转化并风干而成的一种多酶多菌的微生态制品。传统的大曲质量判定标准体系其意义在于:初步认识了大曲的主要酶系状况:淀粉酶、糖化酶、酒化酶、酯化酶、蛋白酶、脂肪酶等;初步认识了大曲在固态白酒发酵体系中的生化作用:产酒、产酯、产香等;初步认识了大曲的主要微生物类群:酵母菌、霉菌、细菌以及放线菌等。在制曲工艺条件确定的前提下,传统大曲的质量品质,就主要取决于制曲环境所处的地理条件、气候条件、水质条件等所滋生和孕育的微生物类群。传统大曲生产主要采用自然网罗自然界的微生物和人工制作曲坯及人工管理,不仅大曲因气候、环境等自然因素的影响而容易导致质量的不稳定性,而且人工制曲坯及人工管理的劳动量大、工作效率低,且大曲质量受工人工作经验的影响。随着制曲专业化,酒化力,酯化力、氨态氮和淀粉消耗率及容重等指标,成为衡量大曲质量的重要指标。强化大曲发酵技术可以解决大曲中某种微生物数量和酶系种类的不足,为大曲坯提供良好的微生物及酶系体系。大曲的质量对白酒品质的影响很大,因此稳定大曲品质是保证酒质的前提。大曲质量评定方法有感官评定法、理化特征指标评定法、微生物种群数量评定法。这些方法及有关标准对大曲质量的进一步规范化、标准化起到一定推动作用。由于影响酿酒生产的因素极其复杂,每种评定方法的可靠性、稳定性都存在一定的缺陷,其评定指标和方法也有待进一步完善。专家们对不同酒厂大曲生产过程中感官、理化、微生物指标的动态变化进行了研究。但目前中国白酒大曲并没有统一的质量标准,只有企业自己的标准。沈才洪等人早就开始提出了鉴别大曲质量的标准,并对其进行了深入的探讨。张肖克等认为,随着制曲专业化的发展,制曲行业正在呼唤“大曲质量统一标准”。在新的大曲质量标准体系指标设置构想中,大曲作为固态白酒酿造中产酒和生香的发酵剂,反映大曲品质的动态指标(对固态酿酒发酵产生动态影响)即大曲生化特征指标,包括以下3个方面:①酒化力——把原料中的淀粉转化为乙醇的特征指标。②酯化力——把有机酸与乙醇缩合生成酯类物质的特征指标。③生香力——把原料中的淀粉、蛋白质和脂肪等物质降解为小分子物质,演化成为曲香香气的特征指标。然而大曲是一种富含多酶多菌的微生态制品,仅仅通过传统的感官评定法和对乙醇(酒化力)、己酸乙酯(酯化力)、脂肪酸(生香力)理化指标分析并不能很好的评定与酒质的关系。制曲过程本身就是微生物大量生长、相互作用的过程,传统的制曲过程是自然界微生物在曲坯上的生长与繁殖过程。不同曲中微生物的种类不同,则酿造的白酒香型也不同。酒曲中的微生物主要有:霉菌,酵母菌以及细菌。由实践所得,香气较好的白酒一般为高温曲酿造,高温菌和低温菌比例随着温度变化,最终逐渐变为产生对酒的香气有一定作用的的代谢产物。如贵州茅台酒高温大曲中微生物以细菌为主,霉菌次之,酵母菌最少。传统的微生物研究方法有直接镜检和平板分离计数,模式菌株的分离、筛选和生理化鉴定。而传统方法并不能全面的了解生产和酿造过程中微生物区系变化。现代方法主要基于分子生物学方法,如dgge技术,由16srdna和its序列构成的基因文库技术,
此外,在微生物数量和类别上的分析结果与其他酱香型白酒高温大曲的研究报告存在部分差异,可能与兼香型白酒的独特风格、培养基的选取及取样操作等多种因素有关。
目前存在的问题有:(1)到目前为止,还没有测定大曲脂肪酸更好的检测方法;(2)大曲中纷繁复杂的微生物区系和酶系,进入大曲酒发酵体系中又进一步彼消此长地繁殖代谢和生化演化,形成种类繁多的酒体呈香呈味物质,目前还未完全确定其种类;(3)大曲酒酒体中的呈香呈味物质含量仅占酒体总量的2%左右,但所形成酒品的价值就远远超越食用酒精的价值;(4)制曲工艺有一定差异;(5)的各理化指标由于生产季节、生产环境、工艺参数、取样方法和部位等因素差异,导致同一指标分析结果差异较大。
综上所述,现有技术存在的问题是:
(1)大曲中纷繁复杂的微生物区系和酶系,进入大曲酒发酵体系中又进一步彼消此长地繁殖代谢和生化演化,形成种类繁多的酒体呈香呈味物质,目前的研究方法还未完全确定其种类。
(2)制曲工艺的差异导致菌落的差异性,未有统一通用的检测方法。
(3)大曲发酵和贮存各个时期的微生物与香气成分的关系,对于大曲中产香微生物的研究,因技术落后还未有公认的结论证实微生物与香味的关系机制。
解决上述技术问题的难度和意义:由于制曲工艺的不同,且大曲发酵和贮存过程中产生的不同微生物,是白酒香气的主要来源,因此有必要对大曲香味成分及其微生物之间的关系进行分析。且微生物种类及其变化规律是大曲香味的关键因素,然而,由于大曲发酵属于固态发酵,对于微生物种类及其数量的检测实时性与准确性要求高,具有一定的挑战。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种快速检测微生物群落的系统及方法。
本发明是这样实现的,一种快速检测微生物群落的系统,所述快速检测微生物群落的系统包括:
传感器阵列模块,采用电化学方法对微生物及其代谢产物检测;从电信号中提取出和待测微生物指标呈良好线性关系的特征,通过氧化还原酶反应和适当的媒介,将微生物的代谢氧化还原反应转换成可量化的电信号;
微生物检测模块,用于检测培养基内部的微生物;
培养基模块,通过遗传算法的全局寻优,找到最优培养基组合。
进一步,所述传感器阵列模块的传感器阵列采用重金属铂,金,钯,钨,钛,银的电极构成,并利用主成分分析法选取对微生物培养基检测的最佳电极和频率段。主成分分析步骤:将大曲发酵检测的数据进行预处理,首先标准化处理,假设原始数据构成的矩阵为x,它是由行n行p列构成。
标准化处理:
则标准化后的相关系数的计算公式为:
经过主成分分析法的处理可以将其分解问特征值与载荷矩阵的相积。
用雅克比方法求特征值λi(按从大到小排序)及其特征向量。
计算其相应的特征值和特征向量,最后得到即x=tl'。根据t的得分矩阵做出图形来判断样品的归类效果图。在选择重要的主成分时,主成分的方差是递减的,代表所含有样本信息量也是递减的,但并没有选择所有的主成分,而是按照其累计贡献率(指某个主成分的方差占全部方差的比重)的大小选取k个主成分来作为抽取样品。
其中贡献率为:
累计贡献率:
进一步,所述微生物检测模块的位置2为微生物检测池,池体底部装有电极的设置,传感器阵列位于检测池的底座位置1,检测池池体内侧设有内螺纹,底座外周设有与该内螺纹相匹配的外螺纹,设置螺旋结构。
进一步,所述培养基模块的实验培养基配比的组合被分成训练组和预测组,训练组用来训练bp神经网络;预测组用来对训练好的网络进行测试,构建神经网络模型;并以模型的输出为ga的目标函数,通过遗传算法的全局寻优,找到最优培养基组合。而将遗传算法应用到参数优化中需要考虑三个方面:编码规则,初始种群的建立,自适应度函数的选择。采用二进制编码方法对参数进行编解码。惩罚参数和参数分别代表不同的染色体,每一种染色体被编码为一定序列的编码,其形式表示如下:
其中,ωi是染色体优化参数的二进制基因位数,[l1,l2]是优化参数的区间,k是单基因二进制编码的长度,设置库k=20,二进制编码的位数是60位。选择k-cv意义下的准确率来确定自适应度函数,确保预测模型的预测值和真实值误差值的足够小来验证模型准确率,均方误差法作为其自适应度函数,因此,自适应度函数值越小,预测模型的准确率越高。为了保证种群的多样性,采用随机选择方法作为种群操作方法。并将最小适应值直接代入下一个种群中。进而通过单点交叉法执行交叉操作和多点变异法执行离散、变异操作进行种群遗传进化,最终通过判断是否满足遗传运算的终止进化代数来确定最优参数。种群数量过大会增加ga算法的时耗,因此需要对数据进行归一化降维处理,本文将输入数据的归一化的范围设为[0,1]。
本发明的另一目的在于提供一种实现所述快速检测微生物群落的系统的快速检测微生物群落的方法,所述快速检测微生物群落的方法包括以下步骤:
步骤一,利用检测平台检测微生物不同种类,对微生物建立生长预测模型;
步骤二,根据微生物呈指数生长的特点,微生物数量的对数随时间的变化得到一条s形曲线,所绘制的生长曲线分别为延滞期、对数期、稳定器和衰老期;
步骤三,用curveexpert软件分析智舌检测菌种的生长数据,启用软件后,x轴输入微生物群落的种类值,y轴输入微生物数量值,将导入的生长数据拟合s曲线,建立生长模型,通过logistic、mmf、gompertz3种模型的标准差s和相关系数r的比较,确定最佳模型;确定检测该菌种的最合适培养基。
综上所述,本发明的优点及积极效果为:通过低选择性交互敏感的多传感器阵列检测曲料样品的整体特征响应信号,检测培养基随着微生物生长的变化(把大的有机物分子转化成小的有机分子和离子),过程中培养基其本身的特性(电导、电阻、粘度等等)也发生了改变,通过对这一变化的检测取得特征值,再通过pca和神经网络等模式识别方法的数据处理来确定不同阶段培养基的不同特征。根据培养基随时间变化的速率来判断微生物延滞期向指数期转变的时间,最后利用转变时间拟合回归其原始的菌量等微生物检测指标。
附图说明
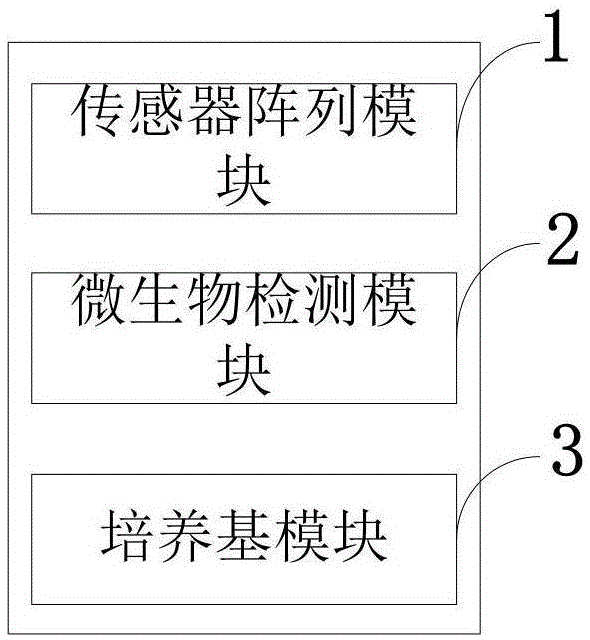
图1是本发明实施例提供的快速检测微生物群落的系统结构示意图;
图中:1、传感器阵列模块;2、微生物检测模块;3、培养基模块。
图2是本发明实施例提供的快速检测微生物群落的方法流程图。
图3是本发明实施例提供的快速检测微生物群落的方法实现流程图。
图4是本发明实施例提供的图2是本发明实施例提供的快速检测微生物群落的方法流程图。
图5是本发明实施例提供的微生物生长曲线示意图。
图6是本发明实施例提供的检测原理图。
图7是本发明实施例提供的四个检测闻水平分别和各个模型的交点示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
如图1所示,本发明实施例提供的快速检测微生物群落的系统包括:传感器阵列模块1、微生物检测模块2、培养基模块3。
传感器阵列模块1,采用电化学方法对微生物及其代谢产物检测;从电信号中提取出和待测微生物指标呈良好线性关系的特征,通过氧化还原酶反应和适当的媒介,将微生物的代谢氧化还原反应转换成可量化的电信号。
微生物检测模块2,用于检测培养基内部的微生物。
培养基模块3,通过遗传算法的全局寻优,找到最优培养基组合。
在本发明的优选实施例中,传感器阵列模块1,传感器阵列采用重金属铂,金,钯,钨,钛,银的电极构成,并利用相同的处理方法(主成分分析法或最小二乘法)来选取对微生物培养基检测的最佳电极和频率段。
微生物检测模块2,微生物检测池是一个密闭的空间,池体底部装有电极的设置可以避免外界对被检测培养基的污染,使检测的数据更加准确,传感器阵列位于检测池的底座还可以消除微生物在生长的时候产生的气泡对电极的影响,检测池池体内侧设有内螺纹,底座外周设有与该内螺纹相匹配的外螺纹,设置螺旋结构,可以使检测池池体与底座脱离,便于清洗电极表面。
培养基模块3,遗传算法又是一种有导向的全局随机搜索方法,对于目标函数和搜索空间没有任何限制,因此非常适合神经网络模型等无明确分析函数形式的优化问题。实验培养基配比的组合被分成训练组和预测组,训练组用来训练bp神经网络,然后预测组用来对训练好的网络进行测试,由此构建神经网络模型。并以该模型的输出为ga的目标函数,通过遗传算法的全局寻优,找到最优培养基组合。
如图2所示,本发明实施例提供的快速检测微生物群落的方法包括以下步骤:
s201:利用检测平台检测微生物不同种类,对微生物建立生长预测模型;
s202:根据微生物呈指数生长的特点,微生物数量的对数随时间的变化得到一条s形曲线,所绘制的生长曲线分别为延滞期、对数期、稳定器和衰老期;
s203:用curveexpert软件分析智舌检测菌种的生长数据,拟合s曲线,建立生长模型,通过logistic、mmf、gompertz3种模型的标准差s和相关系数r的比较,确定最佳模型;确定检测该菌种的最合适培养基。
下面结合实验对本发明的应用效果作详细的描述。
实验:选取少量单细胞纯培养接种到恒定容积的新鲜培养基中,在适宜条件下培养,定时取样测定细菌含量,开始有一短暂时间,细菌数量并不增加,随之细菌数目增加很快,继而细菌数又趋稳定,最后逐渐下降。如果以培养时间为横坐标,以细菌数目的对数或生长速度为纵坐标作图,可以得到如图5的曲线,称为生长曲线。对单细胞微生物而言,虽然生长和繁殖是两个不同的概念,但由于在测定方法上,多以细菌数增加(即繁殖)作为生长指标,它们的繁殖也可视为群体的生长。所以,反应了新的适宜的环境中生长繁殖直至衰老死亡全过程的动态变化。根据微生物生长繁殖速率的不同,可将生长曲线大致分为延迟期、对数期、平稳期和衰亡期。
从图6中可以看到微生物的生长曲线是逐步地从一个生长期进入到下了个生长期的。也就是说,并不是所有细胞在接近某一生长期的末尾时均处于完全相同的生理状态。因此,在细菌生长的整个周期,细菌数和培养时间,若以线性关系表示,往往是一条缓慢上升以后又逐渐下降的曲线,而不是一个阶段分明的直线。
模型拟合曲线检测阀的确定以及标准曲线的建立
通过智舌检测酵母,进行分析得到拟合曲线之后,通过设定检测阀m的方法建立预测模型。首先建立模型到达检测阀的时间关于模型的原始接种量之间的关系。而在检测阀的选取中发现,检测阀过低,虽然检测的时间会比较短,但是相关系数比较低,而且对于接种浓度比较高的培养基检测误差较大,影响对原始接种量的预测。如果检测阀设得过高,则检测的时间就会比较长,达不到快速检测的效果,而且也会影响其检测的效果。检测阀设得过低或者过高都达不到所期望的水平,所以对检测阀的选取要适当。检测阀的选取,首先要确定检测闭所能取的范围。如图7所示,是酵母5个浓度关于logistic模型拟合后的生长曲线图,检测阀的范围可以在0.01g模型的最低点0.8到0.001g模型的最高的3.0之间取值。所以把检测阀在0.8-3.0之间分别取值1.5、2.0、2.5、3.0四个数值进行比较,得到效果最好的检测阀的值。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!