一种体液样本中细胞PD-L1蛋白表达的检测方法及其专用试剂与流程
本发明属于蛋白的免疫组化检测领域,尤其是涉及一种体液样本中细胞pd-l1蛋白表达的检测方法及其专用试剂。
背景技术:
pd-1是i型跨膜免疫球蛋白受体,属于cd28介导的免疫反应超家族成员,是t细胞表面的重要抑制分子,其胞内段含有一个itim和一个免疫受体酪氨酸转换基序(itsm),itsm介导了蛋白酪氨酸磷酸酶家族磷酸酶的募集以及对t细胞活化信号的抑制。pd-1的受体包括pd-l1(b7-h1)与pd-l2(b7-dc),主要在免疫系统效应期的肿瘤微环境中发挥重要作用。pd-l1在多种肿瘤细胞和肿瘤微环境的造血细胞中有诱导性的表达,通过与pd-1的结合,诱导产生机体的免疫抑制,从而使肿瘤细胞获得免疫逃逸,这也许是肿瘤耐受的机制之一。如果将其结合阻断,就有可能阻断这种免疫抑制,使机体自身的t细胞活化,从而达到免疫治疗的目的。
pd-l1抑制剂能阻断了pd-1和pd-l1的结合,使肿瘤细胞对t细胞“松绑”,恢复被肿瘤细胞削弱的免疫功能。pd-l1抑制剂对多种肿瘤治疗有效且副作用小,但其也并非“万能药”,因个体差异,导致药效也有所不同,单独使用客观缓解率仅有15-30%。为判定抑制剂是否对患者有效,需要进行pd-l1相关的检测。目前,市场上还没有单一的指标可以明确地告诉患者该药物是否有效,但可以检测pd-l1的抗体表达水平来进行评估药效。pd-l1抗体的检测主要是基于细胞蛋白水平的检测,临床试验中以免疫组化方法为主,即对手术或穿刺后取得的肿瘤组织进行切片-染色(通过抗体),根据着色深浅来评价表达情况。到目前为止,免疫组化方法(用于检测pd-l1抗体)适用于组织,尚未提及是否可用于胸腹水、骨髓及外周血等肿瘤细胞的pd-l1蛋白表达检测。
技术实现要素:
本发明所要解决的技术问题是提供一种具有操作简单、灵敏度高和检测结果易判读的体液样本中细胞pd-l1蛋白表达的检测方法。
本发明解决上述技术问题所采用的技术方案为:
1、一种体液样本中细胞pd-l1蛋白表达的检测方法,包括以下步骤:将制备的免疫磁微粒混合液与体液样本中肿瘤循环细胞结合,然后置于免疫磁微粒捕获仪中进行捕获,将捕获的肿瘤细胞通过pd-l1免疫组化染色试剂进行染色,评估pd-l1的蛋白表达。
所述的免疫磁微粒混合液为包被抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒、抗人叶酸受体免疫磁微粒、抗人cd10免疫磁微粒、抗人cd19免疫磁微粒、抗人cd20免疫磁微粒和抗人cd33免疫磁微粒中的至少一种。
所述的免疫磁微粒的制备方法具体步骤如下:
(1)磁微粒的预处理:在含有磁微粒的离心管中加入0.05mol/lmes缓冲液,将离心管置于磁力架上静置分层后,吸弃上清,向离心管中加入等量的0.05mol/lmes缓冲液,进行超声处理后,置于磁力架上静置分层后,吸弃上清,重复上述步骤2-4次;在离心管中再次加入0.5ml0.05mol/lmes缓冲液,继续在超声仪中进行超声处理,得到大小一致、形状完整以及分布均匀的磁微粒悬浮液;其中mes缓冲液一次添加量为每2mg磁微粒添加1mlmes缓冲液;磁微粒为粒径200-1000nm的棕色圆形或椭圆形磁微粒,羧基含量为200μmol/g-600μmol/g;
(2)磁微粒活化:在磁微粒悬浮液中分别加入50mg/mlnhs溶液活化剂和50mg/mledac溶液活化剂,然后置于可调式旋转混合器上,于25~40rpm、37±2℃反应30min后,加入heps缓冲液进行润洗,置于磁力架上重复洗涤2-4次,吸弃上清得到活化后磁微粒;其中nhs溶液、edac溶液和heps缓冲液的添加量为每2mg磁微粒添加100μlnhs溶液、100μledac溶液和1mlheps缓冲液;
(3)磁微粒偶联抗体:在含有活化后磁微粒的离心管中加入抗体密封后,放入垂直旋转混合器上,于37±2℃,25~30rpm转速混匀10-14小时,得到包被了抗体的免疫磁微粒;其中抗体添加量为每2mg磁微粒添加10μg抗体,所述的抗体为抗人epcam抗体、抗人icam-1抗体、抗人egfr抗体、抗人叶酸受体抗体、抗人cd10抗体、抗人cd19抗体、抗人cd20抗体或者抗人cd33抗体。
在含有包被了抗体的免疫磁微粒的离心管中迅速加入75mg/ml的封闭剂和100mg/ml的bsa溶液,在漩涡混合器上混匀后,将离心管放入垂直旋转混合器上,于37±2℃,25~30rpm转速封闭2小时;将离心管取下,加入清洗液进行重悬,磁力架上静置分层后吸弃上清,用清洗液重复洗涤2-4次后,加入保存液进行重悬,磁力架上静置分层后吸弃上清,用保存液重复洗涤2次,最后用保存液重悬免疫磁微粒,得到无团聚的免疫磁微粒溶液;其中各成分单次添加量为每2mg磁微粒添加200μl封闭剂、200μlbsa溶液、1ml清洗液和1ml保存液,所述的封闭剂为75mg/ml的甘氨酸水溶液,所述的清洗液为含0.1%曲拉通和0.53%吐温20的0.9wt%氯化钠溶液,所述的保存液为含1.6wt%bsa的heps液。
所述的免疫磁微粒捕获仪为免疫磁微粒捕获仪cellrichtm,设置程序为:样本量为1.0-7.5ml,捕获速度为1.0-5.0ml/h,冲洗速度为2.0-7.0ml/h。
所述的pd-l1免疫组化染色试剂的一抗为型号mab1561或ab205921的抗人pd-l1抗体,二抗为辣根过氧化物酶标记山羊抗鼠igg或辣根过氧化物酶标记山羊抗兔igg。
所述pd-l1免疫组化染色试剂的一抗浓度为0.5mg/ml、二抗浓度为0.8mg/ml、封闭液为含有5vt%山羊血清的tbst缓冲液以及显色液为dab显色剂。
2、一种用于体液样本中细胞pd-l1蛋白表达检测的专用试剂,所述的试剂包括免疫磁微粒混合液,所述的免疫磁微粒混合液为包被抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒、抗人叶酸受体免疫磁微粒、抗人cd10免疫磁微粒、抗人cd19免疫磁微粒、抗人cd20免疫磁微粒和抗人cd33免疫磁微粒中的至少一种。
3、一种用于体液样本中细胞pd-l1蛋白表达检测的专用试剂的应用,所述的免疫磁微粒混合液在制备肺癌患者ctcs捕获剂方面的应用,其中免疫磁微粒混合液中抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒和抗人叶酸受体免疫磁微粒的混合质量比为2:2:2:4;
所述的免疫磁微粒混合液在制备肺癌患者肺癌胸腹水ctcs捕获剂方面的应用,其中免疫磁微粒混合液中抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒和抗人叶酸受体免疫磁微粒的混合质量比为4:4:1:1;
所述的免疫磁微粒混合液在制备白血病幼稚细胞捕获剂方面的应用,其中免疫磁微粒混合液中抗人cd10免疫磁微粒、抗人cd19免疫磁微粒、抗人cd20免疫磁微粒和抗人cd33免疫磁微粒的混合质量比为1:1:4:4。
4、一种用于体液样本中细胞pd-l1蛋白表达检测的专用试剂,所述的试剂包括pd-l1免疫组化染色试剂,所述的pd-l1免疫组化染色试剂的一抗为型号mab1561或ab205921的抗人pd-l1抗体,二抗为辣根过氧化物酶标记山羊抗鼠igg或辣根过氧化物酶标记山羊抗兔igg。
与现有技术相比,本发明的优点在于:本发明一种检测体液样本中细胞pd-l1蛋白表达的检测方法,所述肿瘤细胞不仅包含血液中的肿瘤细胞或淋巴瘤细胞,还包括胸腹水或骨髓来源的肿瘤细胞;所述检测方法包括用于捕获体液样本中肿瘤细胞的免疫磁微粒捕获仪及配套试剂,及用于肿瘤细胞pd-l1免疫组化染色的试剂。本发明主要用于①不同体液样本(胸腹水、骨髓及外周血等)的检测;②nivolumab、pembrolizumab等免疫抑制剂药物的伴随诊断及疗效监测。
本发明的一种体液样本中细胞pd-l1蛋白检测方法,选用不同类型的磁微粒偶联不同的抗体,形成特定的免疫磁微粒。使用特定的免疫磁微粒,并借助免疫磁微粒捕获仪及标准配套试剂对不同体液样本中的细胞进行自动捕获,捕获到的细胞可用pd-l1免疫组化试剂进行pd-l1蛋白检测,具有操作简单、灵敏度高、检测结果易判读等优点。
附图说明
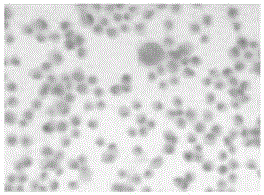
图1为实施例1对肺腺癌患者外周血中脱落的肿瘤细胞进行免疫组化染色结果;
图2为实施例2对肺腺癌患者胸腹水脱落的肿瘤细胞进行免疫组化染色结果;
图3为实施例3对急性单核细胞白血病骨髓单个核细胞进行免疫组化染色。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1
以肺腺癌肿瘤患者外周血样本为例,使用宁波美晶医疗技术有限公司的免疫磁微粒捕获仪cellrichtm及其配套试剂对肿瘤细胞进行捕获。并使用本发明检测方法对其进行后续的检测,具体步骤如下:
1、免疫磁微粒制备(以2mg的磁微粒举例)
1)磁微粒的预处理:选用粒径为200nm的棕色圆形(或椭圆形)磁微粒,羧基含量为200-400μmol/g;在含有2mg磁微粒的离心管中加入1ml0.05mol/lmes缓冲液(酸性缓冲液),在磁力架上静置3分钟,吸弃上清,向离心管中加入1ml0.05mol/lmes缓冲液,进行超声处理后,在磁力架上静置3分钟,吸弃上清,共重复2-4次;在离心管中再次加入0.5ml0.05mol/lmes缓冲液,继续在超声仪中进行超声处理,得到大小一致,形状完整以及分布均匀的磁微粒悬浮液;
2)磁微粒活化:在含有步骤(1)得到的磁微粒悬浮液的离心管中分别加入100μl的50mg/mlnhs溶液(n-羟基琥珀酰亚胺,现配现用)活化剂和100μl的50mg/mledac溶液(碳二亚胺,现配现用)活化剂,将上述活化反应液置于可调式旋转混合器上,于25~40rpm、37±2℃反应30min后,加入1mlheps缓冲液进行润洗,磁力架上重复洗涤3次,吸弃上清得到活化后磁微粒;
3)磁微粒偶联抗体:取四支含有步骤(2)得到的活化后磁微粒的离心管,相应加入10μg的抗人epcam、10μg的抗人icam-1、10μg的抗人egfr抗体和10μg的抗人叶酸受体,将离心管密封后放入垂直旋转混合器上,于37℃,25~30rpm转速混匀12小时,分别得到包被了抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒和抗人叶酸受体免疫磁微粒;
4)封闭:称取一定量的甘氨酸,用h2o溶解配制成75mg/ml的封闭剂;用移液枪各吸取200μl封闭剂和100mg/ml的bsa溶液迅速加入含有偶联抗体的免疫磁微粒的离心管中密封,在漩涡混合器上混匀后,将离心管放入垂直旋转混合器上,于37℃,25~30rpm转速封闭2小时;
5)洗涤:将离心管取下,加入1ml清洗液(含0.1%曲拉通、0.53%吐温20的0.9wt%氯化钠溶液)进行重悬,磁力架上静置3分钟吸弃上清,用清洗液重复洗涤3次后,加入1ml保存液进行重悬,磁力架上静置3分钟吸弃上清,用保存液(含1.6wt%bsa的heps液)重复洗涤2次,最后用1ml保存液重悬免疫磁微粒,得到无团聚的免疫磁微粒溶液;将洗涤后的包被了抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒和抗人叶酸受体免疫磁微粒按质量比2:2:2:4的比例进行混合,最终得到用于肺癌患者ctc分离的免疫磁微粒混合液(2mg/ml,该浓度是4种免疫磁微粒在溶液中的量,并不是单独一种免疫磁微粒在溶液中的量)。
2、肺癌ctcs的捕获
1)血样预处理:将血样轻柔颠倒混匀8次后,吸取5ml血样(含抗凝剂)至15ml离心管中,并补充适量的样本稀释液(含5wt%bsa的pbs液),轻微颠倒、混匀数次;将其在室温下800g,离心10min后去除上清,直至离沉淀1ml处;
2)孵育:往上述15ml离心管中加入3ml样本稀释液及200μl免疫磁微粒混合液,轻微颠倒混匀数次;将离心管固定在垂直混合仪上,以8-10rpm的速度在37℃下孵育1.5h,使ctcs和免疫磁微粒进行结合;
3)捕获ctcs细胞:将重悬好液体的离心管,放置于免疫磁微粒捕获仪cellrichtm,进行ctcs细胞的分离与捕获。设置程序为:样本量为4.5ml,捕获速度为2.5ml/h,冲洗速度为5.0ml/h,捕获程序完成后小心的取出载玻片。
3、肺癌ctcs的pd-l1蛋白检测
1)固定封闭:在捕获的细胞玻片上滴加丙酮(覆盖玻片),4℃固定20min,弃液后室温干燥5min;pbs缓冲液漂洗3次,每次2min;滴加3wt%过氧化氢静置15min以使内源性过氧化物酶灭活,然后用pbs缓冲液漂洗3次,每次2min;滴加封闭液(含有5vt%山羊血清的tbst缓冲液),37℃孵育20min,弃液;
2)孵育抗体:在细胞玻片上加入一抗覆盖细胞,4℃孵育过夜,弃液;pbst缓冲液漂洗3次,每次5min;加入酶标二抗覆盖组织,37℃孵育30min,弃液;pbst缓冲液漂洗3次,每次5min;其中一抗为浓度0.5mg/ml的型号为mab1561或ab205921的抗人pd-l1抗体,二抗为浓度0.8mg/ml的辣根过氧化物酶标记山羊抗鼠igg或辣根过氧化物酶标记山羊抗兔igg;
3)显色以及封片:在细胞玻片加入dab显色剂,室温静置5min,在镜下观察显色情况;用dh2o冲洗后,再使用0.01mpbs缓冲液进行漂洗2min,使用苏木素进行复染:苏木素染色2min,40℃温水20s显蓝,脱水透明,封片镜检。
结果分析:选用粒径为200nm,羧基含量200-400μmol/g的磁微粒具有较高的比表面积、磁响应性和较低的毒性等优点。经过活化离心,磁微粒能在溶液中均匀分散,由此能高效偶联抗体(磁微粒表面包被的羧基能高效偶联抗体)。使用该免疫磁微粒(偶联抗人epcam、抗人icam-1、抗人egfr抗体和抗人叶酸受体)捕获细胞时,因其高磁响应性能使捕获速度得到提升,在1.5h内能完成捕获过程,比以往捕获时间缩短了15min。在提速的同时,因对外周血进行了洗涤离心等预处理,去掉部分杂质,从而使捕获效率得到提高。将捕获的细胞进行pd-l1免疫组化染色,实验结果如图1所示,细胞片中残留淋巴细胞胞膜浅染,肺癌细胞(异形核)较少,细胞膜呈浅棕色,pd-l1表达弱阳性。
实施例2
以肺腺癌肿瘤患者胸腹水样本为例,本发明检测方法对其进行检测。
1、免疫磁微粒制备(以2mg的磁微粒举例)
1)磁微粒的预处理:选用粒径为200nm的棕色圆形(或椭圆形)磁微粒,羧基含量为200-400μmol/g;在含有2mg磁微粒的离心管中加入1ml0.05mol/lmes缓冲液(酸性缓冲液),在磁力架上静置3分钟,吸弃上清,向离心管中加入1ml0.05mol/lmes缓冲液,进行超声处理后,在磁力架上静置3分钟,吸弃上清,共重复2-4次;在离心管中再次加入0.5ml0.05mol/lmes缓冲液,继续在超声仪中进行超声处理,得到大小一致,形状完整以及分布均匀的磁微粒悬浮液;
2)磁微粒活化:在含有步骤(1)得到的磁微粒悬浮液的离心管中分别加入100μl的50mg/mlnhs溶液(n-羟基琥珀酰亚胺,现配现用)活化剂和100μl的50mg/mledac溶液(碳二亚胺,现配现用)活化剂,将上述活化反应液置于可调式旋转混合器上,于25~40rpm、37±2℃反应30min后,加入1mlheps缓冲液进行润洗,磁力架上重复洗涤3次,吸弃上清得到活化后磁微粒;
3)磁微粒偶联抗体:取四支含有步骤(2)得到的活化后磁微粒的离心管,相应加入10μg的抗人epcam、10μg的抗人icam-1、10μg的抗人egfr抗体和10μg的抗人叶酸受体,将离心管密封后放入垂直旋转混合器上,于37℃,25~30rpm转速混匀12小时,分别得到包被了抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒和抗人叶酸受体免疫磁微粒;
4)封闭:称取一定量的甘氨酸,用h2o溶解配制成75mg/ml的封闭剂;用移液枪各吸取200μl封闭剂和100mg/ml的bsa溶液迅速加入含有偶联抗体的免疫磁微粒的离心管中密封,在漩涡混合器上混匀后,将离心管放入垂直旋转混合器上,于37℃,25~30rpm转速封闭2小时;
5)洗涤:将离心管取下,加入1ml清洗液(含0.1%曲拉通、0.53%吐温20的0.9wt%氯化钠溶液,由于曲拉通和吐温20均为液体,两者比例含量指体积比)进行重悬,磁力架上静置3分钟吸弃上清,用清洗液重复洗涤3次后,加入1ml保存液进行重悬,磁力架上静置3分钟吸弃上清,用保存液(含1.6wt%bsa的heps液)重复洗涤2次,最后用1ml保存液重悬免疫磁微粒,得到无团聚的免疫磁微粒溶液;将洗涤后的包被了抗人epcam免疫磁微粒、抗人icam-1免疫磁微粒、抗人egfr抗体免疫磁微粒和抗人叶酸受体免疫磁微粒按质量比4:4:1:1的比例进行混合,最终得到用于肺癌患者ctc分离的免疫磁微粒混合液(2mg/ml)。
2、肺癌胸腹水ctcs的捕获
1)胸腹水预处理:将胸腹水轻柔颠倒混匀后,取45ml的胸腹水至50ml离心管,室温下700g,离心5min后弃上清直至底部剩余5ml的溶液,采用样本稀释液(含5wt%bsa的pbs液)补充至45ml,颠倒混匀后室温下,700g,离心5min后,收集底部的细胞;
2)孵育结合:补充样本稀释液至5ml,重悬细胞后转至15ml离心管中加入200μl免疫磁微粒混合液,轻微颠倒混匀数次;将离心管固定在垂直混合仪上,以8-10rpm的速度在37℃下孵育1.5h,使ctcs和免疫磁微粒进行结合;
3)捕获ctcs:将重悬好液体的离心管,放置于免疫磁微粒捕获仪cellrichtm,进行ctcs的捕获与分离。设置程序为:样本量为1ml,捕获速度为1ml/h,冲洗速度为2.0ml/h,捕获程序完成后小心的取出载玻片。
3、肺癌胸腹水ctcs的pd-l1蛋白检测
1)固定封闭:在捕获的细胞玻片上滴加丙酮(覆盖玻片),4℃固定20min,弃液后室温干燥5min;pbs缓冲液漂洗3次,每次2min;滴加3wt%过氧化氢静置15min以使内源性过氧化物酶灭活,然后用pbs缓冲液漂洗3次,每次2min;滴加封闭液(含有5vt%山羊血清的tbst缓冲液),37℃孵育20min,弃液;
2)孵育抗体:在细胞玻片上加入一抗覆盖细胞,4℃孵育过夜,弃液;pbst缓冲液漂洗3次,每次5min;加入酶标二抗覆盖组织,37℃孵育30min,弃液;pbst缓冲液漂洗3次,每次5min;其中一抗为浓度0.5mg/ml的型号为mab1561或ab205921的抗人pd-l1抗体,二抗为浓度0.8mg/ml的辣根过氧化物酶标记山羊抗鼠igg或辣根过氧化物酶标记山羊抗兔igg;
3)显色以及封片:在细胞玻片加入dab显色剂,室温静置5min,在镜下观察显色情况;用dh2o冲洗后,再使用0.01mpbs缓冲液进行漂洗2min,使用苏木素进行复染:苏木素染色2min,40℃温水20s显蓝,脱水透明,封片镜检。
结果分析:用粒径为200nm,羧基含量200-400μmol/g的磁微粒均一性好,粒度适中。粒径过小,粒间存在偶极-偶极作用,使得粒子间易于团聚。磁微粒经过活化离心,偶联抗体后,能在溶液中良好的分散,不团聚。将胸腹水进行洗涤离心后可去除杂质,使用包被抗体的免疫磁微粒(偶联抗人epcam、抗人icam-1、抗人egfr抗体和抗人叶酸受体)进行捕获,能快速紧密地结合ctcs,由此将捕获的精准度提升至86%。实验结果如图2所示,细胞片中肺癌细胞(异形核)细胞膜呈棕色,pd-l1表达阳性。
实施例3
患者骨髓白血病细胞的捕获富集:首先将患者骨髓样本进行密度梯度离心收集样本中单个核细胞,用预处理液对收集细胞进行重悬后用本公司的免疫磁微粒捕获仪cellrichtm及其配套试剂进行白血病幼稚细胞的捕获。
1、免疫磁微粒制备(以2mg的磁微粒举例)
1)磁微粒的预处理:选用的磁微粒的粒径为1μm,羧基含量200-600μmol/g,形状为圆形,外观为棕色;在含有2mg磁微粒的离心管中加入1ml0.05mol/lmes缓冲液(酸性缓冲液),在磁力架上静置3分钟,吸弃上清,向离心管中加入1ml0.05mol/lmes缓冲液,进行超声处理后,在磁力架上静置3分钟,吸弃上清,共重复2-4次;在离心管中再次加入0.5ml0.05mol/lmes缓冲液,继续在超声仪中进行超声处理,得到大小一致,形状完整以及分布均匀的磁微粒悬浮液;
2)磁微粒活化:在含有步骤(1)得到的磁微粒悬浮液的离心管中分别加入100μl的50mg/mlnhs溶液(n-羟基琥珀酰亚胺,现配现用)活化剂和100μl的50mg/mledac溶液(碳二亚胺,现配现用)活化剂,将上述活化反应液置于可调式旋转混合器上,于25~40rpm、37±2℃反应30min后,加入1mlheps缓冲液进行润洗,磁力架上重复洗涤3次,吸弃上清得到活化后磁微粒;
3)磁微粒偶联抗体:取四支含有步骤(2)得到的活化后磁微粒的离心管,相应加入10μg的抗人cd10、10μg的抗人cd19、10μg的抗人cd20和10μg的抗人cd33,将离心管密封后放入垂直旋转混合器上,于37℃,25~30rpm转速混匀12小时,分别得到包被了抗人cd10免疫磁微粒、抗人cd19免疫磁微粒、抗人cd20免疫磁微粒和抗人cd33免疫磁微粒;
4)封闭:称取一定量的甘氨酸,用h2o溶解配制成75mg/ml的封闭剂;用移液枪各吸取200μl封闭剂和200μl100mg/ml的bsa溶液迅速加入含有偶联抗体的免疫磁微粒的离心管中密封,在漩涡混合器上混匀后,将离心管放入垂直旋转混合器上,于37℃,25~30rpm转速封闭2小时;
5)洗涤:将离心管取下,加入1ml清洗液(含0.1%曲拉通、0.53%吐温20的0.9wt%氯化钠溶液)进行重悬,磁力架上静置3分钟吸弃上清,用清洗液重复洗涤3次后,加入1ml保存液进行重悬,磁力架上静置3分钟吸弃上清,用保存液(含1.6wt%bsa的heps液)重复洗涤2次,最后用1ml保存液重悬免疫磁微粒,得到无团聚的免疫磁微粒溶液;将洗涤后的包被了抗人cd10免疫磁微粒、抗人cd19免疫磁微粒、抗人cd20免疫磁微粒和抗人cd33免疫磁微粒按质量比1:1:4:4的比例进行混合,最终得到用于捕获幼稚细胞的免疫磁微粒混合液(2mg/ml)。
2、白血病幼稚细胞的捕获
1)样本预处理:取穿刺所得的患者骨髓,缓慢注入离心管中后进行密度梯度离心;吸取白膜层细胞,使用pbs缓冲液洗涤细胞2次,随后用3ml预处理液(含5wt%bsa的pbs液)对细胞进行重悬;
2)孵育结合:将重悬的细胞转入15ml离心管中加入500μl的免疫磁微粒混合液,轻微颠倒混匀数次;将离心管固定在垂直混合仪上,以8-10rpm的速度在37℃下孵育1.5h,使幼稚细胞和免疫磁微粒进行结合;
3)幼稚细胞的捕获:将重悬好液体的离心管,放置于免疫磁微粒捕获仪cellrichtm,进行细胞的捕获与分离。设置程序为:样本量为7.5ml,捕获速度为5.0ml/h,冲洗速度为7.0ml/h,捕获程序完成后小心的取出载玻片。
3、幼稚细胞的pd-l1蛋白检测
1)固定封闭:在捕获的细胞玻片上滴加丙酮(覆盖玻片),4℃固定20min,弃液后室温干燥5min;pbs缓冲液漂洗3次,每次2min;滴加3wt%过氧化氢静置15min以使内源性过氧化物酶灭活,然后用pbs缓冲液漂洗3次,每次2min;滴加封闭液(含有5vt%山羊血清的tbst缓冲液),37℃孵育20min,弃液;
2)孵育抗体:在细胞玻片上加入一抗覆盖细胞,4℃孵育过夜,弃液;pbst缓冲液漂洗3次,每次5min;加入酶标二抗覆盖组织,37℃孵育30min,弃液;pbst缓冲液漂洗3次,每次5min;其中一抗为浓度0.5mg/ml的型号为mab1561或ab205921的抗人pd-l1抗体,二抗为浓度0.8mg/ml的辣根过氧化物酶标记山羊抗鼠igg或辣根过氧化物酶标记山羊抗兔igg;
3)显色以及封片:在细胞玻片加入dab显色剂,室温静置5min,在镜下观察显色情况;用dh2o冲洗后,再使用0.01mpbs缓冲液进行漂洗2min,使用苏木素进行复染:苏木素染色2min,40℃温水20s显蓝,脱水透明,封片镜检。
结果分析:选用粒径为1μm,形状为圆形的磁微粒,与其他形状的磁微粒相比,其具有更大的表面积,能捕获结合更多的抗体。磁微粒悬浮液经过洗涤、活化、离心等步骤,去除了形状残缺,粒径过大的颗粒,提高了磁微粒和抗体的结合效率(78%),同时也节约了成本。磁微粒偶联抗体(抗人cd10、抗人cd19、抗人cd20、抗人cd33)后能在溶液中均匀分散,减少了团聚现象。使用该免疫磁微粒捕获时,因其高磁响应性能使捕获速度得到提升,捕获时间缩短了20min。实验结果如图3所示,细胞片中白血病幼稚细胞胞膜深染,pd-l1表达阳性。
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!