一种生物芯片的制作方法
本发明属于生物检测技术领域,具体涉及一种生物芯片。
背景技术:
在传统膜芯片的检测中,需要将每个检测样本一个一个地依次加入到芯片孔或槽中进行孵育。然后,将孵育后的样本从芯片孔或槽中一个一个地移除,并多次地将洗涤液依次加入用来检测的孔或槽中进行洗涤。洗涤之后,将反应液依次加入孔或槽中进行反应,反应后的液体需要一个一个地依次移除。在移除了反应后的液体之后,需要进行多次洗涤用来检测的孔或槽,并将孔或槽中的液体移除,保持干燥。之后,需要将作为检测信号的液体一个一个孔或槽地依次加入进行反应。反应之后,需要在每个孔或槽中依次加入中止液混匀来读取检测数据。
在传统玻璃芯片的检测中,需要把每个反应样本溶液加到芯片表面,然后把玻璃芯片封闭在塑料芯片盒里卡紧。芯片盒置于水浴锅加热几小时,或者空气浴加热过夜。之后取出芯片盒,拆开芯片盒并取出芯片,放到烧杯中。分两次加入洗涤液进行摇洗,之后取出芯片并吹干。之后再放入芯片扫描仪阅读。
因此,传统芯片在整个检测过程中,检测步骤多,检测时间长。
技术实现要素:
为解决上述技术问题,本发明提出的技术方案为:
一种生物芯片,包括:基托和以阵列的形式安装在基托上的若干芯片柄,芯片柄沿垂直于基托的方向相互平行地从所述基托中伸出,和布置在各个芯片柄的自由端处的用于标记检测探针的芯片反应界面。
作为上述技术方案的进一步改进:
在一个实施例中,芯片柄为塑料棒,检测探针直接标记在芯片柄的自由端处。
材质为塑料的芯片柄,检测探针直接标记在塑料棒的自由端处,结构简单,制作成本低。
在一个实施例中,芯片反应界面布置在处于与芯片柄的纵向垂直的平面内。
芯片反应界面布置在处于与芯片柄的纵向垂直的平面内,其横截面积大,因此尤其适用于反应槽为扁平的浅体容器的情况。这样,所有芯片的反应界面可以布置在同一个平面上,检测时,所有的芯片反应界面在显示检测结果时,可以一次同时成像,因此检测结果的阅读效率高,从而可以使阅读仪的设计更加简单,还可以降低成本。其次,浅体容器使得检测过程中,反应液的加热速度快,因此芯片反应速度也加快了,从而进一步增加了检测效率。再者,由于芯片反应界面与芯片柄的纵向垂直,即不管是探针与待测生物分子的反应步骤,还是探针在洗涤等其他步骤中,当芯片反应界面浸入溶液中时,所有的检测探针都维持在溶液中的同一个水平上,因此所有芯片反应界面与溶液的接触条件相同,芯片反应界面上的所有探针与溶液的接触条件也相同,故而在某种程度上进一步增加了测量的效率和检测结果的准确性,以及各待测溶液检测结果的横向比较的准确性。
在一个实施例中,芯片柄为长条状,并且在其自由端的端面上设有用于固定芯片反应界面的夹具。
通过夹具可以确保芯片反应界面处于与芯片柄的纵向垂直的平面内且牢靠地固定在芯片柄上。
夹具为包括安装在芯片柄的自由端上的第一支架,以及能够与第一支架配合而将芯片反应界面固定于其间的第二支架。
互相配合的两个支架构造简单,使用方便,且能够实现简单快速地装配和更换芯片反应界面的效果。
在一个实施例中,芯片柄为长条状,并且在其自由端的端面上设有安装孔。芯片反应界面布置在所述安装孔内。
直接将芯片反应界面布置在芯片柄自由端断面上的安装孔内的构造简单。芯片反应界面可以通过卡接、粘结等方式布置在安装孔内。
在一个实施例中,芯片柄为塑料棒,并且在其自由端设有固定孔。芯片反应界面为片材,并且设有用于与固定孔相互配合的固定柱。该实施方式中,芯片反应界面特别易于更换,其可以与固定柱一同更换。安装简单,只要将芯片反应界面上的固定柱插入芯片柄的固定孔即可。并且,由于芯片反应界面为片材,使得反应面积足够大,可以在其上固定大量的检测探针,实现多种生物分子的同时检测。此外,如前所述,所有的探针在检测过程中始终处于同一水平上,从而检测结果更加精确。
在一个实施例中,芯片反应界面构造为磁珠。芯片柄包括自由端的端面封闭的非磁性套筒,以及布置在套筒内的磁性棒。该实施方式具有特别突出的优势,因为可以利用磁性原理,通过磁珠实现先进的生物分子检测方式,例如可以采用双抗夹心的检测方式,结合化学发光免疫检测方法来高效、准确地测定生物分子。其次,在本发明中,采用磁性棒-非磁性套筒-磁珠的配合方式,磁珠可以随时被磁性棒吸附或解吸附于非磁性套筒上,从而在检测过程中,磁珠可以脱离非磁性套筒而自由地分散在溶液中,期间可以搅拌或者采取其他措施,使得磁珠与溶液充分地接触反应,优化磁珠上的探针与溶液中待测生物分子的反应效果,进而提高检测精确度。此外,该实施方式中,芯片反应界面,即固定有检测探针的磁珠,尤其容易更换,不需要辅助其他的拆卸、安装工艺,也因此更适合多批量的检测。
芯片反应界面标记的探针为1~500个,优选为1~50个。
基托为带有若干孔的矩形基托,各个孔构造成能够与相应的一个芯片柄的安装端可拆卸式地卡接。
使用根据本发明生物芯片进行检测时,所有的样本、反应液和洗涤液都预配好放置在反应槽内,不需要来回移动加入或移除,仅仅只需在盛放样本、反应溶液和洗涤溶液的反应槽之间来回移动生物芯片就可以了。相比现有技术中芯片检测需要每个样本一个一个依次加入、每个反应液一个一个依次加入,反应后的液体一个一个地依次移除,洗涤液一个一个依次加入、移除的繁多步骤,本发明涉及的生物芯片节省了大量检测步骤和操作时间。并且,这种生物芯片在反应槽之间的来回移动可以通过自动化芯片检测仪器操作,操作时间可以进一步减少。
同时,上面所述的基托可以将连接芯片反应界面的的芯片柄串联起来,实现不同芯片间的组合。这样,可以确保检测同一批样本的同一组芯片在每个步骤中都是同步操作,可以进一步节省检测中的步骤和检测时间。其次,由于基托可以确保同一组芯片相互之间可以保持确定的间距,可以防止不同反应液间的交叉造成芯片间的相互污染。这种组合的三维芯片同步操作,能够消除不同样本间的反应时间差异,减少操作的误差率。同时相比现有技术,由于降低了使用移液器的频率和减少了耗材tip头的使用量,从而降低了成本。
附图说明
在下文中将基于实施例并参考附图来对本发明进行更详细的描述。其中:
图1示意性显示了本发明中实施例1的生物芯片;
图2显示了本发明示例1中探针在膜上的排布示意图和检测结果。其中,图2a是探针在膜上的排布示意图,图2b是样本01的检测信号图,图2c是样本02的检测信号图;
图3示意性显示了本发明中实施例2的生物芯片;
图4显示了本发明示例2中探针在芯片反应界面上的排布示意图和检测结果。其中,图4a是探针在膜上的排布示意图,图4b、4c、4d分别是样本03、04、05的检测信号图;
图5示意性显示了可用于本发明中的另一种芯片柄3;
图6示意性显示了可用于本发明中的另一种芯片柄4;
图7显示了本发明示例4中探针在芯片反应界面上的排布示意图和检测结果。其中,图7a是探针在膜上的排布示意图,图7b、7c分别是样本08、09的检测信号图;
图8示意性显示了可用于本发明中的另一种芯片柄5;
图9显示了示例5中甲状腺激素检测结果线性图。
在附图中,相同的部件使用相同的附图标记。附图并未按照实际的比例绘制。
具体实施方式
下面将结合附图和具体实施例对本发明作进一步详细说明,但并不因此而限制本发明的保护范围。
实施例1
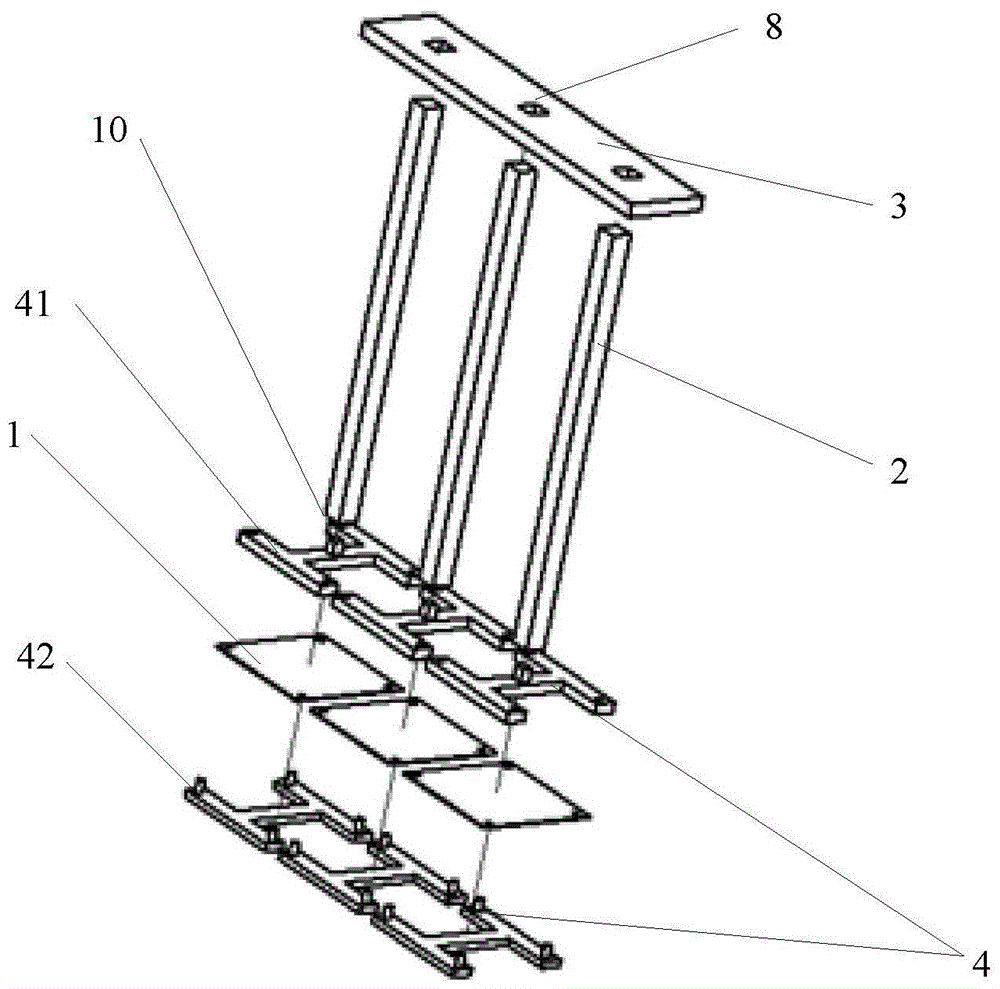
图1示意性显示了本发明的一个实施例的生物芯片10。如图1所示,本实施例的生物芯片10包括基托3。在该实施例中,基托3为长条形板状,其中开有若干个孔8。孔8优选地呈阵列式布置。生物芯片10还包括若干芯片柄2。在该实施例中,芯片柄2为细长的长方体,其数量优选地与孔8的数量一一对应。每个芯片柄2均可插入到一个对应的孔8中,并被固定地夹持住。容易理解,可以使用多种方式来将芯片柄2固定在基托3中,例如卡接、胶粘等。在一个未示出的实施例中,芯片柄2以可拆卸的方式固定到基托3上。
根据本发明,生物芯片10还包括用于标记检测探针的芯片反应界面1。芯片反应界面1布置在处于与芯片柄2的纵向垂直的平面内。如图所示,在芯片柄2的自由端的端面上设有用于固定芯片反应界面的夹具4。通过夹具可以确保芯片反应界面处于与芯片柄的纵向垂直的平面内且牢靠地固定在芯片柄上。夹具4为包括安装在芯片柄2的自由端上的第一支架41,以及能够与第一支架41配合而将芯片反应界面1固定于其间的第二支架42。第一支架41和第二支架42构造为具有中空区域的支架,例如工字形支架,从而能使芯片反应界面1通过其中空区域而露出。这种夹具4的构造简单,使用方便,且能够实现简单快速地装配和更换芯片反应界面1的效果。
芯片反应界面1可以是标记了检测探针的nc膜,也可以为尼龙膜、塑料、玻璃、陶瓷,等等。芯片反应界面1标记的探针可以为1到500个,优选为1~50个。
使用根据本发明生物芯片进行检测时,上面所述的基托可以将连接芯片反应界面的的芯片柄串联起来,实现不同芯片间的组合。这样,可以确保检测同一批样本的同一组芯片在每个步骤中都是同步操作,可以节省检测中的步骤和检测时间。
由于基托可以确保同一组芯片相互之间保持确定的间距,可以防止不同反应液间的交叉造成芯片间的相互污染。这种组合的三维芯片同步操作,能够消除不同样本间的反应时间差异,减少操作的误差率。同时相比现有技术,由于降低了使用移液器的频率和减少了耗材tip头的使用量,从而降低了成本。
其次,使用根据本发明生物芯片进行检测时,所有的样本、反应液和洗涤液都预配好放置在反应槽内,不需要来回移动加入或移除,仅仅只需在盛放样本、反应溶液和洗涤溶液的反应槽之间来回移动生物芯片就可以了。相比现有技术中芯片检测需要每个样本一个一个依次加入、每个反应液一个一个依次加入,反应后的液体一个一个地依次移除,洗涤液一个一个依次加入、移除的繁多步骤,本发明涉及的生物芯片节省了大量检测步骤和操作时间。并且,本发明涉及的生物芯片在反应槽之间的来回移动可以通过自动化芯片检测仪器操作,操作时间可以进一步减少。
再次,芯片反应界面布置在处于与芯片柄的纵向垂直的平面内,其横截面积大,因此尤其适用于反应槽为扁平的浅体容器的情况。这样,所有芯片的反应界面可以布置在同一个平面上,检测时,所有的芯片反应界面在显示检测结果时,可以一次同时成像,因此检测结果的阅读效率高,从而可以使阅读仪的设计更加简单,还可以降低成本。其次,浅体容器使得检测过程中,反应液的加热速度快,因此芯片反应速度也加快了,从而进一步增加了检测效率。
下面通过一个具体的示例来介绍根据本发明实施例的生物芯片的应用,其中采用如图1所示的生物芯片。
示例1
在本示例中,采用如图1所示的生物芯片来进行人乳头瘤病毒基因分型的鉴定,具体用来检测常见型别hpv核酸(hpv16、hpv18、hpv6、hpv11)。
hpv16和hpv18属于最常见高危型人乳头瘤病毒,引起妇女宫颈癌;hpv6和hpv11属于最常见低危型危型人乳头瘤病毒,引起尖锐湿疣。目前已经有了针对这4个型别的人乳头瘤病毒疫苗。
以下介绍使用如图1所示的生物芯片来进行人乳头瘤病毒鉴定的方法的各步骤。
步骤1:固定有hpv基因分型探针的芯片反应界面的制作
设计合成各hpv探针:
hpv16探针序列:ttttttttttctgaagtagatatggcagc
hpv18探针序列:tttttttttttattgcccaggtacagga
hpv6探针序列:ttttttttttggaagatgtagttacgga
hpv11探针序列:ttttttttttcagatttagacacakatgc
阳性对照探针:ttttttttttaactgcagcttggactacgc
阴性对照探针:ttttttttttatgcctttaagcatggca
阳性对照靶序列:gcgtagtccaagctgcagtt(生物素标记,能够与阳性对照探针杂交反应)
探针溶液配制:使用te缓冲溶液(采用tris和edta配制形成的缓冲液)将探针配制并稀释成10μm浓度。
探针在膜芯片(芯片反应界面1)上的固定:在硝酸纤维素膜(10×ssc缓冲液浸泡5min,烘干)点样,取上面6个探针溶液各1μl点到膜上,于80℃烘干2hr。制造两片固定上述探针的膜。
探针在膜上的排布示意图见图2a。
将固定探针的膜片夹到塑料棒(芯片柄2)末端,并与塑料棒垂直,用工字形支架夹住,连接到基托的末端固定好。干燥密封,保存。检测时,塑料棒末端的膜片浸泡在溶液中进行芯片杂交、洗涤和显色等操作。
步骤2:检测样本准备
样本01:hpv16核酸样本
样本02:hpv11核酸样本
使用hpv通用引物序列、taq酶等配制pcr体系扩增样本01、样本02。上游引物序列y03:gaaaaataaactgtaaatcatattc(生物素标记);下游引物序列y04:tttgttactgtggtagatactac,配制成20μm浓度。
pcr扩增反应体系配制(50μl):
pcr反应程序:95℃,5min;95℃,1min,50℃,0.5min,65℃,1min,35cycles;72℃,5min。pcr产物-20℃贮存备用。
步骤3:检测
1)取2个1.5mlep管,做好标记,加入常用磷酸缓冲液(3×sspe)1ml,和阳性对照序靶列10μl(10μm)。然后取20μl的2个样本(01和02)的pcr产物加入,于95℃加热10min变性,取出置于冰水混合物处理。
2)准备一块24孔板,选择2个孔做好标记,将1)处理后的样本对应加到孔内。
3)取出2个制备的膜芯片,作标记。然后分别插入上面两个孔内,置于48℃水浴锅内孵育1hr。
4)将膜芯片取出,转入到另外两个加有1ml缓冲液1(0.1mtris-hcl,ph7.5;0.1mnacl)的孔内,摇洗2min。
5)重复一遍检测步骤4)。
6)将膜芯片取出,转入到另外两个加有1ml链酶亲和素溶液(1μg/ml,用加有3%牛血清白蛋白(bsa)的缓冲液1稀释)的孔内,42℃水浴锅内孵育30min。
7)将膜芯片取出,转入到另外两个加有1ml缓冲液2(0.1mtris-hcl,ph9.5;0.1mnacl;50mmgcl2)的孔内,摇洗2min。
8)重复一遍检测步骤7)。
9)将膜芯片取出,转入到另外两个加有0.5ml显色液(nbt溶液和bcip溶液混合液)的孔内,常温显色10min。
10)将膜芯片取出,于水中涮洗两次,判读结果。
检测结果见图2和下表1。
表1
本示例使用了两个芯片反应界面分别同时测定两个样本,依次类推,可以根据需要增加芯片反应界面数目和待测样本数目,通过同时操作,所有待测样本可被同时检测,提高检测效率。
实施例2
图3示意性显示了本发明的一个实施例的生物芯片11。如图3所示,本实施例的生物芯片11包括基托31。在该实施例中,基托31为板状,其中开有若干个孔81。孔81优选地呈阵列式布置。生物芯片11还包括若干芯片柄21。在该实施例中,芯片柄21为细长的长方体,其数量优选地与孔81的数量一一对应。每个芯片柄21均可插入到一个对应的孔81中,并被固定地夹持住。容易理解,可以使用多种方式来将芯片柄21固定在基托31中,例如卡接、胶粘等。在一个未示出的实施例中,芯片柄21以可拆卸的方式固定到基托31上。
根据本发明,生物芯片11还包括用于标记检测探针的芯片反应界面12。芯片反应界面12布置在处于与芯片柄21的纵向垂直的平面内。如图所示,芯片柄21为长条状,并且在其自由端的端面上设有安装孔5。每个芯片反应界面12布置在一个对应的安装孔5内。这种芯片柄21的构造简单,安装方便。
芯片反应界面12为玻璃芯片。芯片反应界面12标记的探针可以为1到8个。
下面通过一个具体的示例来介绍根据本发明实施例的生物芯片的应用,其中采用如图3所示的生物芯片。
示例2
在本示例中,采用如图3所示的生物芯片来进行分枝杆菌鉴定,检测4种分枝杆菌核酸。临床能够引起的结核病的分枝杆菌属有很多种,其中常见的有结核分枝杆菌、鸟分枝杆菌、胞内分枝杆菌和堪萨斯分枝杆菌等。
本示例2中的芯片反应界面为玻璃芯片,检测信号的方式采用荧光标记方式。本示例2中,固定了分枝杆菌探针的玻片嵌入塑料棒的末端孔内,与塑料棒垂直。检测时,使塑料棒末端的玻片浸泡在溶液中进行芯片杂交、洗涤和荧光信号扫描等操作。
以下介绍使用如图3所示的生物芯片来进行分枝杆菌鉴定鉴定的方法的各步骤。
步骤1:分枝杆菌鉴定基因分型玻璃芯片的制作
设计合成各分枝杆菌种的探针:
结核分枝杆菌探针tbttttttttttttttttttttaagacatgcatcccgt
鸟分枝杆菌探针:ttttttttttttttttttttcatgcgtcttgaggtc
胞内分枝杆菌探针:ttttttttttttttttttttaagacatgcgcctaaa
堪萨斯分枝杆菌探针:ttttttttttttttttttttcgccaagtggtcctat
阳性对照探针:ttttttttttttttttttttaactgcagcttggactacgc
阴性对照探针:ttttttttttttttttttttatgcctttaagcatggca
阳性对照靶序列:gcgtagtccaagctgcagtt(5’端荧光素cy3标记,能够与阳性对照探针杂交反应)
探针溶液配制:使用te溶液将探针配制、稀释成10μm浓度。
探针在玻片上的固定:点样,取上面6个探针溶液各0.2μl点到氨基修饰玻片上。将点样后的基片置于80℃烘箱中保温80分钟增强固定效果。将固定好探针的芯片,浸在60℃的超纯水中摇洗1分钟,晾干备用。
探针排布方式见图4a。
将固定探针的玻片嵌入到塑料棒末端孔内,连接到塑料棒固定好。干燥密封,-20℃保存。
步骤2:检测样品准备
样本03:鸟分枝杆菌核酸样本
样本04:胞内分枝杆菌核酸样本
阴性样本05:无菌水
使用16sdna基因的引物序列、taq酶等配制pcr体系扩增样本03、样本04。
上游引物序列y01:ggtggctcaggacgaacg(5’端荧光素cy3标记);下游引物序列y02:ggcttgcgcccattgtg,配制成20μm浓度。
pcr扩增反应体系配制(50μl):
pcr反应程序:95℃,10min;95℃,2min,50℃,1min,68℃,1min,35cycles;72℃,5min。pcr产物-20℃贮存备用。
步骤3:检测
1)取3个1.5mlep管,做好标记,加入常用磷酸缓冲液(3×sspe)1ml,和阳性对照序靶列10μl(10μm)。然后取20μl的2个样本(03、04和05)的pcr产物加入,于95℃加热10min变性,取出置于冰水混合物处理。
2)准备一块24孔板,选择3个孔做好标记,将(1)处理后的样本对应加到孔内。
3)取出3个制备的芯片,作标记。然后分别插入上面3个孔内,置于48℃水浴锅内孵育0.5hr。
4)将玻璃芯片取出,转入到另外3个加有1ml0.2×ssc溶液(ph7.0,每1000ml溶液含有1.75gnacl,0.88g柠檬酸钠)的孔内,摇洗2min。
5)将玻璃芯片转入纯水中摇洗2min。
6)取出玻璃芯片,吹干,取下嵌入的玻片,把玻片放入芯片荧光扫描仪内扫描荧光信号判读结果。
检测结果见下表2和图4。
表2
本示例使用了三个芯片反应界面分别同时测定三个样本,依次类推,可以根据需要增加芯片反应界面数目和待测样本数目,通过同时操作,所有待测样本可被同时检测,提高检测效率。
图5示意性显示了可用于本发明中的另一种芯片柄22。该芯片柄22构造为塑料棒。各塑料棒的一端安装在基托上,检测探针直接标记在塑料棒的自由端处。这种构造简单,制作成本低。
下面通过一个具体的示例来介绍使用本芯片柄构造的生物芯片的应用,其中采用如图5所示的生物芯片。
示例3
在本示例中,采用如图5所示的芯片柄构造的生物芯片来进行乙肝表面抗原(hbsag)双抗体夹心法检测。芯片柄的材料为聚苯乙烯(polystyrene,缩写ps),直径1~10mm,末端标记抗-hbsag抗体。
以下介绍使用如图5所示的芯片柄构造的生物芯片来进行乙肝表面抗原(hbsag)双抗体夹心法检测的方法的各步骤。
步骤1:塑料芯片棒末端包被抗-hbsag抗体
在试管中,将抗-hbsag用0.05mol/l,ph9.6碳酸盐缓冲液稀释至工作浓度3μg/ml,即为包被液。将塑料芯片棒末端浸入到包被液中,37℃孵育2hr;将芯片棒转入加有碳酸盐溶液的试管,摇洗;再将芯片棒转入含有1%bsa碳酸盐溶液(250μl/试管),37℃孵育2hr;将芯片棒转入加有碳酸盐溶液的试管,摇洗,干燥后备用。
步骤2:检测
1)取出3个芯片检测棒并作标记。在3个试管(或96孔板的3个孔)内加入待测样本h1、h2、和h0。其中h0为标本稀释液5%bsa-0.1mpbs,ph7.2。将这些芯片棒对应加入不同管内,37℃孵育30min。
2)将3个芯片检测棒同时地分别转入已经加有洗液的一组试管(3个),洗液为0.02m、ph7.4的tris-hcl溶液,含有0.1%tween20,摇洗3min;然后芯片检测棒转入第二组盛有洗液的试管(3个),摇洗3min;芯片检测棒再转入第三组盛有洗液的试管(3个),摇洗3min。
3)将3个芯片检测棒分别转入已经加有稀释(1:5000)酶标抗体(抗hbsag-hrp)的一组试管(3个),37℃孵育30min。
4)重复检测步骤2)。
5)将3个芯片检测棒分别转入已经加有显色液h2o2和显色液四甲基联苯胺(tmb)的一组试管(3个,做好标记)。室温反应15min。
6)移走芯片检测棒,加入中止液(0.1m硫酸溶液)混匀,在450nm波长处测定各孔的od值。
检测结果见下表3。
表3
可见,采用本发明提供的检测方法来检测乙肝表面抗原,获得了精确的检测结果。本示例3使用了三个芯片反应界面分别同时测定三个样本,依次类推,可以根据需要增加芯片反应界面数目和待测样本数目,通过同时操作,所有待测样本可被同时检测,提高检测效率。
对照示例1:传统elisa方法检测乙肝表面抗原
步骤1:酶标板包被
将抗-hbsag用0.05mol/l用0.05mol/l,ph9.6碳酸盐缓冲液稀释至工作浓度3μg/ml,即为包被液。取空白96孔酶标板加入包被液,37℃孵育2hr;弃去包被液并用碳酸盐溶液洗涤然后加入含有1%bsa碳酸盐溶液(250μl/孔),37℃孵育2hr;弃去封闭液并用碳酸盐溶液洗涤,干燥后备用。
步骤2:检测
1)取出酶标板并作标记。在三个孔内逐个地加入待测样本h4、h5和h0b其中h0b为标本稀释液5%bsa-0.1mpbs,ph7.2。37℃孵育30min。h4、h5和h0b的组成分别与h1、h2和h0相同。
2)用移液枪将三个孔中的液体逐个地洗出弃去,然后用移液枪吸取洗液对三个孔逐个地洗涤3次,再逐个吸出洗涤液。
3)用移液枪逐个孔地加入稀释好的酶标抗体(抗hbsag-hrp,100μl/孔,1:5000稀释度),37℃孵育30min。
4)重复检测步骤2),并将孔中液体拍干。
5)用移液枪逐个孔地加入显色液h2o2和显色液四甲基联苯胺(tmb),室温反应15min。
6)用移液枪逐个孔地加入中止液(0.1m硫酸溶液)混匀,读取光密度。
检测结果如下表4所示:
表4
由表3和表4结果可见,利用本发明提供的生物芯片对乙肝表面抗原的检测结果与采用传统的elisa方法检测的检测结果相当。但是,从检测过程来看,本发明提供的检测方法却比传统的elisa检测方法明显方便,省去了每一个处理步骤中需要逐个孔进行处理的繁琐步骤,从而极大提高了检测效率;并且,由于多个样本的每一个处理步骤的同步进行,相比较于传统的逐个处理,本发明检测方法避免了样本之间的交叉感染的可能性。示例3和对照示例1仅仅示意性地对3个样本进行检测,当需要大排量地检测多个、例如数十个甚至数百个样本时,本发明的上述优势将更加突出。
图6示意性显示了可用于本发明中的另一种芯片柄23。芯片柄23构造为塑料棒,并且在其自由端设有固定孔6。芯片反应界面13为片材,并且设有用于与固定孔6相互配合的固定柱7。芯片反应界面13布置在处于与芯片柄23的纵向垂直的平面内。
下面通过一个具体的示例来介绍使用本芯片柄构造的生物芯片的应用。
示例4
在本示例中,采用如图6所示的芯片柄构造的生物芯片检测4种hpv核酸,hpv16、hpv18、hpv6和hpv11。
本示例4中以塑料芯片为芯片反应界面,信号检测方式采用hrp催化化学发光方法。固定了hpv探针核酸的聚苯乙烯(ps)材料制作的圆形薄片,通过中心的固定柱嵌入到塑料棒末端的固定孔7内,与塑料棒垂直。检测时,使固定的膜片浸泡在溶液中进行芯片杂交、洗涤和化学发光等操作。ps材料可以吸附蛋白,包括链酶亲和素(sa)等,然后通过把生物素标记的核酸与sa结合来固定探针。
以下介绍使用如图6所示的芯片柄构造的生物芯片来检测4种hpv核酸,hpv16、hpv18、hpv6、hpv11的方法的各步骤。
步骤1:hpv基因分型水平式塑料芯片的制作
设计合成各hpv探针:
hpv16探针序列:bio-ctgaagtagatatggcagc
hpv18探针序列:bio-attgcccaggtacagga
hpv6探针序列:bio-ggaagatgtagttacgga
hpv11探针序列:bio-cagatttagacacakatgc
阳性对照探针:bio-aactgcagcttggactacgc
阴性对照探针:bio-atgcctttaagcatggca
阳性对照靶序列:dig-gcgtagtccaagctgcagtt(地高辛标记,能够与阳性对照探针杂交反应)
探针溶液配制:使用te溶液将探针配制、稀释成5μm浓度。
定制加工的圆形塑料(ps材料)片的预处理:把超声清洗过的塑料芯片晾干,转入1μg/ml链酶亲和素溶液(用ph7.0,100mmtris溶液稀释),于37℃孵育1hr,再转入ph7.0,100mmtris溶液中摇洗5min,再转入纯水摇洗5min。
探针在圆形塑料片上的固定:取上面6个探针溶液各0.5μl点到塑料片上,保湿于37℃孵育1hr。将圆片转入纯水中摇洗2min,晾干。
探针排布方式见图7a。
将固定探针的圆形塑料片嵌入到塑料棒末端。干燥密封,保存。
步骤2:检测样品准备
样本08:hpv16核酸样本
样本09:hpv11核酸样本
使用hpv通用引物序列、taq酶等配制pcr体系扩增样本08、样本09。上游引物序列y03d:gaaaaataaactgtaaatcatattc(地高辛标记);下游引物序列y04:tttgttactgtggtagatactac,配制成20μm浓度。
pcr扩增反应体系配制(50μl):
pcr反应程序:95℃,5min;95℃,1min,50℃,0.5min,65℃,1min,35cycles;72℃,5min。pcr产物-20℃贮存备用。
步骤3:检测
1)取2个1.5mlep管,做好标记,加入常用磷酸缓冲液(3×sspe)1ml,和阳性对照序靶列10μl(10μm)。然后取20μl的2个样本(08和09)的pcr产物加入,于95℃加热10min变性,取出置于冰水混合物处理。
2)准备一块24孔板,选择2个孔做好标记,将1)处理后的样本对应加到孔内。
3)取出2个制备的塑料芯片并作标记。然后分别插入上面两个孔内,置于48℃水浴锅内孵育1hr。
4)将塑料芯片取出,转入到另外两个加有1ml缓冲液3(0.1mtris-hcl,ph7.5;0.15mnacl)的孔内,摇洗2min。
5)重复一遍检测步骤4)。
6)将塑料芯片取出,转入到另外两个加有缓冲液3稀释的抗dig-hrp至150mu/ml(解释:150毫单位每毫升)的孔内,室温孵育30min。
7)将塑料芯片取出,转入到另外两个加有缓冲液3的孔内,摇洗2min。
8)将塑料芯片取出,转入到另外两个加有1ml缓冲液4(0.1mtris-hcl,ph9.5;0.15mnacl,10mmmgcl2)的孔内,摇洗2min。
9)将塑料芯片取出,转入到另外两个加有0.2ml发光液(由发光液i(氨基苯二甲酰胺,增强剂)和发光液ii(氧化剂)混合而成的孔内,使用化学发光仪从空的底部纪录发光信号。从底部用冷ccd(如天能化学发光成像系统)成像。
检测结果见下表5和图7。
表5
本示例中,一个芯片能够同时检测多个指标,是用于临床检测的一个极佳的选择。
图8示意性显示了可用于本发明中的另一种芯片柄24。芯片柄24包括自由端的端面封闭的非磁性套筒241,以及布置在套筒内的磁性棒242。芯片反应界面14构造为磁珠。当将磁性棒242插入到套筒241内时,可以磁性棒242对磁珠施加磁性吸引力,导致磁珠被吸附到套筒241的端面上。由此,可以进行后续的操作。当操作结束后,可以将磁性棒242从套筒241中抽出,则磁珠会从套筒241上脱落,以用于后续处理。
下面通过一个具体的示例来介绍使用本芯片柄构造的生物芯片的应用。
示例5
在本示例中,采用如图8所示的芯片柄构造的生物芯片检测甲状腺激素(tsh)。
甲状腺激素(tsh)是调控甲状腺细胞生长和甲状腺激素合成及分泌的主要因子,通过检测血tsh水平可以反映甲状腺功能状态,有助于甲状腺疾病的筛查、诊断、治疗效果评判和预后判断。
本示例5相关参数如下:双抗体夹心法;酶促化学发光,其中使用辣根过氧化物酶(hrp)标记tsh抗体,选择鲁米诺、过氧化氢作为发光底物。当磁棒插入到中空塑料棒底部时,磁珠被吸附塑料棒末端,当抽离磁棒时,磁珠就会脱离塑料棒,脱落下来。把用于捕获的抗体--抗tsh单克隆抗体包被在磁珠上,通过碳二亚胺把抗体连接到羧基化磁珠上,另一个抗体则用于标记hrp。
以下介绍使用如图8所示的芯片柄构造的生物芯片来检测甲状腺激素(tsh)的方法的各步骤。
步骤1:磁珠的包被以及磁珠吸附芯片的组装
磁珠的活化:取1mg羧基磁珠(约100μl磁悬液)于离心管中,在样品混合仪上震荡5~10min;将离心管置于磁分离架上,待磁珠完全被吸附,把上清液抽掉;加入1ml15mmmes(ph6.0)溶液洗涤磁珠,重复洗涤一次;使用100μl15mmmes(ph6.0)重悬磁珠,再加入100μl(10mg/ml)碳二亚胺(edc)溶液,使用预冷的溶液配制,现配现用;混合均匀,室温条件下,在样品混合仪上活化30min。
磁珠包被:使用1ml的15mmmes(ph6.0)洗涤活化后的磁珠一遍,磁分离,弃上清;加入500μl含抗tsh单克隆抗体(50μg)的15mmmes(ph6.0)溶液,室温反应过夜,得到免疫磁珠。
保存:用1ml的pbst洗涤包被后的磁珠2遍,用1ml含0.1%牛血清白蛋白的pbs重悬磁珠。将磁棒插入中空塑料棒内,插入保存有抗tsh标记磁珠的离心管底部,待吸附完全后,取出,密封,4℃备用。
步骤2:辣根过氧化物酶标tsh抗体的制备
用过碘酸钠法制备辣根过氧化物酶标tsh抗体,然后用0.01mph7.4的磷酸盐缓冲液透析过夜后,加入等量的甘油于-20℃保存。辣根过氧化物酶与抗tsh单克隆抗体的投料比分别为1:2。
步骤3:检测
1)tsh抗原标准品的配制
将tsh抗原标定后溶于灭活小牛血清中,配制成tsh为0、0.1、0.5、4、10、20、50miu/l的标准溶液。
2)取出6个磁珠吸附芯片检测棒并作标记。在化学发光板的6个孔内加入各100μl的上面6个标准品样本,并各加入100μl稀释了1:1000的辣根过氧化物酶标tsh抗体。将这些芯片棒对应加入不同管内,抽走芯片棒,磁珠散落到溶液中,再移走塑料棒,振荡混匀使得磁珠分散到溶液中,37℃孵育40min。
3)将磁棒插入中空塑料棒,转入到反应液中,轻轻搅动,使得溶液中的磁珠重新吸附到塑料棒末端。
4)将6个磁珠吸附芯片检测棒再分别转入已经加有洗液的6个孔内,洗液为0.02m、ph7.4的tris-hcl溶液,含有0.1%tween20,每孔250μl。抽走芯片棒,磁珠散落到溶液中,再移走塑料棒,振荡混匀使得磁珠分散到溶液中,摇洗3min。
5)重复步骤3)、步骤4)2次。
6)将磁棒插入中空塑料棒,转入到反应液中,轻轻搅动,使得溶液中的磁珠重新吸附到塑料棒末端。
7)将6个芯片检测棒分别转入加有200μl鲁米诺化学发光液的孔内中,抽走芯片棒,磁珠散落到溶液中,再移走塑料棒,振荡混匀使得磁珠分散到发光溶液中,将化学发光板置入化学发光仪检测发光计数。
检测结果见下表6:
表6
可见,采用本发明提供的如图8所示的芯片柄构造的生物芯片,配合多样本同步测量的检测方法来检测人促甲状腺激素,获得了精确的检测结果(获得了良好的线性关系,如图9所示)。本示例5使用了六个芯片反应界面分别同时测定六个样本,依次类推,可以根据需要增加芯片反应界面数目和待测样本数目,通过同时操作,所有待测样本可被同时检测,提高检测效率。
进一步地,同时测量20个“零”标准的发光计数率,求出∑x=2sd在标准曲线上查出该法的最低检测限0.02miu/l,说明本法获得了较高的灵敏度。
虽然已经参考优选实施例对本发明进行了描述,但在不脱离本发明范围的情况下,可以对其进行各种改进并且可以用等效物替换其中的部件。尤其是,只要不存在结构冲突,各个实施例中所提到的各项技术特征均可以任意方式组合起来。本发明并不局限于文中公开的特定实施例,而是包括落入权利要求范围内的所有技术方案。
- 还没有人留言评论。精彩留言会获得点赞!