一种粒径可控的荧光聚多巴胺纳米粒子的制备以及胰蛋白酶的检测的制作方法
本发明涉及荧光聚多巴胺纳米粒子的应用领域,具体地,涉及一种基于聚多巴胺纳米粒子的荧光在鱼精蛋白作用下聚集诱导猝灭的荧光方法检测胰蛋白酶。
背景技术:
(1)蛋白酶是一种蛋白水解酶,它涉及各种生物学和生理过程,包括消化,凝血,细胞凋亡和一系列其他细胞活动。胰蛋白酶(try)作为最重要的消化蛋白酶之一,在调节胰腺外分泌功能中起着重要作用。try在急性胰腺炎,囊性纤维化和胰腺癌中过表达。因此,try已被认为是上述疾病的生物标记。
(2)测定胰蛋白酶的方法有很多,包括酶联免疫吸附测定,比色法,化学发光法,电化学免疫测定法,光电化学和荧光法。其中,荧光法具有简便,灵敏度高,快速实施和实时检测等优点,因此更具吸引力和前景。迄今为止,已经报道了基于金纳米颗粒,共轭聚合物点和有机染料的try荧光检测方法。其中的大多数方法是根据try对荧光探针和蛋白质之间相互作用的调节而设计的,以通过荧光共振能量转移或内部过滤效应或聚集的相互作用形式来诱导荧光变化。因此,开发蛋白质与特异性探针之间合适的相互作用体系是胰蛋白酶检测的关键。
(3)建立一种特定荧光性质的量子点,通过尺寸、表面性质合理设计,实现量子点与蛋白质等相互作用实现可调的发光变化,从而根据胰蛋白酶的酶切作用而调节的荧光再次变化,有望建立一种通过简单混合操作的胰蛋白酶测定新方法。
(4)多巴胺作为一种生物神经递质,可以通过共价键,氢键和π-π相互作用变成具有形态可调的聚多巴胺(pda)。pda由于其出色的生物相容性,已成为一种新型的生物聚合物材料,用于生物医学,表面涂层,污水处理等领域。与用作生物分析的普通的大尺寸非荧光聚多巴胺探针载体相比,由某些受控合成方法将pda分解为具有荧光的聚多巴胺纳米颗粒(f-pda)转化为生物分析应用。然而,关于f-pda与生物大分子(如蛋白质)相互作用而建立的分析策略却几乎没有。
技术实现要素:
(1)有鉴于此,本发明的目的是通过加入胰蛋白酶特异性水解与pdnps结合的鱼精蛋白(pro),恢复pdnps的荧光,以此建立荧光方法检测胰蛋白酶,该方法操作简单,灵敏度高。
(2)为了实现上述目的,一种粒径可控的荧光聚多巴胺纳米粒子的制备方法,其特征在于,包括如下步骤:将多巴胺(da)和三羟甲基氨基甲烷(tris)混合搅拌,自聚合成聚多巴胺纳米颗粒(pdananoparticles),之后加入h2o2和naoh加热回流,将最终产物用截留分子量为3500da的透析袋透析便得到荧光聚多巴胺纳米粒子(pdnps)。
所述三羟甲基氨基甲烷(tris)加入hcl调节溶液ph为8.5,搅拌20小时。
所述的制备方法,其特征在于,加入h2o2和naoh加热回流30min后制得pdnps。
所述的pdnps最大激发波长为340nm,最大发射波长为435nm。
本发明上述的制备方法制得荧光聚多巴胺纳米粒子(pdnps)。
本发明所述的荧光聚多巴胺纳米粒子检测胰蛋白酶的检测方法,通过荧光分光光度法对加入不同浓度胰蛋白酶前后pdnps的荧光进行检测,其特征在于,所述荧光分光光度法中使用的溶液由缓冲溶液、权利要求5所述的荧光聚多巴胺纳米粒子(pdnps)、鱼精蛋白和胰蛋白酶混合而成。
在缓冲溶液、pdnps、鱼精蛋白和胰蛋白酶溶液中,鱼精蛋白(pro)浓度在10~80μg/ml范围内和pdnps、鱼精蛋白和胰蛋白酶的反应时间在0.1~20分钟范围内进行优化。
所述的检测方法,其特征在于,选择最佳pro浓度为40μg/ml,最佳反应时间20min。
所述的检测方法,其特征在于,缓冲溶液为pbs,缓冲溶液浓度为10mm、ph为8.0,胰蛋白酶(try)、pdnps和鱼精蛋白溶液在混匀后于室温下孵育10min后,再进行荧光检测。
通过所述荧光分光光度法绘制的荧光光谱曲线方程为:y=0.060+4.298x,r2=0.99203,y为(f-f0)/f0,f0和f分别为加入胰蛋白酶前后pdnps-pro的荧光值;x为胰蛋白酶浓度,最低检测限(lod)=6.4ng/ml;所述溶液中各组分的含量为:pdnps的浓度为0.15μg/ml,pro的浓度为40μg/ml。
具体地说,本发明提供了一种基于荧光性聚多巴胺纳米粒子的荧光在鱼精蛋白作用下聚集诱导猝灭体系(pdnps-pro)的荧光方法检测胰蛋白酶,其特征在于,包括如下步骤:配置不同浓度的胰蛋白酶溶液,加入到pdnps-pro中,分别检测加入胰蛋白酶前后pdnps-pro的荧光。其中,试剂配置操作简单,反应条件易操纵。
(3)制备的试剂室温避光反应20分钟,移入荧光分光光度计,在340nm波长激发,读取435nm的荧光强度。反应、测定条件简单。
(4)为获得测定基于荧光聚多巴胺纳米粒子聚集诱导猝灭的平台检测胰蛋白酶,作为优选,检测加入不同浓度的鱼精蛋白后pdnps的荧光变化值。
(5)针对上述现有技术,本发明的目的是提供一种操作简便、灵敏度高,能有效测定胰蛋白酶的荧光聚多巴胺纳米粒子的新型应用领域。
(6)为了实现上述目的,本发明提供了一种胰蛋白酶的定量检测方法,通过荧光分光光度法进行胰蛋白酶的检测,其特征在于,所述荧光分光光度法中的溶剂通过缓冲溶液、pdnps、pro和胰蛋白酶混合而成。
(7)本发明的有益效果是,本发明将pdnps和pro进行反应,pdnps与pro发生聚集诱导猝灭,接着加入胰蛋白酶特异性水解pro会恢复pdnps的荧光。通过加入胰蛋白酶测定pdnps荧光强度的变化程度,建立pdnps荧光信号变化的荧光检测方法检测胰蛋白酶,获得了良好的效果,且操作方便,灵敏度高,胰蛋白酶的最低检出限可达到6.4ng/ml。
(8)本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
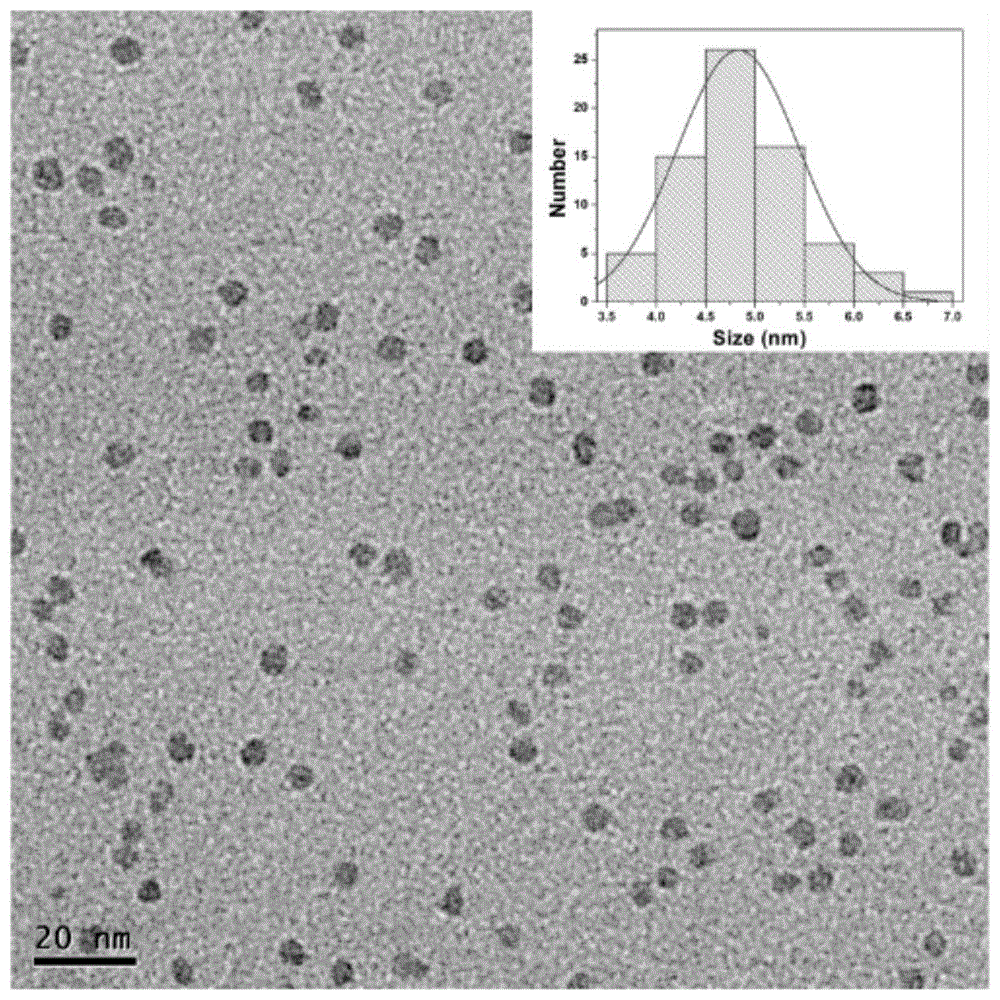
图1是pdnps的透射电镜照片;
图2a是pdnps的紫外光谱图;
图2b是pdnps的荧光光谱图;
图3是pdnps从310nm到440nm激发波长下得到的发射光谱;
图4是pdnps溶液在自然光和紫外光照射下的结果图,其中a为自然光照射,b为365nm紫外光激发;
图5是pdnps在不同ph下的荧光强度图谱;
图6是pdnps在340nm波长持续激发1小时的荧光图;
图7是pdnps的荧光在加入pro后聚集猝灭以及加入胰蛋白酶之后荧光恢复的图谱;
图8是在加入不同浓度pro下pdnps的荧光强度点图;
图9是加入30μg/mlpro和加入40μg/mlpro时pdnps聚集程度的透射电镜照片,其中a为加入30μg/mlpro时的pdnps,b为加入40μg/mlpro时的pdnps;
图10是pdnps在加入不同活性的胰蛋白酶后的荧光强度图谱;
图11是pdnps的荧光强度恢复效率与胰蛋白酶浓度之间的线性关系图;
图12是不同的干扰物质下pdnps荧光的恢复效率的对比图。
具体实施方式
(1)下面结合具体实施方式和附图对本发明进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
(2)实施例(可行性分析)
本实施例的可行性实验的样品通过以下步骤制得:
配置以下溶液:溶液1为pdnps;溶液2为鱼精蛋白(pro);溶液3为pdnps+pro;溶液4为pdnps+pro+胰蛋白酶。其中pdnps浓度0.15μg/ml,pro浓度40μg/ml,胰蛋白酶浓度0.1μg/ml,三种组分溶液都是用磷酸盐缓冲液配的,本发明实施例用的缓冲溶液(缓冲溶液由na2hpo4﹒12h2o、nah2po4﹒2h2o、nacl组成)的浓度为10mm,且缓冲溶液的ph为8.0。所述荧光聚多巴胺纳米粒子(pdnps),由0.05g盐酸多巴胺和0.0606g三羟甲基氨基甲烷(tris)溶解于40ml后搅拌20h,接着加入h2o2(20wt%,15ml)和naoh(2.5m,10ml)加热回流半小时制得,在反应中必要时可以在三羟甲基氨基甲烷(tris)中加入hcl调节溶液ph为8.5。
(3)对本实施例制得的pdnps进行测试:
1)图1为本实施例制得的pdnps的透射电镜图,如图1所示,pdnps颗粒分布均匀,平均尺寸为4.83nm。
2)图2a表明pdnps水溶液的紫外一可见光吸收光谱在200至450nm处显示宽吸收带,表明pdnps含有较低比例的5,6-二羟基吲哚和多巴胺单元。图2b表明pdnps水溶液的最大激发波长和发射波长分别为340nm和435nm,基本对称。
3)图3是pdnps在310nm至440nm变化的激发波长条件下的发射谱图,pdnps的最大激发波长为340nm,最大发射波长为440nm,pdnps的发射波长表现出激发波长依赖的特征。
4)图4中的a所示pdnps在自然光照射下为棕黄色,在紫外光(365nm)的照射条件下,为亮蓝色荧光见图3中的b。
5)图5中为本实施例制得的pdnps在不同ph值的磷酸盐缓冲液中的荧光强度,如图5所示,在ph为3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0时,pdnps的荧光强度保持相对稳定。
6)如图6所示,pdnps的荧光强度在340nm波长持续激发1小时始终保持稳定,说明所制备的聚多巴胺纳米粒子荧光性质稳定,且具有较好的抗光漂白性。
7)图7中本实施例制得的浓度为0.15μg/ml的pdnps加入浓度为40μg/ml的pro前后的荧光强度图,pdnps在pro的作用下发生明显的荧光猝灭。
8)如图8所示,逐渐增加pro造成pdnps逐渐猝灭,且在40μg/mlpro之后,pdnps的荧光猝灭达到平台期。如图9所示,pro的引入造成pdnps发生聚集,且pro浓度越大,pdnp是聚集越明显,这说明了pro的加入使得pdnps发生聚集诱导荧光猝灭体系,从而形成pdnps-pro。
(4)本发明还提供了一种胰蛋白酶活性的检测方法,通过荧光分光光度法进行胰蛋白酶活性的检测,其中,所述荧光分光光度法中的溶剂通过缓冲溶液、pro、胰蛋白酶和上述所述的pdnps混合而成。
①准确量取10µlpdnps溶液、10µlpro和10µl一系列不同浓度胰蛋白酶,补充磷酸盐缓冲液,保持总体积为200µl,避光反应10min后将所得溶液置于荧光分光光度计中。其中,所有的组分溶液都是用磷酸盐缓冲液配的,pdnps浓度0.15μg/ml,pro浓度40μg/ml。
②在激发波长340nm条件下,读取发射波长440nm处荧光强度值,根据荧光强度数据可以得出已知pro的荧光强度值,绘制标准曲线。
③在本发明提供的一种优选的实施方式中,所述溶液中各组分的含量具体为:pdnps的浓度为0.15µg/ml,缓冲溶液(缓冲溶液由na2hpo4﹒12h2o、nah2po4﹒2h2o、nacl组成)的浓度为10mm,且所述缓冲溶液的ph为8.0。图10中的曲线自下而上对应的胰蛋白酶浓度为0µg/ml、0.01µg/ml、0.02µg/ml、0.03µg/ml、0.04µg/ml、0.05µg/ml、0.06µg/ml、0.1µg/ml、0.2µg/ml、0.3µg/ml、0.4µg/ml、0.5µg/ml和0.6µg/ml,从而可以看出,随着胰蛋白酶浓度的增大,pdnps的荧光强度逐渐增大。图11中纵坐标为pdnps的荧光恢复效率,随着胰蛋白酶浓度的增大,pdnps的荧光强度逐渐增大。从图中可以看出,待测胰蛋白酶浓度在0-0.06µg/ml时,其浓度与pdnps的荧光恢复值有着良好的线性关系,线性方程为:y=0.060+4.298x,r2=0.99203,y=0.060+4.298x,r2=0.99203,y为(f-f0)/f0,f0和f分别为加入胰蛋白酶前后pdnps-pro的荧光值;x为胰蛋白酶浓度,最低检测限(lod)=6.4ng/ml。
④本发明提供的胰蛋白酶测定的方法具有良好的选择性,如图12所示,仅有胰蛋白酶可以恢复pdnps-pro的荧光值,其他常见的干扰物均无法恢复pdnps-pro的荧光值。
⑤本发明提供的胰蛋白酶测定的方法测定血清中加标胰蛋白酶,加标回收率在98.0%~109.8%(具体见表1),且相对标准偏差不超过1.6%,具有良好的准确度和重现性。
表1是本方法测定胰蛋白酶的血清加标回收率及相对标准偏差
⑥以上实施例仅仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!