中药抗非酒精性脂肪肝活性物质的筛选方法与流程
本申请涉及一种抗非酒精性脂肪肝活性物质的筛选方法,尤其涉及以线粒体自噬蛋白parkin为靶的中药抗非酒精性脂肪肝活性物质的筛选方法。
背景技术:
非酒精性脂肪肝(nonalcoholicfattyliverdisease,nafld)已经成为重大健康威胁,它不仅会引发肝脏严重病变乃至癌化,还可能引发肝外肿瘤、糖尿病、心血管及代谢疾病,且加快它们的病程。nafld病因不同于酒精性脂肪肝,在全球患病人群数量庞大,国内约有近1/3的人群患有nafld。随着生活方式的迅速转变,我国nafld发展趋势日益加重,且呈年轻化趋势。nafld的威胁在全球都存在被低估的现象,且目前没有药物干预的手段,只能通过改善饮食、运动等习惯进行调理,尚缺乏治疗nafld特效药物。研究nafld防治药物具有重要价值。
线粒体自噬(mitophagy)是指细胞通过自噬的机制选择性地清除线粒体的过程。通过选择性地清除受损或功能不完整的线粒体,维持线粒体功能完整性和细胞生存,达到延缓衰老、治疗疾病的目的。近期研究表明线粒体自噬与nafld密切相关,2009年nature首次报道了自噬调节脂质代谢,随后2018年celldeath&disease报道了线粒体自噬在nafld中的作用。
pink1/parkin通路介导的线粒体自噬途径,可高效选择清除受损的线粒体,并促进线粒体增殖以维持线粒体正常生理功能。因此,pink1/parkin通过对线粒体的调控对相关疾病有极大的相关性。pink1/parkin介导线粒体自噬分子机制:1)正常情况下,蛋白激酶pink1在胞质中合成后通过线粒体膜分子通道进入线粒体内部,被线粒体内蛋白水解酶降解;2)线粒体受损致内膜电位消散,pink1向内膜转移受阻,稳定并积累在线粒体外膜上;3)parkin作为一种e3泛素连接酶,被pink1从胞质中招募到线粒体外膜并使其发生磷酸化而激活;4)被激活的parkin催化线粒体蛋白发生泛素化,使之能被接头蛋白识别;5)泛素化的蛋白与吞噬膜上酵母自噬蛋白8家族同源蛋白如微管相关蛋白轻链3、高尔基体相关atp酶增强子等连接,形成线粒体自噬体;6)线粒体自噬体与溶酶体融合形成成熟线粒体自噬溶酶体,启动线粒体降解程序。
中药作为天然来源化合物库,其中包含的化合物由于结构的多样性、毒性较低和来源广泛等特点,长期以来一直是新药或先导化合物发现的重要来源。目前上市药物中,如紫杉醇、吗啡、青蒿素、青霉素以及大部分抗生素和半合成抗生素等,都是直接来源于天然产物或以天然产物为先导化合物通过结构改造而成。目前已发现中药可影响pink1/parkin通路而调节线粒体自噬,如,厚朴提取液通过parkin蛋白表达调控以改善泛素蛋白酶体系统功能活性,从而保护黑质区多巴胺能神经元;从中药中分离的白藜芦醇、远志皂苷、槲皮素等亦能影响pink1/parkin通路而调节线粒体自噬。因此,从中药及天然药物中搜寻parkin调节剂是最有效、最直接的途径。
众所周知,中药是一个复杂体系,其组成成分数量庞大,种类繁多,使得中药活性成分分析和筛选非常困难。经典筛选方法是:首先从中药中提取分离、制备得到纯度较高的单体化合物;然后将化合物进行体内外药理实验验证,通过检测parkin表达量或酶活性及线粒体自噬的变化情况来反映化合物是否有效。可见,传统方法不能直接从复杂体系中筛选活性成分,筛选成本高,劳动强度高,效率低,样品用量大、动物消耗量大及筛选周期较长等缺点。为此,我们需建立不经分离纯化,能直接从中药复杂体系中快速有效找到parkin调节剂的新方法。
亲和超滤是由亲和采集与超滤技术结合而成,采用超滤膜分离与生物大分子(>10kd的蛋白和dna)相结合的小分子化合物,目前已成为筛选研究中药中作用于生物大分子(如蛋白、酶、dna等)的活性成分的有效途径之一。lc/ms技术具备高分离、高灵敏度、高选择性以及提供丰富结构信息等优点,目前已用lc/ms技术对大部分常用中药的化学成分进行了分析、鉴定,用lc/ms可实现活性成分的结构鉴定分析。
因此,本研究拟联合亲和超滤与lc/ms(gc/ms),构建一种以parkin为靶的集“识别-分离-鉴定”于一体的中药活性组分筛选新方法;用所建方法筛选中药中parkin活性调节剂;并通过测定parkin酶活力证实其对parkin的调节作用(激动/拮抗);最后用细胞实验测试化合物对nafld的缓解作用。
研究结果无疑将揭示所筛中药结合于parkin的主要活性物质,为nafld及其他线粒体自噬相关疾病防治新药的研发提供先导物,并为揭示中药调节线粒体自噬而发挥药效的物质基础提供充分科学依据;所建筛选方法将为中药及天然药物复杂体系中的parkin调节剂的快速、有效筛选开辟新途径。
技术实现要素:
本发明的目的是构建一种以线粒体自噬关键调控蛋白parkin为靶点的集“识别-分离-鉴定”于一体的筛选新方法,实现从中药等复杂样品中高效筛选parkin调节剂,发现抗nafld先导化合物,并为揭示中药调节parkin而发挥抗nafld作用的药效物质提供依据。
具体的,本发明提供以下方案:
一种抗非酒精性脂肪肝活性物质的筛选方法,其特征在于,包括如下步骤:
1)分别将含有活性物质的待分析液和空白对照液与parkin蛋白混悬液充分混合,含有活性物质的待分析液混合形成混合液a,空白对照液混合形成混合液b,采用水浴孵育;
2)分别在混合液a和混合液b中加入pbs,离心,保留沉淀c和沉淀d;
3)在所述沉淀c和沉淀d中分别加入有机溶剂,使parkin蛋白变性,离心,保留上清液获得上清液e和上清液f;
4)分别对上清液e和上清液f微孔滤膜过滤,获得滤过液g和滤过液h;
5)采用hplc/ms对滤过液g和滤过液h进行分析;
6)当滤过液g中的色谱峰面积显著高于(δp>20%)滤过液h中的色谱峰面积时,该色谱峰所对应的活性物质即为抗非酒精性脂肪肝活性物质;
δp=(pe–pc)/pe×100,pe为滤过液g色谱峰面积,pc为滤过液h色谱峰面积。
进一步的,步骤1)中parkin蛋白混悬液采用ph7.4的pbs溶液混悬;
步骤1)中parkin蛋白悬液的蛋白浓度为0.5-1.5g/l;
步骤2)中水浴孵育条件为35-39℃水浴中孵育30-120min;
步骤2)中加入pbs前增加离心步骤,以弃去未与parkin蛋白相互结合的成分;
该离心步骤的离心条件是0-6℃条件下,10000-20000×g离心10-60min;
步骤2)和3)中离心条件是0-6℃条件下,10000-20000×g离心10-60min;
步骤3)中有机溶剂为80%甲醇,采用超声方式使parkin蛋白变性;
步骤3)重复完成2-5次,以充分洗去未与parkin蛋白相互结合的成分;
步骤4)中在上清液e和上清液f微孔滤膜过滤前增加先吹干后再加入80%甲醇复溶的步骤;
步骤4)中采用0.22μm微孔滤膜过滤。
进一步的,一种抗非酒精性脂肪肝活性物质的筛选方法,其特征在于,包括如下步骤:
1)parkin蛋白用ph为7.0-8.0的pbs溶液混悬,制备蛋白浓度为0.8-1.2g/l的parkin蛋白悬液,取200μl作为实验组用于活性筛选,另取200μlpbs作为空白对照组;
2)取5μl含有活性物质的待分析液分别与实验组的200μlparkin蛋白以及200μlpbs涡旋混合,于36-38℃水浴中孵育40-80min,让活性物质充分与parkin蛋白作用;
3)将反应混合液分别倒入2支0.5ml10kda离心超滤管中,3-5℃条件下,12000-16000×g离心20-30min,弃去未与parkin蛋白相互结合的成分;
4)向离心后的沉淀中分别加入200μlpbs,3-5℃条件下,12000-16000×g离心20-30min,洗去与parkin蛋白非特异性结合的成分,此步骤重复操作2-4次;
5)向上述离心后的沉淀中分别加入400μl80%甲醇水溶液,超声混合15-40min,从而使parkin蛋白充分变性,解离结合于parkin蛋白上的活性成分,室温下,12000-16000×g离心20-30min,保留含有活性成分的上清液;
6)滤过液分别用氮吹仪吹干后加入100μl80%甲醇水溶液复溶,接着用0.22μm微孔滤膜过滤,收集含活性物质的滤过液(实验组)和空白滤过液(空白对照组);
7)上述滤过液分别进入hplc/ms系统分析;
8)活性成分判断标准:当实验组中的色谱峰面积显著高于(δp>20%)空白对照组中的色谱峰面积时,该色谱峰所对应的活性物质即为抗非酒精性脂肪肝活性物质;
δp=(pe–pc)/pe×100,pe为实验组色谱峰面积,pc为空白对照组色谱峰面积。
进一步的,一种抗非酒精性脂肪肝活性物质的筛选方法,其特征在于,包括如下步骤:
1)parkin蛋白用ph为7.4的pbs溶液混悬,制备蛋白浓度为1.0g/l的parkin蛋白悬液,取200μl作为实验组用于活性筛选,另取200μlpbs作为空白对照组;
2)取5μl含有活性物质的待分析液分别与实验组的200μlparkin蛋白以及200μlpbs涡旋混合,于37℃水浴中孵育60min,让活性物质充分与parkin蛋白作用;
3)将反应混合液分别倒入2支0.5ml10kda离心超滤管中,4℃条件下,14,000×g离心25min,弃去未与parkin蛋白相互结合的成分;
4)向离心后的沉淀中分别加入200μlpbs,4℃条件下,14,000×g离心25min,洗去与parkin蛋白非特异性结合的成分,此步骤重复操作3次;
5)向上述离心后的沉淀中分别加入400μl80%甲醇水溶液,超声混合20min,从而使parkin蛋白充分变性,解离结合于parkin蛋白上的活性成分,室温下,14,000×g离心25min,保留含有活性成分的上清液;
6)滤过液分别用氮吹仪吹干后加入100μl80%甲醇水溶液复溶,接着用0.22μm微孔滤膜过滤,收集含活性物质的滤过液(实验组)和空白滤过液(空白对照组);
7)上述滤过液分别进入hplc/ms系统分析;
8)活性成分判断标准:当实验组中的色谱峰面积显著高于(δp>20%)空白对照组中的色谱峰面积时,该色谱峰所对应的活性物质即为抗非酒精性脂肪肝活性物质;
δp=(pe–pc)/pe×100,pe为实验组色谱峰面积,pc为空白对照组色谱峰面积。
本发明还提供了采用上述的方法对与parkin蛋白结合的活性成分进行筛选的方法。
本发明所述的抗非酒精性脂肪肝活性物质可选的,存在于中药。
本发明所述的中药为具有抗非酒精性脂肪肝活性的中药,例如大黄、苦参、虎杖。
本发明所述的活性物质选自7,4′-二羟基-5-甲氧基-8-异戊烯基二氢黄酮、苦参醇i、苦参酮、槐黄烷酮g、芦荟大黄素-8-o-葡萄糖苷、芹菜素、大黄素。
附图说明
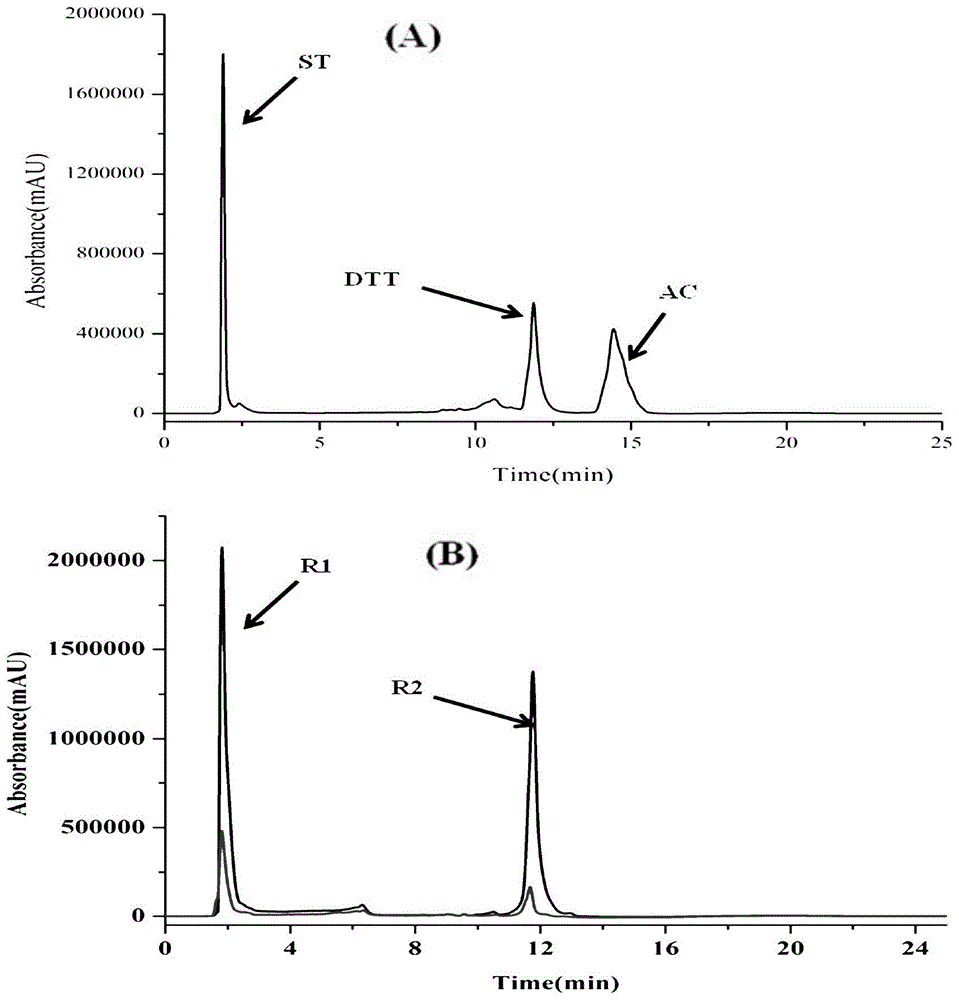
图1:以parkin蛋白为靶点的方法筛选药物混合溶液的hplc色谱图
(a)直接将混合对照品进hplc分析的色谱图;(b)采用筛选方法分析得到的色谱图,包括待分析样品色谱图和空白对照色谱图
st,dl-selenomethionine;ac,amoxicillin;dtt,dl-dithiothreitol
图2:苦参活性成分筛选的hplc图
苦参浓度为10.5g/l,parkin蛋白浓度为1.0g/l,孵育时间为60min,(a)0–70min;(b)70–140min。与空白对照比较,hplc图中显示4个色谱峰(k1-k4)的峰面积显著增大,为活性成分。
图3:荧光分光光度法检测人源parkin蛋白活性(大黄素和芹菜素组,***p<0.001)
图4:荧光分光光度法检测人源parkin蛋白活性(苦参醇、苦参酮、槐黄烷酮g组,***p<0.001)
图5:给予苦参醇i、苦参酮24h后的肝l-02细胞
a,正常组;b,模型组;c,非诺贝特组;d,苦参醇i低剂量组;e,苦参醇i中剂量组;f,苦参酮低剂量组。
图6:苦参醇i、苦参酮对脂肪变性肝l-02细胞tg的调节作用(*p<0.05,**p<0.01,***p<0.001与模型组相比)
图7:苦参醇i、苦参酮对脂肪变性肝l-02细胞tc的调节作用(*p<0.05,**p<0.01,***p<0.001与模型组相比)
具体实施方式
实施例1parkin为靶的中药活性成分筛选方法构建
(一)主要试剂配制
1.反应缓冲液:50mmtris-hcl(ph8.0)、2mm二硫苏糖醇、5mmmgcl2、4mmatp、5%甘油。
2.对照品供试液(2mg/ml):分别取阿莫西林、dtt、dl-硒代蛋氨酸对照品溶于dmso中,制成浓度均为2mg/ml的3种对照品供试液。
3.混合对照品溶液(2mg/ml):将阿莫西林、dtt、dl-硒代蛋氨酸对照品混合后,溶解于dmso中,制成混合对照品溶液(每种药物的浓度均为2mg/ml)。
(二)活性成分筛选方法建立
1.parkin蛋白用pbs(ph7.4)溶液混悬,制备蛋白浓度为1.0g/l的parkin蛋白悬液,取200μl作为实验组用于活性筛选,另取200μlpbs作为空白对照组;
2.取5μl待分析液分别与实验组的parkin蛋白(200μl)以及pbs(200μl)涡旋混合,于37℃水浴中孵育60min,让化合物充分与parkin蛋白作用;
3.将上述反应混合液分别倒入2支0.5ml离心超滤管(10kda)中,4℃条件下,14,000×g离心25min,弃去未与parkin蛋白相互结合的成分;
4.向上述离心后的沉淀中分别加入200μlpbs,4℃条件下,14,000×g离心25min,洗去与parkin蛋白非特异性结合的成分,此步骤重复操作3次;
5.向上述离心后的沉淀中分别加入400μl80%甲醇水溶液,超声混合20min,从而使parkin蛋白充分变性,解离结合于parkin蛋白上的活性成分,室温下,14,000×g离心25min,保留上清液(含有活性成分);
6.滤过液分别用氮吹仪吹干后加入100μl80%甲醇水溶液复溶,接着用0.22μm微孔滤膜过滤,收集含活性物质的滤过液(实验组)和空白滤过液(空白对照组);
7.上述滤过液分别进入hplc/ms系统分析;
8.活性成分判断标准:当实验组中的色谱峰面积显著高于(δp>20%)空白对照组中的色谱峰面积时,确认该色谱峰为与parkin蛋白结合的活性成分。
δp=(pe–pc)/pe×100,pe为实验组色谱峰面积,pc为空白对照组色谱峰面积。
(三)采用阳性药和阴性药评价筛选方法可行性
利用所建方法分别分析dtt(pdb数据库报道为parkin配体)、dl-硒代蛋氨酸(pdb数据库报道为parkin配体)2种阳性药,阿莫西林(β-内酰胺类抗生素)1种阴性药,以及3种对照品的混合溶液,考察方法的可行性。
(四)hplc/ms分析条件
1.hplc条件
阿莫西林供试液:色谱柱:hypersilgoldtmamino,100mm×2.1mm。流动相:甲醇:0.1%甲酸水=15:85;流速0.2ml/min;柱温30℃;进样体积2μl;检测波长210nm。
dtt供试液:色谱柱:hypersilgoldtmamino,100mm×2.1mm。流动相:水(a)和甲醇(b)梯度洗脱;洗脱梯度:0min,100%b;2min,95%b;4min,85%b;5min,90%b;7min,80%b;10min,70%b;15min,100%。流速0.2ml/min;柱温30℃;进样体积2μl;检测波长210nm。
dl-硒代蛋氨酸供试液:色谱柱:hypersilgoldtmamino,100mm×2.1mm。流动相:水(a)和乙腈(b)梯度洗脱;洗脱梯度:0min,80%b;3min,60%b;4min,40%b;5min,20%b;10min,80%b。流速0.2ml/min;柱温30℃;进样体积2μl;检测波长210nm。
混合对照品供试液:色谱柱:hypersilgoldtmamino,100mm×2.1mm。流动相:水(a)和乙腈(b)梯度洗脱;洗脱梯度:0min,100%b;1.5min,90%b;4min,85%b;7min,75%b;10min,25%b;15min,100%b;20min,100。流速0.2ml/min;柱温30℃;进样体积2μl;检测波长210nm。
(五)结果与结论
1.3种对照品溶液的测定分析
结果显示:2种阳性药δp﹥20%,说明这2种化合物均能与parkin蛋白结合,且能用该方法分离、筛选出来。但是,1种阴性药与parkin蛋白作用后检测到的峰面积基本和药物与空白组检测到的峰面积相等(δp﹤20%),说明二者不能与parkin蛋白相结合。因此,确定δp﹥20%的化合物判定为活性成分。
表1对照品的lc/ms数据
aδp=(pe–pc)/pe×100,pe代表实验组色谱峰面积,pc代表空白对照组色谱峰面积。
2.混合对照品溶液的测定分析
结果(图1)显示:从图1-b中可看出r1峰和r2峰显示实验组的峰面积明显大于空白组的峰面积(δp﹥20%),说明它们是可与parkin蛋白发生结合的活性成分。通过比较a与b色谱峰的保留时间,可发现r1为dl-硒代蛋氨酸,r2为二硫苏糖醇。结果说明所建立的方法可选择性识别、分离混合物中与parkin蛋白结合的成分。
dtt和dl-硒代蛋氨酸是parkin蛋白的配体。因此,这两种化合物能与parkin蛋白发生特异性结合。然而,阿莫西林是一种β-内酰胺类抗生素,其主要作用是抑制细菌细胞壁的合成,可选择性地作用于细菌中丰富的青霉素结合蛋白,所以不能与parkin蛋白特异性结合。
研究结果表明,所建方法集“识别-分离-鉴定”于一体。考虑到阳性对照药(与parkin蛋白特异性结合的成分)的δp值均大于20%,而阴性对照药(不与parkin蛋白特异性结合的成分)的δp值均小于20%,我们将δp值大于20%的色谱峰认为是与parkin蛋白发生特异性结合的活性成分。
从图1中可发现,空白对照组中也检测到了目标成分,这是超滤膜对化合物的非特异性吸附导致的。为此,我们在实验设计时以蛋白储存液作为空白对照组,以排除超滤膜的非特异性吸附的影响。
结论:采用parkin蛋白,将亲和超滤技术和lc/ms技术联用,构建一种不经分离纯化的、可快速筛选复杂体系中抗nafld成分的方法。利用2种阳性对照药和1种阴性对照药,以及3种对照品的混合溶液验证了筛选方法的可行性,结果表明所建方法是一种集“识别-分离-鉴定”于一体的快速、有效筛选中药复杂体系中抗nafld成分的方法。
实施例2parkin为靶的中药活性成分筛选方法构建
(一)主要试剂配制
同实施例1。
(二)药材提取物冻干粉制备
苦参、虎杖提取物冻干粉:分别称取中药材粉末(过40目筛)约50g于锥形瓶中,加入10倍量(500ml)甲醇,浸泡30min,超声提取60min后,减压过滤;残渣中加入8倍量(400ml)70%甲醇溶液继续超声提取60min,减压过滤;合并两次滤液,减压回收溶剂(旋转蒸发仪温度设置为45℃);所得浸膏置于-80℃冰箱中结冰后,转移至冷冻干燥机中,冷冻干燥得冻干粉。将冻干粉研碎,混匀,置于干燥器中保存备用。
(三)筛选供试品溶液制备
分别称取苦参、虎杖药材提取物冻干粉适量,充分溶解于dmso中,制备苦参(400mg/ml)、虎杖(300mg/ml)供试品溶液,4℃保存备用。
(四)活性成分筛选
采用以parkin蛋白为靶点的方法分别筛选、分析上述2种供试液,操作步骤见实施例1。
(五)hplc/ms分析条件
虎杖供试液:色谱柱:shim-packxr-ods,2.2μm,2.0mm×10cm。流动相:0.1%甲酸水(a)和乙腈(b)梯度洗脱;洗脱梯度:0min,5%b;10min,10%b;20min,20%b;35min,30%b;55min,40%b;70min,60%b;75min,100%b。流速0.2ml/min;柱温30℃;进样体积5μl;检测波长254nm。
苦参供试液:色谱柱:shim-packxr-ods,2.2μm,2.0mm×10cm。流动相:水(a)和乙腈(b)梯度洗脱;洗脱梯度:0min,2%b;15min,5%b;30min,15%b;40min,20%b;60min,25%b;75min,35%b;90min,40%b;105min,45%b;120min,55%b;130min,65%b;140min,85%b。流速0.2ml/min;柱温30℃;进样体积5μl;检测波长210nm。
ms条件:
质谱采用正负离子同时扫描模式检测;离子源为esi;cdl温度250℃;喷雾气流速:1.5l/min;加热模块:250℃;接口电压:(+)4.5kv,(-)-3.5kv。正离子模式:ms1:质量范围m/z:100~1000da;检测电压:1.70kv;ionaccumulation:20msec;ms2,ms3:质量范围m/z:50~1000da;ionaccumulation:10,20msec;cidenergy:50%。负离子模式:ms1:质量范围m/z:100~1000da;检测电压:1.70kv;ionaccumulation:20msec;ms2,ms3:质量范围m/z:50~1000;ionaccumulation:10,20msec;cidenergy:50%。工作站:lc/mssolutionversion3.60,分子式预测,精确分子量计算。
(六)体外自泛素化验证活性成分筛选结果
parkin蛋白用pbs稀释至蛋白浓度为1.0g/l。在反应缓冲液中加入5μm荧光标记泛素、15nm的泛素激活酶e1、0.5μm泛素结合酶e2,1μm的原核表达的人源parkin蛋白(泛素连接酶e3),37℃孵育1h,进行泛素化反应后4℃过夜终止反应。
(七)苦参活性成分筛选
采用所建方法对苦参提取物进行了筛选,结果如图2。结果显示,与空白对照组比较,苦参中共有4个色谱峰与parkin蛋白作用后峰面积显著升高(δp>20%,表2),为与parkin蛋白结合的活性成分,这些成分可能是苦参作用于parkin蛋白而发挥抗nafld作用的主要物质基础。
活性物质的lc/ms数据及结构指认结果见表2,通过uv、ms和msn数据的分析,并与文献报道的lc/ms数据对照,同时利用对照品进行对照,指认了4种(k1:7,4′-二羟基-5-甲氧基-8-异戊烯基二氢黄酮、k2:苦参醇i、k3:苦参酮、k4:槐黄烷酮g)活性成分的化学结构。这些成分均为首次发现可与parkin蛋白结合的化合物。
(八)虎杖活性成分筛选
采用所建方法对虎杖提取物进行了筛选,结果见图3。结果显示,与空白对照组比较,虎杖中共有4个色谱峰与parkin蛋白作用后峰面积显著升高(δp>20%,表3),为与parkin蛋白结合的活性成分,这些成分可能是虎杖作用于parkin蛋白而发挥抗nafld作用的主要物质基础。
活性物质的lc/ms数据及结构指认结果见表3,通过uv、ms和msn数据的分析,并与文献报道的lc/ms数据对照,同时利用对照品进行对照,指认了3种活性成分的化学结构(h1:芦荟大黄素-8-o-葡萄糖苷、h2:芹菜素、h3:(unidentified)、h4:大黄素)。这些成分均为首次发现可与parkin蛋白结合的化合物。
(九)体外自泛素化验证活性成分筛选结果
将本实施例所筛选到并经过对照品比对的化学结构的5种(芹菜素、大黄素、苦参醇i、苦参酮、槐黄烷酮g)活性成分分别与parkin蛋白进行孵育,通过体外泛素化反应荧光分光光度法检测结果如图3-4,从图可知,随着洗涤次数的增加,洗涤液中的荧光强度逐渐减弱,到第六次洗涤的时候荧光基本消失,说明非共价键结合的泛素化蛋白已经基本上被洗涤除去。在加入溶解液溶解被截留组分之后荧光强度明显增强(且明显高于阴性组),说明虎杖中的2种活性成分(大黄素、芹菜素),苦参中的3种活性成分(苦参醇i、苦参酮、槐黄烷酮g)能增强parkin蛋白的活性增强泛素化反应。
结论:1、本实施例利用以parkin蛋白为靶点的方法从2味中药材(苦参、虎杖)中共筛选到8种活性成分,通过lc/ms指认了7种,且这7种均为首次发现的可与parkin蛋白结合的活性成分。研究结果初步揭示了苦参和虎杖作用于parkin蛋白的主要物质基础,为深入探讨中药药理机制提供科学依据。
2、体外自泛素化实验进一步验证了所筛选到5种化合物(大黄素、芹菜素、苦参酮、苦参醇、槐黄烷酮g)能增强parkin蛋白的活力,促进泛素化。为parkin蛋白相关疾病防治新药的研发提供新的思路。
实施例3采用细胞实验验证化合物的抗非酒精性脂肪肝作用
一、实验方法
1.试液配制
rpmi-1640培养液:精密称取1.69ghepes,165mg丙酮酸钠(pyrurilacidsodiumsalt),2g碳酸氢钠(nahco3),150mg谷氨酰胺(l-glutamine),10.0grpmi-1640粉溶于1l超纯水中,用hcl调节ph至7.20,0.22μm孔径滤器过滤除菌分装,4℃保存备用。
正常培养液的配制(含10%fbs的rpmi-1640培养液):将450mlrpmi-1640与50ml的fbs培养基混匀,4℃冰箱保存备用。
g0液的配制(含有0.2%血清的rpmi-1640培养液):将499mlrpmi-1640培养基与1ml的fbs混匀,4℃冰箱保存备用。
磷酸缓冲液(pbs):精密称取0.2gkcl,0.2gk2hpo4,3.49gnahpo4.12h2o,8gnacl充分溶于800ml超纯水,于室温充分搅拌均匀,调节ph7.4,定容至1000ml,0.22μm孔径滤器过滤除菌分装,4℃保存备用。
0.25%胰酶溶液:精密称取0.5g胰蛋白酶,溶于200mlpbs缓冲液中,0.22μm孔径滤器过滤除菌分装,4℃保存备用。
细胞冻存液:将正常培养液与细胞级dmso溶液按9:1的比例混合而成,现用现配。
造模液的配制(医用脂肪乳rpmi-1640造模液):将5ml医用脂肪乳充分溶解于含10%胎牛血清的rpmi-1640培养液中并定容至100ml,即为医用脂肪乳诱导液。
0.01%tritonx-100溶液:10ml超纯水中加入100μltritonx-100,充分搅拌混匀后,4℃保存备用。
2.肝l-02细胞的复苏、传代、冻存
(1)细胞复苏
将新鲜培养基置于37℃水槽中回温,回温后喷以75%酒精并擦拭之,移入无菌操作台内。自液氮中取出一支冻存的肝l-02细胞,立即放入37℃水浴锅中快速解冻,轻摇冷冻管使其在1分钟内全部融化,以75%酒精擦拭保存管外部,移入无菌操作台内。取出解冻的细胞悬浮液,缓缓加入有培养液的培养瓶内(稀释比例为1:10~1:15),混合均匀,放入co2培养箱培养。另取0.1ml解冻细胞悬浮液作存活测试。
(2)细胞传代
培养液瓶打开后,过酒精灯火焰,置酒精灯火焰周围。打开培养瓶,瓶口过火,将培养瓶内的培养液轻轻倒入废液缸,用2-4mlpbs洗去残留的培养基2次。向有l-02细胞的培养瓶加入1-2ml0.25%胰酶,37℃消化,倒置显微镜下观察到细胞变圆或漂浮时,加入含血清的新鲜培养基终止消化,并轻轻吹打细胞,使其充分脱壁并分散。于4℃下2000rpm离心5min,弃去上清液,加入pbs重悬,重复1-2次;加入新鲜的正常培养液重悬,分取一定量细胞加入培养瓶中,将培养瓶放回5%co2、37℃细胞培养箱中培养。
(3)细胞冻存
肝l-02细胞生长至对数生长期,按上述细胞传代所述方法获得细胞,加入适量细胞冻存液(细胞用dmso:培养液=1:9),制备单细胞混悬液,转入冻存管并置于程序降温冻存盒中,分别置于4℃20min,-20℃4h,-80℃过夜后转入液氮罐冻存。
3.肝细胞脂肪变性模型复制及给药
(1)肝细胞脂肪变性模型复制
用0.25%胰蛋白酶消化对数生长期的正常人肝l-02细胞,细胞计数后用正常培养液配成单个细胞悬液,以每孔3×105个细胞的密度接种于6孔培养板中,每孔培养液体积2ml。将培养板放到co2培养箱中,在37℃、5%co2及饱和湿度条件下,培养48h使其充分贴壁生长,待细胞长至80%时,换成g0液培养24h,使细胞周期同步化。加入造模液(医用脂肪乳rpmi-1640)刺激24h,对照组则给予正常培养液相同的时间,即可得到脂肪变性的肝l-02细胞。
(2)实验分组及给药
将肝细胞传板至6孔板,分为正常组、模型组、给药组,细胞按本节“2”项下的方法进行培养,各组细胞周期同步化,参照文献[1]方法复制医用脂肪乳诱导的肝l-02细胞脂肪变性模型,pbs清洗2-3次后给药刺激:
1)正常组:正常培养液;
2)模型组:正常培养液;
3)给药组:阳性对照非诺贝特组(100μm/l);苦参酮低剂量组(25μm/l);苦参醇i低剂量组(25μm/l);苦参醇i中剂量组(50μm/l)。
每个浓度设3个复孔,给药刺激24h后,分别置于倒置显微镜下观察细胞形态,并取细胞裂解液检测其中tc、tg水平。
4.统计学处理
各组数据用均数±标准差
二、结果与讨论
(一)苦参醇i及苦参酮对脂肪变性肝l-02细胞中脂滴的影响
给药之前,正常组细胞正常生长(图5a),其余各组给予医用脂肪乳后均产生脂滴(图5b~f),表明造模成功。给药24h后,阳性药非诺贝特及苦参醇i低、中剂量组和苦参酮低剂量组细胞脂滴数量较模型组一定程度减少,细胞贴壁生长良好,边缘规则清晰,结果说明苦参醇i和苦参酮可明显减少医用脂肪乳诱导的肝l-02细胞中脂滴。由于苦参酮中剂量(50μm/l)毒性较大造成细胞死亡,导致没有进行tg、tc的检测。
(二)苦参醇i及苦参酮对脂肪变性肝l-02细胞中tc与tg的影响
如图6和图7所示,与正常组相比,模型组tg含量显著升高(p<0.001),tc含量也显著升高(p<0.01),表明医用脂肪乳诱导肝细胞脂质异常。与模型组相比,非诺贝特肝细胞中tg含量降低但无显著性,苦参醇i低、中剂量组及苦参酮低剂量组肝细胞中tg含量均显著降低(p<0.001);此外,非诺贝特组、苦参酮低剂量组肝细胞中tc含量均均显著降低(p<0.05,p<0.001),苦参醇各剂量组无显著变化(与模型组比较)。结果表明苦参醇i、苦参酮可一定程度改善医用脂肪乳诱导的肝细胞脂质异常。
三、结论
苦参醇i和苦参酮可通过降低tg、tc缓解医用脂肪乳诱导的肝l-02细胞脂肪变性,其机制可能与parkin介导的线粒体自噬有关。
综上,联合亲和超滤和lc/ms,构建以parkin蛋白为靶点的集“识别-分离-鉴定”于一体的抗nafld成分筛选方法,并利用阳性对照物(二硫苏糖醇(dtt)、dl-硒代蛋氨酸)、阴性对照物(阿莫西林)以及它们所组成的混合对照品溶液验证筛选方法可行性。
用所建方法筛选2种中药(苦参、虎杖)提取液中作用于parkin蛋白的活性成分,并用lc/ms及对照品指认活性化合物结构;采用体外自泛素化反应,验证被筛选化合物与parkin蛋白的直接作用;通过考察化合物对脂肪变性肝l-02细胞总胆固醇(tc)、甘油三酯(tg)的影响,验证本方法筛选出的苦参中2种化合物的抗nafld活性。
结果显示:
人源parkin蛋白在escherichiacolibl21(de3)中获高表达,经westernblot检测已经除去了大量杂蛋白,得到纯度较高的parkin蛋白;westernblot和荧光分光光度法检测均证实异源表达的人源parkin蛋白具有生物活性。
综上所述,以parkin蛋白为靶点的筛选方法可选择性地识别出混合物中结合于parkin蛋白的活性物质(阳性对照物),且利用超滤技术可将识别到的活性成分分离,并直接排除不与parkin蛋白结合的非活性成分(阴性对照物),最后采用lc/ms鉴定活性物质的结构,所建筛选方法集“识别-分离-鉴定”于一体。
采用所建方法从2种中药中共筛选到8种可与parkin蛋白结合的活性化合物,采用lc/ms和对照品指认了7种,且7种为本研究首次发现可与parkin蛋白结合的活性物质。采用体外泛素化反应验证筛选结果发现5种(芹菜素、大黄素、苦参酮、苦参醇i、槐黄烷酮g)化合物均可显著增强parkin酶活性,提高底物泛素化水平。体外实验证实2种(苦参醇i、苦参酮)被筛选化合物均能显著减少细胞中脂滴,且tc、tg水平显著降低,具有潜在抗nafld活性。
结论:
本研究建立了一种以parkin蛋白为靶点的集“识别-分离-鉴定”于一体的筛选方法,为快速、有效地筛选中药复杂体系中的抗nafld成分提供新途径。从苦参、虎杖2种中药材中筛选到8种活性物质,已证实其中5种(芹菜素、大黄素、苦参酮、苦参醇i、槐黄烷酮g)被筛选的活性化合物可直接调节parkin蛋白活性,这些成分可能是被筛选中药直接作用于parkin蛋白的主要物质基础。利用体外药理实验证实了苦参中2种(苦参酮、苦参醇i)被筛选化合物的抗nafld作用,结果将有助于揭示被筛选中药调节parkin而发挥抗nafld作用的药效物质。
- 还没有人留言评论。精彩留言会获得点赞!