一种检测糖基化CD59的磁性微球检测试剂盒及其应用的制作方法
一种检测糖基化cd59的磁性微球检测试剂盒及其应用
技术领域
1.本发明涉及一种糖基化cd59(gcd59)的检测,尤其涉及一种检测糖基化cd59的磁性微球检测试剂盒及其应用,属于临床检验技术领域。
背景技术:
2.糖尿病是一组以高血糖为特征的代谢性疾病。长期存在的高血糖,导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍。在糖尿病患者人群中70%患者全身小血管和微血管出现增殖性病变,其发病机制与长期血糖升高、糖化蛋白终产物增多,细胞间粘附分子表达、某些细胞因子的增多及多糖类物质沉积与血管内皮下而引起的血管基底膜增厚有关。
3.糖基化cd59(gcd59)是一种新的生物标志物。cd59是一种补体调节蛋白,可保护“自身”细胞免受补体介导的损伤(davies cs等。glycation of cd59 impairs complement regulation on erythrocytes from diabetic subjects]。在糖尿病中,cd59被非酶糖基化物灭活,形成gcd59。血浆gcd59是一种可溶形式的cd59从细胞膜脱落。cd59是补体细胞溶解膜攻击复合物(mac)分布广泛的膜结合抑制剂。cd59通过与新生mac中的c8和/或c9结合而起作用,并干扰c9膜的插入和聚合。这种存在于所有细胞中的蛋白质通过一个脂尾锚定在膜的外表面。因此,它暴露于细胞外液和细胞外液中的葡萄糖水平。从细胞膜上脱落的可溶性cd59存在于循环和尿液中。已有研究表明,gcd59在糖尿病患者血液中的含量明显高于血糖正常人群。因此,检测人体液中gcd59的含量对于临床上糖尿病患者检测与筛查有指导意义。
4.磁微粒化学发光技术是将磁性分离技术、化学发光技术、免疫分析技术三者结合起来的一种新兴分析方法。该技术充分利用了磁性分离技术的快速易自动化性,化学发光技术的高灵敏度性,以及免疫分析的特异性,是目前最受欢迎的标记免疫分析技术。
5.现有技术中,相关糖基化cd59的检测方法已有报道,但检索国家食品药品监督管理总局网站,国产试剂和进口试剂均未搜索到gcd59检测试剂盒注册文号。文献报道的相关酶联免疫检测方法均为:抗cd59的单克隆抗体为捕捉抗体,抗gcd59的单克隆抗体为检测抗体,且通过酶标记二抗为羊抗兔igg
‑
辣根过氧化物酶(hrp)标记物或sa
‑
hrp,试剂盒灵敏度不高,操作时长长达200分钟(g biosciences公司产品,未在国内注册)到400分钟(pamela ghosh,a specific and sensitive assay for blood levels of glycated cd59:a novel biomarker for diabetes)。有关基于磁微粒化学发光法以抗gcd59的单克隆抗体为捕捉抗体、抗cd59的单克隆抗体为标记二抗体的检测方法以及相关检测糖基化cd59的磁性微球检测试剂盒还未见报道。
技术实现要素:
6.针对现有技术的不足,本发明要解决的问题是提供一种检测糖基化cd59的磁性微球检测试剂盒及其应用。
7.本发明所述的检测糖基化cd59的磁性微球检测试剂盒,由设在盒体内的偶联抗gcd59单克隆抗体的磁微球、gcd59标准品梯度溶液、样品稀释液、过氧化物酶标记的抗cd59单克隆抗体酶结合物、20
×
浓缩洗涤液、发光液构成;
8.其特征在于:
9.所述磁微球偶联有浓度为30μg/mg的抗gcd59的鼠单克隆抗体mab1;该磁性微球的工作浓度为0.2mg/ml,稀释液为保存液;
10.所述gcd59标准品梯度溶液分别是:浓度梯度为0pg/ml、10pg/ml、100pg/ml、200pg/ml、500pg/ml、1000pg/ml、2000pg/ml的7个标准品溶液,其中0pg/ml为标准品缓冲液;
11.所述样品稀释液的配方是:除菌的1000ml纯水中,含nacl 8g、nah2po4·
2h2o 0.2g、na2hpo4·
12h2o 2.9g、sds 0.1g、酪蛋白钠盐5g、tritonx
‑
100 0.1ml、proclin300 1ml;
12.所述过氧化物酶标记的抗cd59单克隆抗体酶结合物是辣根过氧化物酶标记的抗cd59鼠单克隆抗体mab2;该酶标抗cd59鼠单克隆抗体mab2酶结合物工作效价为1:10000,稀释液为酶结合物稀释液;
13.所述20
×
浓缩洗涤液的配方是:除菌的50ml双蒸水中,含nacl 8.0g、nah2po4·
2h2o 0.2g、na2hpo4·
12h
2 o 2.9g、吐温20 0.5ml;
14.所述发光液包括a液和b液,浓度为3.0mmol/l的鲁米诺溶液与0.3mmol/l对碘苯酚溶液等体积比的混合液,命名为a液;浓度为7.5mmol/l的双氧水,命名为b液;使用时将a液与b液按体积比1﹕1混合。
15.上述检测糖基化cd59的磁性微球检测试剂盒中,所述磁微球的制备方法是:
16.1.1)配制偶联缓冲液:即配制0.01mol/l的mes缓冲溶液,并调整ph值为6.0;
17.mes
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.95g
18.纯化水
ꢀꢀꢀꢀꢀꢀꢀꢀ
定容至1000ml
19.过滤除菌,4℃保存;
20.1.2)配制洗涤液,洗涤液的配方及制法是:
[0021][0022][0023]
过滤除菌,4℃保存;
[0024]
1.3)配制保存液,保存液的配方及制法是:
[0025][0026]
过滤除菌,4℃保存;
[0027]
1.4)偶联操作
[0028]
(1)抗体酸化处理
[0029]
酸处理:取1ml浓度为5mg/ml的抗体mab1溶液至2.0ml低吸附ep管,向ep管加入0.2ml酸化处理液a,室温40rpm滚轴混匀30min;
[0030]
中和:向酸处理后的抗体溶液中加入0.4ml处理液b中和,缓慢吸打后备用;其中:
[0031]
处理液a:
[0032]
硼酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.06g
[0033]
磷酸二氢钠
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.34g
[0034]
超纯水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定容至100ml
[0035]
调ph2.0
[0036]
过滤除菌,4℃保存;
[0037]
处理液b:
[0038]
硼酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.06g
[0039]
磷酸二氢钠
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.34g
[0040]
超纯水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定容至100ml
[0041]
调ph9.5
[0042]
过滤除菌,4℃保存;
[0043]
(2)羧基磁性微球的活化:取10mg羧基磁性微球,加入500μl的edc/nhs溶液室温下活化30min,磁分离,偶联缓冲液洗涤磁性微球,得活化后的磁性微球;
[0044]
其中,所述edc是:1
‑
乙基
‑
(3
‑
二甲基胺基丙基)碳化二亚胺盐酸盐,所述nhs是:n
‑
羟基丁二酰亚胺,其溶液使用偶联缓冲液为溶剂配制,其浓度均为2mg/ml,使用前将edc与nhs溶液等体积比混匀即得到edc/nhs溶液;
[0045]
(3)羧基磁性微球与mab1抗体偶联:向上述活化后的磁性微球中加入抗gcd59的鼠单克隆抗体mab1,使磁微球偶联mab1抗体的浓度为30μg/mg,室温反应3h,磁分离,洗涤液洗涤,即得免疫磁性微球,加保存液于4℃保存,备用;使用时用保存液稀释使磁性微球的工作浓度为0.2mg/ml。
[0046]
上述检测糖基化cd59的磁性微球检测试剂盒中:所述抗gcd59的鼠单克隆抗体mab1和抗cd59鼠单克隆抗体mab2优选山东莱博生物科技有限公司产品;其中抗体mab1针对抗原表位的氨基酸序列是:daclitkaglqvynkcwkfehc,抗体mab2针对抗原表位的氨基酸序
列是:lqcyncpnptadcktavncss。
[0047]
上述检测糖基化cd59的磁性微球检测试剂盒中:所述gcd59标准品梯度溶液的配制方法是:用纯化的重组gcd59蛋白按0pg/ml、10pg/ml、100pg/ml、200pg/ml、500pg/ml、1000pg/ml、2000pg/ml的比例,制备模拟血清中gcd59标准品;再配制含5wt%牛血清白蛋白、0.85wt%氯化钠的ph=7.0的1.0mmol/l磷酸氢二钠
‑
磷酸二氢钠的缓冲液获得标准品缓冲液;再以标准品缓冲液制备标准品浓度梯度为0pg/ml、10pg/ml、100pg/ml、200pg/ml、500pg/ml、1000pg/ml、2000pg/ml的7个标准品溶液,其中0pg/ml为标准品缓冲液。
[0048]
上述检测糖基化cd59的磁性微球检测试剂盒中,所述酶结合物稀释液的配方是:除菌的1000ml纯水中,含nacl 8g、nah2po4·
2h2o 0.2g、na2hpo4·
12h2o 2.9g、表面活性剂s9 3g、酪蛋白钠盐5g、bsa 10g、proclin300 1ml。
[0049]
试剂盒的精密度和准确性验证是通过平行测试中值gcd59标准品,验证试剂盒的精密度;试剂盒的准确性从试剂盒的样本回收率方面进行验证;试剂盒灵敏度的测定是以gcd59浓度梯度检测不同量gcd59确定试剂盒反应灵敏度。
[0050]
本发明所述检测糖基化cd59的磁性微球检测试剂盒在检测含gcd59生物样品中的应用。
[0051]
其中,所述检测含gcd59样品的方法是:
[0052]
a)向反应杯中加入样本50μl、磁微粒悬浮液50μl、样品稀释液50μl;
[0053]
b)混匀后37℃温育10分钟;
[0054]
c)用磁性分离架或磁性分离器,清洗液洗涤4次;
[0055]
d)每孔分别加入酶结合物150μl;
[0056]
e)混匀后37℃温育10分钟;
[0057]
f)用磁性分离架或磁性分离器,清洗液洗涤4次;
[0058]
g)每孔加入发光液a液和发光液b液各50μl;
[0059]
h)混匀1~5分钟后检测发光强度;
[0060]
i)以标准品浓度为横坐标,rlu值为纵坐标,在坐标纸上绘出标准曲线,将待测样品的rlu值代入方程式,计算出样品的浓度,得到样品的实际浓度。
[0061]
本发明提供的检测糖基化cd59的磁性微球检测试剂盒是基于磁微粒化学发光法制备而得的检测试剂盒,经过测试临床样本,表明本发明检测糖基化cd59的磁性微球可以有效检测人体内gcd59的含量并与临床糖尿病患者判断结果一致,因此,具有较好的临床应用价值。其显著优点在于:
[0062]
1、因gcd59与cd59在蛋白结构上只有极小的差异,因而,制备能够特异性识别gcd59而不识别cd59的特异性单克隆抗体尤为重要。通过大量、反复的筛选和验证,本发明中所述gcd59检测抗体为特异性识别gcd59而不结合cd59的单克隆抗体,这为本发明特异性检测gcd59提供可靠的生物原料。
[0063]
2、在检测方法上,本发明利用的是gcd59单克隆抗体为捕捉抗体,从方法学上采用第一步即特异性捕捉gcd59蛋白,极大降低了非特异性吸附现象,检测方法更加直接,结果更加准确。这克服了已报道的检测方法中第一步非特异性结合的弊端。
[0064]
3、抗体偶联过程加入酸化处理,提高抗体偶联效率。
[0065]
4、因该方法既操作简单且标记物稳定、灵敏度高,以克服现有酶联免疫检测方法
操作步骤繁琐、不稳定和灵敏度较低的缺陷。
[0066]
本发明公开的检测糖基化cd59的磁性微球检测试剂盒,提供了一种基于磁微粒化学发光法更便捷的检测方法,该方法具有稳定性高、灵敏度高、选择性强,检测速度快、费用低廉、易于操作等优点。克服了现有技术中检测gcd59时,灵敏度不高,操作时长等缺点,操作时间由400分钟缩短至30分钟,定量限由18.75pg/ml提升至5pg/ml,具有极好的临床应用前景。
附图说明
[0067]
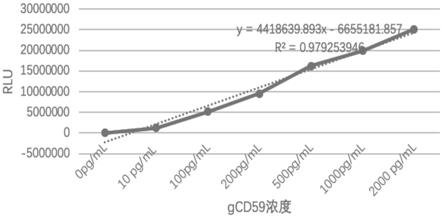
图1:本发明的检测糖基化cd59的磁性微球检测试剂盒定量线性分析图。
具体实施方式
[0068]
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
[0069]
下述实施例中,所使用的材料、试剂等,如无特殊说明,均从商业途径得到。
[0070]
实施例1:gcd59蛋白的制备
[0071]
利用已公布的gcd59氨基酸序列(daclitkaglqvynkcwkfehc)、cd59氨基酸序列(lqcyncpnptadcktavncss),采用生物领域技术人员公知的蛋白表达技术,分别获得gcd59和cd59相应核苷酸序列。
[0072]
构建表达gcd59的质粒即pcdna3.1
‑
gcd59表达载体,转染cho细胞后,筛选阳性克隆,培养后纯化即制得gcd59蛋白。
[0073]
相似方法同样可制得cd59蛋白。
[0074]
实施例2:抗gcd59鼠单克隆抗体mab1和抗cd59鼠单克隆抗体mab2的制备
[0075]
将已得到的gcd59和cd59蛋白分别免疫健康的balb/c小鼠(8周龄),待小鼠产生抗体后通过常规骨髓瘤融合细胞技术,分别制备抗gcd59鼠单克隆抗体mab1和抗cd59鼠单克隆抗体mab2。
[0076]
实验验证,制备的抗体mab1针对抗原表位的氨基酸序列是:daclitkaglqvynkcwkfehc,抗体mab2针对抗原表位的氨基酸序列是:lqcyncpnptadcktavncss。
[0077]
其中,所得mab1经过验证证实不与cd59发生交叉反应,mab2经过验证证实不与gcd59发生交叉反应。具体过程采用生物领域人员常知的杂交瘤抗体制备技术。
[0078]
进一步的,所述抗体mab2用过碘酸钠标记hrp方法制备酶结合物。
[0079]
实施例3:本发明所述检测糖基化cd59的磁性微球检测试剂盒的制备
[0080]
1、磁微球的制备:
[0081]
1.1)配制偶联缓冲液:即配制0.01mol/l的mes缓冲溶液,并调整ph值为6.0;
[0082]
mes
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.95g
[0083]
纯化水
ꢀꢀꢀꢀꢀꢀꢀꢀ
定容至1000ml
[0084]
过滤除菌,4℃保存;
[0085]
1.2)配制洗涤液,洗涤液的配方及制法是:
[0086][0087]
过滤除菌,4℃保存;
[0088]
1.3)配制保存液,保存液的配方及制法是:
[0089][0090][0091]
过滤除菌,4℃保存;
[0092]
1.4)偶联操作
[0093]
(1)抗体酸化处理
[0094]
酸处理:取1ml浓度为5mg/ml的抗体mab1溶液至2.0ml低吸附ep管,向ep管加入0.2ml酸化处理液a,室温40rpm滚轴混匀30min;
[0095]
中和:向酸处理后的抗体溶液中加入0.4ml处理液b中和,缓慢吸打后备用;其中:
[0096]
处理液a:
[0097]
硼酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.06g
[0098]
磷酸二氢钠
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.34g
[0099]
超纯水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定容至100ml
[0100]
调ph2.0
[0101]
过滤除菌,4℃保存;
[0102]
处理液b:
[0103]
硼酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.06g
[0104]
磷酸二氢钠
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.34g
[0105]
超纯水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定容至100ml
[0106]
调ph9.5
[0107]
过滤除菌,4℃保存;
[0108]
(2)羧基磁性微球的活化:取10mg羧基磁性微球,加入500μl的edc/nhs溶液室温下活化30min,磁分离,偶联缓冲液洗涤磁性微球,得活化后的磁性微球;
[0109]
其中,所述edc是:1
‑
乙基
‑
(3
‑
二甲基胺基丙基)碳化二亚胺盐酸盐,所述nhs是:n
‑
羟基丁二酰亚胺,其溶液使用偶联缓冲液为溶剂配制,其浓度均为2mg/ml,使用前将edc与nhs溶液等体积比混匀即得到edc/nhs溶液;
[0110]
(3)羧基磁性微球与mab1抗体偶联:向上述活化后的磁性微球中加入抗gcd59的鼠单克隆抗体mab1,使磁微球偶联mab1抗体的浓度为30μg/mg,室温反应3h,磁分离,洗涤液洗涤,即得免疫磁性微球,加保存液于4℃保存,备用;使用时用保存液稀释使磁性微球的工作浓度为0.2mg/ml。
[0111]
2、试剂盒溶液的配制:
[0112]
样本稀释液配方是:
[0113][0114]
调整ph为7.4,过滤除菌,4℃保存;
[0115]
20
×
浓缩洗涤液的配方是:除菌的50ml双蒸水中,含nacl 8.0g、nah2po4·
2h2o 0.2g、na2hpo4·
12h2o 2.9g、吐温20 0.5ml;
[0116]
gcd59标准品梯度溶液以如下方法制得:用纯化的重组gcd59蛋白按0pg/ml、10pg/ml、100pg/ml、200pg/ml、500pg/ml、1000pg/ml、2000pg/ml的比例,制备模拟血清中gcd59标准品;再配制含5wt%牛血清白蛋白、0.85wt%氯化钠的ph=7.0的1.0mmol/l磷酸氢二钠
‑
磷酸二氢钠的缓冲液获得标准品缓冲液;再以标准品缓冲液制备标准品浓度梯度为0pg/ml、10pg/ml、100pg/ml、200pg/ml、500pg/ml、1000pg/ml、2000pg/ml的7个标准品溶液,其中0pg/ml为标准品缓冲液;
[0117]
酶结合物稀释液的配方是:除菌的1000ml纯水中,含nacl 8g、nah2po4·
2h2o 0.2g、na2hpo4·
12h2o 2.9g、表面活性剂s9 3g、酪蛋白钠盐5g、bsa 10g、proclin300 1ml;
[0118]
发光液包括a液和b液,其配方为:a液是浓度为3.0mmol/l的鲁米诺溶液与0.3mmol/l对碘苯酚溶液等体积比的混合液;b液是浓度为7.5mmol/l的双氧水;使用时将a液与b液按体积比1﹕1混合。
[0119]
实施例4:利用本发明的试剂盒检测含gcd59样品的方法
[0120]
a)向反应杯中加入待测样本50μl、磁微粒悬浮液50μl、样品稀释液50μl;
[0121]
b)混匀后37℃温育10分钟;
[0122]
c)用磁性分离架或磁性分离器,清洗液洗涤4次;
[0123]
d)每孔分别加入酶结合物150μl;
[0124]
e)混匀后37℃温育10分钟;
[0125]
f)用磁性分离架或磁性分离器,清洗液洗涤4次;
[0126]
g)每孔加入发光液a液和发光液b液各50μl;
[0127]
h)混匀1~5分钟后检测发光强度;
[0128]
i)以标准品浓度为横坐标,rlu值为纵坐标,在坐标纸上绘出标准曲线,将待测样品的rlu值代入方程式,计算出样品的浓度,得到样品的实际浓度。
[0129]
实施例5:本发明所述检测糖基化cd59的磁性微球检测试剂盒的线性、准确性、回收率、精密度的检测
[0130]
1)试剂盒的线性
[0131]
采用所述标准品溶液为7个浓度梯度,分别是:0pg/ml、10pg/ml、100pg/ml、200pg/ml、500pg/ml、1000pg/ml、2000pg/ml,用本发明的标准操作步骤进行标准溶液的rlu值读数,根据记录的测试数值画出本发明所述试剂盒线性分析曲线,见图1。
[0132]
由图1可知,本发明所述检测糖基化cd59的磁性微球检测试剂盒线性良好。
[0133]
2)试剂盒的准确性以样本回收率进行验证。
[0134]
分别在标准品缓冲液中添加gcd59,使得gcd59最终浓度为15ng/ml、210ng/ml、1050ng/ml,每个样本平行测试3次,计算回收率统计结果见表1。
[0135]
表1:回收率
[0136][0137]
结果表明,高、中、低浓度的gcd59样本,回收率在83.4%~104.8%之间,平均回收率在88.3%~103.2%之间,总体回收率95.7%。
[0138]
3)精密性试验:
[0139]
以100ng/ml标准品平行测试10次,结果统计见表2。
[0140]
表2:精密性试验结果
[0141][0142]
精密性:cv%=5.4%
[0143]
实施例6:本发明所述检测糖基化cd59的磁性微球检测试剂盒在糖尿病临床样本筛查中的应用
[0144]
利用试剂盒检测gcd59,同时应用该指标在糖尿病患者中筛查。
[0145]
通过与合作医院合作,医院收集糖尿病临床血清样本100例和非糖尿病临床血清样本200例。将上述样本用本发明试剂盒检测血清样本中gcd59,结果显示gcd59在有糖尿病的个体中显著高于无糖尿病的个体,与糖化血红蛋白独立相关,确定糖尿病患者具有高特异性和敏感性。见表3。
[0146]
表3:糖尿病患者筛查
[0147]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1