一种用于体液样本中肿瘤细胞检测的标志物组合及试剂盒的制作方法
1.本发明属于生物医学检测技术领域,具体涉及一种用于体液样本中肿瘤细胞检测的标志物组合及试剂盒。
背景技术:
2.癌症在全球范围内发病率和致死率高,已经严重威胁人类健康。液体活检是近年来出现的肿瘤无创检测新技术。由于肿瘤转移导致其细胞从原位脱落进入循环系统,进而向包括血液、胸腔积液、脑脊液甚至尿液中播散。从这些液体样本检测游离的稀有肿瘤细胞及其分子特征可代替对肿瘤原位病灶的活检,因此被成为液体活检。由于病灶活检存在创伤且在大部分情况下难以对患者进行二次活检,因此液体活检,尤其是针对血液的液体活检,由于其无创且易于获得样本,所以受到临床很大的欢迎。
3.目前在市场上及学术界存在较多的检测血液中循环肿瘤细胞检测技术与设备,主要采用先富集后鉴定的两步检测模式。虽然对肿瘤细胞的富集方法众多,但最终鉴定肿瘤细胞的方法却极为有限,基本都采用强生公司获得美国fda批准的cellsearch系统中所采用的上皮标志物与白细胞标志物相结合的方式来鉴定的。cellsearch系统运用标记有针对epcam抗体的磁性颗粒对癌症患者7.5毫升血液中肿瘤细胞进行捕获,然后通过细胞固定、透膜、以及三重的免疫荧光染色(dapi、ck、cd45),将dapi+/ck+/cd45
‑
且符合一定形态学标准的细胞定义为肿瘤细胞并计数。
4.根据上述方法,cellsearch系统鉴定肿瘤细胞所采用的标志物组合是epcam+/ck+/cd45
‑
/dapi+,其中epcam与ck(细胞角蛋白)均为上皮标志物,cd45为白细胞标志物,而dapi为细胞核标志物。根据上述定义cellsearch系统实际上只能鉴定目标细胞为上皮来源,而不能明确目标细胞的良恶性。因此,当血液中存在良性上皮细胞时,cellsearch易出现假阳性。比如,最新的研究表明在良性疾病患者,甚至健康人的血液中也能检测到循环上皮细胞。另外,由于epcam与ck(细胞角蛋白)均为上皮标志物,无法区分上皮来源的肿瘤细胞,例如:膀胱癌,肾癌等尿路上皮癌。
技术实现要素:
5.本发明的目的是,提供一种用于体液样本中肿瘤细胞检测的标志物组合及试剂盒。主要解决现有技术cellsearch系统鉴定肿瘤细胞易出现假阳性的问题。
6.本发明为解决上述技术问题所采用的技术方案如下:
7.一种用于体液样本中肿瘤细胞检测的标志物组合,所述标志物组合包括tert和cd45。具体为tert阳性和cd45阴性。
8.作为优选实施方案,所述标志物组合还包括ck。
9.作为优选实施方案,所述标志物组合还包括细胞核染料。
10.作为优选实施方案,所述细胞核染料为dapi。
11.本发明还提供一种用于体液样本中肿瘤细胞检测的试剂盒,所述试剂盒包括所述
的标志物组合。
12.作为优选实施方案,所述试剂盒包括0.1
‑
5ug/ml的tert抗体、0.1
‑
5ug/ml的ck抗体和0.1
‑
5ug/ml的cd45抗体。
13.作为优选实施方案,所述检测试剂盒包括如下组分:
14.固定液:0.2
‑
10%的多聚甲醛;
15.破膜液:0.1
‑
5%的聚乙二醇辛基苯基醚;
16.免疫荧光染色液:0.1
‑
5ug/ml的tert抗体,0.1
‑
5ug/ml的ck抗体,0.1
‑
5ug/ml的cd45抗体,所述的抗体均标记有荧光基团;
17.细胞核染料:0.5
‑
5um的dapi磷酸盐缓冲液;
18.缓冲液ii:ph为7.2
‑
7.6浓度为0.15m
‑
0.2m的磷酸盐缓冲液。
19.作为优选实施方案,所述抗体标记的荧光基团为fitc,pe或apc。
20.作为优选实施方案,所述检测试剂盒还包括红细胞裂解试剂,红细胞裂解试剂包括如下组分:
21.红细胞裂解液:0.1
‑
5.0g碳酸氢钾,1
‑
10g氯化氨,0.01
‑
0.1g edta
‑
na2,加双蒸水至1000ml;
22.缓冲液i:含0.1
‑
3%的牛血清白蛋白的磷酸盐缓冲液,ph值为7.2
‑
7.6。
23.作为优选实施方案,所述红细胞裂解液的组份为:1.0g碳酸氢钾,8.3g氯化氨,0.037g edta
‑
na2,加双蒸水至1000ml。
24.作为优选实施方案,所述检测试剂盒还包括目标细胞富集试剂,目标细胞富集试剂包括如下组分:
25.磁珠悬液:0.1
‑
5mg/ml的cd45抗体包被的羧基磁珠;
26.缓冲液ii:ph为7.2
‑
7.6浓度为0.15m
‑
0.2m的磷酸盐缓冲液。
27.关于本发明涉及的缩写说明如下:
28.tert:端粒酶逆转录酶
29.ck:细胞角蛋白
30.cd45:在所有白细胞上都有表达,称为白细胞共同抗原
31.dapi:4',6
‑
二脒基
‑2‑
苯基吲哚
32.fitc:异硫氰酸荧光素
33.pe:藻红蛋白
34.apc:异藻蓝蛋白
35.与现有技术相比,本发明的有益效果如下:
36.1.本发明提供一组新的肿瘤细胞识别标志物组合tert+/ck+/cd45
‑
/dapi+,其中tert为端粒酶逆转录酶。其优势在于:第一、能够显著提高检测的灵敏度和特异性。第二、能够检测上皮来源的肿瘤细胞。
37.2.本发明监测结果显示,对于尿路上皮癌患者而言,使用传统的epcam+/ck+/cd45
‑
/dapi+检测方法无法对肿瘤细胞及正常细胞进行区分,本发明采用的tert+/ck+/cd45
‑
/dapi+检测方法则能够明显区分肿瘤细胞和正常细胞。
附图说明
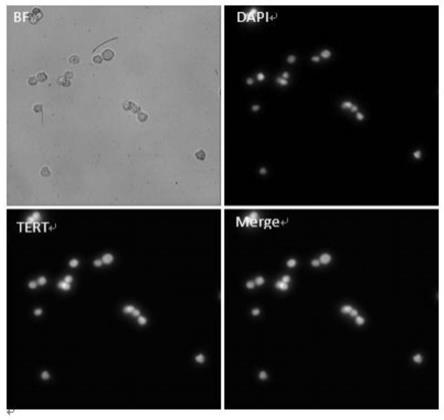
38.图1是本发明实施例1中采用高速荧光成像设备扫载玻片得到的具有不同荧光特征的细胞图;其中bf为白光下细胞视野,tert蛋白的检测显示绿色,dapi为细胞核的染色显示蓝色。
39.图2是本发明实施例2中肺癌患者胸水样本鉴定的肿瘤细胞荧光图,其中框选出的细胞为tert阳性、dapi阳性、ck阴性且cd45阴性。
40.图3是本发明实施例2胸水样本中检测细胞的cd45表达和tert表达情况的统计结果;其中tert+/cd45
‑
表示tert阳性表达cd45阴性表达,tert
‑
/cd45+表示tert阴性表达cd45阳性表达。
41.图4a是本发明实施例3膀胱癌患者尿液样本鉴定的肿瘤细胞荧光图,其中框选部分显示了一个cd45阴性、tert阳性、ck阳性且dapi阳性的细胞。
42.图4b是本发明实施例3膀胱癌患者尿液样本鉴定的肿瘤细胞荧光图,其中框选部分显示了一个cd45阴性、epcam阳性、ck阳性且dapi阳性的正常上皮细胞。
43.图5是本发明实施例3尿液样本中检测细胞的cd45表达和tert表达情况的统计结果;其中tert+/cd45
‑
表示tert阳性表达cd45阴性表达,tert
‑
/cd45+表示tert阴性表达cd45阳性表达。
具体实施方式
44.下面结合实施例对本发明的技术方案进行详细说明。以下采用的试剂和生物材料如未特别说明,均为商业化产品。
45.实施例1:肿瘤细胞系端粒酶表达验证
46.(1)将1毫升mcf
‑
7细胞系离心(500g,5分钟),弃去上清液,加入2ml hbss缓冲液重悬细胞;
47.(2)上述重悬液经细胞计数器计数后,取适量滴加在载玻片上,静置10min;
48.(3)吸去载玻片表面溶液,滴加100ul浓度为2ug/ml的tert
‑
fitc抗体,常温孵育1h;
49.(4)孵育结束后,用pbs清洗芯片3遍,将100ul的dapi滴加到载玻片上,室温孵育10min;
50.(5)孵育结束后,用pbs清洗芯片3遍,并用高速荧光成像设备成像。
51.成像结果如图1所示,展示了采用高速荧光成像设备扫载玻片得到的具有不同荧光特征的细胞图,其中bf为白光下细胞视野,tert蛋白的检测显示绿色,dapi为细胞核的染色显示蓝色。bf条件下有明显的细胞,对应的位置,有蓝色荧光以及绿色荧光,这种特征即代表肿瘤细胞系mcf7端粒酶是高表达的。
52.实施例2:肺癌患者胸水样本测试
53.肺癌患者胸水样本的测试方法包括以下步骤:
54.(1)将20ml肺癌患者胸水离心(500g,5min)分离出细胞,加5ml红细胞裂解液(bd公司)避光裂解5min,再次离心(500g,5min),弃去上清液后用hank平衡盐溶液(hbss)重悬并洗涤细胞,离心(500g,5min),弃去上清液,加入2ml hbss重悬细胞;
55.(2)上述重悬液经细胞计数器计数后,取适量滴加在载玻片上,静置10min;
56.(3)吸去载玻片表面溶液,滴加100ul抗体混合液到载玻片上,其中抗体混合液包括:2ug/ml的fitc标记的tert抗体、pe标记的1ug/ml的ck抗体以及2ug/ml的apc标记的cd45抗体,常温孵育1h;
57.(4)孵育结束后,用pbs清洗芯片3遍,将100ul的dapi滴加到载玻片上,室温孵育10min;
58.(5)孵育结束后,用pbs清洗芯片3遍,并用高速荧光成像设备成像。
59.检测结果如图2所示,框选出的细胞为tert阳性、dapi阳性、ck阴性且cd45阴性,可判定该细胞为肿瘤细胞。而图2中展示的其他细胞则无该荧光特征。
60.进一步对载玻片上部分区域中cd45阳性表达细胞及cd45阴性的细胞进行了对应的tert端粒酶荧光信号强度的统计。参见图3,为胸水样本中检测细胞的cd45表达和tert表达情况的统计结果;其中tert+/cd45
‑
表示tert阳性表达cd45阴性表达,tert
‑
/cd45+表示tert阴性表达cd45阳性表达。图3结果表明:cd45阳性的细胞,tert在1000
‑
2000的范围内呈现出较低水平的背景信号值,而cd45阴性,tert阳性的细胞,tert的信号值均在5000以上。tert阳性的细胞与阴性的细胞可进行一个明显的区分。说明本发明的检测体系具有较高的灵敏度。
61.实施例3:膀胱癌患者尿液测试
62.膀胱癌患者尿液测试的方法包括以下步骤:
63.(1)将20ml膀胱癌患者尿液(500g,5min)分离出细胞,加5ml红细胞裂解液(bd公司)避光裂解5min,再次离心(500g,5min),弃去上清液后用hank平衡盐溶液(hbss)重悬并洗涤细胞,离心(500g,5min),弃去上清液,加入2ml hbss重悬细胞;
64.(2)上述重悬液经细胞计数器计数后,取适量滴加在载玻片上,静置10min;
65.(3a)吸去载玻片表面溶液,滴加100ul抗体混合液到载玻片上,其中抗体混合液包括:2ug/ml的fitc标记的tert抗体、1ug/ml的pe
66.标记的ck抗体以及2ug/ml的apc标记的cd45抗体,常温孵育1h;
67.(3b)作为对照组,滴加另一种100ul抗体混合液到载玻片上,其中抗体混合液包括:2ug/ml的fitc标记的epcam抗体、1ug/ml的pe标记的ck抗体以及2ug/ml的apc标记的cd45抗体,常温孵育1h;
68.(4)孵育结束后,用pbs清洗芯片3遍,将100ul的dapi滴加到载玻片上,室温孵育10min;
69.(5)孵育结束后,用pbs清洗芯片3遍,并用高速荧光成像设备成像。
70.检测结果如图4a和4b所示,其中4a框选部分显示了一个cd45阴性、tert阳性、ck阳性且dapi阳性的细胞,可判定该细胞为肿瘤细胞。图4a中其余cd45阴性细胞亦具有明显的ck阳性,但是这些细胞无明显的tert阳性,属于上皮细胞但不是肿瘤细胞。其中4b显示了一个cd45阴性、epcam阳性、ck阳性且dapi阳性的正常上皮细胞。对于正常的尿路上皮细胞而言,epcam也是高表达的。所以对于尿路上皮癌患者而言,使用传统的epcam+/ck+/cd45
‑
/dapi+检测方法无法对肿瘤细胞及正常细胞进行区分,本发明的检测方法具有更明显的优势。
71.进一步对载玻片上部分区域中cd45阳性表达细胞及cd45阴性的细胞进行了对应的tert端粒酶荧光信号强度的统计,如图5所示,结果显示:cd45阳性的细胞,tert在500
‑
2000的范围内呈现出较低水平的背景信号值,而cd45阴性,tert阳性的细胞,tert的信号值均在5000以上。tert阳性的细胞与阴性的细胞可进行一个明显的区分。说明本发明的检测体系具有较高的灵敏度与特异性。
72.上述仅为本发明的部分优选实施例,本发明并不仅限于实施例的内容。对于本领域中的技术人员来说,在本发明技术方案的构思范围内可以有各种变化和更改,所作的任何变化和更改,均在本发明保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1