一种基于电子批记录的制药生产管理系统的制作方法
本发明涉及制药企业的生产管理技术领域,尤其涉及一种基于电子批记录的制药生产管理系统。
背景技术:
近年来,由于频繁发生药品质量事件,人们越来越关注药品的质量,政府部门也不断出台药品相关法规和政策来加强药品生产的合规性和药品生产数据完整性管理,从而保证药品的质量,保障患者的安全。然而,目前大多数药企仍旧采用人工传达生产指令和批记录手工录入的生产模式,这种传统生产模式很难满足新版gmp相关法规对生产数据完整性、可靠性和可追溯性等要求。首先,手工录入批记录存在数据录入错误和录入延时的风险,会导致质量管理部门无法及时识别产品质量问题,使产品最终放行时缺乏数据的正确性与及时性的依据;其次,手工录入批记录会存在数据记录错误、事后补录等风险,庞大的纸质批记录文件系统不便于问题的发现与数据追溯。
技术实现要素:
针对现有技术中存在的问题,本发明提供一种基于电子批记录的制药生产管理系统,具体包括:
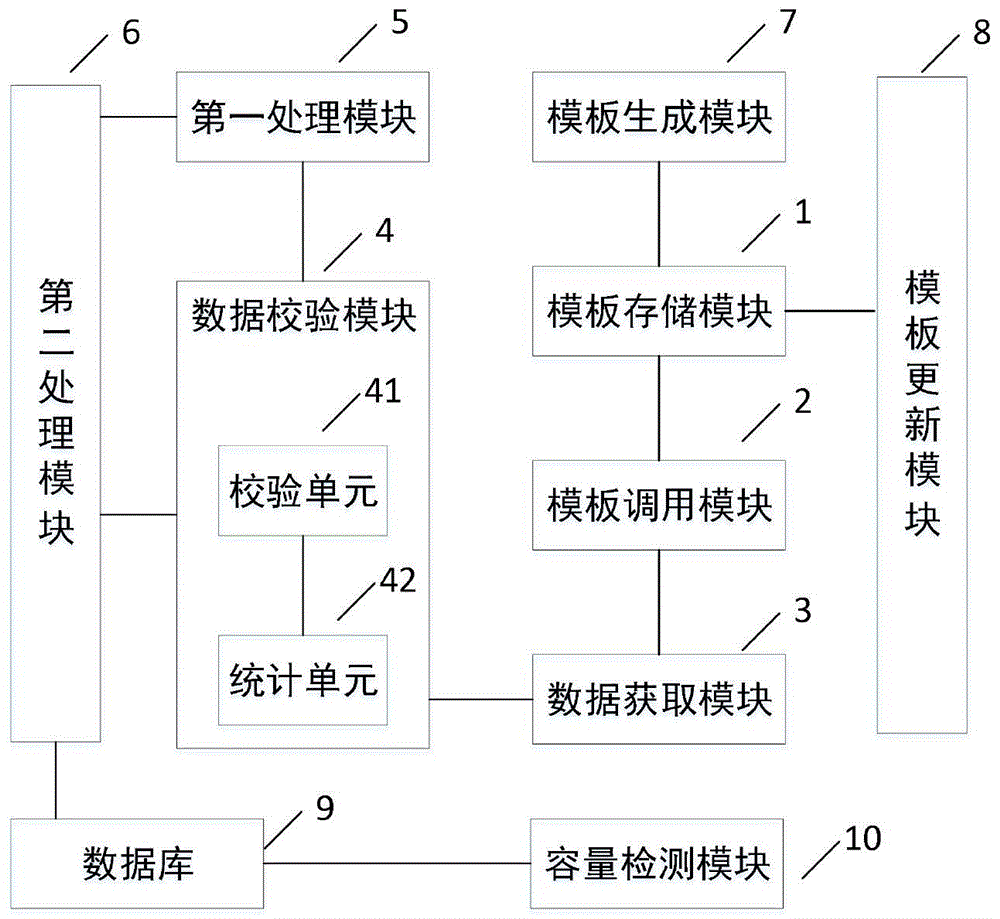
模板存储模块,用于保存预先生成的对应于每个药品生产环节的若干生产记录模板,每个所述生产记录模板包括若干记录项;
模板调用模块,连接所述模板存储模块,用于根据外部输入的包含若干所述药品生产环节的生产订单,调用对应于各所述药品生产环节的各所述生产记录模板;
数据获取模块,连接所述模板调用模块,用于在药品生产过程中,针对每个所述药品生产环节,获取所述药品生产环节的生产数据,并将所述生产数据分别录入对应的所述记录项得到所述药品生产环节的实时生产记录表;
数据校验模块,连接所述数据获取模块,用于对所述实时生产记录表中的各所述生产数据分别进行实时校验,并在所有所述校验结果均表示对应的所述生产数据未出现偏差时输出待审核信息,以及在存在校验结果表示对应的所述生产数据出现偏差时输出偏差告警,以供生产人员查看处理;
第一处理模块,连接所述数据校验模块,用于供所述生产人员将对所述偏差告警的处理结果录入所述实时生产记录表并输出所述待审核信息;
第二处理模块,分别连接所述数据校验模块和所述第一处理模块,用于根据预先生成的关联若干审核人员的审核路径依次将所述待审核信息发送至各所述审核人员,所述审核人员将包含电子签名的审核结果录入所述实时生产记录表;
所有所述药品生产环节的所述实时生产记录表均审核完成后得到包含各所述实时生产记录表的电子批记录。
优选的,所述生产记录模板的各所述记录项预先配置有记录位置信息以及对应的偏差限值;
则所述数据校验模块包括:
校验单元,用于将各所述记录项中录入的各所述生产数据分别与对应的所述偏差限值进行比较,并在所述生产数据超出所述偏差限值的限定范围时生成第一校验结果并将所述第一校验结果加入一结果集合,以及在所述生产数据超出所述限定范围时生成第二校验结果并将所述第二校验结果加入所述结果集合;
统计单元,连接所述校验单元,用于在所述结果集合中不存在所述第二校验结果时生成所述待审核信息并输出,以及在所述结果集合中存在所述第二校验结果时生成包含对应的所述记录位置信息的所述偏差告警并输出,以供生产人员查看处理。
优选的,还包括模板生成模块,连接所述模板存储模块,用于根据药品的标准操作流程生成所述生产记录模板。
优选的,还包括模板更新模块,连接所述模板存储模块,用于供生产管理人员对所述生产记录模板中的各所述记录项进行修改,并在修改完成后将包含所述生产管理人员的电子签名的所述生产记录模板存入所述模板存储模块。
优选的,还包括一数据库,连接所述第二处理模块,用于获取并保存所述电子批记录。
优选的,还包括一容量检测模块,连接所述数据库,用于统计所述数据库的实时存储量,并在所述实时存储量不小于预设的安全存储阈值时生成相应的归档提示,所述生产人员根据所述归档提示对所述数据库中当前存储的所述电子批记录进行归档处理。
优选的,所述生产数据包括生产设备信息,和/或生产物料信息。
上述技术方案具有如下优点或有益效果:
1)生产数据录入具有实时性,且有效避免手工录入导致的录入错误风险,节约人力成本,同时质量管理部门能够及时获取生产数据,以便及时识别产品质量问题;
2)生产记录模板的修改需要进行电子签名,且每个药品生产环节对应的实时生产记录表需要进行审核确认后进行电子签名,实现了生产数据的可追溯性。
附图说明
图1为本发明的较佳的实施例中,一种基于电子批记录的制药生产管理系统的结构示意图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。本发明并不限定于该实施方式,只要符合本发明的主旨,则其他实施方式也可以属于本发明的范畴。
本发明的较佳的实施例中,基于现有技术中存在的上述问题,现提供一种基于电子批记录的制药生产管理系统,如图1所示,具体包括:
模板存储模块1,用于保存预先生成的对应于每个药品生产环节的若干生产记录模板,每个生产记录模板包括若干记录项;
模板调用模块2,连接模板存储模块1,用于根据外部输入的包含若干药品生产环节的生产订单,调用对应于各药品生产环节的各生产记录模板;
数据获取模块3,连接模板调用模块2,用于在药品生产过程中,针对每个药品生产环节,获取药品生产环节的生产数据,并将生产数据分别录入对应的记录项得到药品生产环节的实时生产记录表;
数据校验模块4,连接数据获取模块3,用于对实时生产记录表中的各生产数据分别进行实时校验,并在所有校验结果均表示对应的生产数据未出现偏差时输出待审核信息,以及在存在校验结果表示对应的生产数据出现偏差时输出偏差告警,以供生产人员查看处理;
第一处理模块5,连接数据校验模块4,用于供生产人员将对偏差告警的处理结果录入实时生产记录表并输出待审核信息;
第二处理模块6,分别连接数据校验模块4和第一处理模块5,用于根据预先生成的关联若干审核人员的审核路径依次将待审核信息发送至各审核人员,审核人员将包含电子签名的审核结果录入实时生产记录表;
所有药品生产环节的实时生产记录表均审核完成后得到包含各实时生产记录表的电子批记录。
具体地,本实施例中,本发明的基于电子批记录的制药生产管理系统,通过自动获取各药品生产环节的生产数据并实时记录,节约人力成本的同时避免人工参与造成的操作误差。进一步通过对实时记录得到的实时生产记录表进行实时校验和审核,保证了生产数据的准确性和可追溯性,且在生产数据出现偏差时及时给出偏差告警,以便生产人员及时查看处理,具有实时性。
进一步具体地,在根据生产订单进行药品生产之前,首先需要确定该药品的每个药品生产环节需要记录的生产数据,因此,本发明通过预先生成多个生产记录模板并进行存储,以便于后续生产过程中进行调用。上述生产记录模板包括若干记录项,该记录项对应于需要记录的生产数据,包括但不限于各药品生产环节的所用设备的生产设备信息,以及各药品生产环节所需使用的物料的生产物料信息。上述生产设备信息包括但不限于生产设备的清洁状态、生产设备的检验状态、生产设备所在位置的温湿度信息等;上述生产物料信息包括但不限于生产物料的名称、生产物料的供应商、生产物料的有效期、生产物料的库存量等信息。
在药品生产过程中,不同的药品包含的药品生产环节不同,同时需要记录的生产数据也不尽相同,因此,在生成上述生产记录模板之后,可以根据生产订单中包含的药品生产环节调用关联的生产记录模块,以满足不同药品的生产需求。随后在药品生产过程中,依次获取各个药品生产环节的生产数据并记录在上述生产记录模板上,以得到每个药品生产环节的实时生产记录表。
在记录上述生产数据的同时,还包括对记录的生产数据进行实时校验,优选通过对每个记录项预先配置相应的偏差限值,以验证该生产数据是否出现偏差,该偏差限值分别与各记录项对应,如该记录项记录的生产数据为生产设备的清洁状态,对应的偏差限值为已清洁,即该生产设备的清洁状态若为已清洁,则表示该生产设备的生产数据为出现偏差,若该生产设备的清洁状态为未清洁,则表示该生产设备不满足生产需要,换言之,其生产数据出现偏差,此时及时给出清洁状态的偏差告警,方便生产人员及时查看处理。上述偏差限值也可以用于限定一范围,如该记录项记录的生产数据为生产设备所在位置的实时温度,则该偏差限值可以是温度上限,或温度下限,或温度上限和温度下限限定的温度区间,即是说该实时温度为超出温度上限或温度下限则表示生产环境正常,即生产数据未出现偏差,若该实时温度超出了温度上限或温度下限则表示生产环境出现异常,即生产数据出现偏差,此时及时给出实时温度的偏差告警,方便生产人员及时查看处理,有效保证药品的生产质量。
进一步地,实时生产记录表中的所有生产数据均未出现偏差时则生成待审核信息发送给审核人员进行审核,实时生产记录表中出现偏差时,需要生产人员对偏差告警进行处理,并及时将偏差告警的处理结果记录在实时生产记录表中,随后同样生成待审核信息发送给审核人员进行审核。本实施例中,优选根据预先生成的审核路径将待审核信息发送至审核人员,上述审核路径根据药品生产要求预先生成,优选在实时生产记录表为批生产记录时,该审核路径从下至上分为三级,依次为工艺技术员、工艺主任以及现场qa,即是说工艺技术员首先对实时生产记录表进行审核,并在审核通过后给出电子签名,随后工艺主任对实时生产记录表进行审核,并在审核通过后给出电子签名,最后由现场qa对实时生产记录表进行审核,并在审核通过后给出电子签名,得到电子批记录。更为优选的,在任意一级的审核人员对实时生产记录表存在意见时,可以将该意见及时录入实时生产记录表并将该实时生产记录表返回至上一级的审核人员进行处理,直至该审核路径完成。
因此,根据上述电子批记录,能够获取该生产订单的整个生产过程的生产数据,方便后期追溯分析。
本发明的较佳的实施例中,生产记录模板的各记录项预先配置有记录位置信息以及对应的偏差限值;
则数据校验模块4包括:
校验单元41,用于将各记录项中录入的各生产数据分别与对应的偏差限值进行比较,并在生产数据超出偏差限值的限定范围时生成第一校验结果并将第一校验结果加入一结果集合,以及在生产数据超出限定范围时生成第二校验结果并将第二校验结果加入结果集合;
统计单元42,连接校验单元41,用于在结果集合中不存在第二校验结果时生成待审核信息并输出,以及在结果集合中存在第二校验结果时生成包含对应的记录位置信息的偏差告警并输出,以供生产人员查看处理。
本发明的较佳的实施例中,还包括模板生成模块7,连接模板存储模块1,用于根据药品的标准操作流程生成生产记录模板。
本发明的较佳的实施例中,还包括模板更新模块8,连接模板存储模块1,用于供生产管理人员对生产记录模板中的各记录项进行修改,并在修改完成后将包含生产管理人员的电子签名的生产记录模板存入模板存储模块1。
具体地,本实施例中,对于具有特定生产环节或具有特定生产数据的药品,通过上述模板更新模块8,能够及时对生产记录模板中的各记录项进行修改,该修改包括但不限于增加记录项以及删除记录项,以满足不同药品的生产需求。
本发明的较佳的实施例中,还包括一数据库9,连接第二处理模块6,用于获取并保存电子批记录。
本发明的较佳的实施例中,还包括一容量检测模块10,连接数据库9,用于统计数据库9的实时存储量,并在实时存储量不小于预设的安全存储阈值时生成相应的归档提示,生产人员根据归档提示对数据库9中当前存储的电子批记录进行归档处理。
具体地,本实施例中,通过对电子批记录进行归档处理,使得系统始终运行在安全存储阈值下,达到安全、稳定和高效运行的目的,通过保证了数据的完整性,防止由于存储量过大导致的新生成的电子批记录无法保存或者历史电子批记录被覆盖。
本发明的较佳的实施例中,生产数据包括生产设备信息,和/或生产物料信息。
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!