用于电化学装置的稳定循环的局部超浓缩电解质的制作方法
本申请要求2017年3月2日提交的美国临时申请no.62/466,267的在先申请日的权益,所述申请以全文引用的方式并入本文中。感谢政府支持本发明是在由美国能源部授予的合约de-ac05-76rl01830下,由政府支持进行的。政府拥有本发明中的某些权利。本发明涉及用于电化学装置的稳定循环的局部超浓缩电解质,所述电解质包括活性盐、所述活性盐在其中可溶的溶剂以及所述活性盐在其中不溶或难溶的稀释剂。
背景技术:
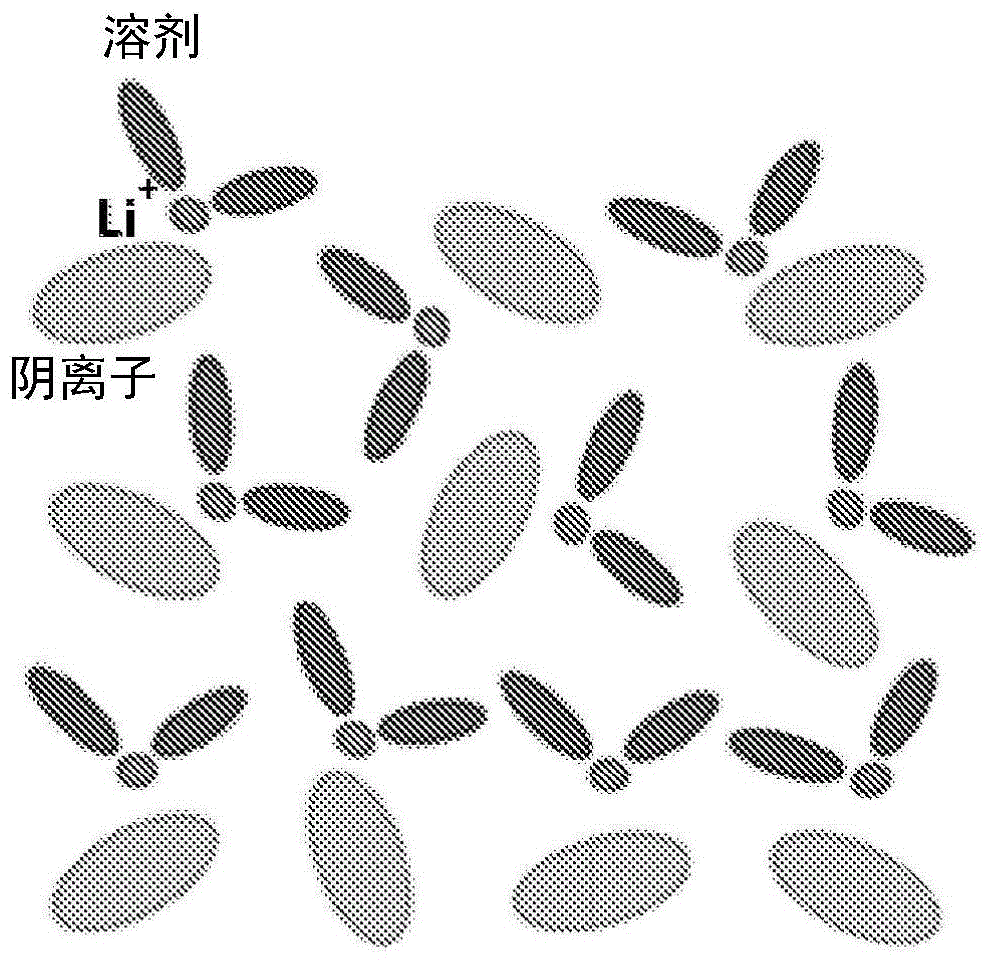
:锂金属被认为是用于实现电池的高能量密度的最终阳极材料,因为它具有最高的比容量(3860mahg-1,2061mahcm-3)和最低的电化学势(-3.04v,相对于标准氢电极而言)。然而,关键的挑战包括锂枝晶生长,而且循环期间有限的库仑效率(ce)抑制了锂电池在可充电电池中的实际应用(xu等人,energyenviron.sci.2014,7:513-537)。近来,重新开始研究以改善li金属阳极的稳定性,旨在实现li金属电池的实际应用。代表性的方法包括使用电解质添加剂、超浓缩电解质、聚合物或固态电解质以及选择性/导向性li沉积。近来,超浓缩电解质由于其各种独特的功能用于li金属电池而受到了广泛的研究关注。qian等人的一项具体的研究报道,使用由二甲氧基乙烷(dme)中单一的双(氟磺酰基)酰亚胺(lifsi)盐组成的超浓缩电解质可使得li金属阳极以高ce(最高99.1%)高速循环,而不形成枝晶(qian等人,nat.commun.2015,6:6362)。然而,超浓缩电解质通常粘度高,和/或隔膜和阴极的润湿不良。在制造过程期间向大型锂离子电池(诸如棱柱形或圆柱形电池)中注入高粘度电解质实际上是不可行的。此外,高浓度锂盐的高成本也阻碍了超浓缩电解质的实际使用。技术实现要素:本发明公开局部超浓缩电解质(lse)和包括lse的电化学系统的实施方案。lse包括活性盐、所述活性盐在其中可溶的溶剂以及稀释剂,其中活性盐在所述稀释剂中的溶解度比活性盐在所述溶剂中的溶解度小至少10倍。在一些实施方案中,所述溶剂包含二甲氧基乙烷(dme)、碳酸二甲酯(dmc)、1,3-二氧戊环(dol)、碳酸甲乙酯(emc)、碳酸二乙酯(dec)、二甲亚砜(dmso)、乙基乙烯基砜(evs)、四亚甲基砜(tms)、乙基甲基砜(ems)、碳酸亚乙酯(ec)、碳酸亚乙烯酯(vc)、氟代碳酸亚乙酯(fec)、4-乙烯基-1,3-二氧戊环-2-酮(vec)、二甲基砜、乙基甲基砜、丁酸甲酯、丙酸乙酯、磷酸三甲酯、磷酸三乙酯、γ-丁内酯、4-亚甲基-1,3-二氧戊环-2-酮、碳酸亚甲基亚乙酯(mec)、4,5-二亚甲基-1,3-二氧戊环-2-酮、烯丙基醚、三烯丙基胺、三烯丙基氰尿酸酯、三烯丙基异氰尿酸酯、水或其任意组合。在任何或所有以上实施方案中,(i)活性盐在电解质中的摩尔浓度可在0.5m至2m的范围内;(ii)活性盐在溶剂中的摩尔浓度可为每升溶剂大于3摩尔活性盐;或(iii)同时具备(i)和(ii)。在一些实施方案中,活性盐在电解质中的摩尔浓度比活性盐在不存在稀释剂的溶剂中的摩尔浓度小至少20%。在任何或所有以上实施方案中,(i)活性盐与溶剂的摩尔比可在0.33至1.5的范围内;(ii)溶剂与稀释剂的摩尔比可在0.2至5的范围内;或(iii)同时具备(i)和(ii)。在任何或所有以上实施方案中,至少90%的溶剂的分子可与活性盐的阳离子缔合。在任何或所有以上实施方案中,少于10%的稀释剂的分子可与活性盐的阳离子缔合。在任何或所有以上实施方案中,活性盐可包括锂盐或锂盐混合物、钠盐或钠盐混合物,或镁盐或镁盐混合物。在一些实施方案中,活性盐包含双(氟磺酰基)酰亚胺锂(lifsi)、双(三氟甲基磺酰基)酰亚胺锂(litfsi)、双(氟磺酰基)酰亚胺钠(nafsi)、双(三氟甲基磺酰基)酰亚胺钠(natfsi)、双(草酸根)硼酸锂(libob)、双(草酸根)硼酸钠(nabob)、lipf6、liasf6、lin(so2cf3)2、lin(so2f)2、licf3so3、liclo4、二氟草酸硼酸锂阴离子(lidfob)、lii、libr、licl、lioh、lino3、liso4或其任意组合。在某些以上实施方案中,活性盐为(i)lifsi、litfsi或其组合或(ii)nafsi、natfsi或其组合;溶剂为dmc、dme、dol、emc或其组合;且活性盐在电解质中的摩尔浓度在0.75m至1.5m的范围内。在任何或所有以上实施方案中,稀释剂可包含氟代烷基醚(也称作氢氟醚(hfe))。在一些实施方案中,稀释剂包含1,1,2,2-四氟乙基-2,2,2,3-四氟丙基醚(tte)、双(2,2,2-三氟乙基)醚(btfe)、1,1,2,2,-四氟乙基-2,2,2-三氟乙基醚(tftfe)、甲氧基九氟丁烷(mofb)、乙氧基九氟丁烷(eofb)或其任意组合。在任何或所有以上实施方案中,溶剂和稀释剂是可混溶的。在一些实施方案中,lse包括活性盐;溶剂,包括碳酸酯溶剂、醚溶剂、磷酸酯溶剂、二甲亚砜、水或其组合,其中活性盐在溶剂中可溶;稀释剂,其中稀释剂与溶剂不混溶,且其中活性盐在稀释剂中的溶解度比活性盐在溶剂中的溶解度小至少10倍;以及与所述溶剂具有不同组成且与所述稀释剂具有不同组成的桥溶剂,其中所述桥溶剂与所述溶剂以及与所述稀释剂可混溶。示例的桥溶剂包括乙腈、碳酸二甲酯、碳酸二乙酯、碳酸亚丙酯、二甲亚砜、1,3-二氧戊环、二甲氧基乙烷、二甘醇二甲醚(双(2-甲氧基乙基)醚)、三甘醇二甲醚(三乙二醇二甲醚)、四甘醇二甲醚(四乙二醇二甲醚)或其任意组合。在溶剂和稀释剂不混溶的某些实施方案中,溶剂包含水。在所述实施方案中,活性盐可为(i)lifsi、litfsi、libob、lipf6、liasf6、lin(so2cf3)2、lin(so2f)2、licf3so3、liclo4、lidfob、lii、libr、licl、lioh、lino3、liso4或其任意组合,或(ii)nafsi、natfsi、nabob或其组合。如本文公开的电池的一些实施方案包括(i)电解质,所述电解质包含活性盐,溶剂,包括碳酸酯溶剂、醚溶剂、磷酸酯溶剂、二甲亚砜、水或其组合,其中活性盐在溶剂中可溶,以及稀释剂,其中活性盐在稀释剂中的溶解度比活性盐在溶剂中的溶解度小至少10倍,且其中活性盐在电解质中的浓度在0.75m至2m范围内;(ii)阳极;以及(iii)阴极,其中所述电池具有≥95%的库仑效率。示例的溶剂包括dme、dol、dmc、emc、dec、dmso、evs、tms、ems、ec、vc、fec、vec、二甲基砜、乙基甲基砜、丁酸甲酯、丙酸乙酯、磷酸三甲酯、磷酸三乙酯、γ-丁内酯、4-亚甲基-1,3-二氧戊环-2-酮、mec、4,5-二亚甲基-1,3-二氧戊环-2-酮、烯丙基醚、三烯丙基胺、三烯丙基氰尿酸酯、三烯丙基异氰尿酸酯、水或其任意组合。在电池的一个实施方案中,(i)阳极为锂金属;(ii)活性盐包含lifsi、litfsi、libob、lipf6、liasf6、lin(so2cf3)2、lin(so2f)2、licf3so3、liclo4、lidfob、lii、libr、licl、lioh、lino3、liso4或其任意组合;(iii)溶剂包含dmc、dme、dol、evs、tms、ems、ec、vc、fec、vec、二甲基砜、乙基甲基砜、丁酸甲酯、丙酸乙酯、磷酸三甲酯、γ-丁内酯、4-亚甲基-1,3-二氧戊环-2-酮、mec、4,5-二亚甲基-1,3-二氧戊环-2-酮、烯丙基醚、三烯丙基胺、三烯丙基氰尿酸酯、三烯丙基异氰尿酸酯或其任意组合;(iv)稀释剂包含tte、btfe、tftfe、mofb、eofb或其任意组合;且(v)阴极为li1+wnixmnycozo2(x+y+z+w=1,0≤w≤0.25)、linixmnycozo2(x+y+z=1)、licoo2、lini0.8co0.15al0.05o2、lini0.5mn1.5o4尖晶石、limn2o4、lifepo4、li4-xmxti5o12(m=mg、al、ba、sr或ta;0≤x≤1)、mno2、v2o5、v6o13、liv3o8、limc1xmc21-xpo4(mc1或mc2=fe、mn、ni、co、cr或ti;0≤x≤1)、li3v2-xm1x(po4)3(m1=cr、co、fe、mg、y、ti、nb或ce;0≤x≤1)、livpo4f、limc1xmc21-xo2(mc1和mc2独立地为fe、mn、ni、co、cr、ti、mg或al;0≤x≤1)、limc1xmc2ymc31-x-yo2(mc1、mc2和mc3独立地为fe、mn、ni、co、cr、ti、mg或al;0≤x≤1;0≤y≤1)、limn2-yxyo4(x=cr、al或fe,0≤y≤1)、lini0.5-yxymn1.5o4(x=fe、cr、zn、al、mg、ga、v或cu;0≤y<0.5)、xli2mno3·(1-x)limc1ymc2zmc31-y-zo2(mc1、mc2和mc3独立地为mn、ni、co、cr、fe或其混合物;x=0.3-0.5;y≤0.5;z≤0.5)、li2m2sio4(m2=mn、fe或co)、li2m2so4(m2=mn、fe或co)、lim2so4f(m2=fe、mn或co)、li2-x(fe1-ymny)p2o7(0≤y≤1)、cr3o8、cr2o5、碳/硫复合物或空气电极。在电池的一个独立实施方案中,(i)阳极为钠金属;(ii)活性盐包含nafsi、natfsi或其组合;(iii)溶剂包含dmc、dme、dol或其任意组合;(iv)稀释剂包含btfe、tte、tftfe、mofb、eofb或其任意组合;且(v)阴极为nafepo4、na2fepo4f、na2fep2o7、na3v2(po4)3、na3v2(po4)2f3、navpo4f、navpopof、na1.5vopo4f0.5、naco2o4、nafeo2、naxmo2,其中0.4<x≤1,且m为过渡金属或过渡金属混合物、na2/3ni1/3mn2/3o2、na2/3fe1/2mn1/2o2、na2/3ni1/6co1/6mn2/3o2、nani1/3fe1/3mn1/3o2、nani1/3fe1/3co1/3o2、nani1/2mn1/2o2、普鲁士白模拟阴极(prussianwhiteanaloguecathode)或普鲁士蓝模拟阴极(prussianblueanaloguecathode)。在电池的一些实施方案中,溶剂和稀释剂不混溶且电解质进一步包括与所述溶剂具有不同组成且与所述稀释剂具有不同组成的桥溶剂,其中所述桥溶剂与所述溶剂以及与所述稀释剂可混溶。在溶剂和稀释剂不混溶的一个实施方案中,(i)活性盐包含lifsi、litfsi或其组合;(ii)溶剂为h2o;(iii)桥溶剂包含an、dmc、dec、pc、dmso、dol、dme、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚或其任意组合;(iv)稀释剂包含btfe、tte、tftfe、mofb、eofb或其任意组合;(v)阳极为mo6s8、tio2、v2o5、li4mn5o12、li4ti5o12、c/s复合物或聚丙烯腈-硫复合物;且(vi)阴极为linixmnycozo2(x+y+z=1)、lifepo4、limnpo4、lifexmn1-xpo4、licoo2、lini0.8co0.15al0.05o2、lini0.5mn1.5o4尖晶石或limn2o4。在溶剂和稀释剂不混溶的一个独立实施方案中,(i)活性盐包含nafsi、natfsi或其组合;(ii)溶剂为h2o;(iii)桥溶剂包含an、dmc、dec、pc、dmso、dol、dme、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚或其任意组合;(iv)稀释剂包含btfe、tte、tftfe、mofb、eofb或其任意组合;(v)阳极为nati2(po4)3;tis2、cus、fes2、nico2o4、cu2se或li0.5na0.5ti2(po4)3;且(vi)阴极为na4co3(po4)2p2o7、na4co2.4mn0.3ni0.3(po4)2p2o7、na7v4(p2o7)4po4、nafepo4、na2fepo4f、na2fep2o7、na3v2(po4)3、na3v2(po4)2f3、navpo4f、navpopof、na1.5vopo4f0.5、na2fe2(so4)3、nafeo2和naxmo2,其中0.4<x≤1,且m为过渡金属或过渡金属混合物(例如,nacro2、nacoo2、naxcoo2(0.4≤x≤0.9)、na2/3[ni1/3mn1/2ti1/3]o2、na2/3ni1/3mn2/3o2、na2/3fe1/2mn1/2o2、na2/3ni1/6co1/6mn2/3o2、nani1/3fe1/3mn1/3o2、nani1/3fe1/3co1/3o2、nani1/2mn1/2o2、普鲁士白模拟阴极或普鲁士蓝模拟阴极。本发明的上述以及其他目的、特征和优势从以下详细说明更明显,所述详细说明参考附图来进行。附图说明本专利或申请文件含有至少一个彩色绘制的附图。本专利或专利申请公布具有彩色附图的副本将由专利局根据要求来提供,并需支付必要的费用。图1为包含锂盐和溶剂的超浓缩电解质(se)的示意图。图2为示例性局部超浓缩电解质(lse)的示意图,所述示例性局部超浓缩电解质包含锂盐、锂盐在其中可溶的溶剂,以及稀释剂,即与溶剂相比锂盐在其中不溶或难溶的组分。图3为在水分子与稀释剂的分子之间的示例性“桥”溶剂的分子的示意图。图4为电池的示意图。图5a和5b显示对于具有在碳酸酯溶剂中包含锂盐的各种浓缩电解质,在1macm-2下测试具有0.5mahcm-2的锂面积沉积容量的li||cu电池单元,初始的锂沉积/剥离电压曲线(图5a)和库仑效率随循环数的变化(图5b)。图6为对于具有在含和不含氟代烷基醚稀释剂的碳酸甲乙酯(emc)中包含浓缩lifsi的电解质而言,在0.5macm-2下测试具有1mahcm-2的锂面积沉积容量的li||cu电池单元,库仑效率随循环数的变化的曲线图。图7的数码照片表明向lifsi/emc电解质中加入双(2,2,2-三氟乙基)醚(btfe)改善电池隔膜润湿。图8a和8b的曲线图显示具有含和不含btfe稀释剂的浓缩lifsi/emc电解质的li||nmc761410(lini0.76mn0.14co0.10o2)电池单元在c/3(图8a)和1c倍率(图8b)时的循环稳定性(btfe:双(2,2,2-三氟乙基)醚)。图9a和9b显示对于具有包含7.5mol/kglibf4/pc和2.5mol/kglibf4/pc-tte(pc:tte=2:1v:v)(tte:1,1,2,2-四氟乙基2,2,3,3-四氟丙基醚)的电解质、0.5mah/cm2的锂面积沉积容量的cu||li电池单元而言,初始的锂沉积/剥离电压曲线(图9a)和库仑效率随循环数的变化(图9b)。图10a-10d为使用传统电解质(1.0mlipf6/ec-emc(4:6,w))(图10a)、1.2mlifsi/dmc(图10b)、3.7mlifsi/dmc(图10c)和5.5mlifsi/dmc(图10d)的li||cu电池单元的li电镀/剥离曲线。图11a-11d为使用浓缩3.8mlifsi/dmc-btfe(1:0.5)(图11a)、2.5mlifsi/dmc-btfe(1:1)(图11b)、1.8mlifsi/dmc-btfe(1:1.5)(图11c)和1.2mlifsi/dmc-btfe(1:2)(图11d)的li||cu电池单元的li电镀/剥离曲线。括号中的比率表示dmc:btfe的摩尔比。图12a-12d为由1.0mlipf6/ec-emc(图12a)、5.5mlifsi/dmc(图12b)、3.7mlifsi/dmc(图12c)和1.2mlifsi/dmc-btfe(1:2)(图12d)电解质向铜基板上镀锂在100个循环(1ma/cm2至0.5mah/cm2)后的扫描电子显微镜图像。图13为对于传统电解质、稀lifsi/dmc电解质、超浓缩lifsi/dmc电解质和1.2mlifsi/dmc-btfe(1:2)的lse而言,库仑效率相对于循环数的曲线图。图14为对于传统电解质、稀lifsi/dmc电解质、超浓缩lifsi/dmc电解质和如本文公开的某些lse而言,电导率相对于温度的曲线图。图15a和15b为展示li||li对称电池单元在变化的电流密度下,在5.5mlifsi/dmc的se(图15a)和1.2mlifsi/dmc-btfe(1:2)的lse(图15b)中的性能(电压相对于容量)的曲线图。图16的电流相对电压曲线图说明5.5mlifsi/dmc的se和如本文公开的某些lse的阳极稳定性。图17a-17d为显示由1.2mlifsi/dmc(图17a、17b)和3.7mlifsi/dmc(图17c、17d)向铜基板上镀锂的sem图像;图17a和17c为剖视图;图17b和17d为顶视图。图18a-18d显示具有不同电解质的li||nmc电池的电化学行为。图18a显示循环稳定性和库仑效率。图18b-18d显示在1.0mlipf6/ec-emc(图18b)、5.5mlifsi/dmc(图18c)和1.2mlifsi/dmc-btfe(1:2)(图18d)中的典型电压曲线。图19显示使用不同电解质的li||nmc电池的倍率性能;电池以恒定的c/5倍率充电,但以递增的c倍率放电;1c=2.0ma/cm2。图20显示使用不同电解质的li||nmc电池的倍率性能;电池以恒定的c/5倍率放电,但以递增的c倍率充电;1c=2.0ma/cm2。图21a-21f为显示li金属在不同电解质中电镀在cu基板上后的形态的sem图像。图21a、21c和21e为剖视图;图21b、21d和21f为li金属电镀在cu基板上的顶视图。电解质为1.0mlipf6/ec-emc(图21a、21b)、5.5mlifsi/dmc(图21c、21d)和1.2mlifsi/dmc-btfe(1:2)(图21e、21f)。图22a-22c为显示在2ma/cm2(图22a)、5ma/cm2(图22b)和10ma/cm2(图22c)的电流密度下,li金属在1.2mlifsi/dmc-btfe(1:2)中电镀在cu基板上后的形态的sem图像。图23显示在1mahcm-2的li沉积面积容量下,在0.5macm-2下测试的使用浓缩lifsi/dme电解质和具有tte或btfe稀释剂的电解质的li||cu电池单元的库仑效率随循环数的变化(ce)。图24显示在2.5~3.7v的电压范围内,在以c/10进行3次形成循环后,具有含和不含tte或btfe稀释剂的浓缩4mlifsi/dme电解质的li||lifepo4(lfp)电池单元在1c倍率下的循环稳定性。图25a和25b显示在1.3mahcm-2的na沉积面积容量下,在以0.26macm-2进行2次形成循环后,在0.65macm-2下测试的na||cu电池单元的初始na沉积/剥离电压曲线(图25a)和ce随循环数的变化(图25b)。图26a和26b显示在c/3下,含有超浓缩nafsi/dme电解质和具有tte稀释剂的lse的na||na3v2(po4)3电池单元的初始充电/放电电压曲线(图26a)和循环稳定性(图26b)。图27a和27b显示含有5.2mnafsi/dme(图27a)和2.3mnafsi/dme-tte(dme:tte摩尔比为1:1)(图27b)电解质的na||na3v2(po4)3电池单元的充电和放电容量。图28a和28b显示对于5.2mnafsi/dme、3.1mnafsi/dme-btfe(1:1)、2.1mnafsi/dme-btfe(1:2)和1.5mnafsi/dme-btfe(1:3)电解质,在以0.2macm-2进行2次形成循环后,在1macm-2下测试的na||cu电池单元的初始na沉积/剥离电压曲线(图28a)和ce随循环数的变化(图28b)。括号中的比率表示在不同的经btfe稀释的lse中,dme:btfe的摩尔比。图29a-29c显示使用5.2mnafsi/dme和经btfe稀释的nafsi/dme-btfe电解质的na||na3v2(po4)3电池单元的电化学性能。图29a显示初始na电镀/剥离曲线;图29b显示经过100次循环的循环稳定性;图29c显示nafsi/dme-btfe(1:1:2,以mol计)经过100次循环的充电和放电容量。图30a和30b显示使用低浓度1mlitfsi/dol-dme、浓缩3.3mlitfsi/dol-dme电解质、1.06mlitfsi/dol-dme-tte电解质的lse,在1mahcm-2的li沉积面积容量下,在以0.2macm-2进行2次形成循环后,在1macm-2下测试的li||cu电池单元的初始li沉积/剥离电压曲线(图30a)和ce随循环数的变化(图30b)。图31a-31c显示含有低浓度1mlitfsi/dol-dme、浓缩3.3mlitfsi/dol-dme电解质和1.06mlitfsi/dol-dme-tte电解质的lse的li-s电池单元的电化学性能;图31a为初始充电/放电电压曲线,图31b为循环性能,且图31c显示在0.1c(168mag-1)下评估的li-s电池单元的ce随循环数的变化。图32显示在0.1macm-2的电流密度下,具有600mahg-1的有限放电容量的使用litfsi-3dmso(二甲亚砜)(2.76m)和litfsi-3dmso-3tte(1.23m)电解质的li-o2电池单元的充电/放电曲线。图33显示在10mvs-1的扫描速率下,使用不锈钢工作电极和反电极,且以ag/agcl作为参比电极,在不同‘桥’溶剂(乙腈(an)、碳酸二甲酯(dmc)、碳酸亚丙酯(pc)和dmso)的帮助下,在用tte稀释前后,浓缩水性电解质的循环伏安图。电势转化为相对于li/li+氧化还原电对的电势。图34a和34b分别显示在pc的帮助下,用不同量的tte稀释浓缩水性电解质的第一个和第二个循环的循环伏安图。不锈钢为工作电极和反电极,且ag/agcl为参比电极。扫描速率为10mvs-1。电势转化为相对于li/li+氧化还原电对的电势。图35显示dmc和btfe溶剂的分子、lifsi盐以及dmc+lifsi和btfe+lifsi溶剂-盐对的优化分子结构。li、o、c、h、s、n和f原子分别为洋红色、红色、灰色、白色、黄色、蓝色和浅蓝色。图36a-36f为显示溶剂的分子dmc(图36a)和btfe(图36b)、lifsi盐(图36c)以及dmc-lifsi溶剂-盐对(图36d-36f)在锂(100)阳极表面上的吸收的分子模型。每一对中的上图和下图分别是顶视和侧视结构。图37a-37c为在303k下来自aimd模拟的电解质/盐混合物的分子模型-lifsi-dmc(1:1.1)(图37a);lifsi-dmc-btfe(0.94:1.1:0.55)(图37b);lifsi-dmc-btfe(0.51:1.1:2.2)(图37c);括号中的比率表示lifsi:dmc:btfe的摩尔比。图38为由303k下的aimd模拟轨道计算的li-odmc和li-obtfe对的径向分布函数曲线图。图39a和39b为纯dmc溶剂、纯btfe溶剂和dmc-btfe溶剂混合物(2:1)的拉曼光谱;图39b为图39a在2000-200cm-1波数范围内的放大图。图40a和40b为不同浓度的lifsi/dmc溶液(图40a)和不同浓度的经btfe稀释的lifsi/dmc-btfe溶液(图40b)的拉曼光谱。图41显示在以粘度的倒数(η-1)绘图的样品之间,li+、fsi-和溶剂的分子(dmc和btfe)在30℃下的扩散系数(d),用星形表示。条形图自左向右表示存在以下物质:btfe、dmc、li、fsi。图42显示在30℃下,btfe、li和fsi在dmc中的扩散比-dbtfe/ddmc、dli/ddmc和dfsi/ddmc。图43a-43c的曲线图显示稀电解质(lifsi/dmc、lifsi:dmc的摩尔比为1:2)(图43a)、超浓缩电解质(5.5mlifsi/dmc、lifsi:dmc的摩尔比为1:1)(图43b)和经btfe稀释的电解质(lifsi/dmc-btfe、lifsi:dmc:btfe的摩尔比为1:2:4)(图43c)在锂阳极表面上的投影态密度(pdos)。具体实施方式超浓缩电解质,例如浓缩lifsi/dme或浓缩lifsi/dmc,可实现锂金属阳极的高库仑效率(ce)操作,这是由于与更稀的电解质相比存在的游离溶剂的分子减少且形成了稳定的sei层。本文中所用的术语“超浓缩”是指活性盐的浓度为至少3m。然而,这些超浓缩电解质遭遇高成本、高粘度和/或对隔膜和厚阴极电极的润湿不良,阻碍其实际使用。本发明公开了局部超浓缩电解质(lse)的实施方案。所公开的lse的某些实施方案在具有碱金属、碱土金属或碳基(例如,石墨)阳极和各种阴极材料的电化学电池单元中是稳定的。lse包含活性盐、所述活性盐在其中可溶的溶剂以及所述活性盐在其中不溶或难溶的稀释剂。在某些实施方案中,通过加入稀释剂来降低活性盐的浓度,但不显著降低使用lse的电池的性能。i.定义和缩写提供以下术语解释和缩写来更好地描述本发明并引导本领域技术人员实施本发明。如本文中所用,除非上下文另外明确表示,否则“包含”是指“包括”且单数形式的“一(a/an)”或“所述(the)”包括多个提及物。除非上下文另外明确表示,否则术语“或”是指所述可选要素的单个要素或两个或更多要素的组合。除非另外解释,否则本文所用的所有技术和科学术语具有本公开所属领域的一般技术人员通常所理解的相同含义。尽管在实施或测试本公开中可使用与本文所述的方法和材料类似或等效的方法和材料,但下文中描述合适的方法和材料。所述材料、方法和实例只是说明性且并不打算限制。本公开的其他特征由下文的具体实施方式和权利要求书明显可知。除非另外说明,否则说明书或权利要求书中使用的表达组分量、分子量、摩尔浓度、电压、容量等的所有数值都理解为由术语“约”来修饰。因此,除非另外隐含或明确表示,或除非本领域技术人员适当理解上下文具有更明确的解释,否则列举的数值参数为可取决于所寻求的理想特性的近似值和/或如本领域技术人员已知的在标准测试条件/方法下的检测极限值。在直接且明确区别于所述现有技术的实施方案中,实施方案数值并非近似值,除非引用词语“约”。尽管本文列举的各种组分、参数、操作条件等存在替代物,但并不意味着所述替代物必然等效和/或具有同等好的功效。也不意味着所述替代物是以优选的顺序列举的,除非另外说明。化学中常用术语的定义可见于由johnwiley&sons,inc.,1997(isbn0-471-29205-2)出版的richardj.lewis,sr.(ed.),hawley’scondensedchemicaldictionary中。为便于阅读本公开的各种实施方案,提供以下具体术语的解释:活性盐:本文中所用的术语“活性盐”是指显著参与电化学装置的电化学过程的盐。在电池的情形下,是指有助于能量转化,最终使得电池能够传递/储存能量的充电和放电过程。本文中所用的术语“活性盐”是指在初始充电后,在电池循环期间占参与氧化还原反应的氧化还原活性材料的至少5%的盐。an:乙腈阳极:电荷流入极化电子装置的电极。就电化学的观点而言,带负电荷的阴离子向阳极移动,和或带正电荷的阳离子离开阳极移动以平衡通过外部电路离开的电子。在放电电池或原电池中,阳极为电子流出的负极端。如果阳极由金属组成,那么让给外部电路的电子伴随有离开电极移动且进入电解质中的金属阳离子。当对电池充电时,阳极成为电子流入且金属阳离子被还原的正极端。缔合:本文所用的术语“缔合”是指配位或溶剂化。例如,与溶剂的分子缔合的阳离子与溶剂的分子配位或被溶剂的分子溶剂化。溶剂化为溶剂的分子与溶质的分子或离子的吸引。缔合可能是由于阳离子与溶剂的分子之间的电子相互作用(例如,离子偶极相互作用和/或范德华力(vanderwaalsforce))。配位是指阳离子与溶剂原子的孤对电子之间形成一个或多个配位键。在溶质的阳离子与阴离子之间也可形成配位键。桥溶剂:具有带有极性端或部分和非极性端或部分的两性分子的溶剂。btfe:双(2,2,2-三氟乙基)醚容量:电池的容量为电池可传递电荷的量。容量通常以mah或ah为单位来表示,并且表示电池在一小时时间内可产生的最大恒定电流。例如,容量为100mah的电池可传递100ma的电流持续一小时或传递5ma的电流持续20小时。面积容量(arealcapacity)或比面积容量为每单位面积的电极(或活性材料)表面的容量,且通常以mahcm-2为单位来表示。阴极:电荷流出极化电子装置的电极。就电化学的观点而言,带正电荷的阳离子向阴极移动,和或带负电荷的阴离子离开阴极移动以平衡来自外部电路的电子。在放电电池或原电池中,阴极为朝向传统电流方向的正极端。这种向外的电荷在内部由从电解质向带正电的阴极移动的正离子携带,所述正离子在带正电的阴极处可被还原。当对电池充电时,阴极成为电子流出且金属原子(或阳离子)被氧化的负极端。电池单元(cell):如本文中所用,电池单元是指用于由化学反应产生电压或电流,或反过来由电流诱发化学反应的电化学装置。实例尤其包括伏打电池单元、电解质电池单元和燃料电池单元等。电池(battery)包括一个或多个电池单元。当是指只含有一个电池单元的电池时,术语“电池单元”和“电池”可互换使用。纽扣电池(coincell):小的通常为圆形的电池。纽扣电池的特征在于其直径和厚度。转化化合物:包含一个或多个阳离子的化合物,在电池放电时所述阳离子被另一种金属取代。例如,当使用硒化铁(ii)(fese)作为阴极材料时,在na电池放电期间fe被na取代:库仑效率(ce):在促使电化学反应的系统中转移电荷的效率。ce可定义为在放电循环期间离开电池的电荷量除以在充电循环期间进入电池的电荷量。li||cu或na||cu电池单元的ce可定义为在剥离过程期间流出电池的电荷量除以在电镀过程期间进入电池的电荷量。dec:碳酸二乙酯dmc:碳酸二甲酯dme:二甲氧基乙烷dmso:二甲亚砜dol:1,3-二氧戊环供体数:对lewis碱度的定量测量,诸如溶剂溶剂化阳离子的能力。供体数定义为在具有0供体数的1,2-二氯乙烷稀溶液中,在lewis碱和sbcl5之间形成1:1加合物的负焓值。供体数通常以kcal/mol为单位来报告。例如,乙腈具有14.1kcal/mol的供体数。另举一例,二甲亚砜具有29.8kcal/mol的供体数。ec:碳酸亚乙酯电解质:充当导电介质的含有游离离子的物质。电解质通常包含溶液中的离子,但也已知熔融的电解质和固体电解质。emc:碳酸甲乙酯ems:乙基甲基砜eofb:乙氧基九氟丁烷evs:乙基乙烯基砜fec:氟代碳酸亚乙酯不混溶:此术语描述无法均匀混合或共混的相同物质形态的两种物质。油和水是两种不混溶液体的常见实例。嵌入:此术语是指一种材料(例如,离子或分子)插入另一种材料的微结构中。例如,锂离子可插入或嵌入石墨(c)中以形成锂化石墨(lic6)。lifsi:双(氟磺酰基)酰亚胺锂litfsi:双(三氟甲基磺酰基)酰亚胺锂libob:双(草酸根)硼酸锂lidfob:二氟草酸硼酸锂阴离子lse:局部超浓缩电解质mec:碳酸亚甲基亚乙酯mofb:甲氧基九氟丁烷nafsi:双(氟磺酰基)酰亚胺钠natfsi:双(三氟甲基磺酰基)酰亚胺钠nabob:双(草酸根)硼酸钠pc:碳酸亚丙酯隔膜:电池隔膜是位于阳极和阴极之间的多孔片或膜。它防止阳极与阴极之间的物理接触,同时便于离子传输。可溶:能够以分子或离子形式分散在溶剂中以形成均质溶液。本文中所用的术语“可溶”是指活性盐在给定溶剂中具有至少1mol/l(m,摩尔浓度)或至少1mol/kg(m,质量摩尔浓度)的溶解度。溶液:由两种或更多种物质组成的均质混合物。溶质(微量组分)溶解于溶剂(主要组分)中。溶液中可存在多种溶质和/或多种溶剂。超浓缩:本文中所用的术语“超浓缩电解质”是指盐浓度为至少3m的电解质。tftfe:1,1,2,2,-四氟乙基-2,2,2-三氟乙基醚tmts:四亚甲基砜或环丁砜tte:1,1,2,2-四氟乙基-2,2,2,3-四氟丙基醚vc:碳酸亚乙烯酯vec:4-乙烯基-1,3-二氧戊环-2-酮ii.局部超浓缩电解质超浓缩电解质包含溶剂和盐,其中盐浓度为至少3m。一些超浓缩电解质具有至少4m或至少5m的盐浓度。在某些情形下,盐的质量摩尔浓度可高达20m或更大,例如,水性litfsi。图1为包含溶剂和锂盐的传统超浓缩电解质的示意图。理想的是,全部或大部分溶剂的分子与超浓缩电解质中的锂阳离子缔合。存在的游离未缔合溶剂的分子减少使锂金属阳极的库仑效率(ce)增加,促使形成稳定的固体电解质中间相(sei)层,和/或增加包括电解质的电池的循环稳定性。然而,超浓缩电解质存在不足,诸如高材料成本、高粘度和/或电池隔膜和/或阴极的润湿不良。尽管用另一种溶剂稀释可解决一种或多种不足,但稀释产生游离溶剂的分子且常减小ce,阻止形成稳定的sei层,和或减小电池的循环稳定性。所公开的包含盐、盐在其中可溶的溶剂以及盐在其中不溶或难溶的稀释剂的的“局部超浓缩电解质”(lse)的某些实施方案可解决上文论及的一些或全部问题。图2为一种示例性lse示意图,所述示例性lse包括锂盐、锂盐在其中可溶的溶剂以及锂盐在其中不溶或难溶的稀释剂。如图2中所示,在加入稀释剂之后,锂离子仍与溶剂的分子缔合。阴离子也接近锂离子或与锂离子缔合。因此,形成溶剂-阳离子-阴离子聚集体的局部区域。与此相反,锂离子和阴离子不与稀释剂的分子缔合,稀释剂的分子在溶液中保持游离。通过拉曼光谱(参见例如,实例10,图39a-b、40a-b)、nmr表征和分子动力学(md)模拟可见具有局部浓缩盐/溶剂区域和游离稀释剂的分子的这种电解质结构的证据。因此,尽管溶液整体而言不及图1的溶液浓,但在锂阳离子与溶剂的分子缔合时仍存在高浓度的局部区域。在稀释的电解质中存在极少或不存在游离的溶剂的分子,由此提供不存在相关不足的超浓缩电解质的益处。所公开的局部超浓缩电解质(lse)的实施方案包括活性盐,溶剂a,其中活性盐在溶剂a中可溶,以及稀释剂,其中活性盐在稀释剂中不溶或难溶。如本文中所用,“难溶”是指活性盐在稀释剂中的溶解度比活性盐在溶剂a中的溶解度小至少10倍。活性盐在溶剂a(不存在稀释剂)中的溶解度可大于3m,诸如至少4m或至少5m。在一些实施方案中,活性盐在溶剂a中的溶解度和/或浓度在3m至10m,诸如3m至8m、4m至8m或5m至8m的范围内。在某些实施方案中,诸如当溶剂a包含水时,可根据质量摩尔浓度来表示浓度,且活性盐在溶剂a(不存在稀释剂)中的浓度可在3m至25m,诸如5m至21m或10m至21m的范围内。与此相反,活性盐在整个电解质(盐、溶剂a和稀释剂)中的摩尔或摩尔浓度可比活性盐在溶剂a中的摩尔或摩尔浓度小至少20%,诸如比活性盐在溶剂a中的摩尔或摩尔浓度小至少30%、小至少40%、小至少50%、小至少60%或甚至小至少70%。例如,活性盐在电解质中的摩尔或摩尔浓度可比活性盐在溶剂a中的摩尔或摩尔浓度小20-80%、小20-70%、小30-70%或小30-50%。在一些实施方案中,活性盐在电解质中的摩尔浓度在0.5m至3m、0.5m至2m、0.75m至2m或0.75m至1.5m的范围内。活性盐为参与包括电解质的电池单元的充电和放电过程的盐或盐的组合。活性盐包含能形成具有不同氧化和还原状态的氧化还原对的阳离子,诸如具有不同氧化状态的离子物质或金属阳离子及其相应的中性金属原子。在一些实施方案中,活性盐为碱金属盐、碱土金属盐或其任意组合。活性盐例如可为锂盐、钠盐、镁盐、锂盐混合物、钠盐混合物或镁盐混合物。有利的是,所述活性盐对于碱金属或碱土金属阳极而言是稳定的。示例性的盐包括(但不限于)双(氟磺酰基)酰亚胺锂(lifsi)、双(三氟甲基磺酰基)酰亚胺锂(litfsi)、双(草酸根)硼酸锂(libob)、双(氟磺酰基)酰亚胺钠(nafsi)、双(三氟甲基磺酰基)酰亚胺钠(natfsi)、双(草酸根)硼酸钠(nabob)、lipf6、liasf6、libf4、lin(so2cf3)2、lin(so2f)2、licf3so3、liclo4、二氟草酸硼酸锂阴离子(lidfob)、lii、libr、licl、lioh、lino3、liso4以及其组合。在一些实施方案中,盐为lifsi、litfsi、nafsi、natfsi或其任意组合。用作溶剂a的合适溶剂包括(但不限于)某些碳酸酯溶剂、醚溶剂、磷酸酯溶剂、二甲亚砜、水以及其混合物。溶剂a与活性盐或盐混合物的阳离子缔合(例如,溶剂化物或配位体)。在制备成包含活性盐和溶剂a的超浓缩电解质时,形成溶剂-阳离子-阴离子聚集体。所公开的超浓缩电解质的一些实施方案对于阳极(例如,金属或碳基阳极)、阴极(包括离子嵌入和转化化合物)和集电器(例如,cu、al)是稳定的,其在使用较低浓度电解质时和/或在使用其他溶剂时可为不稳定的。用作溶剂a的示例性溶剂包括二甲氧基乙烷(dme)、1,3-二氧戊环(dol)、碳酸二甲酯(dmc)、碳酸甲乙酯(emc)、碳酸二乙酯(dec)、二甲亚砜(dmso)、乙基乙烯基砜(evs)、四亚甲基砜(tms)(也称为环丁砜)、乙基甲基砜(ems)、碳酸亚乙酯(ec)、碳酸亚丙酯(pc)、碳酸亚乙烯酯(vc)、氟代碳酸亚乙酯(fec)、4-乙烯基-1,3-二氧戊环-2-酮(vec)、二甲基砜、乙基甲基砜、丁酸甲酯、丙酸乙酯、磷酸三甲酯、磷酸三乙酯、γ-丁内酯、4-亚甲基-1,3-二氧戊环-2-酮、碳酸亚甲基亚乙酯(methyleneethylenecarbonate)(mec)、4,5-二亚甲基-1,3-二氧戊环-2-酮、烯丙基醚、三烯丙基胺、三烯丙基氰尿酸酯、三烯丙基异氰尿酸酯、水以及其组合。在一些实施方案中,溶剂a为dmc、dme、dol、emc或其组合。在某些实施方案中,溶剂a为dmc、dme、dol或其组合。在一个实施方案中,溶剂a为dmc。在一个独立的实施方案中,溶剂a为dme。在另一个独立的实施方案中,溶剂a为dme和dol的组合。在又一个实施方案中,溶剂a为emc。在又一个独立的实施方案中,溶剂a为dmso。在又一个独立的实施方案中,溶剂a为水。如前文所论述,在超浓缩电解质中,有利的是具有极少、基本上不含或不含游离的溶剂的分子,即未与活性盐或盐混合物的阳离子缔合的溶剂的分子。可选择活性盐的浓度以使电解质中游离溶剂a分子的数量最少。由于每个活性盐阳离子可缔合多于一个的溶剂a分子和/或由于每个溶剂a分子可缔合多于一个的活性盐阳离子,因此活性盐与溶剂a的摩尔比可不为1:1。在一些实施方案中,活性盐与溶剂a的摩尔比(盐的摩尔数/溶剂a的摩尔数)在0.33至1.5的范围内,诸如在0.5至1.5、0.67至1.5、0.8至1.2或0.9至1.1的范围内。稀释剂为活性盐在其中不溶或难溶的组分,即溶解度比活性盐在溶剂a中的溶解度小至少10倍。例如,如果盐在溶剂a中具有5m的溶解度,则选择稀释剂以使盐在稀释剂具有小于0.5m的溶解度。在一些实施方案中,活性盐在溶剂a中的溶解度比活性盐在稀释剂中的溶解度大至少10倍、至少15倍、至少20倍、至少25倍、至少30倍、至少40倍或至少50倍。选择在低活性盐浓度(例如,≤3m)下或甚至在不含活性盐时与阳极、阴极和集电器稳定的稀释剂。在一些实施方案中,选择具有低介电常数(例如,相对介电常数≤7)和/或低供体数(例如,供体数≤10)的稀释剂。有利的是,稀释剂不破坏溶剂a-阳离子-阴离子聚集体的溶剂化结构,且因其不与活性盐相互作用而被认为是惰性的。换句话说,稀释剂的分子与活性盐阳离子之间不存在显著的配位或缔合。活性盐阳离子仍与溶剂a分子缔合。因此,尽管电解质被稀释,在电解质中存在极少或不存在游离的溶剂a分子。在一些实施方案中,稀释剂包含非质子性有机溶剂。在某些实施方案中,稀释剂为具有宽电化学稳定窗口(例如,>4.5v)的氟化溶剂,诸如氢氟醚(hfe)(也称作氟代烷基醚)。hfe有利地具有低介电常数、低供体数、与活性盐的金属(例如,锂、钠和/或镁)具有还原稳定性,和/或由于吸电子氟原子而对氧化具有高稳定性。示例性的氟化溶剂包括(但不限于)1,1,2,2-四氟乙基-2,2,2,3-四氟丙基醚(tte)、双(2,2,2-三氟乙基)醚(btfe)、1,1,2,2,-四氟乙基-2,2,2-三氟乙基醚(tftfe)、甲氧基九氟丁烷(mofb)、乙氧基九氟丁烷(eofb)以及其组合。在一些实施方案中,选择不易燃稀释剂(例如,mofb、eofb)显著改善实际可充电电池(诸如锂和钠电池)的安全性。易燃:不易燃:在公开的lse的一些实施方案中,至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的溶剂a分子与活性盐阳离子缔合(例如,溶剂化或配位)。在某些实施方案中,少于10%,诸如少于5%、少于4%、少于3%或少于2%的稀释剂的分子与活性盐阳离子缔合。可通过任何合适的方式来量化缔合的程度,诸如通过拉曼光谱或通过使用nmr光谱计算与阳离子缔合的溶剂的分子与游离溶剂的峰值强度比。选择溶剂a与稀释剂的相对量以减少电解质的材料成本、减小电解质的粘度、维持电解质在高电压阴极处对氧化的稳定性、改善电解质的离子电导率、改善电解质的润湿能力、促使形成稳定的固体电解质中间相(sei)层或其任意组合。在一个实施方案中,电解质中的溶剂a与稀释剂的摩尔比(溶剂a的摩尔数/稀释剂的摩尔数)在0.2至5的范围内,诸如在0.2至4、0.2至3或0.2至2的范围内。在一个独立的实施方案中,电解质中的溶剂a与稀释剂的体积比(l溶剂/l稀释剂)在0.2至5的范围内,诸如在0.25至4或0.33至3的范围内。在另一个独立的实施方案中,电解质中的溶剂a与稀释剂的质量比(g溶剂/g稀释剂)在0.2至5的范围内,诸如在0.25至4或0.33至3的范围内。有利的是,所公开的lse的某些实施方案允许显著稀释活性盐而不牺牲电解质的性能。由于活性盐阳离子与溶剂a分子之间的相互作用,电解质的行为与溶剂a中的活性盐浓度更密切相关。然而由于存在稀释剂,活性盐在电解质中可具有比活性盐在溶剂a中的摩尔浓度小至少20%的摩尔浓度。在某些实施方案中,电解质中的活性盐的摩尔浓度比溶剂a中的活性盐摩尔浓度小至少25%、小至少30%、小至少40%、小至少50%、小至少60%、小至少70%或甚至小至少80%。在一些实施方案中,阳离子-阴离子-溶剂聚集体的形成也减小了阴离子的最低未占分子轨道(lumo)能量,因此其可形成稳定的固体电解质中间相(sei)。如实施例10中所述,当导带的lumo位于溶剂的分子处时,溶剂的分子在阳极处还原性分解,导致对阳极的腐蚀以及在循环时容量快速下降。与此相反,在公开的lse的某些实施方案中,阴离子的最低能级导带低于溶剂的最低能级导带,表明代替溶剂的分子的阴离子将分解,形成稳定的sei。在一些实施方案中,稀释剂与溶剂a混溶。在其他实施方案中,稀释剂与溶剂a不混溶,例如,当溶剂a包含水且稀释剂为如本文中公开的氟化有机溶剂时。当溶剂a与稀释剂不混溶时,电解质可能无法用稀释剂有效稀释。因此,在一些实施方案中,当稀释剂与溶剂a不混溶时,电解质还包含桥溶剂。桥溶剂与溶剂a或稀释剂具有不同的化学组成。选择与溶剂a和稀释剂是混溶的桥溶剂,由此增强溶剂a和稀释剂的实际混溶性。在一些实施方案中,桥溶剂的分子是两亲性的,包括极性端或部分和非极性端或部分,以便桥溶剂的分子将如图3中所示与溶剂a分子和稀释剂的分子都缔合,由此改善溶剂a和稀释剂之间的混溶性。示例性的桥溶剂包括(但不限于)乙腈、碳酸二甲酯、碳酸二乙酯、碳酸亚丙酯、二甲亚砜、1,3-二氧戊环、二甲氧基乙烷、二甘醇二甲醚(双(2-甲氧基乙基)醚)、三甘醇二甲醚(三乙二醇二甲醚)、四甘醇二甲醚(四乙二醇二甲醚)以及其组合。示例性的溶剂、稀释剂和(一些情形下)桥溶剂的组合包括emc-btfe、emc-tte、dmc-btfe、dme-btfe、dme-tte、dol-dme-tte、dmso-tte、h2o-dmc-tte、h2o-pc-tte、h2o-an-tte和h2o-dmso-tte。在一些实施方案中,活性盐为lifsi、litfsi、nafsi或natfsi。在一些实例中,活性盐为lifsi或nafsi,溶剂为dmc、dme或emc,且稀释剂为tte或btfe。在某些实例中,盐为litfsi或natfsi,溶剂为dmso或dme和dol的混合物,且稀释剂为tte。在另一个独立的实施方案中,盐为litfsi或natfsi,溶剂为h2o,稀释剂为tte且桥溶剂为dmc、碳酸亚丙酯(pc)、乙腈(an)或dmso。示例性的电解质包括(但不限于)lifsi/dmc-btfe、lifsi/dme-btfe、lifsi/dme-tte、lifsi/emc-btfe、lifsi/emc-tte、nafsi/dme-tte、nafsi/dme-btfe、nafsi/dmc-btfe、nafsi/emc-btfe、nafsi/emc-tte、litfsi/dmso-tte、litfsi/dme-dol-tte、natfsi/dmso-tte、natfsi/dme-dol-tte、litfsi/h2o-dmc-tte、litfsi/h2o-pc-tte、litfsi/h2o-an-tte、litfsi/h2o-dmso-tte、natfsi/h2o-dmc-tte、natfsi/h2o-pc-tte、natfsi/h2o-an-tte、natfsi/h2o-dmso-tte。iii.电池所公开的lse的实施方案适用于电池(例如,可充电电池)、传感器和超级电容器中。合适的电池包括(但不限于)锂金属电池、锂离子电池、锂-硫电池、锂-氧电池、锂-空气电池、钠金属电池、钠离子电池、钠-硫电池、钠-氧电池、钠-空气电池、镁离子电池,包括水性锂和钠电池。在一些实施方案中,可充电电池包含如本文公开的lse、阴极、阳极且任选地包含隔膜。图4为可充电电池100的一个示例性实施方案的示意图,所述可充电电池100包括阴极120、注入有电解质(即,lse)的隔膜130和阳极140。在一些实施方案中,电池100还包括阴极集电器110和/或阳极集电器150。集电器可为金属或另一种导电材料,诸如(但不限于)镍(ni)、铜(cu)、铝(al)、铁(fe)、不锈钢或导电碳材料。集电器可为涂有导电材料的箔、泡沫或聚合物基板。有利的是,集电器在电池的操作电压窗口中与阳极或阴极和电解质接触时稳定(即,不腐蚀或反应)。如果阳极或阴极分别是自支撑的,例如当阳极为金属或包含嵌入材料或转化化合物的自支撑(free-standing)膜,和/或当阴极是自支撑膜时,可省略阳极和阴极集电器。“自支撑”是指膜本身具有足够的结构完整性,膜无需支撑材料即可安置在电池中。在一些实施方案中,阳极为金属(例如,锂、钠)、嵌入材料或转化化合物。嵌入材料或转化化合物可沉积在基板(例如,集电器)上,或以通常包括一种或多种粘合剂和/或导电性添加剂的自支撑膜形式提供。合适的粘合剂包括(但不限于)聚乙烯醇、聚氯乙烯、聚氟乙烯、环氧乙烷聚合物、聚乙烯吡咯烷酮、聚氨酯、聚四氟乙烯、聚偏二氟乙烯、聚乙烯、聚丙烯、苯乙烯-丁二烯橡胶、环氧树脂、尼龙等。合适的导电性添加剂包括(但不限于)碳黑、乙炔黑、科琴黑(ketjenblack)、碳纤维(例如,气相生长碳纤维)、金属粉末或纤维(例如,cu、ni、al)和导电性聚合物(例如,聚亚苯基衍生物)。用于锂电池的示例性阳极包括(但不限于)mo6s8、tio2、v2o5、li4mn5o12、li4ti5o12、c/s复合物和聚丙烯腈(pan)–硫复合物。用于钠电池的示例性阳极包括(但不限于)nati2(po4)3;tis2、cus、fes2、nico2o4、cu2se和li0.5na0.5ti2(po4)3。用于锂电池的示例性阴极包括(但不限于)富li的li1+wnixmnycozo2(x+y+z+w=1,0≤w≤0.25)、linixmnycozo2(nmc,x+y+z=1)、licoo2、lini0.8co0.15al0.05o2(nca)、lini0.5mn1.5o4尖晶石、limn2o4(lmo)、lifepo4(lfp)、li4-xmxti5o12(m=mg、al、ba、sr或ta;0≤x≤1)、mno2、v2o5、v6o13、liv3o8、limc1xmc21-xpo4(mc1或mc2=fe、mn、ni、co、cr或ti;0≤x≤1)、li3v2-xm1x(po4)3(m1=cr、co、fe、mg、y、ti、nb或ce;0≤x≤1)、livpo4f、limc1xmc21-xo2(mc1和mc2独立地为fe、mn、ni、co、cr、ti、mg或al;0≤x≤1)、limc1xmc2ymc31-x-yo2(mc1、mc2和mc3独立地为fe、mn、ni、co、cr、ti、mg或al;0≤x≤1;0≤y≤1)、limn2-yxyo4(x=cr、al或fe,0≤y≤1)、lini0.5-yxymn1.5o4(x=fe、cr、zn、al、mg、ga、v或cu;0≤y<0.5)、xli2mno3·(1-x)limc1ymc2zmc31-y-zo2(mc1、mc2和mc3独立地为mn、ni、co、cr、fe或其混合物;x=0.3-0.5;y≤0.5;z≤0.5)、li2m2sio4(m2=mn、fe或co)、li2m2so4(m2=mn、fe或co)、lim2so4f(m2=fe、mn或co)、li2-x(fe1-ymny)p2o7(0≤y≤1)、cr3o8、cr2o5、碳/硫复合物或空气电极(例如,包含石墨碳且任选地包含诸如ir、ru、pt、ag或ag/pd的金属催化剂的碳基电极)。在一个独立的实施方案中,阴极可为锂转化化合物,诸如li2o2、li2s或lif。用于钠电池的示例性阴极包括(但不限于)nafepo4、na2fepo4f、na2fep2o7、na3v2(po4)3、na3v2(po4)2f3、navpo4f、navpopof、na1.5vopo4f0.5、naco2o4、na2ti3o7和naxmo2,其中0.4<x≤1,且m为过渡金属或过渡金属混合物(例如,nacro2、nacoo2、naxcoo2(0.4≤x≤0.9)、na2/3ni1/3mn2/3o2、na2/3fe1/2mn1/2o2、na2/3ni1/6co1/6mn2/3o2、nani1/3fe1/3mn1/3o2、nani1/3fe1/3co1/3o2、nani1/2mn1/2o2、普鲁士白模拟阴极(例如,na2mnfe(cn)6和na2fe2(cn)6)、普鲁士蓝模拟(pba)阴极(na2-xma[mb(cn)6]1-y·nh2o,其中ma和mb独立地为fe、co、ni或cu,x=0至0.2、y=0至0.2、n=1至10)。其他钠嵌入材料包括na4ti5o12、fe3o4、tio2、sb2o4、sb/c复合物、snsb/c复合物、bisb/c复合物和无定形p/c复合物。在一个独立的实施方案中,阴极为钠转化化合物,其中钠取代另一种阳离子,诸如fese、cuwo4、cus、cuo、cucl或cucl2。用于镁电池的示例性阴极包括(但不限于)二硫化锆、氧化钴(ii,iii)、硒化钨、v2o5、氧化钼钒、不锈钢、mo6s8、mg2mo6s8、mos2、mo6s8-ysey(其中y=0、1或2)、mgxs3o4(其中0<x<1)、mgcosio4、mgfesio4、mgmnsio4、v2o5、wse2、硫、聚(2,2,6,6-四甲基哌啶氧基-4-基甲基丙烯酸酯)/石墨烯、mno2/乙炔黑和多硫化碳炔。隔膜可为玻璃纤维、具有或不具有陶瓷涂层的多孔聚合物膜(例如,聚乙烯基或聚丙烯基材料)或复合物(例如,无机颗粒和粘合剂的多孔膜)。一种示例性的聚合物隔膜为k1640聚乙烯(pe)膜。另一种示例性的聚合物隔膜为2500聚丙烯膜。另一种示例性的聚合物隔膜为涂有3501表面活性剂的聚丙烯膜。隔膜可注入有如本文公开的电解质。在一些实施方案中,电池包括锂金属阳极、适合如上文公开的锂电池的阴极、隔膜以及lse,所述lse包含(i)选自lifsi、litfsi或其组合的活性盐,(ii)选自dmc、dme、dol、dec、dmso、emc、水或其组合的溶剂,和(iii)选自tte、btfe、tftfe、mofb、eofb或其任意组合的稀释剂。在溶剂和稀释剂不混溶的某些实施方案中,lse进一步包含与溶剂具有不同组成且与稀释剂具有不同组成的桥溶剂,其中桥溶剂与溶剂和稀释剂是混溶的。桥溶剂可选自乙腈、碳酸二甲酯、碳酸二乙酯、碳酸亚丙酯、二甲亚砜、1,3-二氧戊环、二甲氧基乙烷、二甘醇二甲醚(双(2-甲氧基乙基)醚)、三甘醇二甲醚(三乙二醇二甲醚)、四甘醇二甲醚(四乙二醇二甲醚)或其任意组合。在某些实施方案中,阴极包含linixmnycozo2(nmc)、硫/碳或空气电极。在一些实施方案中,电池包括钠金属阳极、适合如上文公开的钠电池的阴极、隔膜和lse,所述lse包含(i)选自nafsi、natfsi或其组合的活性盐、(ii)选自dmc、dme、dol、dec、dmso、emc、水或其组合的溶剂,和(iii)选自btfe、tte、tftfe、mofb、eofb或其任意组合的稀释剂。在溶剂和稀释剂不混溶的某些实施方案中,lse进一步包含与溶剂具有不同组成且与稀释剂具有不同组成的桥溶剂,其中桥溶剂与溶剂和稀释剂是混溶的。桥溶剂可选自乙腈、碳酸二甲酯、碳酸二乙酯、碳酸亚丙酯、二甲亚砜、1,3-二氧戊环、二甲氧基乙烷、二甘醇二甲醚(双(2-甲氧基乙基)醚)、三甘醇二甲醚(三乙二醇二甲醚)、四甘醇二甲醚(四乙二醇二甲醚)或其任意组合。在一个实施方案中,阴极为na3v2(po4)3。在一些实施方案中,包括如本文公开的lse的电池具有与包括传统超浓缩电解质的类似电池同等或甚至更佳的性能。例如,包括lse的电池可具有比包括浓缩电解质的类似电池更大或同等的ce。在一些实施方案中,电池具有≥95%的ce,诸如≥96%、≥97%、≥98%、≥99%或甚至≥99.5%。电池还可具有与包括传统超浓缩电解质的电池相比更大的放电容量和/或循环稳定性。在一些实施方案中,lse提供以高电流密度(例如,0.5-10macm-2)在阳极上无枝晶电镀,ce大于99%。包括如本文公开的lse的电池的实施方案经至少10个循环、至少25个循环、至少50个循环、至少75个循环、至少100个循环、至少200个循环或至少300个循环展示稳定的循环性能(例如,如稳定的ce和/或比容量所证实)。例如,电池可持续10-500个循环,诸如25-500个循环、50-500个循环、100-500个循环、200-500个循环或300-500个循环展示稳定的循环性能。在一个实例中,包括包含1.2mlifsi/dmc-btfe(dmc:btfe摩尔比为1:2)的电解质的li||nmc电池展示经历长期稳定循环(至少300个循环)的无枝晶镀锂,甚至在快速充电(1c,即2macm-2)下充电至4.3v的高电压时,具有99.3-99.9%的高ce和>95%的保留率。通过传统的1.2mlifsi/dmc电解质或低浓度的lipf6/碳酸酯溶剂或甚至通过高浓缩的5.5mlifsi/dmc电解质无法实现所述的优良性能。通过1.2m的lifsi/dmc电解质或低浓度的lipf6/碳酸酯溶剂,li金属循环效率极低(<50%)且只在几个循环内产生显著的超电势用于剥离。这些结果表明在剥离过程期间无法去除沉积在cu基板上的大量li。这个问题可归因于li和电解质之间的寄生副反应以及随之由电阻性固体电解质中间相(sei)层分离li区域。与此相反,在超浓缩的5.5mlifsi/dmc电解质中可获得ce高达99.2%的稳定li电化学电镀/剥离曲线。用与dmc混溶但不溶剂化li+离子的经btfe稀释的浓缩的lifsi/dmc电解质使得形成lse且在高电压下对li金属阳极和linixmnycozo2(nmc)阴极展现良好的稳定性。另外,由经btfe稀释的超浓缩lifsi/dmc电解质的较低粘度和较高电导率产生的协同效应也有助于包括所公开的lse的某些实施方案的锂金属电池的优越电化学性能。在一些实施例中,lifsi/dmc-btfe电解质展示99.3-99.5%的平均ce。总之,所公开的lse的某些实施方案具有成本效益、可进行无枝晶电镀、提供高ce和/或极大地增强电池的快速充电和/或稳定循环。例如,1.2mlifsi/dmc-btfe使得能够以约99.3%的高ce进行无枝晶li电镀,并提供li||nmc电池在4.3v的高截止电压下增强的快速充电(2macm-2)和稳定循环。不希望受特定操作理论束缚,所公开的lse的某些实施方案的优势是由于氢氟醚稀释剂不破坏局部盐/溶剂高浓度溶剂化结构,但在改善金属阳极的界面稳定性中具有重要作用的‘惰性’性质。这种杰出的性能甚至优于在例如5.5mlifsi/dmc的超浓缩电解质中实现的性能。由公开的lse的其他实施方案以及其他电池类型可见类似的有益结果,所述其他电池类型诸如锂-硫电池、锂-氧电池、锂-空气电池、钠金属电池、钠离子电池、钠-空气电池、钠-硫电池、钠-氧电池和镁离子电池,包括水性锂和钠电池。iv.实施例材料六氟磷酸锂(lipf6)、碳酸二甲酯(dmc)、碳酸亚乙酯(ec)和碳酸甲乙酯(emc)(全部为电池级的纯度)由basf公司(florhampark,nj)获得。双(氟磺酰基)酰亚胺锂(lifsi)由nipponshokubai(日本)获得并在120℃下真空中干燥24h后使用。通过将所需量的盐溶解在溶剂中来制备电解质。li芯片购自mti公司(richmond,ca)。cu和al箔购自allfoils(strongsville,oh)。nmc(lini1/3mn1/3co1/3o2)阴极电极由位于pacificnorthwestnationallaboratory的advancedbatteryfacility(abf)通过将nmc、超级c碳(superccarbon)、聚偏二氟乙烯(pvdf)粘合剂以96:2:2的质量比混合在n-甲基-2-吡咯烷酮(nmp)并将浆料涂到al箔上来制备。在预先干燥并在约75℃下在真空下进一步干燥12h后,将电极层压板冲压成圆盘(1.27cm2)。在具有氩气氛(o2<0.1ppm且h2o<0.1ppm)的mbraunlabmaster手套箱(stratham,nh)中储存并处理材料。材料表征在5.0kv下在feiquanta或helios聚焦离子束扫描电子显微镜(sem)9hillsboro,or)上对循环电极进行形态观察和eds测量。为制备样品,将循环电极浸泡在纯dmc中10min,然后用纯dmc冲洗至少3次以清除剩余的电解质,且最后在真空下进行干燥。通过使用剃刀片(razorblade)切割电极获得横截面。使用配备有用于激发的单色alkαx射线源(1,486.7ev)的physicalelectronicsquantera扫描x射线微探针(chanhassen,mn)进行xps。为避免副反应或大气中的氧和水分污染电极,将来自循环电极的样品在氩气保护的密封容器中从手套箱输送到sem和xps仪器中。所有样品密封在玻璃试管中,使用具有sub-1cm-1光谱分辨率的拉曼分光计(horibalabramhr)收集拉曼光谱。在5℃和30℃的温度下,在brookfielddv-ii+pro粘度计(middleboro,ma)上测量电解质的粘度(η)。在装备有5mm液体nmr探针(dotyscientific,columbia,sc)的600mhznmr分光计(agilenttech,santaclara,ca)上,以约31tm–1的最大梯度强度,在0~50℃的温度范围内,使用7li、19f和1h脉冲梯度场(pfg)nmr分别测量li+阳离子、fsi-阴离子和溶剂的分子(dmc和btfe)的扩散系数,表示为dli、dfsi、ddmc/dbtfe。以对于1h、19f和7lipfg-nmr而言分别为599.8、564.3和233.1mhz的拉莫尔频率(larmorfrequency)采用具有5.5、7和12μs的90度脉冲长度的双极性脉冲梯度刺激回波序列(vnmrj中的dbppste,供应商提供的序列)。将以梯度强度(g)函数获得的回波曲线s(g)用stejskal-tanner方程式拟合[1](stejskal等人,j.chem.phys.1965,42:288-292):s(g)=s(0)exp[-d(γδg)2(δ-δ/3)][1]其中s(g)和s(0)分别为梯度强度为g和0时的峰值强度,d为扩散系数,γ为观察核的旋磁比,δ和δ分别为梯度脉冲长度和两个梯度脉冲的持续时间。对于所有测量和变化的g值而言,δ和δ固定在2ms和30ms以在回波曲线中获得足够的衰变。电化学测量在5℃至30℃的温度范围内,使用biologicmcs10全集成的多通道电导率光谱仪,用由两个平行pt电极制成的电池单元测量离子电导率。使用来自okaloninc的电导率标准溶液预先确定电导池常数。在30℃环境室中,在电池测试仪(landbt2000和arbinbt-2000,arbininstruments,collegestation,tx)上使用具有双电极配置的cr2032型纽扣电池以恒流模式进行电化学循环测试。将纽扣电池(li||cu、li||li和li||nmc)组装在手套箱中,以li芯片作为反电极和参比电极。使用2500聚丙烯膜作为隔膜,除了具有lifsi/dmc电解质的电池单元以外,由于2500膜的润湿性问题,具有lifsi/dmc电解质的电池单元使用涂有3501表面活性剂的聚丙烯膜以确保润湿良好。为了测试标准化,每个纽扣电池中加入200μl电解质(过量),尽管在电池单元封口过程(cellcrimpingprocess)期间出现一些溢出。对于li||cu电池单元而言,用于li沉积的cu箔的有效面积为2.11cm2(直径为1.64cm)。在每个循环期间,在各种电流密度下在cu基板上沉积所需量的li金属且随后剥离直到电势相对于li/li+达到1.0v。使用li金属作为工作电极和反电极组装li|li对称电池单元。对于阴极部分使用包铝的纽扣电池罐来组装所有的li||nmc电池以消除对不锈钢罐的腐蚀和高电压下的副作用,并在2.7和4.3v之间进行测试。1c等于160mag-1(约2macm-2)的活性nmc材料。在chi660c工作台(chinstruments,inc.,austin,tx)上,以0.2mv/s的扫描速率从ocv(开路电压)至6v,使用2.11cm2的al箔片作为工作电极在纽扣电池中进行电解质溶液的线性扫描伏安(lsv)研究。库仑效率(ce)测量使用以下方案,使用li||cu纽扣电池测量li金属阳极的平均ce:1)一个初始的形成循环,以5mah/cm2在cu上电镀li并剥离至1v;2)以5mah/cm2在cu上电镀li作为li储备;3)以1mah/cm2重复剥离/电镀li(或如果需要>1v的超电势来以1mah/cm2剥离li,则剥离至1v)持续9(n=9)个循环;4)将所有li剥离至1v。电流:0.5ma/cm2。基于下式,用总剥离容量除以总电镀容量来计算平均ce:其中n为q循环,剥离充电容量和q循环,电镀放电容量时的循环数,q剥离为最后剥离期间的充电容量且q储备为步骤2期间沉积的锂的量。md模拟使用第一性原理密度泛函理论(dft)和从头算分子动力学(aimd)模拟来表征局部超浓缩电解质中的dmc-lifsi溶剂化结构。使用维也纳从头算模拟软件包(vasp)(kresse等人,phys.rev.b1996,54:11169-11186;kresse等人,phys.rev.b1993,47:558-563;kresse等人,phys.rev.b1994,49:14251-14269)进行所有计算。通过截止能为400ev的投影扩充波(paw)赝势描述电子-离子相互作用(blochl,physrevb1994,50:17953-17979;kresse等人,physrevb1999,59:1758-1775)。使用perdew-burke-ernzerhof广义梯度近似(gga-pbe)表示交换关联泛函(perdew等人,physrevlett1996,77:3865-3868)。使用高斯展开宽度项为0.05ev的交换关联泛函计算与li金属阳极表面系统相互作用的电解质和lifsi盐。使用monkhorst-packk点网格栅方案(4×4×1)获得优化的li阳极表面并吸收基态的电解质和盐分子。电子自洽迭代和离子弛豫的收敛准则分别设定为1×10-5ev和1×10-4ev。在303k下以正则(nvt)系综进行电解质-盐混合物的aimd模拟。使用nose质量参数为0.5的nose恒温法控制aimd模拟系统的恒定温度。所有aimd模拟中使用0.5fs的时间步长。aimd模拟中使用monkhorst-packk点网格栅方案(2×2×2)。每种电解质/盐系统的总aimd模拟时间为15ps。使用最后5ps的aimd轨道获得li-o对的径向分布函数。实施例1具有lifsi/emc-btfe和lifsi/emc-tte电解质的锂金属电池评估在碳酸酯溶剂中使用不同超浓缩li盐的li||cu电池单元的库仑效率(ce)。如图5a中所示的li盐:溶剂摩尔比所反映,不同盐在碳酸酯溶剂中的溶解度(例如emc)不同。例如,在饱和lipf6/emc溶液中的lipf6:emc比率为约1:2.35,而在饱和lifsi/emc溶液中的lifsi:emc比率可高达1:1.1。li||cu电池单元以1macm-2循环,每个循环中的锂沉积/剥离面积容量为0.5mahcm-2。图5b中的ce数据表明只有基于lifsi盐的浓缩电解质,例如lifsi/emc(摩尔比为1:1.1,8.73molkg-1)可使得以约97%的稳定ce进行可逆的li沉积/剥离。使用氟代烷基醚稀释浓缩的lifsi/emc(摩尔比为1:1.1,8.73molkg-1)电解质。证明lifsi盐不溶于氟代烷基醚,例如tte。另一方面,tte与emc混溶。因此,认为氟代烷基醚是电解质的‘惰性’稀释剂,不参与lifsi的溶剂化。电解质配方和这些电解质的相应摩尔数展示在表1中。表1.电解质编号和配方在e2和e3中,将局部超浓缩lifsi/emc(1:1.1)溶剂化阳离子-阴离子聚集体(agg)良好保存,有益于达到更高的ce用于可逆的li沉积/剥离。li+-fsi---溶剂聚集体的形成也降低了fsi-阴离子的最低未占分子轨道(lumo)能量,因此其可首先分解形成稳定的固体电解质中间相(sei)。通过添加氟代烷基醚至emc:氟代烷基醚的比率为2:1,大幅减小lifsi/emc-氟代烷基醚的浓度,经计算对于lifsi/emc-btfe(2:1)而言浓度为4.66molkg-1,且对于lifsi/emc-tte(2:1)而言浓度为4.13molkg-1。如图6中所示,通过添加氟代烷基醚(即,tte、btfe)作为稀释剂,li||cu电池单元自第3个至第86个循环的平均ce高达98.95%,这与母体超浓缩lifsi/emc电解质的ce(98.93%)相当。研究具有含和不含btfe稀释剂的浓缩lifsi/emc电解质的li||nmc电池单元的循环性能。如图7中所示,在添加btfe之后可视觉观察到2500隔膜的润湿得到改善。在4.5v的充电截止电压下,使电池单元以c/3或1c循环。图8a显示添加btfe作为稀释剂大幅缩短了润湿电极/隔膜所需的静止时间(resttime)。循环性能结果显示使用经btfe稀释的lifsi/emc-btfe(2:1)电解质的li||nmc电池单元在如图8a和8b中所示分别以c/3和1c倍率循环期间展示相当的放电容量、循环稳定性和ce。结果表明添加btfe或tte作为稀释剂并不损害浓缩电解质的氧化稳定性。并非所有的盐/溶剂组合都提供如此优异的结果。在碳酸亚丙酯(pc)中评估libf4。在具有0.5mah/cm2的锂面积沉积容量的li||cu电池单元中比较pc中7.5mol/kglibf4和pc-tte中2.5mol/kglibf4(2:1v:v)的循环性能。以0.2ma/cm2进行初始的两个循环,其他循环在1ma/cm2下进行。结果展示在图9a和9b中。libf4/pc电解质具有约50%的初始ce。在用tte稀释时,电解质经过50个循环具有小于50%的平均ce。这与lifsi/emc、lifsi/emc-btfe和lifsi-emc-tte电解质形成鲜明对比,其ce值高达98.95%。litfsi-四甘醇二甲醚也产生不良的ce结果。实施例2锂金属电池中的lifsi/dmc-btfe电解质性能在基于dmc溶剂的电解质中证明稀释和形成局部浓缩电解质溶液结构的概念。表2中列举各种浓度的lifsi/dmc-btfe溶液的电解质配方。通过添加btfe,将5.5mlifsi/dmc电解质的浓度稀释至低至1.2m。表2电解质编号、配方和粘度图10a-10d中分别展示使用1.0mlipf6/ec-emc(e4)、1.2mlifsi/dmc(e5)、3.7mlifsi/dmc(e6)和5.5mlifsi/dmc(e7)的li||cu电池单元的li电镀/剥离曲线。使用以下方案获得曲线:1)一个初始的形成循环,在0.5macm-2下在cu上电镀5mahcm-2li;且随后在0.5macm-2下li剥离至1v;2)在0.5macm-2下在cu上电镀5mahcm-2li作为li储备;3)在1mahcm-2下以20%的深度剥离/电镀li9个循环;4)在0.5macm-2下剥离所有li至1v。用总的li剥离容量除以总的li电镀容量来计算平均ce。使用1.0m的lipf6/ec-emc电解质以及1.2m的lifsi/dmc电解质,li金属循环效率低(<50%)至使得只在几个循环内产生显著的超电势用于剥离。对于3.7m和5.5m的lifsi/dmc而言,ce可达到>99.0%。也使用如图11a-11d中所示的相同方案测量稀释lifsi/dmc-btfe电解质的平均ce。经btfe稀释的lse展示比超浓缩5.5mlifsi/dmc(ce99.2%)甚至更高的ce,其ce在99.3至99.5%的范围内。结果说明用btfe稀释并未改变局部超浓缩结构且使存在的游离dmc溶剂的分子减至最小,因此在重复的电镀/剥离过程期间保持电解质对于li金属阳极的高稳定性。通过在li||cu电池单元中的重复电镀/剥离循环检查在不同电解质中长期循环期间li电镀/剥离曲线和ce的演化。电池单元以0.5ma·cm2的电流密度循环;cu电极的工作面积为2.11cm2。图12a-12d为第100个循环(1ma/cm2至0.5mah/cm2)自1.0mlipf6/ec-emc(4:6,w)(图12a)、5.5mlifsi:dmc(1:1)(图12b)、3.7mlifsi/dmc(1:2)(图12c)和1.2mlifsi/dmc-btfe(0.51:1.1:2.2)(图12d)电解质向铜基板上镀锂的扫描电子显微镜图像。具有高度浓缩的5.5mlifsi/dmc和高度稀释的1.2mlifsi/dmc-btfe(1:2)电解质的电池单元稳定循环>200个循环(图13),其平均ce为约99%。由于导电性更佳且粘度更低(图14,表2),因此在稀释的电解质中充电-放电期间的电池单元极化比在高度浓缩的电解质中小得多,而且这种差异随着电流密度增加而变得更明显(图15a,15b)。实施例3具有lifsi/dmc-btfe电解质的锂离子电池首先在0.2mv/s的扫描速率下通过线性扫描伏安法(lsv)在以al作为工作电极的电池单元中研究浓缩电解质和经btfe稀释的电解质在高电压下的稳定性。结果显示,尽管在高电压下随着btfe浓度增加稳定性减小,但经btfe稀释的电解质在4.5v或更高电压时都展示阳极稳定性(图16)。图17a-17d为显示锂金属在lifsi在dmc中的低浓度和中等浓度电解质–1.2mlifsi/dmc(图17a、17b)和3.7mlifsi/dmc(图17c、17d)中电镀至cu基板上后的形态的显微照片。接着,组装li||nmc电池单元通过使用具有约2.0mah/cm2高面积容量的nmc电极来评估稀的1.2mlifsi/dmc-btfe电解质的性能。还组装具有浓缩的5.5mlifsi/dmc和传统的1.0mlipf6/ec-emc的li||nmc电池单元并测试进行比较。图18a-18d显示li||nmc电池单元的长期循环性能和相应的电压曲线演化。在0.67ma/cm2(1/3小时倍率)下的3个形成循环后,对所有电池单元进行2.0ma/cm2(1小时倍率)高电流密度下的循环,以展现li金属阳极在此严苛条件下这些电解质的稳定性。在形成循环期间,li||nmc电池单元传递约160mahg-1nmc的类似比放电容量,对应于2.0mah/cm2的标称面积容量。当在2.0ma/cm2下循环时,具有1.0mlipf6/ec-emc电解质的li||nmc电池单元在100个循环后展示电极极化剧烈增加和容量快速衰退,保留<30%(图18a、18b),这归因于li金属和电解质之间的严重腐蚀反应。当使用浓缩的5.5mlifsi/dmc时,如li金属本身高得多的ce所反映,li金属的稳定性大大改善。然而,具有浓缩的5.5mlifsi/dmc的li||nmc电池单元仍显示容量继续衰退且电极极化继续增加,在100个循环后其容量剩余约70%(图18c)。浓缩的5.5mlifsi/dmc不令人满意的循环性能归因于由超浓缩电解质的高粘度、低电导率和不良润湿能力而产生的缓慢电极反应动力学。与此形成鲜明对比的是,使用经btfe稀释的1.2mlifsi/dmc-btfe电解质,可实现显著改善的长期循环稳定性和电极极化的有限增加(图18d)。在2.0ma/cm2高电流密度下300个循环之后,电池单元显示>95%的高容量保留,这是对于li金属电池曾经报道过的最佳性能。此发现表明,具有低li盐浓度的lse可实现li金属电池(lmb)的快速充电和稳定循环。评估li||nmc电池单元的倍率性能来确定经btfe稀释的电解质的电化学反应动力学。使用两个充电/放电方案来测试倍率性能,即(i)以相同的c/5充电且以增加的倍率放电;(ii)以增加的倍率充电且以相同的c/5放电。如图19和20中所示,与浓缩的5.5mlifsi/dmc电解质和基线的1mlipf6稀电解质相比,具有经btfe稀释的电解质(1.2mlifsi/dmc-btfe)的li||nmc电池单元显示优越的充电和放电能力。具体来说,使用方案(i),在以5c(即,10ma/cm2)放电时,使用1.2mlifsi/dmc-btfe电解质的电池单元传递141mah/g的高放电容量,显著高于浓缩的5.5mlifsi/dmc电解质的116mah/g和1mlipf6稀电解质的68mah/g。与浓缩的5.5mlifsi/dmc电解质相比,1.2mlifsi/dmc-btfe电解质的倍率性能增强归因于粘度减小、电导率增加、电极/隔膜润湿改善以及界面反应动力学改善。实施例4li金属阳极上的无枝晶沉积为深入了解lse(1.2mlifsi/dmc-btfe)的优越电化学特性,评估li沉积在不同电解质中的形态特征。电流密度为1.0ma/cm2且沉积容量为1.5mah/cm2。图21a-21f显示在1ma/cm2的电流密度下在不同电解质中沉积在cu基板上的li膜的横截面和表面形态。电解质如下:1.0mlipf6/ec-emc(图21a、21b)、5.5mlifsi/dmc(图21c、21d)和1.2mlifsi/dmc-btfe(1:2)(图21e、21f)。由lipf6电解质电镀li金属产生具有大量枝晶li的高度多孔/疏松结构(图21a、21b)。如图17a-17d中先前所示,在低(1.2m)和中等(3.7m)浓度的lifsi/dmc电解质中也观察到枝晶的li沉积。与此相反,在高浓度的5.5mlifsi/dmc和稀释的低浓度1.2mlifsi/dmc-btfe电解质(图21c-21f)中都获得无枝晶形成的结节状(nodule-like)li沉积物。与在浓缩电解质中相比,在lse电解质(1.2mlifsi/dmc-btfe)中发现更大的初级li颗粒(平均约5μm)和更紧密的沉积层(约10μm,接近块状li的1.5mahcm-2(约7.2μm)的理论厚度)。此外,随着电流密度增加(2、5和10ma/cm2),li沉积物在1.2mlifsi/dmc-btfe电解质中维持结节状性质,尽管粒径略微减小(图22a-22c)。形成大粒径的结节状li沉积物可显著减轻与电解质的界面反应,并减小li渗透隔膜的风险,由此改善使用lse(稀1.2mlifsi/dmc-btfe)的lmb的循环寿命和安全性。稀电解质也产生比高浓缩5.5mlifsi/dmc更稳定的sei层。另外,沉积高密度li有益于减小lmb在充电/放电过程期间的体积变化,且高度有利于lmb的发展。实施例5具有lifsi/dme-btfe和lifsi/dme-tte电解质的锂金属电池用醚基电解质(诸如dme)稀释浓缩电解质也有效。表3中显示示例性的电解质配方。通过添加btfe或tte,将4mlifsi/dme电解质的浓度稀释至2m或1m。表3.电解质编号和配方电解质编号电解质配方浓度e124mlifsi/dme(lifsi:dme1:1.4)4moll-1e13lifsi/dme+btfe(dme:btfe=3:5,v:v)2moll-1e14lifsi/dme+tte(dme:tte=3:5,v:v)2moll-1e15lifsi/dme+btfe(dme:btfe=3:8,v:v)1moll-1e16lifsi/dme+tte(dme:tte=3:8,v:v)1moll-1图23显示使用浓缩lifsi/dme电解质和具有tte或btfe稀释剂的lifsi/dme电解质的li||cu电池单元的ce。所有电池单元在第一循环中且在长期循环期间展示极为类似的ce。当通过添加氟代烷基醚(即,tte、btfe)作为稀释剂将lifsi/(dme+btfe)和lifsi/(dme+tte)的浓度稀释至2m,经tte和btfe稀释的电解质的li||cu电池单元的平均ce为98.83%和98.94%,这与母体浓缩lifsi/dme的ce(98.74%)相当或甚至更优。即使在通过添加tte、btfe作为稀释剂将lifsi/(dme+btfe)和lifsi/(dme+tte)的浓度稀释至1m时,经tte和btfe稀释的电解质的li||cu电池单元的平均ce为98.90%和98.94%和98.74,这与母体浓缩lifsi/dme的ce(98.74%)极为相当或甚至更优。含有含和不含tte或btfe稀释剂的浓缩的4mlifsi/dme电解质的li||lfp电池单元的循环性能显示在图24中。使用lfp阴极(hydro-québec,1mahcm-2)、锂金属阳极、一片聚乙烯(pe)隔膜和稀释前后的浓缩醚基电解质组装li||lfp纽扣电池。将浓缩lifsi/dme电解质从4m稀释至2m,使用2mlifsi/(dme+btfe)电解质和2mlifsi/(dme+tte)电解质的li||lfp电池单元显示与使用母体浓缩4mlifsi/dme电解质的电池单元相比类似的长期循环稳定性。在2.5~3.7v的电压范围内,在c/10下进行3个形成循环后,在1c倍率下获得结果。实施例6具有nafsi/dme-tte和nafsi-dme-btfe电解质的钠金属电池局部超浓缩电解质的概念在钠金属电池中也有效。所评估的电解质配方显示在表4中。通过添加tte,将5.2mnafsi/dme电解质的浓度稀释至1.5m。表4.此实施例中使用的电解质编号和配方电解质编号电解质配方浓度e17nafsi/dme(nafsi:dme,1:1,摩尔比)5.2moll-1e18nafsi/dme+tte(dme:tte=1:0.5,摩尔比)3.0moll-1e19nafsi/dme+tte(dme:tte=1:1,摩尔比)2.3moll-1e20nafsi/dme+tte(dme:tte=1:2,摩尔比)1.5moll-1为进行充电/放电性能测试,在填充氩气的手套箱(mbraun,inc.)中,使用na3v2(po4)3阴极、以na金属作为阳极、以玻璃纤维作为隔膜以及含和不含tte稀释剂的nafsi/dme电解质构建na||na3v2(po4)3纽扣电池。na3v2(po4)3阴极含有80%na3v2(po4)3、10%super碳黑(例如,可购自fisherscientific)和10%pvdf(聚偏二氟乙烯)。图25a和25b显示具有1.3mahcm-2的na沉积面积容量的na||cu电池单元的初始na电镀/剥离电压曲线(图25a)和ce相对于循环数(图25b)。在1.3mahcm-2的na沉积面积容量下,在以0.26macm-2进行两个形成循环后,在0.65macm-2下测试ce随循环数的变化。对于具有5.2m、3.0m、2.3m和1.5mnafsi盐的nafsi/dme和nafsi/dme-tte电解质的初始ce分别为94.3%、96.1%、94.8%和96.5%。在接下来的循环期间,稀释的电解质的ce与母体5.2mnafsi/dme电解质的ce相比相当或更高。图26a和26b显示使用浓缩5.2mnafsi/dme电解质和经tte稀释的nafsi/dme-tte电解质(2.3m和1.5m)的na||na3v2(po4)3电池单元在c/3倍率下的电化学性能。使用经tte稀释的nafsi/dme-tte电解质的电池单元与浓缩nafsi/dme电解质相比显示约97mahg-1的类似初始比放电容量(图26b)。图27a和27b分别显示使用5.2mnafsi/dme电解质和2.3mnafsi/dme-tte电解质的电池单元的充电和放电容量。图28a和28b显示在5.2mnafsi/dme、3.1mnafsi/dme-btfe(1:1)、2.1mnafsi/dme-btfe(1:2)和1.5mnafsi/dme-btfe(1:3)下,具有1.0mahcm-2的na沉积面积容量的na||cu电池单元的初始na电镀/剥离电压曲线(图28a)和ce相对于循环数(图28b)。括号中的比率为dme:btfe的摩尔比。在以0.2macm-2进行两个形成循环后,评估随在1macm-2下测试的循环数而变化的ce。如图28b中所示,lse,2.1mnafsi/dme-btfe(1:2)显示经200多个循环的稳定循环,ce接近100%。图29a-29c显示使用5.2mnafsi/dme和经btfe稀释的nafsi/dme-btfe电解质-3.1mnafsi/dme-btfe(1:1)、2.1mnafsi/dme-btfe(1:2)和1.5mnafsi/dme-btfe(1:3)的na||na3v2(po4)3电池单元的电化学性能。图29a显示初始na电镀/剥离电压曲线。图29b显示在c/10和c/3倍率下经100个循环的循环稳定性。图29c显示2.1mnafsi/dme-btfe(1:2mol)在c/10和c/3倍率下经过100个循环的充电和放电容量。结果表明btfe为用于浓缩nafsi/dme电解质的优越稀释剂。实施例7具有litfsi/dol-dme-tte电解质的li-s电池局部超浓缩电解质的概念对于锂硫电池也有效。此实施例中评估的电解质配方显示在表5中。通过添加tte,将3.3mlitfsi在dol-dme(1:1,v:v)电解质中的浓度稀释至1.06m。表5.电解质编号和配方电解质编号电解质配方浓度e21litfsi在dol-dme中(1:1,v:v)1moll-1e22litfsi在dol-dme中(1:1,v:v)3.3moll-1e23litfsi在dol-dme-tte中(1:1:9,v:v:v)1.06moll-1为进行充电/放电性能测试,在填充氩气的手套箱(mbraun,inc.)中,使用科琴黑导电碳(kb)/s阴极、以锂金属作为阳极、以一片聚乙烯作为隔膜以及含和不含tte稀释剂的litfsi/dol-dme电解质组装li-s纽扣电池。通过涂覆含有80%kb/s复合物、10%pvdf和10%super导电碳的浆料来制备kb/s阴极。通过将80%s和20%kb混合、然后在155℃下热处理12hr来制备kb/s复合物。图30a和30b显示具有1mahcm-2的li沉积面积容量的li||cu电池单元的初始li电镀/剥离电压曲线(图30a)和ce相对于循环数(图30b)。在1mahcm-2的li沉积面积容量下,在以0.2macm-2进行2个形成循环后,在1macm-2下获得结果。超浓缩3.3mlitfsi/dol-dme电解质显示91.6%的初始ce,这比低浓度1mlitfsi/dol-dme电解质时的70.1%高得多。通过用tte稀释3.3m的litfsi/dol-dme电解质,保持局部超浓缩li+溶剂化结构,且在dol-dme-tte(1:1:9,v:v:v)电解质中稀释的1.06mlitfsi在初始的电镀/剥离过程期间显示96.4%的更高ce。含有常规低浓度1mlitfsi/dol-dme、浓缩3.3mlitfsi/dol-dme电解质和在dol-dme-tte电解质中稀释的1.06mlitfsi的li-s电池单元的电化学性能显示在图31a-31c中。图31a显示初始充电/放电电压曲线。在图31a中,曲线a是由1.0mlitfsi/dol-dme获得的,曲线b是由3.3mlitfsi/dol-dme获得的,且曲线c是由1.06mlitfsi/dol-dme-tte获得的。使电解质/硫比率为50ml/g的li-s电池单元在c/10(168ma/g)的低电流倍率下循环。将浓缩litfsi/dol-dme电解质从3.3m稀释至1.06m,li-s电池单元与使用母体浓缩3.3mlitfsi/dol-dme电解质的电池单元相比显示甚至更佳的长期循环稳定性(图31b)和更高的ce(图31c)。实施例8具有litfsi/dmso-tte电解质的li-o2电池也在锂氧电池中研究局部超浓缩电解质的概念。所评估的电解质配方列举在表6中。通过添加tte,将2.76mlitfsi在dmso(litfsi:dmso摩尔比1:3)电解质中的浓度稀释至1.23m(litfsi:dmso:tte摩尔比为1:3:3)。表6.电解质编号和配方图32显示在0.1macm-2的电流密度下具有600mahg-1的有限放电容量的使用litfsi-3dmso(2.76m)和litfsi-3dmso-3tte(1.23m)电解质的li-o2电池单元的充电/放电曲线。在将litfsi浓度从2.76m稀释至1.23m之后,li-o2电池单元展示与在使用高浓度电解质的li-o2电池单元中观测到的容量类似的容量。为进行充电/放电性能测试,在填充氩气的手套箱(mbraun,inc.)中组装li-o2纽扣电池。将用200μl含和不含tte稀释剂的litfsi–dmso电解质浸泡的一片隔膜(whatman玻璃纤维b)放置在空气电极圆盘和li金属芯片之间。封口后,将组装的电池单元转移到ptfe(聚四氟乙烯)容器中并移出手套箱。ptfe容器中填充超高纯度的o2。使这些li-o2电池单元在o2气氛中静止至少6h,然后在室温下,在arbinbt-2000电池测试仪(arbininstruments,collegestations,tx)上在0.1macm-2的电流密度下进行放电/充电评估。实施例9具有桥溶剂的水性电解质据报道具有超浓缩锂盐litfsi的水基电解质(例如,1kgh2o中21mollitfsi)将其电化学稳定性窗口拓宽至约3.0v(即,1.9~4.9相对于li/li+)。如以上实施例中所示,稀释这种浓缩的水基电解质,同时保持宽的电化学稳定性窗口可为降低电解质成本的一种好的策略。然而,具有低介电常数和低供体数的氟代烷基醚与水不混溶。因此,在‘桥’溶剂的帮助下用tte稀释超浓缩的水性电解质(1kgh2o中21mollitfsi)。所评估的电解质配方显示在表7和8中。‘桥’溶剂包括dmc、pc、an和dmso。通过将h2o:tte的比率固定为1:1,小心优化‘桥’溶剂的最佳含量。不同溶剂的最佳含量不同,取决于‘桥’溶剂与h2o和tte稀释剂之间的相互作用强度。表7.电解质编号和配方电解质编号h2o-溶剂-tte重量比m(mol/kg)m(mol/l)e27h2o1215.04e28h2o-dmc-tte1:0.85:17.373.78e29h2o-pc-tte1:1.05:16.893.69e30h2o-an-tte1:0.5:18.43.87e31h2o-dmso-tte1:1.15:16.673.69图33显示在10mvs-1的扫描速率下,使用不锈钢工作电极和反电极,且以ag/agcl作为参比电极,在不同‘桥’溶剂(包括dmc、pc、an和dmso)的帮助下,在用tte稀释前后,浓缩水性电解质的循环伏安图。电势转化为相对于li/li+氧化还原电对的电势。相比之下,发现使用pc作为‘桥’溶剂,用tte稀释不损害大多数的氧化和还原稳定性。然而,在1:1的h2o:tte比率下,litfsi/h2o溶液的浓度只从5.04m稀释至3.69m。为进一步稀释浓缩的litfsi/h2o溶液,随着添加增多的pc作为‘桥’溶剂,使用更多的tte。稀释的电解质中pc:tte之间的比率极为接近1:1。通过增加添加的pc和tte,浓缩litfsi/h2o溶液的浓度从5.04m稀释至2.92m。表8.电解质编号和配方电解质编号h2o-溶剂-tte重量比m(mol/kg)m(mol/l)e32h2o1215.04e33h2o-pc-tte1:0.55:0.510.34.30e34h2o-pc-tte1:1.05:16.893.69e35h2o-pc-tte1:1.5:1.55.253.27e36h2o-pc-tte1:2:24.292.92图34a和34b分别显示在pc的帮助下用不同量的tte稀释浓缩水性电解质的第一个和第二个循环的循环伏安图。不锈钢为工作电极和反电极,且ag/agcl为参比电极;扫描速率为10mvs-1。电势转化为相对于li/li+氧化还原电对的电势。在第一个循环中(图34a),如负扫描期间更高的电流反应所反映,添加的pc-tte增加导致在约2.35v下的还原不稳定性略微增加。然而,稀释适当量的pc-tte改善还原稳定性和氧化稳定性,可能是由于在工作电极上形成了增强的sei层(图34b)。浓缩电解质的最佳稀释确定为h2o:pc:tte的比率为1:1.5:1.5。实施例10分子模拟不希望受特定操作理论束缚,相信在经btfe稀释的lifsi/dmc-btfe电解质中实现的lmb的优越电化学性能源于其独特的高度局部超浓缩li盐溶剂化结构。使用第一性原理密度泛函理论(dft)和从头算分子动力学(aimd)模拟来表征局部超浓缩电解质中的dmc-lifsi溶剂化结构。使用维也纳从头算模拟软件包(vasp)(kresse等人,phys.rev.b1996,54:11169-11186;kresse等人,phys.rev.b1993,47:558-561;kresse等人,phys.rev.b1994,49:14251-14269)进行所有计算。通过截止能为400ev的投影扩充波(paw)赝势描述电子-离子相互作用(blochl,physrevb1994,50:17953-17979;kresse等人,physrevb1999,59:1758-1775)。使用perdew-burke-ernzerhof广义梯度近似(gga-pbe)表示交换关联泛函(perdew等人,physrevlett1996,77:3865-3868)。使用高斯展开宽度项为0.05ev的交换关联泛函计算与li金属阳极表面系统相互作用的电解质和lifsi盐。使用monkhorst-packk点网格栅方案(4×4×1)获得优化的li阳极表面并吸收基态的电解质和盐分子。电子自洽迭代和离子弛豫的收敛准则分别设定为1×10-5ev和1×10-4ev。在303k下以正则(nvt)系综进行电解质-盐混合物的aimd模拟。使用nose质量参数为0.5的nose恒温法控制aimd模拟系统的恒定温度。所有aimd模拟中使用0.5fs的时间步长。aimd模拟中使用monkhorst-packk点网格栅方案(2×2×2)。每种电解质/盐系统的总aimd模拟时间为15ps。使用最后5ps的aimd轨道获得li-o对的径向分布函数。图35显示使用vasp,dmc、btfe、lifsi和dmc/lifsi、btfe/lifsi对在真空中的优化几何结构。li、o、c、h、s、n和f原子分别为洋红色、红色、灰色、白色、黄色、蓝色和浅蓝色。以上计算只使用γ为中心的k点网格。使用具有pbe的高斯09软件包和6-311++g(p,d)基组(frisch等人,gaussian09,2009,gaussianinc.,wallingford,ct)也获得类似的结果,表10。发现lifsi盐优先通过li-odmc键与dmc配位,优化的li-odmc键长度为且lifsi与dmc之间存在强烈的相互作用(-88.7kj/mol)。另一方面,如的li-obtfe键距离(比优化的li-odmc键长得多)和lifsi与btfe之间-41.4kj/mol的更弱的相互作用所反映,lifsi与另一种电解质溶剂btfe之间的相互作用相当弱。如先前关于li团块和表面的理论研究(camacho-forero等人,jphyschemc2015,119:26828-26839;doll等人,jphyscondensmatter1999,11:5007-5019)所表明,使用三种低指数表面结构(即(100)、(110)和(111)晶面)中最稳定的(100)表面来模拟li阳极表面。周期性的li(100)表面具有p(4×4)超晶胞,其具有七个原子li层。图36a-36f中显示li(100)表面上的dmc、btfe、lifsi和dmc/lifsi对的优化结构。进行贝德电荷分析(baderchargeanalysis,henkelman等人,computmatersci2006,36:354-360)获得电解质和盐物质之间在吸附时可能的电荷转移。dft计算的吸附能量和每种物质的贝德电荷总结在表9中。与dmc、lifsi和dmc/lifsi对相比,btfe与li阳极表面之间的相互作用极弱且几乎不具有还原性。这表明btfe分子几乎为惰性的且几乎不被还原。而dmc和dmc/lifsi对通过分别获得-0.19和-0.40|e|的分数电荷而被轻微还原,暗示两者都被还原,由此导致可能的分解。总而言之,发现btfe比dmc和dmc/lifsi对在li阳极上更稳定。为理解添加第二种电解质溶剂btfe对dmc/lifsi混合物的微观结构的影响,使用aimd模拟研究三种电解质/盐混合物系统,即一种二元dmc/lifsi混合物和具有两种不同摩尔比的两种三元dmc/btfe/lifsi混合物。通过在实验密度和摩尔比(浓度)的基础上随机放置dmc、btfe和lifsi分子的数量来建立每种液体电解质/盐混合物系统的初始结构。模拟系统的大小为首先使用具有灵活力场的自制的经典分子动力学模拟方法使这些初始结构弛豫(han等人,jelectrochemsoc2014,161:a2042-2053;soetens等人,jphyschema1998,102:1055-1061)。在系统准平衡后,对每种混合物系统进行总计15ps的aimd模拟。三种电解质/盐混合物系统来自aimd求和法的简况显示在图37a-37c中。图38显示由303k下的aimd模拟轨道计算的li-odmc和li-obtfe对的径向分布函数。由三种电解质/盐混合物系统的简况(图37a-37c)以及li-odmc和li-obtfe对的径向分布函数(图38)显而易见,所有lifsi盐分子都与dmc而非btfe紧密配位。使用最后5ps的aimd模拟轨道来计算li-odmc和li-obtfe对的径向分布函数。如图38中所示,对于所有三种研究的系统而言,都在下识别li-odmc对的尖峰,表明所有lifsi盐都被dmc溶剂的分子包围,作为第一配位壳层。这是由于dmc和lifsi之间的强烈吸引相互作用。对于具有高和低btfe浓度的两种三元混合物系统,发现li-obtfe对位于4.65和处的两个小峰。这表明btfe未与两种dmc/btfe/lifsi混合物中的lifsi配位,明确表示存在局部超浓度的dmc/lifsi对,而与btfe稀释剂的分子的浓度无关。采用拉曼光谱法和nmr光谱法来研究浓缩lifsi/dmc电解质和经btfe稀释的lifsi/dmc-btfe电解质的溶剂化结构。图39a和39b显示纯dmc、btfe和dmc-btfe(2:1)溶剂混合物的拉曼光谱。在dmc与btfe混合物中dmc和btfe的峰位置未观察到拉曼位移。此结果表明dmc与btfe之间无显著的相互作用。如图40a中所呈现,在不同浓度的lifsi/dmc溶液的拉曼光谱中,稀lifsi/dmc(1:9)溶液的特征在于游离dmc溶剂的分子在约920cm-1处的主要o-ch3伸缩振动带和li+-配位dmc在约940cm-1处的次要振动带。随着lifsi浓度增加(较高的lifsi:dmc摩尔比),游离dmc减少且消失以形成相接的离子对(cip,与单一li+离子配位的fsi-)和聚集体(agg,与两个或更多li+离子配位的fsi-)。通过fsi-拉曼带在710~780cm-1处的明显上移也证明了在浓缩的5.5mlifsi/dmc中形成了cip和agg。图40b显示不同浓度的经btfe稀释的lifsi/dmc溶液的拉曼光谱。通过用btfe稀释,发现li+-配位的dmc溶剂化结构保存完好,未观察到约940cm-1处的振动带发生任何位移。此外,在不同lifsi/dmc-btfe溶液中,btfe在830~840cm-1处的振动带无改变。结果表明稀释剂btfe因其低介电常数和低供体数而未参与li+阳离子的溶剂化,证实了lse的溶剂化结构。值得注意的一种特征在于用btfe稀释轻微减弱了li+阳离子与fsi-阴离子之间的缔合,由fsi-拉曼带的下移(710~780cm-1)得以证实,这将有益于增强li+离子扩散并改善lmb的动力学特性。lse溶剂化结构也通过nmr表征得以证实。nmr数据(图41)显示所有扩散系数(d)都与溶液粘度的倒数(η-1)全部成正比,而其变化略微不同,如stokes-einstein扩散理论所预测,取决于离子-离子以及离子-溶剂之间的相互作用(pregosin等人,chemicalreviews2005,105:2977-2998))。在纯dmc、btfe溶剂及其混合物中发现ddmc>dbtfe,但随着lifsi盐的引入,ddmc和dbtfe分别变得小于和大于η-1。这强烈表明主要由dmc分子发生li+阳离子溶剂化,btfe与其他电解质组分的相互作用相当弱。也表明通过添加btfe增强li+阳离子扩散(dli≥dfsi),这与拉曼观察相一致,而与lifsi/dmc电解质中相反(dli≤dfsi)。稳定的扩散比dli/ddmc和dfsi/ddmc表明由li+阳离子、fsi-阴离子和dmc溶剂组成的lse溶剂化结构对lifsi/dmc-btfe电解质中的btfe群体不敏感(图42)。温度依赖性ds似乎符合stokes-einstein扩散理论,d=kbt/6πηrs,其中d为扩散系数,kb为波尔兹曼常数(boltzmannconstant)、t为绝对温度,η为粘度且rs为扩散分子的流体力学半径。dli/ddmc和dfsi/ddmc值更接近统一值,且dbtfe/ddmc值比统一值大得多,这是由于dmc分子优先溶剂化li+阳离子。dmc:btfe电解质中相对恒定的dli/ddmc和dfsi/ddmc值表明由li+阳离子、fsi-阴离子和dmc组成的溶剂化结构对lifsi的浓度和dmc:btfe之间的比率较不敏感。可推断主要取决于li盐浓度的离子-离子以及离子-溶剂之间的相互作用较不可能随dmc:btfe二元电解质系统中的lifsi浓度而变化。为了解电解质组分与li金属的稳定性,通过使用1lifsi:2dmc、1lifsi:1dmc和1lifsi:2dmc:4btfe的溶液作为最稳定li(100)表面上的三种吸附配置类型来模拟适度稀释的3.7mlifsi/dmc、se(5.5mlifsi/dmc)和lse(1.2mlifsi/dmc-btfe(1:2))。对于适度稀释的溶液而言,在高浓度lifsi的情形下,lifsi吸附两个dmc分子(图36f),而只有dmc-lifsi对吸附li(100)表面(图36d)。如先前的研究(yamada等人,jamchemsoc2014,136:5039-5046)所表明,使用最低未占分子轨道(lumo)能量检查li阳极lifsi和dmc的减少。图43a-43c显示三种配置中,吸附的lifsi和dmc分子中每个原子的投影态密度(pdos)。显而易见,在稀lifsi/dmc溶液中(图43a),导带的lumo位于dmc分子处。因此,dmc分子在li阳极上还原性分解,导致对li金属阳极的连续腐蚀以及lmb在循环时容量快速下降。与此相反,对于5.5m的lifsi浓缩溶液而言(图43b),出现与fsi-阴离子相关的新的lumo峰。fsi-的导带最低能级低于dmc的导带最低能级,表明fsi-阴离子而非dmc溶剂将分解作为主要的还原反应,形成源自fsi的表面膜。重要的是,通过用惰性btfe稀释至1.2m(图43c),li+-dmc-fsi-溶剂化结构得以良好保持,且导带的lumo仍位于fsi-阴离子上,而非dmc或btfe分子上。就此而言,fsi-阴离子仍优选被还原,在li金属上形成牢固的源自fsi的表面膜,因此使得可改善lmb在如此低浓度的电解质(1.2mlifsi/dmc-btfe)中的稳定性。表9.dft计算的吸附能量以及dmc、btfe和lifsi在li(100)阳极表面上的贝德电荷。表10.使用高斯09计算的lifsi盐、dmc和btfe电解质的mullikan电荷鉴于多种可能的实施方案可适用于公开的本发明,因此应了解,说明的实施方案只是本发明的优选实施例,且不应认为限制本发明的范围。相反,本发明的范围由随附权利要求书来定义。因此我们要求所有落入这些权利要求书的范围和精神内的技术方案作为本发明。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1