纳米化RNAi制剂及其制备方法和应用与流程
本发明涉及基因工程技术领域,尤其涉及一种纳米化rnai制剂及其制备方法和应用。
背景技术:
壳聚糖(chitosan,cs)又称脱乙酰甲壳素,是由广泛存在于自然界的几丁质(chitin)经化学处理脱乙酰作用得到。1859年,来自法国的rouget首次分离获得壳聚糖后,因其天然高分子具有良好的安全性、生物相容性和微生物降解性等优良性能被广泛研究和应用于植物保护、生物治疗、基因工程、食品和医药等领域。壳聚糖分子中存在带正电荷葡糖胺基,因此可与负电荷的dna、dsrna等产生静电作用,二者经混合凝聚为的多聚复合物,使得dna与cs结合形成结构较为致密的纳米级粒。研究表明,将cs与dsrna进行结合,cs包裹住dsrna获得的纳米微粒可以防止埃及伊蚊饲料琼脂块中的dsrna游离,使得dsrna更为稳定且可以有效传送至蚊虫体内。
rnai(rnainterference)现象在生物中普遍存在,是一种由小干扰rna(smallinterferingrna,sirna)介导在转录后产生基因沉默的现象,具有特异性、高效性、可传播性、竞争效应和位置效应等特点,在调控基因表达、抵御病毒入侵和防止基因组中逆转座元件扩增等方面均起到重要作用。rnai技术在植物中的表现是将病毒的病原dsrna转入植株的叶片或叶脉等部位,使得病原dsrna与其同源mrna发生基因沉默,使其降解的过程。随着对rna干扰技术及其相关机制的不断研究,运用rna干扰技术的特点为高效性、特异性和可传播性地治疗植物病毒病已有了一定的研究和应用,且运用rnai为治疗植物病毒的提供了一个新途径。目前应用dsrna抵抗病毒的稳定性与系统性欠佳,增强dsrna的稳定性能使得rnai更为稳定且可以提高治疗病毒病效果。
技术实现要素:
本发明要解决的技术问题是克服现有技术的不足,提供一种纳米化rnai制剂,该纳米化rnai制剂稳定性提高,对环境友好,其制备方法简单,可应用于对tmv的预防和治疗。
一种纳米化rnai制剂,所述纳米化rnai制剂包括壳聚糖和dsrna,所述dsrna吸附在所述壳聚糖表面;所述dsrna的靶标基因为tmv外壳蛋白cp基因。
上述的纳米化rnai制剂,优选的,所述壳聚糖和dsrna的质量比为1︰4~10。进一步的,所述壳聚糖和dsrna的质量比为1︰4。
作为一个总的技术构思,本发明还提供了一种上述的纳米化rnai制剂的制备方法,包括以下步骤:
s1、以tmvrna为;根据所述tmvrna设计含有hindiii和kpni的扩增引物,进行rt-pcr扩增得到扩增产物;
s2、将所述扩增产物连接转化至感受态细胞中,得到重组子;
s3、以所述重组子作为模板,设计含有t7启动子序列的引物,进行pcr扩增,得到含有t7启动子的扩增产物;
s4、将含有t7启动子的扩增产物作为模板,进行dsrna的体外合成;
s5、将合成的所述dsrna与壳聚糖进行结合即得到纳米化rnai制剂。
上述的制备方法,优选的,所述s1步骤中所述含有hindiii和kpni的扩增引物为seqidno.2所示的dna序列和seqidno.3所示的dna序列。
上述的制备方法,优选的,所述s2步骤具体为:将所述扩增产物连接至peasy-t1载体上得到连接产物,将所述连接产物转化至感受态细胞中得到重组子。
上述的制备方法,优选的,所述s3步骤中所述含有t7启动子序列的引物为seqidno.4所示的dna序列和seqidno.5所示的dna序列。
上述的制备方法,优选的,所述s5步骤具体为:
s5-1、将所述壳聚糖溶于naac缓冲液中制备0.02w/v%壳聚糖工作液;
s5-2、将所述dsrna悬浮于na2so4液中得到dsrna悬浮液;
s5-3、将所述0.02w/v%壳聚糖工作液和所述dsrna悬浮液振荡混合,使所述dsrna吸附在壳聚糖的表面得到纳米化rnai制剂。
作为一个总的技术构思,本发明还提供了一种上述的纳米化rnai制剂在预防和治疗tmv上的应用。
上述的应用,优选的,所述应用方法为:在烟草为5叶期时,将纳米化rnai制剂喷施烟叶上。
上述的应用,优选的,所述纳米化rnai制剂的浓度为1v/v%。
与现有技术相比,本发明的优点在于:
(1)本发明提供了一种纳米化rnai制剂,纳米材料为壳聚糖;dsrna的靶标基因为tmv外壳蛋白cp基因;采用体外合成dsrna,结合纳米材料-壳聚糖,提高dsrna的稳定性,形成纳米化rnai制剂,使得dsrna更好的作用于植物。
(2)本发明提供了一种纳米化rnai制剂的制备方法,工艺简单,对环境友好。
(3)本发明提供了一种纳米化rnai制剂在预防和治疗tmv上的应用,纳米化rnai制剂对于tmv的预防和治疗效果分别为57.79%和58.4%,效果良好。
附图说明
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。
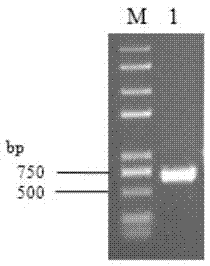
图1为体外合成dsrna电泳图。
图2为壳聚糖结合dsrna最佳比例筛选图。图中,m:trans2kplusiidnamarker;1:dsrna;2:0.02%cs纳米材料工作液;3:cs与dsrna融合比例1︰1;4:cs与dsrna融合比例1︰2;5:cs与dsrna融合比例1︰3;6:cs与dsrna融合比例1︰4;7:cs与dsrna融合比例1︰5;8:cs与dsrna融合比例1︰10。
图3为4℃条件下,壳聚糖结合dsrna稳定性试验图。a:分别以dsrna、cs-dsrna初始溶液中dsrna的量(100%)作为对照,测定其在4℃下30d内dsrna量的变化图。b为琼脂糖凝胶电泳图;其中,m:trans2kplusiidnamarker;1-4:dsrna在4℃下0、10、20和30d稳定性结果;5-8:cs-dsrna在4℃下0、10、20和30d稳定性结果。
图4为25℃条件下,壳聚糖结合dsrna稳定性试验图。a:分别以dsrna、cs-dsrna初始溶液中dsrna的量(100%)作为对照,测定其在25℃下30d内dsrna量的变化图。b为琼脂糖凝胶电泳图;其中,m:trans2kplusiidnamarker;1-4:dsrna在25℃下0、10、20和30d稳定性结果;5-8:cs-dsrna在25℃下0、10、20和30d稳定性结果。
图5为37℃条件下,壳聚糖结合dsrna稳定性试验图。a:分别以dsrna、cs-dsrna初始溶液中dsrna的量(100%)作为对照,测定其在37℃下30d内dsrna量的变化图。b为琼脂糖凝胶电泳图;其中,m:trans2kplusiidnamarker;1-4:dsrna在37℃下0、10、20和30d稳定性结果;5-8:cs-dsrna在37℃下0、10、20和30d稳定性结果。
具体实施方式
以下结合说明书附图和具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。
实施例
以下实施例中所采用的材料和仪器均为市售。
实施例1:
一种本发明的壳聚糖结合tmvdsrna纳米化rnai制剂的制备,其制备方法包括以下步骤:
(1)烟草花叶病毒rna的提取:将感染tmv是三生烟叶片采集后,采用trizol法进行rna的提取。具体操作如下:
1.1、取称量好的新鲜植物发病叶片0.1g置于已灭菌研钵中,往研钵中倒入适量液氮,迅速将液氮冻住的叶片研磨成较为均匀的粉末状或液状物,再将研磨好的粉末状或液状物迅速转入1.5mlrnase-free离心管中。
1.2、快速吸取1mltrizol加入离心管中,二者充分混匀后将离心管置于室温5min。
1.3、将离心管置于4℃,12000rpm,离心10min。
1.4、吸取离心后的上清液置于新的1.5mlrnase-free离心管,再向其中加入氯仿200μl,将离心管剧烈震荡1min,然后常温下放置3min。
1.5、在4℃下以12000rpm离心10min。
1.6、吸取离心后的上清液置于新的1.5mlrnase-free离心管,再往离心管中加入异丙醇600μl,将离心管置于-20℃环境放置30min。
1.7、在4℃下以12000rpm离心10min,弃上清。
1.8、吸取1ml70%乙醇溶液(现配)加入离心管中,用移液枪吸打使得沉淀悬浮,在4℃下以5000rpm离心3min,弃上清液。
1.9、重复一次步骤1.8,离心后再在4℃下以5000rpm离心30s,用移液枪吸取残留的70%乙醇溶液。
1.10、开盖自然干燥沉淀物,向离心管中加入30μlrnase-freewater,移液枪吸打混匀使沉淀充分溶解,即得rna。
(2)rt-pcr反应
2.1、根据序列信息设计含有hindiii和kpni的tmvcp基因特异性引物,引物序列如下:
f:ccaagctttcaagttgcrggaccagaggt(seqidno.2);
r:cggggtaccatgtcttacagtatcactactccatct(seqidno.3)。
下划线部分为引入的酶切位点。
2.2、利用上述引物对tmv基因组进行rt-pcr扩增,得到完整的tmvcp基因的扩增产物。
cdna合成按照北京全式金生物技术有限公司反转录说明进行,具体步骤为:tmvrna8μl;randomprimer1μl;2×tsreactionmix10μl;enzymemix1μl;总体积为20μl。轻弹混匀,短暂离心后,25℃孵育10min,42℃孵育下30min;85℃5min酶失活。即得tmvcdna。
rt-pcr具体扩增体系为:10×pcrbuffer2μl;dntps(2.5mm)1.6μl;上游引物/下游引物(10μm)各1μl;dna聚合酶0.3μl;cdna1μl;ddh2o补足20μl;总体积为20μl。
扩增程序为94℃预变性5min,94℃变性45s,60℃复性30s,72℃延伸60s,35个循环,最后72℃延伸10min。
将扩增产物经1.0%琼脂糖凝胶电泳检测,显示在500bp有单一条带,与预期序列大小一致。
(3)含tmvcp基因重组子的获得,具体步骤如下:
3.1、将pcr扩增片段进行纯化回收。
3.2、将纯化回收后的目的片段连接至peasy-t1zerocloningvector,具体体系为:目的片段4μl,peasy-t1zerocloningvector1μl;轻弹混匀,短暂离心后,pcr仪反应,25℃,连接5min,反应结束后转至冰上,即得连接产物。
将上述得到的5μl连接产物加入刚刚化冻的感受态细胞中,冰浴30min;42℃水浴热激30s,后迅速置于冰上2min;加入300μl提前37℃预热的soc培养基,200rpm、37℃条件下孵育1h;然后涂布与含有氨苄青霉素抗性的lb固状培养平板上,置于37℃恒温培养箱进行过夜培养。
取37℃过夜培养的含有重组子的平板,挑取单克隆菌落进行菌落pcr筛选,选取阳性菌落进行37℃、200rpm过夜培养,培养后的菌液进行质粒提取,经酶切、测序验证正确后,即得含有tmvcp基因的重组子。
tmvcp基因序列(seqidno.1)为:
cggggtaccatgtcttacagtatcactactccatctcagttcgtgttcttgtcatcagcgtgggccgacccaatagagttaattaatttatgtactaatgccttaggaaatcagtttcaaacacaacaagctcgaactgtcgttcaaaggcaattcagtgaggtgtggaaaccttcaccacaagtaactgtcaggttccctgacagtgactttaaggtgtacaggtacaatgcggtattagacccgctagtcacagcactgttaggtgcatttgacactagaaatagaataatagaagttgaaaatcaggcgaaccccacgactgccgaaacgttagacgctacccgtagagtagacgacgcaacggtggccataaggagcgctataaataatttagtagtagaattgatcagaggaaccggatcttataatcggagctctttcgggagctcttctggtttggtttggacctctggtcccgcaacttgaaagcttgg。
(4)含有t7启动子tmvcp基因模板的获得,具体步骤为:
4.1、根据序列信息设计含有t7启动子tmvcp基因特异性引物,引物序列如下:
f:taatacgactcactatagggagatcaagttgcrggaccagaggt(seqidno.4);
r:taatacgactcactatagggagaatgtcttacagtatcact(seqidno.5)。
下划线部分为引入的t7启动子序列。
4.2、利用上述引物对含有tmvcp基因进行pcr扩增,得到完整的含有t7启动子序列的tmvcp基因的扩增产物。
pcr具体扩增体系为:10×pcrbuffer2μl;dntps(2.5mm)1.6μl;上游引物/下游引物(10μm)各1μl;dna聚合酶0.3μl;含有tmvcp基因重组子1μl;ddh2o补足20μl;总体积为20μl。
扩增程序为94℃预变性5min,94℃变性45s,61℃复性30s,72℃延伸60s,35个循环,最后72℃延伸10min。
将扩增产物经1.0%琼脂糖凝胶电泳检测,显示在500bp左右有单一条带,与预期序列大小一致。
4.3、将4.2获得的扩增产物经割胶纯化回收,即得含有t7启动子的tmvcp基因模板。
(5)体外合成dsrna,参照megascript®rnaikit试剂盒的说明书面进行dsrna的体外合成。具体步骤如下:
5.1、dsrna的形成:转录体系的配制:含有t7启动子的模板1-2μg,10×t7reactionbuffer2μl,atpsolution2μl,ctp2μl,gtp2μl,utp2μl,t7enzymemix2μl,nuclease-freewater补足20μl。总体积为20μl。轻弹混匀,短暂离心后转入pcr进行孵育操作:37℃孵育4h,75℃孵育5min,冷却至室温;即形成dsrna。
5.2、rnase消化以去除dna和ssrna:rnase消化反应体系:上述5.1中得到的dsrna20μl,nuclease-freewater21μl,10×digestionbuffer5μl,dnasei2μl,rnase2μl在37℃孵育1h。
5.3、dsrna的纯化。具体步骤为:配制dsrnabindingmix:消化后的dsrna50μl,10×bindingbuffer50μl,nuclease-freewater150μl,无水乙醇250μl,使用移液枪轻轻吸打混匀;加入80μl(95℃预热)洗脱液,15000rpm,离心2min,再加入80μl(95℃预热)洗脱液,15000rpm,离心2min;洗脱后的产物即为纯化后的dsrna。
电泳检测体外合成dsrna见图1。图1中,m:trans2kplusiidnamarker;1:体外合成dsrna。从图1中可知:在500bp左右有一条与预期大小一致的电泳条带,说明已成功体外合成dsrna。
(6)壳聚糖与dsrna的结合。
6.1、醋酸钠(naac)缓冲液的制备:将naac配置成ph4.5,0.1mol/mlnaac-0.1mol/ml醋酸缓冲液,即为naac缓冲液。
6.2、0.02%的壳聚糖工作液的制备:按0.02%(w︰v)比例将壳聚糖溶于naac缓冲液中,即为0.02%壳聚糖工作液。
6.3、壳聚糖与dsrna的结合:分别吸取8、16、24、32、40、80μgdsrna至干净的离心管中,向离心管中加入2μl2.5mol/l的na2so4并用depc水补足至100μl,充分混匀后加入100μl0.02%的壳聚糖工作液。将离心管置于55℃水浴中静置1min,迅速转至高速漩涡振荡器振荡30s,静置10min,此时dsrna被吸附在cs的表面,形成稳定的cs-dsrna纳米微粒,琼脂糖凝胶电泳检测cs-dsrna纳米微粒,根据电泳结果选取最佳融合比例。
图2为dsrna与壳聚糖最佳融合比例筛选电泳图。第1泳道为dsrna,第2泳道为0.02%壳聚糖工作液,第3-8泳道分别为8、16、24、32、40、80μg与100μl0.02%的壳聚糖工作液不同融合比例的纳米化rnai制剂。由图2得知,第6泳道为dsrna与壳聚糖最佳融合比例,壳聚糖与dsrna融合后没有多余的dsrna析出,即壳聚糖和dsrna的体积质量比为100μl︰32μg时为最佳融合比例。
实施例2:
实施例1的纳米化rnai制剂稳定性的测定,其测定方法包括以下步骤:
1、分别取5μl实施例1的纳米化rnai制剂和体外合成的dsrna置于rnase-freepcr管中,各45管;用parafilm封口膜封严rnase-freepcr管,避免液体蒸发,短暂离心;
2、将45管平均分成三份并依次摆放于pcr板上,分别置于4℃、25℃、37℃条件下放置30d;
3、每2d进行一次琼脂糖凝胶电泳检测,电泳时取3μlloadingbuffer、3μl溴化乙锭荧光染料和3μl样品混匀后分别点入点样孔,130v电泳25min后,观察并保存电泳图(参见图3b、图4b、图5b);
4、同时用nanodrop2000c仪器测定dsrna的量,记录数据,试验重复两次。
5、以体外合成的dsrna作为对照,测定纳米材料-rnai制剂中dsrna含量的变化,得出其吸附稳定性,结果参见图3a、图4a、图5a。
从图3a、图4a、图5a中可知:在4、25和37℃稳定性测定试验中,dsrna的量较初始值分别减少了80.01%、59.56%和59.76%,降解比较明显;cs-dsrna中dsrna的量较初始值分别增加了65.98%、103.82%和157%;从图3b、图4b、图5b电泳结果显示:dsrna在30d稳定性测定实验中降解非常明显,4℃的dsrna降解速率略高于25和37℃存放的dsrna;cs-dsrna纳米制剂降解量少且纳米材料与dsrna的结合稳定,在4、25和37℃下30d内均无明显条带析出。
实施例3:
一种实施例1的纳米化rnai制剂在tmv预防和治疗中的应用,具体应用方法如下:
采用半叶法研究纳米材料-rnai制剂对烟草花叶病毒的预防和治疗试验,共设计4组处理,(1)以清水为空白对照处理、1v/v%dsrna处理;(2)以清水为空白对照处理、1v/v%cs-rnai制剂处理;(3)以清水为空白对照处理、0.1%盐酸吗啉胍处理;(4)以清水为空白对照处理、cs纳米材料处理;每组处理10株植物,试验重复3次。
以主叶脉为间隔,叶片左部为对照组,叶片右部为处理组,预防和治疗效果枯斑数目为三次试验重复每组(10株)心叶烟枯斑总数的均值。
预防试验:温室内培养心叶烟至5叶期,以主叶脉为间隔,用硬塑料板遮住不施药部分,在叶片左部喷施对照处理药剂,右部喷施生物或化学处理药剂,间隔1d后,采用摩擦接种法接种tmv枯斑寄主心叶烟,接种病毒后,2d后观察植株发病情况,拍照,统计3次试验叶片病斑数量,计算预防效果,统计数据。
治疗试验:采用摩擦接种法接种5叶期心叶烟,接种病毒后,间隔6h,进行喷药处理,以主叶脉为间隔,用硬塑料板遮住不施药部分,在叶片左部喷施对照处理药剂,右部喷施生物或化学处理药剂,2d后观察发病情况,拍照,统计3次试验叶片病斑数量,计算治疗效果,统计数据,记录于表1中。
从表1的结果可知:dsrna、cs-dsrna制剂、0.1%盐酸吗啉胍和cs制剂对tmv的预防效果分别为60.12%、57.79%、3.27%和1.06%;治疗效果分别为65.01%、58.4%、4.47%和1.09%。结果表明,cs-dsrna制剂对tmv的预防与治疗均有一定的效果。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制。虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。
<110>湖南省植物保护研究所
<120>纳米化rnai制剂及其制备方法和应用
<160>5
<170>siposequencelisting1.0
<210>1
<211>497
<212>dna
<213>烟草花叶病毒(tobaccomosaicvirus)
<400>1
cggggtaccatgtcttacagtatcactactccatctcagttcgtgttcttgtcatcagcg60
tgggccgacccaatagagttaattaatttatgtactaatgccttaggaaatcagtttcaa120
acacaacaagctcgaactgtcgttcaaaggcaattcagtgaggtgtggaaaccttcacca180
caagtaactgtcaggttccctgacagtgactttaaggtgtacaggtacaatgcggtatta240
gacccgctagtcacagcactgttaggtgcatttgacactagaaatagaataatagaagtt300
gaaaatcaggcgaaccccacgactgccgaaacgttagacgctacccgtagagtagacgac360
gcaacggtggccataaggagcgctataaataatttagtagtagaattgatcagaggaacc420
ggatcttataatcggagctctttcgggagctcttctggtttggtttggacctctggtccc480
gcaacttgaaagcttgg497
<210>2
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>2
ccaagctttcaagttgcrggaccagaggt29
<210>3
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>3
cggggtaccatgtcttacagtatcactactccatct36
<210>4
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>4
taatacgactcactatagggagatcaagttgcrggaccagaggt44
<210>5
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>5
taatacgactcactatagggagaatgtcttacagtatcact41
- 还没有人留言评论。精彩留言会获得点赞!