经体外培养的人源性肿瘤异种移植模型的建立方法与流程
本发明涉及一种人源性异种移植模型研究领域,尤指经体外培养的人源性肿瘤异种移植模型的建立方法。
背景技术:
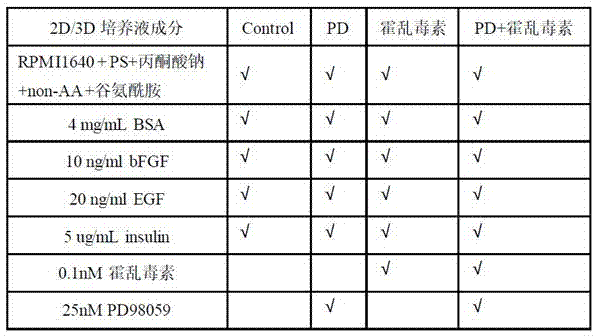
癌症属于世界范围内的重大公共卫生问题,其发病率和死亡率逐年增加,同时癌症病发是现今导致死亡的主要原因(siegelrletal.,2017);因此在目前状况基础上,建立能够高度模拟人体内肿瘤发生发展的模型是肿瘤研究的关键一步;当前通过小鼠体内模型研究以模拟人体内肿瘤发生发展模型,而目前应用较多的小鼠体内模型包括基因工程小鼠、化学诱导模型及人源性异种移植模型,其中人源性异种移植模型(英文:patient-derivedxenografts,缩写pdx)是基于将患者的新鲜肿瘤细胞或组织通过注射、外科操作等接种到免疫缺陷小鼠体内,更能保留原发肿瘤的组织病理及遗传学特性,也从而成为肿瘤病理研究和药物筛选的重要工具(sausvilleeaetal.,2006)。根据移植部位的不同,pdx模型主要分为皮下移植、原位移植、肾包膜下移植,皮下移植一般位于小鼠双侧腹股沟或腋窝处,容易观察和定期测量肿瘤大小,但该部位缺乏血供及肿瘤-宿主间的相互作用,并且极少出现扩散和转移瘤;原位移植是最符合肿瘤微环境的移植方式,但该模型操作较难,成瘤率较低,仅限于乳腺脂肪垫、胰腺、大脑等部位,不具有普适性(hidalgometal.,2014);肾包膜处血供丰富,成瘤率较高,因此肾包膜处成为移植的理想部位(cunhagretal.,2016)。人源性异种移植模型根据接种材料的不同可分为单细胞悬液移植和组织块移植,细胞块移植模型易操作,成瘤率高;但是由于细胞块移植模型经过体外筛选,基因谱的表达已发生改变,丧失肿瘤内的异质性,同时缺乏肿瘤微环境的相互作用,不能客观的反映原发肿瘤发生、增殖、转移等的特性(danielvcetal.,2009;siolas,detal.,2013);组织块移植模型基因组突变减少,更加真实地反应了原发肿瘤的生物学特性(bendaviduetal.,2017;loukopoulosp,2004),但由于肿瘤类型不同及操作较复杂,该模型移植成功率在23%-75%不等,同时对临床手术和动物实验操作的时限和肿瘤部位定位要求比较高,需要在手术后极短时间内移植动物,同时需要选取活性高的肿瘤癌巢部位移植才能获得较高的移植成功率,需要临床医生的密切配合才能实现,这些成为目前本技术推广应用的严重障碍(siolasdetal.,2013)。目前pdx技术应用面临的最大问题是,人源性异种移植模型以细胞移植为主,丧失肿瘤内的异质性,同时缺乏肿瘤微环境的相互作用,不能客观的反映原发肿瘤发生、增殖、转移等的特性;而组织块移植,由于肿瘤类型不同及操作较复杂,移植成功率及建模时间差异较大,均有待进一步优化改进。参考文献:siegelrl,millerkd,jemala,etal.cancerstatistics,2017.ca:acancerjournalforclinicians,2017,67(1):7-30.chenw,zhengr,baadepd,etal.cancerstatisticsinchina,2015.ca:acancerjournalforclinicians,2016,66(2):115-132.sausvilleea,burgeram.contributionsofhumantumorxenograftstoanticancerdrugdevelopment.cancerres2006;66:3351–4.danielvc,marchionnil,hiermanjs,rhodesjt,devereuxwl,rudincm,etal.aprimaryxenograftmodelofsmall-celllungcancerrevealsirreversiblechangesingeneexpressionimposedbycultureinvitro.cancerres2009;69:3364–73.siolas,d.&hannon,g.j.patient-derivedtumorxenografts:transformingclinicalsamplesintomousemodels.cancerres.73,5315–5319(2013).loukopoulosp,kanetakak,takamuram,shibatat,sakamotom,hirohashis.orthotopictransplantationmodelsofpancreaticadenocarcinomaderivedfromcelllinesandprimarytumorsanddisplayingvaryingmetastaticactivity.pancreas2004;29:193–203.bendavidu,hag,tsengy,etal.patient-derivedxenograftsundergomouse-specifictumorevolution.naturegenetics,2017,49(11):1567-1575.hidalgom,amantf,biankinav,etal.patient-derivedxenograftmodels:anemergingplatformfortranslationalcancerresearch.cancerdiscovery,2014,4(9):998-1013.cunhagr,baskinls.useofsub-renalcapsuletransplantationindevelopmentalbiology.differentiation,2016:4-9.。技术实现要素:为解决上述问题,本发明旨在公开一种人源性异种移植模型研究领域,尤指经体外培养的人源性肿瘤异种移植模型的建立方法,通过对组织块的体外培养后再进行异种移植,建立能高度模拟人体内肿瘤发生发展的小鼠模型,为肿瘤病理研究和药物筛选获得新工具与方法。为实现上述目的,本发明采用的技术方案是:经体外培养的人源性肿瘤异种移植模型的建立方法,其特征在于,所述的建立方法包括以下步骤:1)收集经手术切除的肿瘤组织标本;2)将所述肿瘤组织暂时置于预冷的含抗生素的培养液中储存;3)然后于2h内完成低温运输并准备进一步处理;4)在无菌操作台内,将从步骤2)的培养液中取得的肿瘤组织切成米粒大小;5)所述肿瘤组织经含抗生素的pbs清洗,然后置于48孔板中培养;随后在48孔板中加入培养基,再添加调节激酶抑制剂pd98059;6)所述肿瘤组织通过原位末端标记法,检测组织凋亡情况;7)选取免疫缺陷型ncg(nod-prkdcem26cd52il2rgem26cd22/nju)小鼠经腹腔麻醉、消毒背部皮肤处理,然后自肋脊角逐层切开暴露肾脏,揭开肾包膜;8)将培养的肿瘤组织用毛细玻璃管轻轻植入小鼠肾包膜内,缝合肌肉及皮肤;9)经过3个月后完成建模,得到所述人源性肿瘤异种移植模型。优选地,所述用于步骤1)的肿瘤组织标本大小为1-3cm3。优选地,所述步骤2)的培养液为无血清rpmi-1640培养液。优选地,所述步骤5)的每个孔板加入400ul培养基,每三天换一次液,并置于5%co2、37℃的恒温箱中培养2个月。优选地,步骤7)的免疫缺陷型ncg(nod-prkdcem26cd52il2rgem26cd22/nju)小鼠基于spf环境饲养。优选地,所述步骤5)的培养基中,还添加有人工基质胶。本发明的有益效果体现在:本发明在pdx模型利用人体新鲜细胞或组织进行接种移植的基础上,通过对肿瘤组织块进行体外培养,结合肾包膜下移植,优化pdx模型的接种条件,提高成瘤率;并通过结果验证,体外培养中添加pd98059及人工基质胶能减少组织凋亡;培养后的组织能成功建模,并保持原发肿瘤的远处转移及形成腹水的特性;该体系可应用于大部分恶性肿瘤的pdx建模,尤其是肝癌及卵巢癌中可广泛实施。本发明为异种移植模型选择肿瘤组织块进行建模,有利于保留原发肿瘤的组织病理及遗传学特性;且获取的肿瘤组织先进行体外培养,有利于肿瘤分型和临床实践;添加pd98059和人工基质胶可以大幅度减少组织凋亡,有利于提高移植成功率;同时本发明中异种移植部位选择在肾包膜下,血供丰富,有利于缩短建模时间,提高成瘤率,重现肿瘤在体内的发生发展过程。附图说明图1是本发明具体实施例一的体外组织培养的培养基组分及相应浓度对照表。图2是本发明具体实施例一的光密度半定量统计图。图3是本发明具体实施例一的肾包膜下异种移植模型(pdx)图。图4是本发明具体实施例一的免疫组化法检测肝细胞癌移植瘤块的标记物显示图。具体实施方式下面结合附图详细说明本发明的具体实施方式:经体外培养的人源性肿瘤异种移植模型的建立方法,所述的建立方法包括以下步骤:1)收集经手术切除的肿瘤组织标本;患者在术前均经病理学检查确诊为恶性肿瘤;2)取大小为1-3cm3的肿瘤组织标本,将所述肿瘤组织暂时置于预冷的含抗生素的培养液中储存;培养液为无血清rpmi-1640培养液;3)然后于2h内完成低温运输并准备进一步处理;4)在无菌操作台内,将从步骤2)的培养液中取得的肿瘤组织切成米粒大小;5)所述肿瘤组织经含抗生素的pbs清洗,然后置于48孔板中培养;随后在48孔板中加入培养基,再添加调节激酶抑制剂pd98059;所述步骤5)的培养基中,还添加有人工基质胶;所述步骤5)的每个孔板加入400ul培养基,每三天换一次液,并置于5%co2、37℃的恒温箱中培养2个月;6)所述肿瘤组织通过原位末端标记法,检测组织凋亡情况;7)选取基于spf环境饲养的免疫缺陷型ncg(nod-prkdcem26cd52il2rgem26cd22/nju)小鼠经腹腔麻醉、消毒背部皮肤处理,然后自肋脊角逐层切开暴露肾脏,揭开肾包膜;8)将培养的肿瘤组织用毛细玻璃管轻轻植入小鼠肾包膜内,缝合肌肉及皮肤;9)经过3个月后完成建模,得到所述人源性肿瘤异种移植模型。进一步具体应用:步骤5)中的培养基的主要成分如图一所示,其必要成分为:rpmi1640+ps+丙酮酸钠+non-aa+谷氨酰胺、4mg/mlbsa、10ng/mlbfgf、20ng/mlegf、5ug/mlinsulin,另外可以选择性仅添加调节激酶抑制剂pd98059,或仅添加蛋白激酶a激动剂霍乱毒素,或者同时添加调节激酶抑制剂pd98059与蛋白激酶a激动剂霍乱毒素,从而比较模型建立效果;2d/3d培养液成分controlpd霍乱毒素pd+霍乱毒素rpmi1640+ps+丙酮酸钠+non-aa+谷氨酰胺√√√√4mg/mlbsa√√√√10ng/mlbfgf√√√√20ng/mlegf√√√√5ug/mlinsulin√√√√0.1nm霍乱毒素√√25nmpd98059√√如图1,为体外组织培养的培养基组分及相应浓度的对照表,“√”代表各组添加的成分;每组5份中分化肝癌样本;对照组分别对照添加调节激酶抑制剂pd98059、霍乱毒素或者调节激酶抑制剂pd98059+霍乱毒素的效果;在相同培养基的2d培养方法与3d培养方法中,3d培养方法效果更好:2d培养方法为:在48孔板中放入2-3块肝癌组织,然后每孔加400ul培养基;3d培养方法为:在48孔板的每孔内平铺60ul人工基质胶,待凝固后放入2-3块肝癌组织,再加入100-120ul人工基质胶覆盖肝癌组织,继而添加400ul培养基。如图2,采用免疫荧光的原位末端标记(tunel)法检测肝癌组织各组凋亡情况;imagej软件进行光密度半定量统计,graphpadprism软件进行统计分析,*:p<0.05;添加调节激酶抑制剂pd98059或霍乱毒素的结果对照:1)3d培养相对2d培养可减少组织凋亡;2)在培养基添加pd98059相比添加霍乱毒素能减少组织凋亡;3)在培养基添加pd98059相比添加pd98059与霍乱毒素能减少组织凋亡;4)在培养基添加pd98059和人工基质胶后,减少组织凋亡的效果最佳。如图3a,spf环境饲养的免疫缺陷型ncg小鼠经腹腔麻醉,消毒背部皮肤,自肋脊角逐层切开暴露肾脏,揭开肾包膜,将培养的肿瘤块用毛细玻璃管轻轻植入小鼠肾包膜内,缝合肌肉及皮肤;如图3b,小鼠在3个月内成功建模,其中卵巢癌模型出现颈部转移;如图3c,肝细胞癌模型出现腹水。如图4,建模成功的肝癌小鼠经颈椎脱臼处死后,获得移植瘤块,经免疫组化染色后,仍能检测到原发肿瘤afp、gpc-3、heppar-1的表达,由此证实其能保留原发肿瘤的组织病理及遗传学特性,该体系适用于大部分恶性肿瘤的人源性异种移植模型(patient-derivedxenografts,pdx)的建立。以上所述,仅是本发明的较佳实施例,并非对本发明的技术范围作任何限制,本行业的技术人员,在本技术方案的启迪下,可以做出一些变形与修改,凡是依据本发明的技术实质对以上的实施例所作的任何修改、等同变化与修饰,均仍属于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1