使用SLO3钾通道抑制剂提高动物精子寿命和运动力的方法与流程
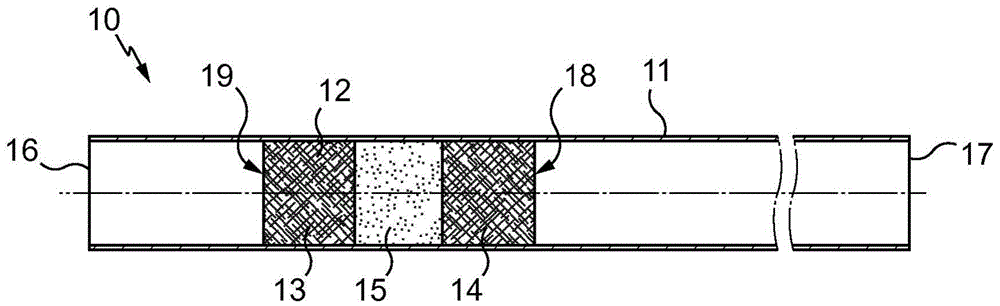
本发明涉及提高动物(即非人类)精子的寿命。本发明还涉及提高动物精子、特别是获能精子的运动力。本发明还涉及用于动物人工授精的人工授精工具,用于人工授精动物的方法以及用于提高动物生育力的方法。
背景技术:
人工授精(ai)的普及率在奶牛繁殖中接近100%,在人工授精中精子沉积在雌性的阴道或子宫中,以提高具有高遗传价值的雄性精液的利用。但是,在过去的二十年中,牛人工授精的受孕率有所下降。导致低受孕率的一个主要因素是无法确定排卵时间。
当受孕失败时,需要重复人工授精,例如对雌性牛进行人工授精,这给农民造成了负担。因此,需要一种提高受孕率的人工授精方法。
在人工生殖技术中经常需要冷冻精子,特别是对于牛精子。对于家畜的人工授精,通常采用等分在精液吸管(semenstraw)并保存在液氮中的冷冻精液。用于冷冻保存的精液吸管通常是通过将精液稀释在至少一种稀释剂(通常是在一级稀释剂中稀释,然后在二级稀释剂中稀释,二级稀释剂通常是补充有冷冻保护剂的一级稀释剂)中来制备的。用经这样稀释的精液填充吸管,然后冷冻。
精子(spermatozoa,sperm)是细胞,因此对冷冻敏感。为了防止细胞死亡,所述稀释剂中必须加入至少一种冷冻保护剂。甘油、糖(葡萄糖、果糖、乳糖和棉子糖)和脂质(蛋黄或合成脂质)通常用作冷冻保护剂以改善冷冻和解冻后精子的存活率和受精能力。
尽管在稀释剂中使用了冷冻保护剂,但冷冻通常会对精子运动力产生负面影响。事实上,与新鲜精子样品相比,先前冷冻过的精子一旦解冻,其运动力就会降低。冷冻保存导致精子运动力、生存力和寿命降低。
激活运动力和/或保持运动力的试剂(特别是在冷冻后)能够对许多物种(例如马、猪、牛和家禽(例如火鸡))的人工繁殖成功率产生积极的影响。
冷冻方法的另一个缺点是加速精子的成熟过程(称为获能)。获能是成熟的必要步骤,通常发生在雌性生殖道中。虽然是必要的,但获能导致精子发生不可逆的变化,并最终导致精液质量、运动力和使卵母细胞受精的能力降低。获能与代谢活动的强烈增加有关,并降低雌性生殖道内精子的总寿命。当授精与排卵不同步时,这尤其有害。
因此,需要能够提高受孕率的试剂,用于动物(特别是哺乳动物和禽类,更特别地是家养哺乳动物和家禽)的工业人工授精过程中,特别是当人工授精需要冷冻精子时。
技术实现要素:
本发明人已发现,slo3钾通道的抑制剂,特别是钡、米贝拉地尔(mibefradil)、氯非铵(clofilium)和/或奎尼丁,更特别地是氯非铵和/或奎尼丁,可用于提高动物精子的寿命。
这导致精子储存时间增加,并且改善在长时间(例如24小时或48小时)获能后精子受精的能力。
根据本发明,特别是在长时间(例如24小时或48小时)获能后,获能精子的运动力令人惊讶地增加。
精子寿命的提高使得在排卵前引入的精子,特别是获能精子,在雌性生殖道中的存活时间更长,并在雌性(例如奶牛)排卵日,在排卵部位表现出运动力和使卵母细胞受精的能力,从而有可能提高动物种群的受孕率。
因此,本发明涉及用于提高动物精子寿命的方法,其包括使所述动物精子与slo3钾通道抑制剂接触。
本发明还涉及用于提高获能动物精子运动力的方法,其包括使所述获能动物精子与slo3钾通道抑制剂接触。
本发明还涉及slo3钾通道抑制剂用于提高动物精子寿命的非治疗性用途,其包括使slo3钾通道抑制剂与所述动物精子接触。
本发明还涉及slo3钾通道抑制剂用于提高获能动物精子运动力的非治疗性用途,其包括使slo3钾通道抑制剂与所述获能动物精子接触。
本发明还涉及用于动物人工授精的人工授精工具,其包括与slo3钾通道抑制剂接触的动物精子。所述人工授精工具优选是用于冷冻保存的精液吸管。
本发明还涉及用于人工授精动物的方法,其包括使用所述人工授精工具。
本发明还涉及用于提高动物生育力的方法,其包括以下连续步骤:
a)使所述动物精子与slo3钾通道抑制剂接触;
b)用步骤a)产生的精子人工授精所述动物。
发明详述
slo3钾通道被认为是参与获能的关键钾通道。slo3基因缺失导致雄性不育,slo3钾通道抑制剂被认为是受精阻断剂,其通过防止精子在获能过程中发生超极化和ca2+内流,这两个事件被认为是精子生育能力所必需的。
由于本发明人对填充在吸管中的用于人工授精的精子的存活以及动物精子(特别是获能精子)的运动力和受精能力进行了深入研究,本发明人已发现当制备包含与slo3钾通道抑制剂接触的精液的用于人工授精的吸管时,能够令人惊奇地提高动物精子的寿命以及获能动物精子的运动力。当刚射出的精液与slo3钾通道抑制剂接触时,也能够令人惊讶地提高动物精子的寿命。当刚射出的精子与slo3钾通道抑制剂接触并在含有slo3钾通道抑制剂的获能培养基中获能时,也能够令人惊讶地提高动物获能精子的运动力。
本发明还涉及在动物生产方法中提高动物生育力,包括其中精子与slo3钾通道抑制剂接触的人工授精方法。
在本发明中,术语“a和/或b”是指“a”或“b”或“a和b”。
在本发明中,“获能培养基”是精子能够在其中进行获能的培养基。
在本发明中,“冷冻培养基”(或保护性培养基)是保护细胞免受冷冻引起的损害的培养基。冷冻培养基通常包含至少一种冷冻保护剂。所述冷冻培养基通常包含在人工授精工具内。
在本发明中,“成熟培养基”是支持卵母细胞从gv(生发泡)期到mii(中期ii)期成熟的培养基。mii期的卵母细胞是“成熟卵母细胞”。
在本发明中,“受精培养基”是指包含获能精子和成熟卵母细胞的培养基,通常为溶液。
根据本发明,“提高精子寿命”是指当在大约37℃下、在包含精子的培养基中使用slo3通道抑制剂时,在所有其他条件保持相同的情况下,与不使用这种抑制剂的情况相比,在一定的孵育时间后,具有受精能力的精子群的百分比增加,而不损害精子群的受精能力。
孵育时间因目标物种的不同而有所不同。对于大多数物种,12小时足以观察到技术效果。
当受精前在大约37℃的获能培养基(例如以下示例中的一种:sp-talp获能培养基)中对精子进行孵育时,这是通过成熟卵母细胞受精后产生的2-细胞胚胎的百分比来测量的。相应地,它分别对应于在24小时孵育时间10%至60%(例如30%)范围内的增加和在48小时孵育时间10%至50%(例如45%)范围内的增加。
根据本发明,“提高获能精子的运动力”是指当在大约37℃下、在包含精子的培养基中使用slo3通道抑制剂时,在所有其他条件保持相同的情况下,相对于不使用这种抑制剂的情况,在一定孵育时间后,以百分比表示的获能精子群的总运动力增加。
这是通过在大约37℃下、在获能培养基(例如以下示例中的一种:sp-talp获能培养基)中孵育24h来测量的。相应的,它对应于100%至500%(例如400%)范围内的增加。
换言之,在所有其他条件保持相同的情况下,在包含精子的培养基中存在slo3钾通道抑制剂会增加获能精子的运动力。
在上述定义中,包含精子的培养基通常是保存培养基或保护性培养基。例如这是冷冻培养基或获能培养基。
在本发明中,术语“运动力”是精子自发主动运动的能力,在该过程中消耗能量。对于精子而言,这是一种由其鞭毛有规律的拍打而产生的类似游泳的运动,即鞭毛运动。
在本发明中,术语“获能”是指使动物精子具有使卵母细胞受精的能力所需的动物精子的成熟(一旦经历了这个最后的成熟步骤,精子就会穿透卵母细胞的周围保护层,这涉及顶体反应)。获能期是发生获能的时期。发生获能后,获能期可能会持续。根据本发明,“获能精子”是指在获能培养基中孵育最短时间的精子。这个时间段因目标物种的不同而有所不同(例如,对于小鼠,通常为大约45min,以及对于牛,通常为大约4小时)。对于小鼠精子,获能培养基通常含有牛血清白蛋白,以及对于牛精子,获能培养基通常含有牛血清白蛋白和肝素。
如本领域技术人员所知,获能导致精子运动模式(其可通过casa系统测量)改变以及蛋白质在其酪氨酸残基的磷酸化(其可通过蛋白质印迹(westernblot)测量)。
例如,根据本发明,如在“capacitationofmousespermatozoa.i.correlationbetweenthecapacitationstateandproteintyrosinephosphorylation.viscontipe等人,development.1995apr;121(4):1129-37”中所描述的,用抗磷酸酪氨酸蛋白质印迹测量精子获能。简而言之,将经洗涤的精子重悬于不含β-巯基乙醇的laemmli样品缓冲液中,并煮沸5分钟。离心后,将5%β-巯基乙醇加入上清液,并将混合物再次煮沸5分钟。每个泳道上样相当于1-2x106个精子的蛋白质提取物并进行sds-page。将溶解的蛋白质转移到聚偏二氟乙烯膜(millipore)上。用在pbs-t中的20%鱼皮明胶(sigma)处理膜,然后在室温下用抗磷酸酪氨酸抗体(克隆4g10,millipore)(1:10000)孵育1小时;然后用辣根过氧化物酶标记的二抗孵育1小时。使用化学发光检测试剂盒试剂和chimidoctmstation(biorad)检测免疫反应性。
根据本发明,“接触”是指“使...与...接触”。优选地,接触是混合。
在本发明中,术语“受孕率”是指动物生育力的测量。通常通过将怀孕雌性的数量除以授精总数来计算。
根据本发明,动物优选为哺乳动物和禽类,更优选为家养哺乳动物和家禽。
在本发明中,通常以有效量使用slo3钾通道抑制剂。术语“有效量”是指足以诱导所希望的生物学结果的量。在这里,所述结果是精子寿命或运动力增加。“有效量”取决于slo3钾通道抑制剂。一般如下:
-当slo3钾通道抑制剂是钡时,为0.5mm至5mm,优选为1mm至2.5mm,更优选为1.5mm至2.5mm;
-当slo3钾通道抑制剂是米贝拉地尔时,为1mm至100mm,优选为10mm至30mm,更优选为15mm至25mm;
-当slo3钾通道抑制剂是氯非铵时,为0.1μm至50μm,优选为0.1μm至5μm,更优选为0.2μm至1μm;
-当slo3钾通道抑制剂是奎尼丁时,为0.1μm至50μm,优选5μm至30μm,更优选20μm至30μm。
通常从液滴形式的冷冻培养基或获能培养基的总体积中计算或推断该摩尔浓度。
根据本发明,人工工具优选包括冷冻培养基和精子。该冷冻培养基包含slo3钾通道抑制剂。优选地,这些成分已经全部混合在一起。
钡是钡的盐,例如氯化钡或硫酸钡。硫酸钡,被认为是放射性造影剂,是化学式为baso4,cas号为7727-43-7的无机化合物。
米贝拉地尔是米贝拉地尔二氯化物,其是(1s,2s)-2-(2-((3-(1h-苯并[d]咪唑-2-基)丙基)(甲基)氨基)乙基)-6-氟-1-异丙基-1,2,3,4-四氢萘-2-基2-甲氧基乙酸盐的当前名称,已知的商品名为posicor,来自roche,cas号为116644-53-2。它被认为是抗高血压剂和抗慢性心绞痛剂。
氯非铵是4(-4(氯苯基)丁基-二乙基-庚铵(iupac名称)的当前名称,cas号为68379-02-2。它被称为是抗心律失常剂(iii类)。
奎尼丁是(9s)-6’-甲氧基辛可南-9-醇(iupac名称)的当前名称,cas号为56-54-2。它被认为是抗心律失常剂(ia类)。
根据本发明的优选实施方案包括以下特征中的至少一个:
-动物精子选自牛、猪、绵羊、禽类(例如鸡和火鸡)、马、山羊和宠物(例如猫和狗)的精子;
-slo3钾通道抑制剂是钡、米贝拉地尔、氯非铵和/或奎尼丁,优选氯非铵和/或奎尼丁,更优选氯非铵;
-所述接触是在体外或在体内进行的;
-所述动物精子先前已被冷冻和解冻,或刚被射出,或从附睾或睾丸中回收。
本发明还涉及slo3钾通道抑制剂用于提高动物精子寿命的用途,其包括使slo3钾通道抑制剂与所述动物精子接触。
本发明还涉及slo3钾通道抑制剂用于提高获能动物精子的运动力的用途,其包括使slo3钾通道抑制剂与所述获能动物精子接触。
本发明还涉及用于人工授精动物的方法,其包括使用根据本发明的人工授精工具。
根据本发明的用于提高动物生育力的方法的优选实施方案,
-通过在所述雌性的阴道和/或子宫颈中施用slo3钾通道抑制剂组合物在雌性中进行所述接触步骤,并且所述人工授精步骤是通过所述动物精子对所述雌性进行授精;和/或
-优选通过注射至所述雄性的附睾或睾丸在雄性中进行所述接触步骤,并且所述人工授精步骤是通过所述动物精子对雌性进行授精;和/或
-所述人工授精步骤通过使用人工授精工具来进行;和/或
-所述人工授精步骤通过使用用于冷冻保存的精液吸管来进行。
本发明的吸管内的冷冻培养基优选包含本领域技术人员已知的通常合适的添加剂,例如至少一种冷冻保护剂(例如醇(甘油、丙二醇)、醛(甲酰胺)、糖(蔗糖、棉子糖、海藻糖)或二甲基亚砜(dmso))和稀释剂(例如蛋黄、牛奶蛋白或糖)。
slo3钾通道抑制剂可以通过允许抑制剂与精子接触的途径来进行施用,其剂型(例如溶液、混悬剂、凝胶、霜剂、乳剂、胶囊、片剂和/或其他合适的形式)适合每种向动物施用的施用途径。
例如,根据本发明的一个实施方案,slo3钾通道抑制剂通过阴道途径以任何合适的形式(包括霜剂或凝胶,优选以栓剂的形式)向雌性施用。
附图说明
通过考虑附图,将容易理解本发明的技术:
图1是根据本发明的人工授精工具10的部分示意图。
图2是对于所测试的两种溶液(对照溶液和5μm氯非铵溶液)中的每一种,通过显示相对于受精前精子的孵育时间(小时,h)的受精后48h时2-细胞胚胎相对于(vs)成熟卵母细胞的百分比,说明在小鼠精子获能培养基中的氯非铵的影响的示意图。
图3包括两个示意图,分别为图3a和图3b,对于所测试的溶液(对照和氯非铵,分别为0.2μm氯非铵溶液(图3a)和5μm氯非铵溶液(图3b))中的每一种,通过显示受精后24h时2-细胞胚胎相对于成熟卵母细胞的百分比,说明受精前(孵育12小时)小鼠精子获能培养基中的氯非铵的影响。
图4是通过显示所测试的溶液(对照和0.2μm氯非铵)中的每一种的运动力,说明受精前(孵育12小时)小鼠精子获能培养基中的运动力百分比的示意图(以vcl表示,μm/s)。
图5包括两个示意图,分别为图5a和图5b,在两种情况下,对于所测试的溶液(对照0h、对照24h、氯非铵24h)中的每一种,通过显示受精后在48h时牛2-细胞胚胎相对于成熟卵母细胞的百分比(图5a)和受精后第9天测量的牛胚泡相对于成熟卵母细胞的百分比(图5b),分别说明了受精前(孵育24小时)在牛精子获能培养基中的氯非铵的影响。
图6包括两个示意图,分别为图6a和图6b,分别说明了氯非铵对牛精子运动力(以vcl表示,μm/s)的影响,在casa评估之前将精子在获能培养基中孵育24小时,对于所测试的溶液(对照、0.2μm氯非铵、0.5μm氯非铵、1μm氯非铵和5μm氯非铵)中的每一种(图6a)以及对于所测试的溶液(对照、0.2μm氯非铵、0.5μm氯非铵、1μm氯非铵和5μm氯非铵)中的每一种的总运动力(%)(图6b)。
图7是说明在牛精子受精后24h时洗涤氯非铵对2-细胞胚胎相对于成熟卵母细胞的百分比的影响的示意图。将牛精子用对照培养基(“对照”)或含有0.2μm氯非铵(“氯非铵”)的培养基冷冻,解冻后立即(“0h”)、24小时后(“24h”)或48小时后(“48h”)用于受精。测试了两种情况:解冻精子后,将其离心并用对照溶液(“洗涤氯非铵”)或含有0.2μm氯非铵的溶液(“氯非铵”)进行稀释。
图8是说明氯非铵对牛精子运动力(以vcl表示,μm/s)的影响的示意图,在casa评估之前将精子在获能培养基中孵育0h或24h,对于所测试的溶液(对照或0.2μm氯非铵)中的每一种,精子呈现出足够的速度(vcl>150μm/s)。
图9是对于所测试的溶液(对照、5μm奎尼丁、10μm奎尼丁、25μm奎尼丁和100μm奎尼丁)中的每一种,通过显示小鼠精子受精后在24h时2-细胞胚胎相对于成熟卵母细胞的百分比说明在获能培养基中(孵育12小时)奎尼丁的影响的示意图。
图1是用于保存预定剂量的液基物质(特别是稀释的动物精液)的吸管10的纵截面示意图。
吸管10包括容器,其是管11和阻塞物12。它用于人工授精家畜(特别是牛)。
管11通常由挤出塑料材料制成,其内径例如为1.6mm或2.5mm,长度为约133mm。管11是大体为圆柱形的套管,部分由稀释在冷冻培养基中的精子填充。该管能够在不改变其性质的情况下冷冻和解冻并且不会浸出其内容物中的任何物质。
阻塞物12通常是最初在法国专利995878(对应于英国专利669265)中描述的三部分类型,即由两个由纤维物质制成的塞子13和14包围粉末15形成,粉末15与液体接触时能够转化为不可渗透的糊剂或凝胶粘附在管壁上,从而使所述阻塞物是液密的。
在图1所示的初始状态下,阻塞物12靠近管11的末端16布置,并且如果在填充状态下,必须保存在吸管10中的液体物质剂量被放置在阻塞物12和离阻塞物12最远的管11的末端17之间。
为了填充吸管10,将末端16与真空源连通,而将末端17与包含要引入所述吸管中的物质的器皿连通。
最初包含在阻塞物12和末端17之间的空气通过所述阻塞物吸入,而物质在管中向前移动直到它遇到阻塞物12,其末端18朝向管11的末端17,也就是说,在图1的右侧能够看到阻塞物12的末端。
如有必要,将吸管靠近其两个末端16或17的一端或两端焊接,然后放入冷藏库中。
为了排空吸管10,如果需要,在切割焊接的末端部分并解冻之后,在管11中插入一根杆,该杆压在阻塞物12的末端19(该末端位于末端18的对面)上。使用该杆,使阻塞物12以活塞的方式朝向末端17或切割焊接部分后对应的末端滑动,其导致已经引入所述吸管中的物质剂量的排出。
在以下实施例中说明了图2、3(3a和3b)、4、5(5a和5b)、6(6a和6b)、7、8和9。
通过以下非限制性实施例进一步说明本发明,这些实施例仅为说明性目的而给出。
实施例
实施例1:氯非铵对小鼠精子寿命和运动力的影响
这些测试是在小鼠精子和成熟mii卵母细胞上进行的。它们如图2至图4所示。
通过手工研磨来自雄性的附睾尾(caudaeepididymides)获得小鼠精子,并使其在m2培养基(来自sigma)中游动10分钟。
以g/l计的m2培养基组成如下:cacl20.25;mgso4(无水)0.1649;kcl0.35635;k2hpo40.162;nahco30.35;nacl5.53193;白蛋白,牛级分v4.0;d-葡萄糖1.0;hepes(4-(2-羟乙基)-1-哌嗪乙磺酸)×na5.42726;丙酮酸×na0.0363;dl-乳酸×na2.95)。
然后,在5%v/vco2培养箱中于37℃将精子在具有2%无脂肪酸bsa(牛血清白蛋白)的m16培养基(来自sigma)(称为“m16-bsa培养基”)中按指定的不同时间进行获能。m16培养基是用于体外受精和植入前阶段胚胎的培养的商业化和常用的培养基。
以g/l计的m16培养基组成如下:氯化钙.2h2o0.25137;硫酸镁(无水)0.143276;氯化钾0.356349;磷酸二氢钾0.161959;氯化钠5.5319304;白蛋白牛级分v4.0;葡萄糖1.0;酚红.na0.01;丙酮酸.na0.0363和dl-乳酸.na2.61。
从成熟的of1雌性中收集卵母细胞,并用5个单位的孕马血清促性腺激素(pmsg)和5个单位的人绒毛膜促性腺激素(hcg)进行同步。直接从壶腹收获卵丘,并将精子注射到含有卵丘的m16液滴中。
1.第一项测试涉及受精前在包含氯非铵的获能培养基中孵育时,相对于对照培养基(其是相同的获能培养基但不含氯非铵),小鼠精子使卵母细胞受精的能力,所述获能培养基为m16-bsa培养基。
所述对照培养基是含有精子的m16-bsa培养基。将其与还含有浓度为5μm的氯非铵的相同培养基(在包含精子的m16-bsa培养基中)进行比较。
将精子在含有或不含氯非铵的m16-bsa培养基中孵育,然后加入包含含有卵母细胞的卵丘的m16液滴中。授精后48h时对2-细胞胚胎进行计数(n=3)。受精后48h时对达到2-细胞期的卵母细胞数进行计数。
这些结果显示在图2中,图2是显示对于所测试的溶液(“ctrl”(表示“对照”)和“5μm氯非铵”)中的每一种,受精后48h时2-细胞胚胎相对于成熟卵母细胞的百分比相对于孵育时间(小时,h)的示意图。
在48小时时,由于短孵育期(<3小时)和长孵育期(>3小时)两者达到2-细胞期的卵母细胞数目相似,因此氯非铵对两者都具有积极作用。对于3h的孵育期,2-细胞期的百分比与对照没有显著差异。另一方面,对于长孵育期(>3小时),用氯非铵处理观察到的2-细胞期的数目高于对照。
因为对照溶液中精子使卵母细胞受精的能力在12小时时最低,因此我们在第二项测试中比较了氯非铵对受精前孵育12h的精子的影响。
2.第二项测试涉及受精前用于孵育的氯非铵的剂量。
测试了两种不同浓度的氯非铵:0.2μm的氯非铵和5μm的氯非铵(在包含精子的m16-bsa培养基中)。
受精前精子孵育时间为12小时。
结果显示在图3a中,图3a显示了受精后24h时“对照”和0.2μm氯非铵溶液(“0.2μm氯非铵”)获得的2-细胞胚胎相对于成熟mii卵母细胞的百分比,以及图3b显示了受精后24h时“对照”和5μm氯非铵溶液(“0.5μm氯非铵”)获得的2-细胞胚胎相对于成熟mii卵母细胞的百分比。
能够看出,低至0.2μm的氯非铵浓度改善小鼠的体外受精结果。这表明两种浓度(0.2μm和5μm)都是有效的。
3.通过测量精子运动力来确定小鼠精子的生存力。使用计算机辅助精液分析(casa分析)进行运动力分析。在实施例中始终使用cerostm,hamiltonthornebioscience,usa进行casa分析。因此测量了vcl。
如本领域技术人员已知的,vcl(curvilinearvelocity,曲线速度)是精子头部通过其真实路径的平均速度。
为了进行这个分析,将样品稀释为0.1106/ml。将稀释的样品在含有或不含0.2μm氯非铵的获能培养基m16-bsa培养基中于37℃孵育12小时。
为了进行casa测量,将10μl样品放置在2x-cel载玻片(深度100mm,lejaproductsb.v.,netherlands)上,放置在cerostm的加热台(37℃)上。总共分析了10个自动选择的区域。
图4是说明精子的运动力(以vcl表示,μm/s)的百分比,即对于所测试的溶液(对照和0.2μm氯非铵)中的每一种,在获能12小时后,氯非铵对精子速度的影响的示意图。观察到用0.2μm氯非铵(“0.2μm氯非铵”)处理的精子比“对照”(即未处理的)精子具有更高的速度。
实施例2:氯非铵处理对冷冻的牛精子寿命和运动力的影响
这些测试是在牛精子上进行的。它们如图5和6所示。使用冷冻牛精子和体外成熟卵母细胞进行与实施例1类似的体外受精实验。
精子准备和运动力评估
通过射精获得牛精子。将射出的精液在optixcell中以1:1稀释。在34℃孵育10分钟后,然后将精液在optixcell中稀释至5700万个精子/ml的终浓度。optixcell是一种tris柠檬酸盐缓冲液,其含有从蛋黄卵磷脂、甘油中挤出的脂质体和由cee(directive88/407/cee)描述的抗生素。将稀释的精液缓慢冷却至4℃(在回火水浴中平衡3h至4h),填充0.25ml吸管,然后在可控速率冷冻机中以5℃/min的冷却速度从4℃冷冻至-10℃、以40℃/min的冷却速度从-10℃冷冻至-110℃、以15℃/min的冷却速度从-110℃冷冻至-140℃/min。然后将吸管储存在液氮中直至体外受精。
将吸管在37℃的水浴中解冻45s。在打开之前,将每根吸管用70°乙醇擦拭。在15ml锥形管中,将每根吸管的0.25ml解冻的精液在4mlsp-talp获能培养基下分层。
以mm计的sp-talp培养基组成如下:nacl(114.0);kcl(3.2);nah2po4(0.3);乳酸钠60%(10);mgcl2(0.5);hepes(10);nahco3(25);丙酮酸钠(1)和庆大霉素50μg/ml;用6mg/mlbsa(牛血清白蛋白)和2μg/ml肝素调节ph7.4。
将精子离心并重悬浮在含有或不含氯非铵(0.2μm)的4mlsp-talp获能培养基中。将精子在饱和湿度下于37℃保持0h或24h。
针对运动力,将精子与稀释在获能培养基中的0.2μm、0.5μm、1μm和5μm氯非铵在饱和湿度下于37℃孵育24小时。使用计算机辅助精液分析(casa分析)测量精子运动力。使用cerostm,hamiltonthornebioscience,usa进行casa分析。然后测量vcl(曲线速度)。
受精步骤
在孵育期结束时,将精子离心并将沉淀重悬浮于在管中的100μl剩余溶液中。测量精子浓度并将750000个精子细胞注射到包含浸于受精培养基中的卵母细胞的受精液滴(500μl)中。以mm计的ivf受精培养基组成如下:nacl114.0;kcl3.2;nah2po40.3;乳酸钠10.0;cacl22.0;mgcl20.5;nahco325.0;mem(极限必需培养基)氨基酸溶液50x(来自lifetechnologies)2%vol/vol。ivf培养基还包含6mg/ml的bsa、0.2mm的丙酮酸、50μg/ml的庆大霉素、23.5μg/ml的肝素、20μm/ml的青霉胺、10μm的亚牛磺酸和2μm/ml的肾上腺素。精子(1.5m/ml)和卵丘卵母细胞复合体(coc)在5%v/vco2的气体环境和饱和湿度下于38.5℃共培养48h,然后评估受精结果。
卵母细胞制备
屠宰后3h内收集牛卵巢并在25℃至35℃之间用抗生素(卡那霉素)覆盖的盐溶液(0.9%)中带回实验室。使用连接到填充有收集培养基(在m199培养基中的1%v/vpva(聚乙烯醇)、4.2mmnahco3、10mmhepes、2mm谷氨酰胺、50iu/ml青霉素和50μg/ml链霉素)的无菌5ml注射器的无菌18号针头,通过手动抽吸来从2-8mm的囊状卵泡中回收卵丘卵母细胞复合体(coc)。仅选择1级和2级coc用于进一步的处理。使30组coc在具有500μl卵母细胞成熟培养基的4孔板中、在5%co2气体环境和饱和湿度中于38.5℃成熟24h。
以mm计的m199培养基组合物是来自sigma-aldrich的被称为m0393的复合溶液,其包含无机盐(例如0.1396g/l的氯化钙、0.4g/l的氯化钾、8g/l的氯化钠);氨基酸(例如0.1g/l的l-谷氨酰胺和0.0668g/l的l-谷氨酸);维生素;以及其他成分。
卵母细胞成熟培养基是改良的m199培养基,其包含来自lifetechnologies的m199培养基earle’s盐复合溶液(参考31150-022)和2mm谷氨酰胺、0.2mm丙酮酸钠、0.1mm半胱胺、50μg/ml庆大霉素、10%v/vfbs(胎牛血清)和0.2μg/mlegf(表皮生长因子)。
受精评估和胚胎发育
受精后24小时从受精孔中取出卵母细胞,通过涡旋振荡处理2min以去除卵丘细胞,并通过收集培养基的培养皿洗涤3次,然后将推测的受精卵在4孔平板中用500μl覆盖有250μl平衡矿物油的胚胎培养基培养24小时,然后测量分裂卵母细胞的数量。培养基是来自momozawa等人,journalofreproductionanddevelopment,第57卷,第6期,681-689,2011的10%rd-mksom/aa。在受精后48h评估卵裂率,以及在第9天评估胚泡率。
以mm计的rd-mksom/aa培养基组成如下:nacl98.6;kcl2.5;cacl21.71;kh2po40.35;mgso40.2;丙酮酸钠0.3;乳酸钠3.0;nahco325;hepes10.0;l-谷氨酰胺+必需氨基酸和非必需氨基酸;胰岛素5μg/ml;转铁蛋白5μg/ml;亚硒酸钠5ng/ml;edta10μm硫酸地贝卡星65μg/ml,补充rd10%(v/v)和对应于rpmi和dubelcoo’smem的1:1混合物。
1.第一项测试涉及相对于不含氯非铵的对照培养基,受精前在含有0.2μm氯非铵的培养基中长时间孵育时牛获能精子使卵母细胞受精的能力。
2-细胞胚胎的发育一直持续到胚泡期。受精前精子孵育期为24小时。
培养基是补充有6mg/mlbsa和2μg/ml肝素的sp-talp培养基。
将精子在含有或不含氯非铵的sp-talp培养基中孵育24小时,然后加入包含卵母细胞的液滴中。授精后在48h时对2-细胞胚胎进行计数(n=3)。
第一个结果显示在图5a中,图5a是说明受精后在48h时获得的牛2-细胞胚胎相对于成熟卵母细胞的百分比的示意图,对于所测试的溶液中的每一种:在0h时的对照(“对照0h”)(解冻后立即使用精子)、在24h时的对照(“对照24h”)(对应于受精前精子在sp-talp中孵育24h)和在24h时的氯非铵(“氯非铵24h”)(对应于受精前精子在包含0.2μm氯非铵的sp-talp中孵育24h)。
第二个结果显示在图5b中,图5b是对于所测试的每种(相同)溶液:“对照0h”、“对照24h”和“氯非铵24h”,说明受精后第9天获得的胚泡相对于成熟卵母细胞的百分比的示意图。
这些结果表明,当用获能24小时的精子进行受精时,氯非铵改善了牛胚泡的产量。
2.通过测量精子运动力来确定获能精子的生存力。如实施例1.3进行运动力分析。
第一个结果显示在图6中,图6说明了对于所测试的溶液中的每一种:对照(“[0μm]”)、0.2μm氯非铵(“[0.2μm]”或“[0.2]”)、0.5μm氯非铵(“[0.5μm]”或“[0.5]”)、1μm氯非铵(“[1μm]”或“[1]”)和5μm氯非铵(“[5μm]”或“[5]”)的运动力(以vcl表示,μm/s),即精子速度,在casa之前将精子在获能培养基中孵育24h(图6a),并说明了对于所测试的溶液中的每一种“[0μm]”、“[0.2μm]”(或“[0.2]”)、“[0.5μm]”(或“[0.5]”)、“[1μm]”(或“[1]”)和“[5μm]”(或“[5]”)的总运动力(%)(图6b)。
如本领域技术人员所知,“总运动力”表示在任何方向上移动的精子的总百分比(vap>1μm/s)。
对于每种标准,观察到用0.2μm氯非铵、0.5μm氯非铵或1μm氯非铵处理的精子群具有比未处理(即对照)的精子群更高的速度。
实施例3:在精液制备过程中和在冷冻过程前添加的氯非铵对牛精子寿命的影响
为了尽可能接近可能的田间使用,在测试氯非铵改善受精能力之前将精子与氯非铵冷冻。测试了两种条件:在第一种条件中,在精子孵育期存在氯非铵,以及在第二种条件中,洗涤精子以去除氯非铵,以模拟雌性生殖道中可能出现的情况。
如下所述获得包含氯非铵的吸管。将牛射出的精液分为两部分,并1:1稀释在optixcell(第1部分)或含有0.2μm氯非铵的optixcell(第2部分)中。在34℃孵育10分钟后,然后将精液在optixcell(第1部分)或含有0.2μm氯非铵的optixcell(第2部分)中稀释至终浓度为5700万个精子/ml。如上所述将稀释的精液冷冻并储存在液氮中直至体外受精。
使用了两种类型的吸管:对照吸管和包含氯非铵的吸管。对于包含氯非铵的吸管,测试了两种条件:洗涤和不洗涤。洗涤培养基是用于牛精子处理的常用培养基sp-talp,其组成如上所述。对于“不洗涤”的条件,将精子与包含0.2μm氯非铵的sp-talp孵育。
洗涤程序的实验方案如下:
-对于在0h时的对照(标记为“对照0h”),解冻后,通过用sp-talp进行第一次洗涤来去除冷冻培养基,然后用sp-talp进行第二次洗涤,以及最后将精子注射到包含成熟卵母细胞的液滴中;
-对于在0h时含有氯非铵的冷冻培养基(标记为“氯非铵0h”),解冻后,通过用含有0.2μm氯非铵的sp-talp进行第一次洗涤来去除冷冻培养基,然后用含有0.2μm氯非铵的sp-talp进行第二次洗涤。以及最后将精子注射到包含成熟卵母细胞的液滴中。
-对于在24h或48h时的对照(分别标记为“对照24h”或“对照48h”),解冻后,通过用sp-talp进行第一次洗涤来去除冷冻培养基,然后在sp-talp中孵育24h或48h,以及最后用sp-talp进行第二次洗涤,然后注射到包含成熟卵母细胞的液滴中。
-对于在24h或48h时含有氯非铵的冷冻培养基,解冻后,通过用sp-talp进行第一次洗涤来去除冷冻培养基,然后在sp-talp中(标记为“洗涤氯非铵24h”或“洗涤氯非铵48h”)或在含有0.2μm氯非铵的sp-talp中进行24h或48h孵育(标记为“氯非铵24h”或“氯非铵48h”),以及最后用sp-talp进行第二次洗涤,然后立即注射到包含成熟卵母细胞的液滴中。
结果显示在图7中,图7说明了对于不同培养基和过程(如上面所解释的),24h和48h孵育条件中的每一种获得的受精后在24h时的2-细胞胚胎相对于成熟卵母细胞的百分比。
从这些实验中得出两个结论。第一,当存在氯非铵时,它对胚胎结局的积极作用持续了48小时。第二,在洗涤条件下,在24小时时仍然存在积极作用,尽管较低。但是,在孵育48小时后,这种作用不再存在。
实施例4:氯非铵(在精液制备过程中和在冷冻过程之前添加)对表现出足够曲线速度的精子亚群的牛精子运动力的影响
精子群在它们的速度方面表现出很大的差异,速度范围在每秒0μm至400μm之间。但是,只有表现出足够速度的精子才能穿过卵子周围的保护层,从而有能力使卵子受精。考虑到这一点,选择了表现出vcl>150μm/s的精子,并在对照条件下或在存在氯非铵时,在不同时间(0h和24h)测量它们的速度。
在测试精子运动力之前,将精子在不含氯非铵(对照)和含有氯非铵的情况下冷冻。在第二种情况下,在精子孵育期和获能期存在氯非铵。
如在上面实施例2中所描述的关于精子制备的段落获得对照吸管(即,不含氯非铵)。
如在上面实施例3中所描述的获得包含氯非铵的牛吸管。
将牛射出的精液分为两部分,并以1:1稀释在optixcell(第1部分)或含有0.2μm氯非铵的optixcell(第2部分)中。在34℃孵育10分钟后,然后将精液在optixcell(第1部分)或含有0.2μm氯非铵的optixcell(第2部分)中稀释至终浓度为5700万个精子/ml。如上所述将稀释的精液冷冻并储存在液氮中直至体外受精。
因此,使用了两种类型的吸管:对照吸管和包含氯非铵(0.2μm)的吸管。将吸管在37℃的水浴中解冻45s。打开之前,将每根吸管用70°乙醇擦拭。在15ml锥形管中将来自对照吸管的0.25ml解冻的精液在4mlsp-talp获能培养基下分层。在15ml锥形管中将来自氯非铵吸管的0.25ml解冻的精液在4mlsp-talp获能培养基下分层。
将精子离心并重悬浮于200μl含有或不含氯非铵(0.2μm)的sp-talp获能培养基中。将精子在饱和湿度下于37℃储存0h或24h。
选择表现出vcl>150μm/s的精子以及如上所述在对照条件下或在存在氯非铵的条件下使用casa测量它们的运动力。
结果显示在图8中,图8说明了氯非铵对牛精子运动力(以vcl表示,μm/s)的影响,对于所测试的溶液中的每一种(对照或0.2μm氯非铵),在casa评估之前将精子在获能培养基中孵育0h或24h,精子表现出足够的速度(vcl>150μm/s)。
在图8中,“ns”表示“无显著性”。
图8清楚地显示,在获能培养基中,在氯非铵存在24小时的情况下,vcl>150μm/s的精子亚群具有更高的平均速度。因此,在具有氯非铵的获能培养基中孵育24小时改善了该精子的运动力。
实施例5:奎尼丁处理对小鼠精子寿命的影响
测试了另一种钾通道抑制剂:奎尼丁。
该测试涉及小鼠精子使卵母细胞受精的能力,相对于不含奎尼丁的对照培养基,在受精前精子在含有奎尼丁的培养基中孵育。
对照培养基是包含精子的m16-bsa培养基(“对照”)。将其与还包含不同浓度(5μm奎尼丁(“5μm奎尼丁”)、10μm奎尼丁(“10μm奎尼丁”)、25μm奎尼丁(“25μm奎尼丁”)和100μm奎尼丁(“100μm奎尼丁”))的奎尼丁的相同培养基进行比较。
结果显示在图9中,图9说明了对于所测试的溶液中的每一种(如上面所解释的),由小鼠精子受精后24h时2-细胞胚胎相对于成熟卵母细胞的百分比。
观察到与25μm奎尼丁孵育12小时的精子比未处理(即对照)的精子具有更好的寿命。
- 还没有人留言评论。精彩留言会获得点赞!