一种牛支原体感染豚鼠的动物模型构建方法及其应用与流程
本发明属于动物模型构建技术领域,具体涉及一种牛支原体感染豚鼠的动物模型构建方法及其应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
牛支原体(mycoplasmabovis)感染肉牛或奶牛后可引起犊牛肺炎、关节炎和角膜结膜炎等疾病,是影响牧场犊牛成活率最主要的疫病之一,被认为犊牛呼吸道疾病的主要病因。自1961年美国人hale等首次从在患乳房炎奶牛的牛奶中分离出牛支原体后,牛支原体迅速扩散至世界各个国家和地区的牛群,对世界养牛业的健康发展造成了极大的威胁和严重的经济损失。2008年以来我国多地相继报道犊牛支原体肺炎,牛支原体感染现已呈全国性分布。犊牛感染牛支原体所致的牛支原体肺炎,由于该病常规药物疗效不佳,且无有效疫苗进行预防,因此给我国的养牛业造成了严重经济损失。
目前,牛支原体已成为国内外牛病学家的研究热点,但进展缓慢。同时,我国因缺乏商品化的牛支原体疫苗,无法有效控制牧场的牛支原体疫情。发明人发现,导致上述两种情况的一个重要原因是缺乏合适的动物模型用于基础研究和生物制品研发。目前,国内外仅有关于牛支原体兔动物模型的报道,而无牛支原体豚鼠动物模型的相关报道。相比兔动物模型,豚鼠动物模型具有试验技术和试剂配套齐全,个体小,易操作,饲喂难度小,成本低等优点。因此开发牛支原体豚鼠动物模型不仅可以更加深入研究牛支原体,阐明牛支原体的感染途径和致病机理,同时也将加快我国牛支原体疫苗的研发步伐,为解决我国牛支原体疫情奠定基础。
技术实现要素:
针对上述现有技术的不足,本发明一种牛支原体感染豚鼠的动物模型构建方法及其应用。本发明制备得到的豚鼠动物模型,其对牛支原体敏感期长达42天,同时有效模拟牛支原体感染犊牛肺炎症状,因而可用于牛支原体疫苗保护效果尤其是长期保护效果的评价,具有良好的实际应用之价值。
本发明是通过如下技术方案实现的:
本发明的第一个方面,提供一种牛支原体感染豚鼠的动物模型构建方法,所述构建方法包括:
将牛支原体感染豚鼠,获得感染牛支原体的豚鼠即构建牛支原体感染豚鼠动物模型。
其中,所述牛支原体为牛支原体(mycoplasmabovis)16m株,保藏于中国典型培养物保藏中心(地址:湖北省武汉市武昌珞珈山武汉大学),保藏日期为2019年4月4日,保藏号为cctccno:m2019235。
所述感染途径包括但并不限于滴鼻、腹腔、肺内和气管内注射;最优选为滴鼻,感染方法简单,可操作性强。
本发明的第二个方面,提供上述构建方法获得的牛支原体感染豚鼠动物模型。
本发明的第三个方面,提供上述构建方法和/或牛支原体感染豚鼠动物模型在评估牛支原体疫苗效力中的应用。
进一步的,所述应用具体方法包括:选择21日龄hartley品系豚鼠,注射牛支原体灭活疫苗进行免疫后,鼻腔接种牛支原体(mycoplasmabovis)16m株,构建牛支原体感染豚鼠动物模型进行评估。
进一步的,所述应用方法还包括:监测豚鼠是否出现被毛粗糙、体温升高精神萎靡、嗜睡甚至死亡,攻毒后剖检观察,并进行病理学评价,完成牛支原体感染豚鼠的对疫苗保护效果的评价。
本发明有益效果:本发明首次制备了牛支原体感染的豚鼠动物模型,该模型易于操作,配套的商品化检测方法成熟,对牛支原体的敏感期长达42天(豚鼠14日龄~55日龄),优于已报道的兔攻毒模型,可用于牛支原体疫苗保护效果尤其是长期保护效果的评价;该模型极大模拟了临床上犊牛感染牛支原体后在呼吸系统方面出现的病变,尤其是肺,且价格优势明显,动物易于获得,饲养管理方便,可解决本体动物牛攻毒过程中存在的经济成本高、操作难度大和配套设施复杂等问题,具有良好的实际应用之价值。
附图说明
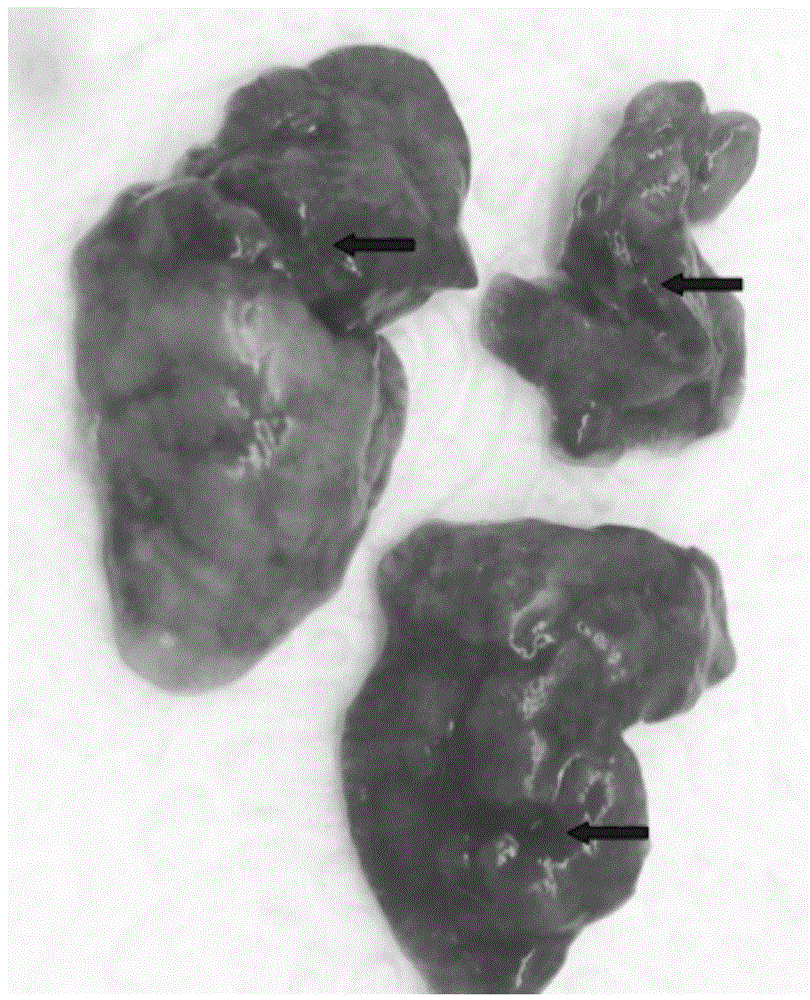
图1为本发明实施例1中21日龄豚鼠接种牛支原体后的剖检肺部病变图,箭头所指之处即豚鼠剖检肺部病变区域。
图2为本发明实施例1中攻毒组和对照组豚鼠肺脏中牛支原体的pcr检测结果图,其中,m道:2000bpdnamaker;n道:阴性对照;p道:阳性对照;1-5道:攻毒组豚鼠肺脏;6-10道:对照组豚鼠肺脏。
图3为本发明实施例1中21日龄豚鼠鼻腔接种牛支原体后肺部的病理变化图。
图4为本发明实施例2中牛支原体灭活疫苗对豚鼠的保护作用相关图,其中左图为免疫-攻毒组豚鼠肺部图,右图为对照-攻毒组豚鼠肺部图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本领域技术内的分子生物学的常规方法和条件,这种技术和条件在文献中有完整解释。
本发明的一个具体实施方式中,提供一种牛支原体感染豚鼠的动物模型构建方法,所述构建方法包括:
将牛支原体感染豚鼠,获得感染牛支原体的豚鼠即构建牛支原体感染豚鼠动物模型。
其中,所述牛支原体为牛支原体(mycoplasmabovis)16m株,保藏于中国典型培养物保藏中心(地址:湖北省武汉市武昌珞珈山武汉大学),保藏日期为2019年4月4日,保藏号为cctccno:m2019235。
本发明的又一具体实施方式中,所述感染途径包括但并不限于滴鼻、腹腔、肺内和气管内注射;最优选为滴鼻,感染方法简单,可操作性强。
本发明的又一具体实施方式中,豚鼠接种量不低于4.0×107cfu/只(优选为4.0×107cfu/只);
本发明的又一具体实施方式中,所述豚鼠为hartley品系豚鼠,体重为180g~200g;
经试验验证,本发明中55日龄以下豚鼠对牛支原体16m株均敏感。而14日龄以下豚鼠无法断奶,为避免母源抗体干扰,本发明选择14日龄以上豚鼠。因此,本发明的又一具体实施方式中,所述豚鼠为14~55日龄豚鼠,更优选21~42日龄断奶豚鼠,最优选为21日龄豚鼠。
本发明的又一具体实施方式中,提供上述构建方法获得的牛支原体感染豚鼠动物模型。
本发明的又一具体实施方式中,提供上述动物模型构建方法和/或动物模型在评估牛支原体疫苗效力中的应用。
本发明的又一具体实施方式中,所述应用具体方法为:选择21日龄hartley品系豚鼠,注射牛支原体灭活疫苗进行免疫后,鼻腔接种牛支原体(mycoplasmabovis)16m株,构建牛支原体感染豚鼠动物模型。
本发明的又一具体实施方式中,所述应用方法还包括:监测豚鼠是否出现被毛粗糙、体温升高、精神萎靡、嗜睡甚至死亡等临床症状,攻毒后14天剖检观察,并进行病理学评价,完成牛支原体感染豚鼠的对疫苗保护效果的评价。
本发明的又一具体实施方式中,所述牛支原体灭活疫苗的制备方法为常规方法,具体包括:将牛支原体(mycoplasmabovis)16m株接种至培养基扩大培养,收获培养物,将培养物灭活,灭活后加佐剂混合得到灭活疫苗。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。另外,实施例中未详细说明的分子生物学方法均为本领域常规的方法,具体操作可参看分子生物指南或产品说明书。
实施例1豚鼠感染实验
攻毒用牛支原体悬液:将牛支原体(mycoplasmabovis)16m株按照1:10比例接种于含20%马血清的pplo液体培养基(购自bd公司)中,置于37℃培养箱中,培养3~5天至培养液由红变黄后,12000g离心10min,收集牛支原体菌体。pbs重悬,10倍梯度稀释至第10管。分别从第6管、第7管、第8管、第9管和第10管吸取50μl悬液,均匀涂布到牛支原体固体培养平板上,置37℃,10%co2条件下培养5天后进行菌落计数。根据菌落计数结果制备所需浓度的牛支原体悬液。
选择21日龄断奶健康hartley品系豚鼠12只,随机分为攻毒组和对照组两组,豚鼠滴鼻接种滴度为1.0×108cfu/ml的牛支原体悬液,接种量为0.1ml,每个鼻孔0.05ml。正常饲养,观察豚鼠状态,发现接种病毒后7天豚鼠出现被毛粗糙、耳朵下垂等现象,同时测量豚鼠体温,待攻毒后14天进行剖检、组织培养、pcr检测和病理学观察。
结果显示,攻毒组豚鼠攻毒后,4只豚鼠(4/5)出现背毛直立,3只豚鼠(3/5)体温升高至40℃。攻毒组豚鼠剖检后显示,6只攻毒豚鼠的肺部均存在实变区域,如图1。剪取豚鼠肺脏研磨后,可分离到牛支原体,进一步提取dna,pcr检测显示牛支原体阳性,如图2所示。攻毒组肺切片图3显示,实变区域存在细支气管壁和肺泡壁增厚等肺间质增生情况,与牛支原体肺炎导致的实变病理特征相符;而对照组无上述表现。通过上述实验显示,牛支原体16m株可感染21日龄豚鼠,并导致与本体动物牛相似的病例变化,说明豚鼠可作为牛支原体感染的小动物模型。
需要说明的是,采用牛支原体标准株pg45(atccno:25523)通过滴鼻感染21日龄hartley品系豚鼠后肺部未发生无明显的实变,未能成功构建牛支原体感染豚鼠动物模型。另外,选择20日龄近交系2三色豚鼠作为攻毒模型,并未发现豚鼠肺脏出现明显的实变,未能成功构建牛支原体感染动物模型。因此,选择合适的菌株和豚鼠品系为成功构建动物模型的必要条件。
实施例2疫苗保护实验
将实施例1中制备的豚鼠模型用于评价牛支原体灭活疫苗的保护作用。
将牛支原体(mycoplasmabovis)16m株接种至培养基扩大培养,收获培养物,将培养物灭活,灭活后加佐剂混合得到灭活疫苗。经无菌检验和过敏原检测后,用于疫苗保护试验。
选择21日龄健康断奶豚鼠12只,随机分为免疫-攻毒组和对照-攻毒组两组。采用所得牛支原体灭活疫苗,对免疫-攻毒组豚鼠进行疫苗免疫,首次免疫后21天进行二次免疫1次,免疫剂量均为0.2ml/只。二次免疫后14天,参考实施例1所述,对免疫-攻毒组和对照-攻毒组豚鼠进行鼻腔接种攻毒,持续观察豚鼠的临床表现。观察豚鼠是否出现被毛粗糙、耳朵下垂、体温升高等临床特征,攻毒后14天进行剖检,观察肺部病变情况,并进行病理切片观察,完成牛支原体感染豚鼠的对疫苗保护效果的评价。
结果显示,免疫-攻毒组豚鼠剖检显示肺脏无明显实变,病理学观察显示肺泡结构完整,肺泡壁正常,气管壁与血管壁正常,无明显的病理学变化。对照-攻毒组豚鼠剖检显示肺部均存在不同程度的实变区域,病理学观察显示肺泡壁、气管壁和血管壁增厚,出现明显的间质性肺炎的病理学特征,如图4所示。
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!