一种胎源性成年癫痫动物模型的构建方法及其用途与流程
本发明涉及动物模型构建
技术领域:
,具体涉及一种胎源性成年癫痫动物模型的构建方法及其用途。
背景技术:
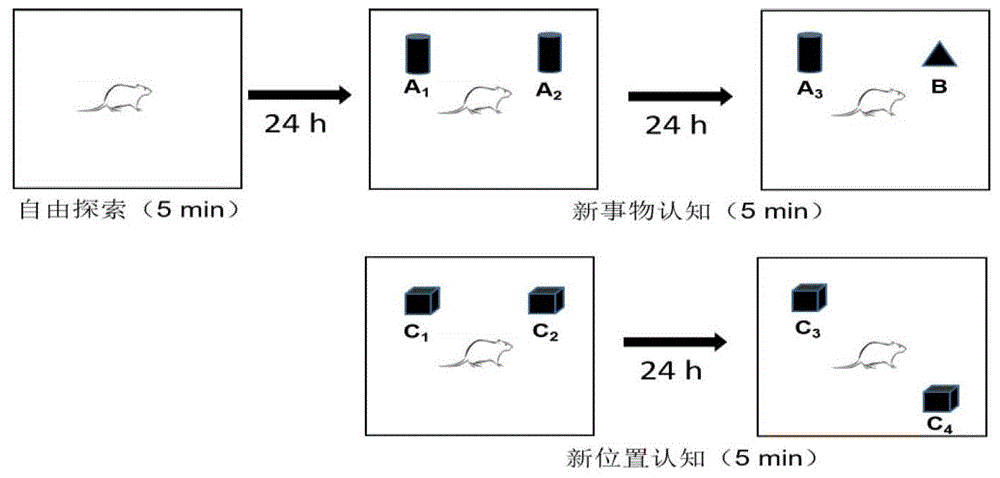
:癫痫是大脑神经元细胞群过度放电引起的阵发性脑功能障碍,是以反复痫样发作为特征的神经系统慢性疾病。流行病学调查发现,世界范围内癫痫的发病率约为0.5~1.5%,发病人数约为5000万人,婴幼年期、青春期和成年早期均为癫痫发病高峰期。我国癫痫发病率约为0.6%,尤以10~19岁男性居多。ollinevalainen通过对3,558例确诊癫痫患者死亡原因分析,发现脑癌(17%)、其他癌症(15%)、缺血性心脏病(11%)、脑血管疾病(10%)以及自杀(1.6%)均为癫痫患者致死原因。此外,癫痫患者通常伴有认知功能障碍、抑郁、焦虑、睡眠障碍等不同类型的并发症,且在没有已知的可导致死亡的病因下会发生不可预测性突然死亡。在神经系统疾病死因统计中,癫痫患者死亡率比普通人群要高3倍,仅次于脑血管病。由此可见,癫痫不仅严重影响了患者的生活质量,也给家庭及社会带来巨大的负担和压力,已成为迫切需要解决的公共卫生问题。目前部分患者使用现有的抗癫痫药物能有效控制发作,但仍有20~30%的癫痫患者治疗效果差,不能有效控制发作,称为药物难治性癫痫。颞叶癫痫(temporallobeepilepsy,tle)作为最常见的药物难治性癫痫,虽然大多到青春期或成年期才出现癫痫发作,但其发病机制被认为始于生命早期,存在发育起源。流行病学研究提示,孕期各种不良因素导致的胎儿宫内发育迟缓(intrauterinegrowthretardation,iugr),与出生后早期热性惊厥风险增加相关,且部分导致儿童期或成年期癫痫发作。以上提示,癫痫存在宫内起源,为胎源性成年癫痫。由于胎源性成年癫痫发作机制的复杂性以及不确定性,需要使用一种胎源性成年癫痫的动物模型来复制这种神经系统疾病中遇到的组织病理学,脑电图和行为学特征。胎源性成年癫痫模型的建立对于深入研究胎源性成年癫痫的发病机制以及探讨早期预警及药物防治靶标都具有十分重要的意义。癫痫的动物模型是指某特定物种具有外界诱发或遗传的癫痫发作倾向。因此,为了检测癫痫持续发作状态时脑电图的变化以及行为学特征,大量癫痫模型研究中使用诱导因素使其保持癫痫的持续发作。如腹腔给予匹罗卡品或者戊四氮构建tle动物模型;侧脑室注射海人酸建立tle动物模型等。在给予诱导因素后,动物保持癫痫持续发作的状态,有利于我们监测脑电波以及探究癫痫发作区域。现有的tle动物模型均为出生后期给予不同的诱导因素处理。这些造模方法虽能模拟癫痫发生的疾病表型,但给药的时间为出生后而非孕期,因而只能反映出生后的环境或药物造成的部分情绪异常,与胎源性成年癫痫发病机制方面存在较大的差异。因此,现有研究迫切需要建立与人类癫痫疾病高度相似的胎源性成年癫痫大鼠模型,探究其发病机制、早期预警及药物防治靶标,进一步造福人类。合成糖皮质激素(syntheticglucocorticoid,sgc)如地塞米松,由于其容易透过胎盘的特性,临床上广泛用于有早产倾向孕妇的预防性治疗。然而,流行病学调查发现,孕期应用地塞米松可致胎儿iugr。临床和动物实验证据表明,药物、环境毒物暴露、围产期脑损伤或长时间的热性惊厥均可损伤海马,可能是癫痫发生的始动因素。我们的前期研究发现,孕期地塞米松暴露可损伤胎鼠海马发育。技术实现要素:本发明目的之一在于提供一种胎源性成年癫痫动物模型的构建方法,所述方法简单,较好的模拟了胎源性成年癫痫的发作。本发明目的之二在于提供一种胎源性成年癫痫动物模型的构建方法构建的动物模型在研究胎源性癫痫的发生机制、确定癫痫临床早期预警及干预靶标中的应用,具有重要的临床意义。本发明实现目的之一采用以下技术方案:一种胎源性成年癫痫动物模型的构建方法,包含以下步骤:步骤1:取正常受孕的啮齿类动物,在孕9-20天期间给予0.2mg/kg.d地塞米松皮下注射,该过程中孕鼠自由饮水和饮食;步骤2:上述步骤1的给予地塞米松后的孕鼠自然生产f1子代仔鼠,选取窝仔数8~14只的窝仔,调整每窝雄、雌性仔鼠各4只进行哺乳喂养,4周后断奶,断奶后雄、雌分笼继续正常饮食饲养;步骤3:取上述步骤2的正常饮食至12周龄的f1子代仔鼠,按照体重以127mg/kg剂量腹腔注射氯化锂,16~24小时后按照体重以30mg/kg腹腔注射匹罗卡品诱导癫痫发作,经癫痫相关指标检测提示癫痫易感性,进一步于18周龄检测行为学相关指征提示焦虑、抑郁及认知障碍,判定得到所述胎源性成年癫痫动物模型。所述步骤3中,癫痫相关指标检测采用以下方法:取所述步骤2的正常饮食至11周龄的f1子代仔鼠,植入电极,1周后将大鼠称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg剂量腹腔注射匹罗卡品诱导癫痫发作,记录90分钟的脑电图、并拍摄癫痫行为学视频以检测癫痫相关指标。所述癫痫相关指标为癫痫发作等级、首次癫痫发作时间、癫痫活化百分比、代表性癫痫样活动痕迹。所述步骤3中,行为学相关指征检测采用以下方法:在所述步骤3中按照127mg/kg剂量腹腔注射氯化锂、16~24小时后按照体重以30mg/kg腹腔注射匹罗卡品诱导癫痫发作之后,于癫痫发作90分钟后按照体重以350mg/kg经腹腔注射10%水合氯醛终止癫痫发作,于癫痫发作6周后分别检测行为学相关指征。所述行为学相关指征为旷场实验、十字高架迷宫、新事物/位置认知、morris水迷宫。所述步骤1中,所述啮齿类动物为spf级wistar、sd大鼠或昆明种小鼠。本发明实现目的之二采用以下技术方案:一种胎源性成年癫痫动物模型的构建方法构建的动物模型在研究胎源性癫痫的发生机制、确定癫痫临床早期预警及干预靶标中的应用。本发明通过孕期地塞米松处理,f1子代仔鼠出生后常规正常饲养至12周龄以氯化锂-匹罗卡品腹腔注射诱导癫痫发作,为进行脑电图检测和拍摄癫痫行为学视频,取部分f1子代仔鼠常规正常饲养至11周龄时植入电极,于12周龄时称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg腹腔注射匹罗卡品,进行脑电图检测并拍摄癫痫行为学视频;另一部分f1子代仔鼠于12周龄称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg腹腔注射匹罗卡品,六周后进行旷场、十字高架迷宫、新事物/新位置认知、水迷宫行为学检测,通过f1子代出现癫痫发作等级增加、首次癫痫发作时间提前、癫痫活化百分比和高频率癫痫样放电增加,伴随焦虑、抑郁及认知障碍等人类癫痫一致的并发症典型特征,来判定得到胎源性成年癫痫动物模型。本方法是建立胎源性成年癫痫的有效方法,可应用于研究胎源性成年癫痫的发生机制、确定癫痫临床早期预警及干预靶标中。与现有技术相比,本发明具有以下优点:本发明通过孕期地塞米松暴露并对子代进行氯化锂-匹罗卡品诱导,检测癫痫相关指标进而建立了胎源性成年癫痫大鼠模型。本发明提供的胎源性成年癫痫动物模型的构建方法简单、稳定性好、可重复性高,较好的模拟了胎源性成年癫痫的发作;胎源性成年癫痫起源于宫内,发病于成年期,目前现有的动物模型均为出生后期给予不同的诱导因素处理建立的,虽能模拟癫痫发生的疾病表型,但给药的时间为出生后而非孕期,因而只能反映出生后的环境或药物造成的部分情绪异常,与胎源性成年癫痫发病机制方面存在较大的差异,而本发明提供的胎源性成年癫痫动物模型正是起因于宫内、发病于成年期的动物模型,能模拟成年后癫痫发生的疾病表型,对研究胎源性成年癫痫的发生机制,确定癫痫临床早期预警及药物防治靶标方面具有重要意义。附图说明图1为本发明实施例1中新事物/位置认知实验对象摆放示意图;图2为本发明实施例1中孕期地塞米松暴露胎鼠体重及iugr率;图中:a为体重,b为iugr率;图3为本发明实施例1中氯化锂-匹罗卡品诱导的孕期地塞米松暴露成年f1子代癫痫易感性的脑电图结果;图中:a为癫痫发作等级,b为首次癫痫发作时间,c为癫痫活化百分比,d为代表性癫痫样活动痕迹。具体实施方式通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。本发明不局限于以下实施例中wistar大鼠,任意spf级wistar、sd大鼠或昆明种小鼠均可。本发明以下实施例以雄性大鼠为代表例说明胎源性成年骨关节炎易感动物模型的构建方法及用途,雄性大鼠与雌性大鼠等同。【实施例1】胎源性成年癫痫动物模型的构建1、实验动物spf级正常健康wistar大鼠,购自湖北省疾病预防控制中心,动物许可证号:scxk(鄂)2012-2014。本研究获武汉大学医学部伦理委员会批准,并严格按照国际实验动物保护认证评估机构相关处理准则执行。实验动物饲养于屏障环境内,温度22~25℃,湿度50%,12小时昼夜交替。2、实验方法雄性wistar大鼠20只(体重260-300g),雌鼠wistar大鼠40只(体重200-240g)。自由饮水进食,适应性喂养7天后,按照雄:雌=1:2合笼,次晨阴道涂片,确定受孕大鼠,记为孕0天。受孕大鼠随即分为两组:对照组和地塞米松组,每组20只。自孕9~20天,地塞米松组每日经皮下给予地塞米松0.2mg/kg.d,对照组给予同等体积的蒸馏水,给药体积均为1ml/kg。各组孕鼠均自由正常饮食。饲料购自武汉市万千佳兴生物科技有限公司,许可证号:scxk(鄂)2011-0011。饲料配方与《中华人民共和国国家标准gb14924.3-2001》规定的小鼠大鼠配方饲料相同。部分孕鼠于孕20天麻醉处死,取雌、雄胎鼠称重,通过体重诊断iugr。剩余孕鼠自然生产,获得f1子代,以生产日作为出生后(postnatalday,pd)0天,pd1时每组选取窝仔数为8~14只的窝仔,调整每窝雄、雌性仔鼠各为4只进行哺乳喂养,以保证仔鼠均衡营养(n=10窝/组)。断奶后,在对照组和pde组(地塞米松组)的每窝仔鼠中随机选择2只雄性仔鼠进行以下实验检测,检测结果进行数据分析,计量资料采用均数±标准误(mean±sem)表示。采用student’st-test配对检验两个样本均数之间差异;采用单因素anova方差分析进行多个样本均数间的比较。p<0.05,表示差异具有统计学意义结果。癫痫相关指标检测:每窝1只仔鼠于pw11(11周龄)麻醉,用牙科钻钻开颅骨,暴露硬脑膜,利用脑立体定位仪定位海马内记录电极植入坐标:前囟后3.0mm、中线旁开2.2mm,深度3.0mm,用牙科水泥固定植入的脑电极。1周后将大鼠称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg剂量腹腔注射匹罗卡品,连接脑电仪器记录90分钟的脑电图,并拍摄癫痫行为学视频,癫痫发作等级根据racine癫痫行为分级标准进行,经腹腔注射10%水合氯醛(350mg/kg)终止癫痫发作。行为学相关指征检测:每窝另1只仔鼠于pw12(12周龄)称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg腹腔注射匹罗卡品。癫痫发作90分钟后经腹腔注射10%水合氯醛(350mg/kg)终止癫痫发作。继续饲养6周后进行旷场、十字高架迷宫、新事物/新位置认知、水迷宫行为学检测,上述实验完成后第2天,经麻醉处死动物。racine癫痫行为分级标准如下表1,表1racine癫痫行为分级标准分级行为学0级正常行为状态ⅰ级凝视、咀嚼、动须或头面部轻微颤动ⅱ级点头、甩尾、搔抓,湿狗样抖动ⅲ级一侧前肢局限性阵挛ⅳ级以上双前肢阵挛、伴后肢站立的全身强直性阵挛发作、跌倒3、检测指标及方法3.1癫痫相关指标检测(脑电图以及癫痫行为学视频拍摄)注射氯化锂-匹罗卡品后连接脑电仪器记录90分钟的脑电图,并拍摄癫痫行为学视频。脑电图数据使用labchart软件进行分析并使用racine量表评估癫痫发作等级。检测指标:①癫痫发作等级;②首次癫痫发作时间;③癫痫活化百分比;④高频率癫痫样放电。3.2行为学检测3.2.1旷场实验实验装置为100cm×100cm×50cm的无盖木箱方盒,四周和底面全部涂黑。根据smart3.0系统,自动将地面划分为16个方格。用酒精将方盒擦拭干净后,将大鼠置于木箱中心方格内,观察5分钟内大鼠的活性情况。观察指标:①周围运动距离(外周12个格子的运动距离);②中央运动距离(中央4个格子的运动距离);③周围运动时间;④外周运动时间。3.2.2十字高架迷宫实验开始前,用酒精将迷宫的四个臂擦拭干净。将大鼠放置于迷宫的两臂相交的中心,观察5分钟内大鼠的活动情况。观察指标:①开放臂运动时间;②封闭臂运动时间;③开放臂运动距离;④封闭臂运动距离。3.2.3新事物/位置认知实验装置为80cm×80cm×40cm的无盖木箱方盒,四周和底面全部涂黑。将大鼠置于木箱中心方格内,实验动物被允许进入木箱自由探索5分钟。24小时后,两个相同的对象(对象a1和a2;长方体)位于两个相邻的角落,离两侧边各20cm,实验动物进入木箱自由探索5分钟。在短期记忆识别测试后1.5小时,大鼠重置于木箱中心方格内,对旧对象(a3,圆柱体)和新对象(b,三角形)探索5分钟。探索的定义为嗅探(距离物体3~5cm)或用鼻子和/或前爪碰触物体。计算每只动物的探索指数,为tb/(ta3+tb)的比率(ta3=探索对象a3的时间;tb=探索对象b的时间)。24小时后,选择另外两个相同的对象(对象c1和c2;正方体),实验动物进入木箱自由探索5分钟。1.5小时后,大鼠重置于木箱中心方格内,在旧位置(c3)和新位置(c4)探索5分钟。计算每只动物的探索指数,为tc4/(tc3+tc4)的比率(tc3=探索对象c3的时间;tc4=探索对象c4的时间)。新事物/位置认知实验对象摆放如图1所示。3.2.4morris水迷宫固定好水迷宫站台,保证站台没于水面2~3cm,水温维持在22℃,第1~6天,从四个象限依次将大鼠面朝迷宫壁放入水中,观察其在90秒内的运动状态。第7天,从选定的一个象限将大鼠放入水中,观察其运动变化,随后撤去站台,继续观察其运动变化。实验结果计量资料采用均数±标准误(mean±sem)表示。采用student’st-test配对检验两个样本均数之间差异;采用单因素anova方差分析进行多个样本均数间的比较。p<0.05,表示差异具有统计学意义结果。4、实验结果4.1孕期地塞米松暴露成年子代在氯化锂-匹罗卡品诱导下癫痫易感性增加孕期地塞米松暴露可引起成年子代大鼠由氯化锂-匹罗卡品诱导的癫痫易感性增加,具体表现为:与对照组相比,地塞米松组子代癫痫发作等级增加(p<0.05,图3a)、首次癫痫发作时间提前(p<0.01,图3b)、癫痫活化百分比(p<0.05,图3c)和高频率癫痫样放电增加(图3d-3e)。4.2子代抑郁样情绪变化成年子代大鼠抑郁样情绪改变结果如下表2所示,与对照组相比,地塞米松组子代中心运动距离和中心运动时间显著减少(p<0.01,表2),但总运动距离、周边运动距离、周边运动时间等则无明显改变。实验结果说明,与对照组相比,氯化锂-匹罗卡品诱导癫痫发作6周后,地塞米松组子代即出现了抑郁样情绪改变倾向。表2旷场实验(mean±sem,n=10)4.3子代焦虑样情绪变化成年子代大鼠焦虑样情绪改变结果如下表3所示,与对照组相比,地塞米松组子代进入开放臂运动距离%和开放臂运动时间均显著降低(p<0.05,表3),进入闭合臂运动时间显著增加(p<0.05,表3),而总运动距离和进入闭合臂运动距离%则无明显改变。实验结果说明,与对照组相比,地塞米松组出现焦虑样情绪改变倾向。表3十字高架迷宫字高架迷宫(mean±sd,n=10)4.4子代学习记忆功能变化成年子代大鼠学习记忆功能改变结果如下表4和表5所示,对照组子代对新对象/位置探索时间显著高于旧事物(p<0.05,p<0.01,表4,表5),而地塞米松组子代对新对象/位置的探索时间无显著差别。此外,地塞米松组子代对新旧对象/位置的探索比例显著低于对照组(p<0.05,表4,表5)。实验结果说明,与对照组相比,地塞米松组子代出现学习记忆功能损伤。表4新事物认知(mean±sem,n=10)4.5子代空间认知功能变化成年子代大鼠空间认知功能变化结果如下表6所示。与对照组相比,地塞米松组子代隐蔽平台测试中的逃避潜伏期及运动距离均显著增加(p<0.05,表6),在探索测试中目标象限时间及跨越平台次数均显著减少(p<0.01,表7)。实验结果说明,与对照组相比,地塞米松组子代出现为明显的空间认知功能损伤。表6morris水迷宫隐蔽平台测试(mean±sem,n=10)本发明通过孕9-20天给予0.2mg/kg地塞米松处理,出生后f1子代常规正常饲养至11周植入电极,所有f1子代于12周以氯化锂-匹罗卡品腹腔注射,在整体水平观察孕期地塞米松暴露所致成年子代癫痫易感、脑电图改变,并于癫痫发作6周后进行行为学检测。发现子代癫痫发作等级增加、首次癫痫发作时间提前、癫痫活化百分比和高频率癫痫样放电增加,伴随焦虑、抑郁及认知障碍等人类癫痫一致的并发症典型特征,提示成功建立了胎源性成年癫痫模型,证实本发明造模方法稳定有效可靠,可重复性强。【实施例2】本发明胎源性成年癫痫动物模型在胎源性成年癫痫的发生机制研究、早期预警及干预靶标的应用1、按照本发明实施例1方法建立胎源性成年癫痫模型;2、检测宫内及出生后子代海马相关指标的变化确定胎源性成年癫痫的发生机制。3、利用本发明建立的胎源性成年癫痫模型确定癫痫临床早期预警及干预靶标。综上,本发明通过孕期地塞米松处理,f1子代仔鼠出生后常规正常饲养至12周龄以氯化锂-匹罗卡品皮下注射诱导癫痫发作。为进行脑电图检测和拍摄癫痫行为学视频,取部分f1子代仔鼠常规正常饲养至11周龄时植入电极,于12周龄时称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg腹腔注射匹罗卡品,进行脑电图检测并拍摄癫痫行为学视频;另一部分f1子代仔鼠于12周龄称重并按照127mg/kg剂量腹腔注射氯化锂,16~24小时后按照30mg/kg腹腔注射匹罗卡品,六周后进行旷场、十字高架迷宫、新事物/新位置认知、水迷宫行为学检测,通过f1子代出现癫痫发作等级增加、首次癫痫发作时间提前、癫痫活化百分比和高频率癫痫样放电增加,伴随焦虑、抑郁及认知障碍等人类癫痫一致的并发症典型特征,来判定得到胎源性成年癫痫动物模型。本方法是建立胎源性成年癫痫的有效方法,可用于研究胎源性成年癫痫作用机制、对确定癫痫临床早期预警及干预靶标具有重要意义。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1