一种低温及饮食节律调控诱导2型糖尿病动物模型的方法与流程
本发明涉及一种2型糖尿病动物模型的构建方法,尤其是通过低温环境及昼夜饮食节律调控快速诱导2型糖尿病动物模型的方法,属于生物医药技术领域。
背景技术:
糖尿病已成为21世纪全球最严重的公共卫生问题之一,其中绝大多数为2型糖尿病。2型糖尿病又称非胰岛素依赖型糖尿病,是因胰岛素分泌相对不足或靶细胞对胰岛素敏感性降低,引起糖、蛋白质、脂肪和继发的水、电解质代谢紊乱,以高血糖为主要标志的内分泌-代谢性疾病。临床主要表现为“三多一少”,“三多”指多尿、多饮、多食,“一少”指身体消瘦,兼有疲乏、烦渴等症状。研究表明当今社会2型糖尿病的高发病率与人类生活水平的提高、生活方式及行为(尤其是昼夜饮食)的改变密切相关,因此解析2型糖尿病的发病原因对2型糖尿病的早期诊断及防治具有重要意义。
目前的2型糖尿病模型主要由自发性2型糖尿病动物模型及实验性2型糖尿病动物模型构成,其中自发性2型糖尿病动物因其来源相对较少,饲养、繁殖条件要求高,动物昂贵等缺点,限制了其在科学研究中的应用和普及。实验性2型糖尿病动物模型是用高脂饮食、链脲菌素(streptozocin,stz)及四氧嘧啶等方法损伤胰脏或胰岛β细胞导致胰岛素缺乏,或用各种拮抗剂对抗胰岛素的作用,引起实验性糖尿病或实验性高血糖。此外,自发性高血压大鼠与2型糖尿病患者的早期病理生理基础都是胰岛素抵抗,因此在糖尿病机制研究和药物疗效评价中发挥重要作用。然而,这些动物模型的制作方法与人类2型糖尿病的发病存在明显差异,尤其不能揭示生活方式及行为的改变在2型糖尿病过程中的作用。
技术实现要素:
本发明所要解决的技术问题在于提供一种低温及饮食节律调控诱导2型糖尿病动物模型的方法,通过模拟生活方式及行为改变诱导2型糖尿病的动物模型,研究其发病机制,为2型糖尿病的早期诊断及防治提供新途径。
为解决上述技术问题,本发明采用的技术方案如下:
一种低温及饮食节律调控诱导2型糖尿病动物模型的方法,该方法是通过低温环境的调控结合喂养饲料饮食节律的改变,或者单独通过喂养饲料饮食节律的改变,诱导动物形成体重增加、高血脂、高血糖、高胰岛素血症及胰岛素抵抗为主要标志的2型糖尿病动物模型。
上述的低温及饮食节律调控诱导2型糖尿病动物模型的方法,具体说,所述的低温环境为低于动物适宜的环境温度,饮食节律改变为限时喂养一段时间后改变限时喂养的时段及时长。
前述的低温及饮食节律调控诱导2型糖尿病动物模型的方法,作为一种优选方案,所述的低温环境为16~25℃。
前述的低温及饮食节律调控诱导2型糖尿病动物模型的方法,作为一种优选方案,所述喂养的饲料采用高脂饲料或普通饲料。
前述的低温及饮食节律调控诱导2型糖尿病动物模型的方法,作为一种优选方案所述动物为大鼠、小鼠、裸鼠、家兔、豚鼠、猴子或猩猩等动物。
前述的低温及饮食节律调控诱导2型糖尿病动物模型的方法,作为一种优选方案,所述诱导的时间为10~20天。
低温及饮食节律调控诱导2型糖尿病动物模型的方法在糖尿病治疗中的应用。
上述的应用,可以将所述方法构建的糖尿病动物模型用于研发糖尿病的早期诊断试剂及方法。
上述的应用,也可以将所述方法构建的糖尿病动物模型用于发现新的治疗靶点及研发糖尿病的治疗药物。
上述的应用,还可以将所述方法构建的糖尿病动物模型用于开发针对糖尿病的其他治疗方法。
本发明的有益效果:申请人在实验研究中发现低温环境及昼夜饮食节律的改变可在10天左右的时间诱导大鼠体重增加、高血脂、高血糖、高胰岛素血症及胰岛素抵抗等2型糖尿病的主要标志。本发明通过“环境温度及昼夜饮食节律对大鼠体重及糖脂代谢成分的影响”实验以及“低温环境及昼夜饮食节律对大鼠肠道微生物多样性的影响”实验,证明低温环境及昼夜饮食节律的改变可以诱发大鼠的糖脂代谢紊乱及降低大鼠的肠道微生物丰度,符合2型糖尿病的早期症状,对于研究2型糖尿病的发病机制,寻找早期诊断的相关靶点及制定防治方法提供新途径及新思路。
本发明的优点在于:(1)本发明可以在较短时间(10天)诱导出2型糖尿病的早期症状。(2)本发明的构建方法简单,仅通过低温环境及昼夜饮食节律的改变,易于操作。(3)本发明构建的2型糖尿病动物模型更符合目前人类2型糖尿病的发病模式,可用于对于研究2型糖尿病的发病机制,寻找早期诊断的相关靶点,研发糖尿病的治疗药物及防治方法。
附图说明
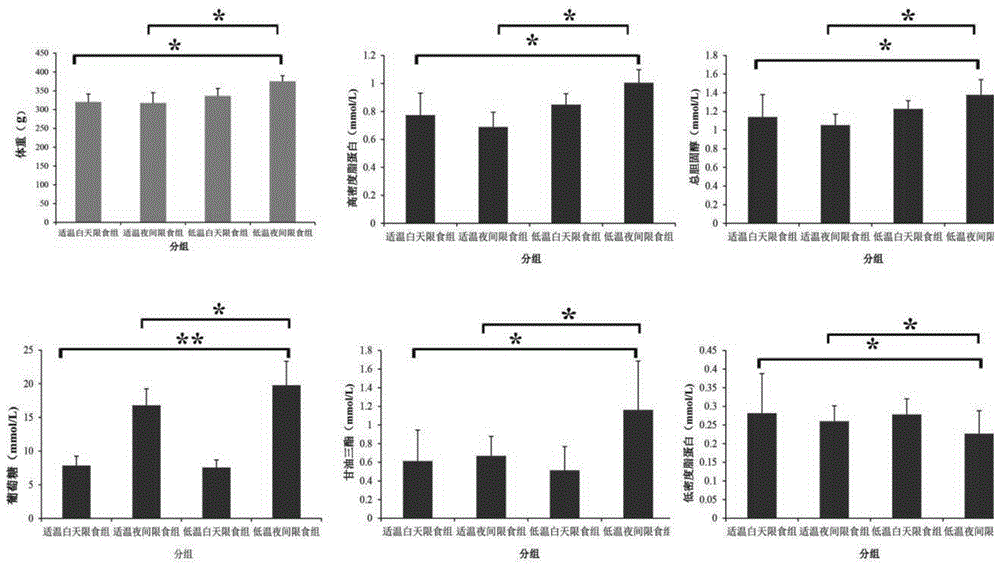
图1是本发明的低温环境及昼夜饮食节律对大鼠体重及糖脂代谢成分的影响示意图;
图2是本发明的低温环境及昼夜饮食节律对大鼠胰岛素及胰岛素抵抗系数(ir)的影响示意图;
图3是本发明的低温环境及昼夜饮食节律对大鼠肠道微生物丰度的影响示意图;
图4是本发明的低温环境及昼夜饮食节律对大鼠肠道门级微生物的影响示意图。
下面结合具体实施方式和附图对本发明作进一步的说明。
具体实施方式
实施例1:环境温度及昼夜饮食节律改变对大鼠体重及糖脂代谢成分的影响。
1.2型糖尿病动物模型的诱导
选用4周龄150g-200g雄性sd大鼠。每日12小时自然光照,适应性喂养1周。通过不同温度(高温30℃、适温25℃、低温16℃)、限时饮食(白天、晚上)、高脂饮食影响大鼠的饮食节律及结构,设置高温正常饲料白天限食组、高温正常饲料晚上限食组、适温正常饲料白天限食组、适温正常饲料晚上限食组、低温正常饲料白天限食组、低温正常饲料晚上限食组、高脂饮食白天限食组、高脂饮食晚上限食组共8组,观察大鼠的摄食量、体重等生理指标的变化,采用全自动生化分析仪检测血清中葡萄糖、甘油三酯、总胆固醇等指标。
结果显示适温条件下夜间饮食与白天大鼠饮食摄入量趋于稳定(见图1,*0.01<p≤0.05,**0.001<p≤0.01),高温及低温饲养环境下夜间饮食摄入量显著增加,高温白天限食组大鼠体重显著低于适温组,低温夜间限食组大鼠体重显著高于适温组。
2.生理指标及糖脂代谢成分的分析
分析了饮食昼夜节律变化及环境温度对血糖、血脂的影响(见图2,*0.01<p≤0.05,**0.001<p≤0.01),发现夜间限食组大鼠的血糖随环境温度的降低而显著增加(p≤0.01);白天限食组及夜间限食组的大鼠血清中总胆固醇及高密度脂蛋白随着环境温度增加;低温夜间限时饮食大鼠甘油三脂显著高于其他组(p≤0.05),但与环境温度并无显著相关性;大鼠血清中低密度脂蛋白与环境温度有一定的关联性,但结果不显著。暗示夜晚饮食下容易导致糖分在身体内无法正常代谢,低温环境的改变容易导致糖脂代谢的紊乱。
实施例2:低温环境及昼夜饮食节律对大鼠肠道微生物多样性的影响。
采用微生物多样性测序技术分析低温环境及昼夜饮食节律对大鼠肠道微生物多样性的影响,结果显示低温环境可显著降低大鼠肠道微生物丰度,其中低温夜间限食组大鼠微生物丰度最低(见图3,*0.01<p≤0.05,**0.001<p≤0.01),夜间限食饮食使肠道微生物中拟杆菌门(bacteroidetes)及放线菌门(actinobacteria)显著减少,增加厚壁菌门(firmicutes)及变形菌门(proteobacteria),其中低温夜间限食组中厚壁菌门的丰度远高于其他组(见图4,y轴表示某一分类学水平下的物种名,x轴表示物种不同分组中平均相对丰度,不同数字的柱子表示不同分组;最右边为p值,*0.01<p≤0.05,**0.001<p≤0.01),暗示了低温环境可能促进厚壁菌门微生物的定植。
结果:低温环境及夜间限时饮食可诱导sd大鼠形成体重增加、高血脂、高血糖等2型糖尿病的主要标志,且低温环境加上夜间饮食能够显著降低肠道微生物多样性,接近人类2型糖尿病的发病模式。
本发明的实施方式不限于上述实施例,在不脱离本发明宗旨的前提下做出的各种变化均属于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!