阿尔茨海默病模型非人动物及其制备方法与流程
1.本发明涉及通过使脑发育调节蛋白(drebrin)表达量减半而与以往的阿尔茨海默病模型非人动物相比更准确地反映阿尔茨海默病的病症的基因重组非人动物、该基因重组非人动物的制造方法、使用了该基因重组非人动物的用于治疗和/或预防阿尔茨海默病的药物的筛选方法。
背景技术:
2.近年来,作为痴呆症的主要原因的阿尔茨海默病的患者增加,成为社会关注的重大问题,期望能早期确立其治疗药或治疗方法。为了研究特定疾病的治疗药或治疗方法,通常使用其疾病的模型动物来进行分析。
3.在阿尔茨海默病患者的死后脑中观察到老年斑,已知其是“淀粉样蛋白β蛋白”的聚集体(淀粉样蛋白斑)。据报道,淀粉样蛋白β蛋白的沉积是在病理学上能确认到的最早期的病变,淀粉样蛋白β蛋白聚集并直接表现出神经细胞毒性。而且,目前被广泛接受的是:根据家族性阿尔茨海默病患者的基因分析,阿尔茨海默病的发病与淀粉样蛋白β蛋白的产生和蓄积的异常存在广泛的关联。这被称为淀粉样蛋白级联假说。由此,通过众多的研究已广泛接受淀粉样蛋白β蛋白是阿尔茨海默病的主要原因(非专利文献1)。
4.在阿尔茨海默病中,老化被认为是最大的风险因素(非专利文献2)。然而,如上所述,其主要原因是淀粉样蛋白β蛋白,因此,以往其模型小鼠是通过操纵基因的表达而开发的,该基因与促进淀粉样蛋白斑沉积等呈疾病特异性的显著病症直接相关(非专利文献1)。然而,由于即使促进淀粉样蛋白斑的沉积也不易引起作为临床症状的痴呆或作为阿尔茨海默病后期的病理影像的神经原纤维缠结,或者反而引起非常严重的病理变化,因此认为目前的阿尔茨海默病模型小鼠是未病状态模型小鼠或病症与人阿尔茨海默病本质上不同的模型小鼠。
5.本发明人们在世界上首次发现在发育过程的神经细胞中大量表达的作为肌动蛋白结合蛋白的脑发育调节蛋白(drebrin)(例如,参照非专利文献3及4),并且已经证明:该脑发育调节蛋白通过改变肌动蛋白纤维的性状来参与神经细胞的形态形成、尤其是突起形成(例如,参照非专利文献5~7);在发育过程中迁移的神经细胞存在于全部的细胞体和突起中,但成熟的神经细胞特异性地存在于棘结构中(例如,参照非专利文献8~10)。脑发育调节蛋白存在胚胎型(embryonic type)的脑发育调节蛋白e和成体型(adult type)的脑发育调节蛋白a这两种亚型(例如,参照非专利文献4),对成熟神经细胞的棘呈现特异性的脑发育调节蛋白a具有仅在神经细胞中表达的特征(例如,参照非专利文献9和10)。
6.本发明人们还报道在阿尔茨海默病等痴呆性疾病中树突棘的脑发育调节蛋白会在广范围内消失(非专利文献11)。近年来,本发明人们制作脑发育调节蛋白的完全敲除小鼠(dxko)和亚型转化机制缺损小鼠a(dako),并阐明了脑发育调节蛋白在突触可塑性中的作用。当研究对学习行为、突触可塑性的影响时,dako小鼠没有明显的脑形态异常,但观察到条件性恐惧记忆的障碍和海马突触可塑性的障碍(非专利文献12)。进而,还揭示出dxko
纯合小鼠在神经细胞迁移和嗅觉上出现异常(非专利文献13)。
7.现有技术文献
8.非专利文献
9.非专利文献1:齐藤贵志、西道隆臣“阿尔茨海默病的模型小鼠”,日药理志(folia pharmacol.jpn.)144,250-252,2014
10.非专利文献2:a ging cell.17,e12 802,2018
11.非专利文献3:j.neurochem.44,1210-1216,1985
12.非专利文献4:j.biochem.117,231-236,1995
13.非专利文献5:j.neurosci.res.38,149-159,1994
14.非专利文献6:exp.cell res.215,145-153,1994
15.非专利文献7:j.biol.chem.269,29928-29933,1994
16.非专利文献8:j.neurosci.15,7161-7170,1996
17.非专利文献9:dev.brain res.29,233-244,1986
18.非专利文献10:brain res.413,374-378,1987
19.非专利文献11:j neurosci.res.43(1),87-92,1996
20.非专利文献12:neuroscience.165(1),138-50,2010
21.非专利文献13:eur.j.neuroscience,46,2214-2228,2017
技术实现要素:
22.发明所要解决的技术问题
23.如上所述,目前的阿尔茨海默病模型小鼠(其是通过操纵与促进淀粉样蛋白斑沉积等呈疾病特异性的显著病症直接相关的基因的表达而开发的)被认为是未病状态的模型小鼠或病症与人阿尔茨海默病本质上不同的模型小鼠。本发明是鉴于上述的情况而完成的,其目的在于,通过开发更准确地反映阿尔茨海默病的病症的基因重组非人动物,从而有助于疾病机制的阐明或创新药的研究。
24.用于解决技术问题的手段
25.本发明人们通过针对迄今为止的脑发育调节蛋白敲除小鼠(dxko)的研究,发现:在完全敲除脑发育调节蛋白时会导致与记忆、学习相关的突触可塑性出现异常,但除脑发育调节蛋白以外的各种突触功能蛋白的表达量没有明显变化(非专利文献13),对于行为异常,除嗅觉相关行为以外,也未检测出显著变化。本发明人们着眼于对于人而言脑中的脑发育调节蛋白从20岁左右开始逐渐减少且到60岁大致减半(参照j neuropathol exp neurol.1999jun;58(6):637-43),经反复潜心研究,结果想到,在如呈现在60岁以上的高龄者中那样脑发育调节蛋白减半时,有可能表现出与完全敲除脑发育调节蛋白不同的、反映出老化的表型。因此,制作杂合敲除脑发育调节蛋白基因的动物并进行了分析,结果与预期相反地观察到在完全敲除脑发育调节蛋白基因的dxko小鼠中未出现过的突触异常、行为异常。因此,本发明人们考虑是否能够通过使目前使用的阿尔茨海默病模型小鼠的脑发育调节蛋白的量减半来制作具有老化这一阿尔茨海默病的最大风险因素的模型动物,通过使5xfad小鼠(具有5个家族性阿尔茨海默病基因的小鼠)和脑发育调节蛋白敲除小鼠(纯合)交配,制作杂合有5xfad基因和脑发育调节蛋白基因(+/-)的小鼠(5xfad/dxko
+/-)。将所获
得的小鼠中的淀粉样蛋白β的量和psd-95蛋白的量进行比较,结果发现:与5xfad小鼠相比,交配得到的小鼠更促进淀粉样蛋白β的蓄积,反之,psd-95显著减少。本发明是基于这些见解来完成的。
26.即,本发明涉及以下内容。
27.[1]一种基因重组非人动物,其特征在于,所述基因重组非人动物杂合敲除了作为基础的阿尔茨海默病模型非人动物的脑发育调节蛋白基因。
[0028]
[2]根据上述的[1]所述的基因重组非人动物,其特征在于,所述基因重组非人动物为脑发育调节蛋白a和脑发育调节蛋白e的杂合敲除体。
[0029]
[3]根据上述的[1]或[2]所述的基因重组非人动物,其特征在于,作为基础的阿尔茨海默病模型非人动物是伴有脑中淀粉样蛋白β蓄积的阿尔茨海默病模型非人动物。
[0030]
[4]根据上述的[1]至[3]中任一项所述的基因重组非人动物,其特征在于,作为基础的阿尔茨海默病模型非人动物是阿尔茨海默病模型小鼠。
[0031]
[5]根据上述的[4]所述的基因重组非人动物,其特征在于,阿尔茨海默病模型小鼠是5xfad小鼠。
[0032]
[6]一种制作使阿尔茨海默病发病的基因重组非人动物的方法,其特征在于,使作为基础的阿尔茨海默病模型非人动物与脑发育调节蛋白基因敲除非人动物进行交配。
[0033]
[7]一种用于治疗和/或预防阿尔茨海默病的药剂的筛选方法,其特征在于,包括以下的步骤(a)和步骤(b),
[0034]
步骤(a),对上述的[1]至[5]中任一项所述的基因重组非人动物施用受试物质;
[0035]
步骤(b),评价针对阿尔茨海默0病的治疗和/或预防效果。
[0036]
发明效果
[0037]
根据本发明,通过将脑发育调节蛋白减半,能够容易地实现在小鼠等短寿命模型动物中难以实现的因突触老化引起的脆弱性,通过使以往的模型小鼠(其为需要老化的疾病模型小鼠)与脑发育调节蛋白敲除小鼠交配来得到脑发育调节蛋白杂合敲除小鼠,从而能够制作具有老化风险的疾病模型小鼠。
附图说明
[0038]
图1的a为表示实施例1的脑发育调节蛋白敲除(dxko)小鼠的制作方法的概要的图。b为表示为了分选实施例1的dxko纯合小鼠和dxko杂合小鼠而进行基因分型得到的结果的图。
[0039]
图2为表示通过蛋白质印迹对实施例2的野生型(wt)、dxko杂合小鼠(dxko
+/-)、dxko纯合小鼠(dxko-/-)的脑发育调节蛋白表达量进行分析得到的结果的图。
[0040]
图3为表示对实施例3的野生型(wt)、dxko杂合小鼠(het)、dxko纯合小鼠(ko)的存活神经细胞数、树突长度、脑发育调节蛋白的集成影像数(脑发育调节蛋白簇的总数、脑发育调节蛋白簇密度)进行测定得到的结果的图。
[0041]
图4为表示对实施例4的野生型和dxko杂合小鼠(杂合型)的nmda受体活性进行分析得到的结果的图。
[0042]
图5为表示对实施例6的野生型(wt)、dxko杂合小鼠(het)、dxko纯合小鼠(ko)进行转棒疲劳试验(rotor-rod test)得到的结果的图。
[0043]
图6的a为实施例7中使用的y字型迷宫。b为表示对实施例7的野生型(wt)、dxko杂合小鼠(杂合型)、dxko纯合小鼠(纯合型)的行为变化进行分析得到的结果的图。自主运动的减少通过探索行为的减少来评价,空间工作记忆的减少通过交替反应的减少来评价。
[0044]
图7为表示通过蛋白质印迹对实施例9的5xfad/dxko
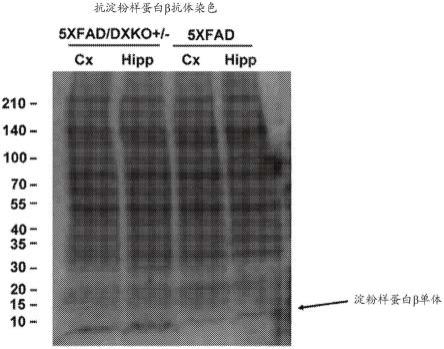
+/-小鼠和5xfad小鼠的脑中淀粉样蛋白β蓄积进行比较得到的结果的图。
[0045]
图8为表示通过蛋白质印迹对实施例9的5xfad/dxko
+/-小鼠和5xfad小鼠的脑中psd95表达进行比较得到的结果的图。
具体实施方式
[0046]
本发明涉及一种基因重组非人动物,其特征在于,所述基因重组非人动物杂合敲除了作为基础的阿尔茨海默病模型非人动物的脑发育调节蛋白基因(以下,称作“本发明的基因重组非人动物”)。此处,“脑发育调节蛋白基因”具有两个主要亚型(作为胚胎型亚型的脑发育调节蛋白e和作为成体型亚型的脑发育调节蛋白a),这两个亚型是由来自单个脑发育调节蛋白基因的可变剪接(alternative splicing)产生的肌动蛋白结合蛋白。脑发育调节蛋白e和脑发育调节蛋白a的区别点在于有无ins2序列(46个氨基酸残基),在脑发育调节蛋白a中,分子中插入有ins2序列。
[0047]
在本说明书中,“杂合敲除了作为基础的阿尔茨海默病模型非人动物的脑发育调节蛋白基因”是指敲除了用作基础的阿尔茨海默病模型非人动物的、同源染色体上的一个脑发育调节蛋白基因。其结果,在本发明的基因重组非人动物中,由于同源染色体上的一个脑发育调节蛋白基因被敲除,因此脑发育调节蛋白的表达并未完全丧失,但相较于作为基础的阿尔茨海默病模型非人动物而言有所降低。本发明的基因重组非人动物优选为作为基础的阿尔茨海默病模型非人动物的、脑发育调节蛋白a和脑发育调节蛋白e两者被杂合敲除的基因重组非人动物,与作为基础的阿尔茨海默病模型非人动物相比,可以更准确地反映阿尔茨海默病的病症,例如脑中淀粉样蛋白β蓄积增强等。本发明的基因重组非人动物与作为基础的阿尔茨海默病模型非人动物相比更准确地反映阿尔茨海默病的病症的原因尚不明确,但认为这是因为能够通过使脑发育调节蛋白的量减半来使之具有老化这一阿尔茨海默病的最大风险因素。因此,本发明的基因重组非人动物只要脑发育调节蛋白的表达量低于作为基础的阿尔茨海默病模型非人动物的基因重组非人动物即可,可以替代杂合敲除或与杂合敲除一同使用基因敲除等已知的基因表达量的调节方法来降低脑发育调节蛋白的表达量。
[0048]
在本发明中,对于作为基础的阿尔茨海默病模型非人动物而言,可列举使淀粉样蛋白β的前体蛋白(amyloid precursor protein,app)过表达的模型非人动物、在app基因中导入了阿尔茨海默病的家族性突变的模型非人动物等伴有淀粉样蛋白β蓄积的阿尔茨海默病模型非人动物。其中,作为非人动物,可列举小鼠、大鼠、兔子、豚鼠、仓鼠等,其中优选小鼠等啮齿类动物。对于作为基础的阿尔茨海默病模型非人动物而言,可使用例如alzforum网站的数据库(https://www.alzforum.org/databases)中记载的阿尔茨海默病模型非人动物,具体而言,可例示tg2576、app23、pdapp、j20、appps1、app/ps1δe9、tgcrnd8、3xtg、5xfad、app/ps1-dki、app
nl-f-ki、app
nl-g-f-ki等模型小鼠,但不限定于该数据库中记载的阿尔茨海默病模型非人动物。另外,在一个实施方式中,作为基础的阿尔茨海
默病模型非人动物不包含脑发育调节蛋白a和/或脑发育调节蛋白e的敲除体,优选不包含脑发育调节蛋白a的敲除体。
[0049]
在本发明的基因重组非人动物中,脑发育调节蛋白a和/或脑发育调节蛋白e、优选脑发育调节蛋白a和脑发育调节蛋白e两者的表达量是指用作基础的阿尔茨海默病模型非人动物的90%以下、80%以下、70%以下、60%以下、或55%以下,且为10%以上、20%以上、30%以上、40%以上、或45%以上。具体而言,脑发育调节蛋白的表达量优选为作为基础的阿尔茨海默病模型非人动物的10%~90%、20%~80%、30%~70%、40%~60%、或45%~55%。在优选的实施方式中,在本发明的基因重组模型非人动物中,脑发育调节蛋白基因并未被完全敲除。另外,上述的脑发育调节蛋白的表达量的降低优选为脑中表达量的降低,可以通过以下方法来判定,即,将脑匀浆在丙烯酰胺凝胶中进行电泳,并转印到聚偏氟乙烯(pvdf)膜上,然后用脑发育调节蛋白抗体进行染色,并比较条带的浓度。
[0050]
作为杂合敲除脑发育调节蛋白基因的方法,例如,可列举使作为基础的阿尔茨海默病模型非人动物与脑发育调节蛋白基因敲除非人动物交配的方法。其中,作为脑发育调节蛋白基因敲除非人动物,可以使用杂合体或纯合体中的任一种,但是,在使用纯合体时,不需要从通过交配产生的非人动物中选拔杂合敲除体的步骤,故而优选。另外,在本发明中,通过使脑发育调节蛋白基因敲除非人动物与作为基础的阿尔茨海默病模型非人动物交配一次,可制作杂合有阿尔茨海默病基因突变的基因重组模型非人动物,通过使脑发育调节蛋白基因敲除非人动物与作为基础的阿尔茨海默病模型非人动物交配两次,可制作纯合有阿尔茨海默病基因突变的基因重组模型非人动物。使作为基础的阿尔茨海默病模型非人动物与脑发育调节蛋白基因敲除非人动物交配获得的后代的基因型可使用已知的基因分型方法来确定,可使用例如dna测序、sscp(single strand conformation polymorphism,单链构象多态性)法、rflp(restriction fragment length polymorphism,限制性酶切片段长度多态性)法、pcr(polymerase chain reaction,聚合酶链反应)法、aflp(amplified fragment length polymorphism,扩增片段长度多态性)法、aso(allele specific oligonucleotide,等位基因特异的寡核苷酸)探针法、检测与dna微阵列或dna磁珠的结合的方法等。利用上述方法获得的本发明的基因重组模型非人动物例如可以通过进一步与作为基础的阿尔茨海默病模型非人动物交配、并利用上述的基因分型方法分选具有所需基因型的后代来进行继代培养。
[0051]
上述的脑发育调节蛋白基因敲除非人动物例如可通过使包含脑发育调节蛋白基因的外显子3的区域缺失来制作。作为用于使脑发育调节蛋白基因的一部分缺失的方法,可使用已知的任意方法,其中,来源于噬菌体p1的cre-loxp系统能够脑内部特异性地导入突变,可诱发突触的成熟障碍(突触脆弱性),因此可优选用于制作本发明的基因重组非人动物。代替上述的cre-loxp系统,还可以使用来源于出芽酵母(saccharomyces cerevisiae)的flp-frt系统、来源于酱油酵母(zygosaccharomyces rouxii)的r-rs系统、来源于噬菌体mu的gin-gix系统。
[0052]
本发明的基因重组非人动物对于阿尔茨海默病的发病机制的分析是有用的。而且,本发明的基因重组非人动物可用于阿尔茨海默病的治疗用和/或预防用药剂的筛选。作为进行上述筛选的方法,可列举包括以下步骤的方法:步骤(a),对本发明的基因重组非人动物施用受试物质;以及步骤(b),评价针对阿尔茨海默病的治疗和/或预防效果。作为上述
步骤(b)的评价阿尔茨海默病的治疗效果的步骤,可例示如下方法,即,对表现出阿尔茨海默病的症状的本发明的基因重组非人动物施用受试物质,并以脑中淀粉样蛋白β蓄积、psd-95蛋白的量、突触的形态或功能、空间记忆或空间工作记忆能力、协调运动或运动学习作为指标,来判定阿尔茨海默病的治疗效果。另外,作为上述步骤(b)的评价阿尔茨海默病的预防效果的步骤,可例示如下方法,即,对表现出阿尔茨海默病的症状之前的本发明的基因重组非人动物施用受试物质,并以脑中淀粉样蛋白β蓄积、psd-95蛋白的量、突触的形态或功能、空间记忆或空间工作记忆能力、协调运动或运动学习作为指标来,判定阿尔茨海默病的发病预防效果。
[0053]
以下,通过实施例来更具体地说明本发明的敲除小鼠的制作方法,但本发明的技术范围不限定于这些例示。
[0054]
实施例1
[0055]
1.脑发育调节蛋白敲除(dxko)小鼠的制作
[0056]
dbn1基因的外显子3(ggctctgtacacatacgaggatggctcagatgacctcaagcttgcagcgtcaggag;序列号1)缺失的dxko小鼠是通过脑发育调节蛋白flox小鼠与tlcn-cre小鼠(fuse et al.,biochem biophysres commun.2004jun 4;318(3):665-72)交配来制作的。在图1的a中示出制作方法的概要。以下,具体描述制作方法。
[0057]
通过pcr来克隆c57bl/6j小鼠的脑发育调节蛋白基因,在外显子3的168个碱基上游插入loxp,在318个碱基下游插入被frt序列夹持的新霉素(neo)抗性基因(pkg-neo)并且在接下来的24个碱基下游插入另一个loxp,且在5’端插入用于阴性分选的白喉毒素a基因(dt),由此制作靶向载体。通过电穿孔法(electroporation),向在c57bl/6n小鼠中建立的es细胞(renka)导入靶向载体,并分离出在g418存在下存活并增殖的es克隆。通过dna印迹(southern blot),分选出在分离的es克隆中靶向载体被准确地同源重组的部分。从所获得的重组es细胞中除去neo抗性基因,将该es细胞显微注射至来源于icr系小鼠的桑椹胚中,将其移植到假妊娠的代孕母体子宫内,获得嵌合小鼠。在所获得的嵌合小鼠中,将高比例地含有来源于es细胞的体细胞的嵌合个体和野生型c57bl/6n小鼠作为亲本,获得具有重组基因的脑发育调节蛋白flox小鼠。脑发育调节蛋白flox小鼠于2019年9月27日保藏于国立研究开发法人理化学研究所生物资源研究中心实验动物开发室(日本茨城县筑波市高野台3-1-1)(保藏号:rbrc10925;c57bl/6n-dbn1《tm2.1shira》,dxko-flox)。
[0058]
将所获得的脑发育调节蛋白flox小鼠和tlcn-cre小鼠作为亲本,并使它们交配,从而获得了被两个loxp夹持的区域缺失的小鼠的杂合个体(dxko杂合小鼠)。使所获得的dxko杂合小鼠相互交配,获得dxko纯合个体(dxko纯合小鼠)。通过基于pcr的基因分型进行dxko纯合小鼠和dxko杂合小鼠的分选(图1的b)。如图1的b所示,通过pcr将夹持外显子3的区域(图1的a中被箭头夹持的区域)扩增并进行了电泳,结果在dxko纯合小鼠中仅外显子3缺失的500bp的片段被扩增,在dxko杂合小鼠中外显子3缺失的500bp的片段和包含外显子3的880bp的片段被扩增。
[0059]
实施例2
[0060]
2.dxko小鼠的脑发育调节蛋白表达量的分析
[0061]
将野生型(wt)、dxko杂合小鼠(dxko
+/-)、dxko纯合小鼠(dxko-/-)各自的大脑皮层用sds-样品缓冲液进行均质化,热处理后,将湿重量为100μg和50μg的量的匀浆在丙烯酰胺
凝胶中进行电泳,并转印到pvdf膜上,然后使用脑发育调节蛋白抗体(m2f6杂交瘤上清(shirao and obata,1986;非专利文献9)、rrid:ab_2532045)进行检测。另外,使用β-肌动蛋白作为上样对照(loading control),用抗肌动蛋白抗体(sigma-aldrich a5441,sigma-aldrich公司制)进行检测。
[0062]
将结果示于图2中。在dxko纯合小鼠中未发现脑发育调节蛋白表达,相对于此,在dxko杂合小鼠中检测到野生型的一半左右的脑发育调节蛋白表达。
[0063]
实施例3
[0064]
3.dxko小鼠的神经细胞观察
[0065]
在96孔板上培养野生型(wt)、dxko杂合小鼠(het)、dxko纯合小鼠(ko)的海马神经细胞,在培养第21天进行固定,使用脑发育调节蛋白抗体(m2f6杂交瘤上清(shirao and obata,1986;非专利文献9),rrid:ab_2532045)、抗map2抗体(sigma-aldrich m4403,sigma-aldrich公司制)进行免疫细胞染色,并且使用dapi进行核染色,然后使用in cell analyzer 2200(ge healthcare公司制)进行拍摄。使用in cell developer toolbox v1.9(ge healthcare公司制),通过hanamura等人的方法(hanamura et al.,j pharmacol toxicol methods.2019jul 2:106607.doi:10.1016/j.vascn.2019.106607)对存活神经细胞数、树突长度、脑发育调节蛋白的集成影像数(脑发育调节蛋白簇的总数、脑发育调节蛋白簇密度)进行了自动分析。
[0066]
将结果示于图3中。在野生型(wt)、dxko杂合小鼠(het)、dxko纯合小鼠(ko)的神经细胞中,存活率、突起的生长速度没有变化,但是,对于脑发育调节蛋白的集成影像数,在dxko杂合小鼠中变为约一半,在完全敲除了脑发育调节蛋白的dxko纯合小鼠中变为零。
[0067]
实施例4
[0068]
4.nmda受体活性的分析
[0069]
使用96孔板,将野生型和dxko杂合小鼠(杂合型)的冷冻小鼠海马神经细胞培养3周之后,用50μm谷氨酸处理10分钟后进行固定。用脑发育调节蛋白抗体(m2f6杂交瘤上清(shirao and obata,1986;非专利文献9)、rrid:ab_2532045)检测脑发育调节蛋白簇数。按照hanamura等人(hanamura et al.,j pharmacol toxicol methods.2019jul 2:106607.doi:10.1016/j.vascn.2019.106607)和mitsuoka等人(j pharmacol toxicol methods.2019may 10:106583.doi:10.1016/j.vascn.2019.106583)的方法,使用in cell analyzer 2200(ge healthcare公司制)进行照片拍摄和分析。
[0070]
将结果示于图4中。nmda受体活性在野生型和杂合型中均得以保持,但与野生型相比,杂合型中显示出活性的减弱。
[0071]
实施例5
[0072]
5.棘稳定性的分析
[0073]
5-1野生型与dxko纯合小鼠的比较
[0074]
为了比较野生型(wt)与dxko纯合小鼠(homo)的小鼠的棘稳定性,针对与在thy-1启动子的下游表达yfp的转基因小鼠交配而制作的小鼠(35~57周龄),在采用三种混合麻醉药的深度麻醉下应用薄头盖骨(thin skull)法(即,将头盖骨削薄来制作观察窗),使用多光子激发激光扫描型显微镜(fvmpe-rs,olympus公司制),对从大脑新皮层体感区的主要5层的锥体神经细胞延伸的尖端树突中的一层树突棘进行了观察。它们基本上基于
takatsuru等人的方法(brainres.2009 oct 19;1294:45-51)来进行。首次观察后,在6小时后再次观察,对在6小时内发生的棘的新生、消失进行了研究,结果揭示棘的稳定性无差异(表1)。
[0075]
[表1]
[0076]
6小时后棘的新生棘的消失wt2.70%4.30%homo2.70%4.80%
[0077]
5-2野生型与dxko杂合小鼠的比较
[0078]
为了比较野生型(wt)与dxko杂合小鼠(hetero)的小鼠的棘稳定性,针对与在thy-1启动子的下游表达gfp的转基因小鼠交配而制作的小鼠,在采用氯胺酮/甲苯噻嗪混液的深度麻醉下应用薄头盖骨(thin skull)法,使用多光子激发激光扫描型显微镜,对从大脑新皮层体感区的主要5层的锥体神经细胞延伸的尖端树突中的一层树突棘进行了观察。它们也基于上述的takatsuru等人的方法来进行。针对这些小鼠(9~17周龄),对在1周内出现的棘的新生、消失进行了研究,结果判定,在dxko杂合小鼠中以高比例发生棘的新生、消失,揭示了在dxko杂合小鼠的棘比野生型小鼠的棘更不稳定。
[0079]
[表2]
[0080]
24小时后棘的新生棘的消失wt2.40%2.40%hetero5.20%9.40%
[0081]
实施例6
[0082]
6.转棒疲劳试验(rotor-rod test)
[0083]
将野生型(wt)、dxko杂合小鼠(het)、dxko纯合小鼠(ko)(8个月龄)放在直径32mm的轮子上(该轮子一边使转速从4rpm(0秒)开始逐渐加速至40rpm(300秒)一边进行旋转),测定直至落下为止的时间。训练五次后,将第六次中直至落下为止的时间作为测定结果。连续两天进行每天三次的试行试验,并计算出平均值。
[0084]
将结果示于图5中。与野生型、dxko纯合小鼠相比,dxko杂合小鼠更早跌落,由此揭示了在野生型、纯合型中协调运动和运动学习没有出现异常,而仅在dxko杂合小鼠中出现异常。
[0085]
实施例7
[0086]
7.行为变化分析
[0087]
使用图6的a所示的y字型迷宫,对野生型(wt)、dxko杂合小鼠(杂合型)、dxko纯合小鼠(纯合型)(8个月龄)的行为变化进行了分析。y字型迷宫由灰色塑料的中央平台和三条臂形成,各臂设为宽度3cm(底部)
·
12cm(上部)
×
高度13cm
×
长度40cm。在上述的y字型迷宫的中央平台上放置小鼠,使之自由探索5分钟。将对臂的侵入次数作为自主运动的指标,将按照下式(1)计算的自发性交替行为率作为空间工作记忆的指标。
[0088]
自发性交替行为率(%)=[(自发性交替行为)/(总侵入次数-2)]
×
100
…
(1)
[0089]
※
自发性交替行为:连续三次进入至不同臂的次数
[0090]
将结果示于图6的b中。与野生型相比,在纯合型中未观察到自主运动、空间工作记忆的降低,但在杂合型中观察到自主运动、空间工作记忆均降低。
[0091]
由实施例3~7的结果可知,在dxko杂合小鼠中,未确认到神经细胞的存活率、突起的生长速度出现异常(实施例3),但nmda受体功能减弱(实施例4),棘的稳定性变低(新生、消失的比例高)(实施例5),协调运动和运动学习出现异常(实施例6),空间记忆和空间工作记忆减少(实施例7)。推测这种异常仅在杂合小鼠中确认到的原因在于:在生来就完全没有脑发育调节蛋白的dxko纯合小鼠中某些代偿功能起作用而没有确认到如杂合小鼠中观察到的异常。
[0092]
已知脑发育调节蛋白会随着年龄的增长而减少。因此,dxko杂合小鼠中的上述异常有可能由于dxko杂合小鼠中的脑发育调节蛋白表达量如呈现在60岁以上的高龄者中那样减半而表现出反映老化的表型。因此认为,在以往的阿尔茨海默病模型小鼠中,通过脑发育调节蛋白基因的杂合敲除而使表达量减半,从而能够制作具有老化这一阿尔茨海默病的最大风险因素的模型动物,并进行了以下实验。
[0093]
实施例8
[0094]
8.杂合敲除了脑发育调节蛋白基因的阿尔茨海默病模型小鼠(5xfad/dxko
+/-)的制作
[0095]
作为阿尔茨海默病模型小鼠,通过使用5xfad小鼠(mmrrc034848、杰克逊实验室)与dxko纯合小鼠交配,制作杂合有5xfad基因和脑发育调节蛋白基因(+/-)的小鼠(5xfad/dxko
+/-)。其中,5xfad小鼠是指如下小鼠,即,在神经细胞特异性小鼠thy-1启动子的转录控制下,过表达具有瑞典型突变(swedish)(k670n和m671l)、佛罗里达型突变(florida)(i716v)及伦敦型突变(london)(v717i)的人app695cdna、和人ps1cdna(m146l和l286v的突变)、并促进脑中淀粉样蛋白β蛋白蓄积的小鼠(oakley,h.et al.,jneurosci,26,10129-10140,2006)。
[0096]
实施例9
[0097]
9.5xfad/dxko
+/-小鼠的脑中淀粉样蛋白β蓄积
[0098]
对实施例8中制作的5xfad/dxko
+/-小鼠和5xfad小鼠的脑中淀粉样蛋白β蓄积进行了比较。将从5xfad/dxko
+/-小鼠和5xfad小鼠(15周龄)提取的湿重量为500μg的大脑皮层(cx)和海马(hipp)的匀浆进行电泳,用抗淀粉样蛋白β抗体(bio-legend公司制)进行蛋白质印迹分析。
[0099]
将结果示于图7中。对淀粉样蛋白β单体的条带进行了比较,结果表明,在大脑皮层和海马这两者中,与5xfad的小鼠相比,5xfad/dxko
+/-小鼠的淀粉样蛋白β单体的条带更深,淀粉样蛋白β更蓄积。
[0100]
实施例10
[0101]
10.5xfad/dxko
+/-小鼠的psd95表达量的比较
[0102]
psd95(postsynaptic density protein 95,突触后密度蛋白95)是突触后部的主要的支架蛋白,是突触后致密区(postsynaptic density,psd)中存在的最丰富的蛋白质之一。认为psd95与nr2a-d、glur6、神经连接蛋白(neuroligin)、nnos等各种分子相互作用,有助于维持突触功能和可塑性。
[0103]
因此,对实施例8中制作的5xfad/dxko
+/-小鼠和5xfad小鼠的psd95表达量进行了比较。将从5xfad/dxko
+/-小鼠和5xfad小鼠(15周龄)提取的湿重量为300μg的大脑皮层(cx)和海马(hipp)的匀浆进行电泳,用抗psd95抗体(thermo fisher scientific公司制)进行
蛋白质印迹分析。
[0104]
将结果示于图8中。在海马中,未观察到5xfad/dxko
+/-小鼠和5xfad小鼠的psd95的条带浓度存在差异,但是,在大脑皮层中,5xfad/dxko
+/-小鼠的淀粉样蛋白β单体的条带比5xfad的小鼠更浅,表示5xfad/dxko
+/-小鼠中psd95的表达降低。
[0105]
由实施例9、10的结果可知,与5xfad小鼠相比,在5xfad/dxko
+/-小鼠中淀粉样蛋白β的蓄积得以促进,且psd95(认为其有助于维持正常的突触功能和可塑性等)的表达降低。因此,揭示了通过杂合敲除脑发育调节蛋白基因来使脑发育调节蛋白表达减半的阿尔茨海默病模型小鼠能够更准确地反映阿尔茨海默病的病症。
[0106]
产业上的可利用性
[0107]
本发明通过将脑发育调节蛋白减半,能够容易地实现在小鼠等短寿命的模型动物中难以实现的因突触老化引起的脆弱性,通过使需要老化的以往的阿尔茨海默病模型非人动物与脑发育调节蛋白敲除非人动物交配,制成脑发育调节蛋白杂合敲除非人动物,从而能够制作具有老化风险的阿尔茨海默病模型非人动物。
[0108]
对于通过本发明制作的模型动物(ad动物),除了促进淀粉样蛋白斑沉积等之类的阿尔茨海默病的病理观察结果之外,还具有老化这一阿尔茨海默病的最大风险因素,因此成为人阿尔茨海默病的前所未有的良好模型动物,能够用于阿尔茨海默病等痴呆症的创新药。
[0109]
对于从本发明中制作的模型动物中调制出的培养神经细胞,由于突触中的脑发育调节蛋白的累积与高龄者同样地减少至50%左右,因此能够用作高龄者中发病的阿尔茨海默病的患者神经细胞的模型细胞,并且能够用于阿尔茨海默病等痴呆症的创新药。
[0110]
因此,本发明在医疗和制药领域中的产业上的可利用性极高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1