一种沙打旺组织的培养再生方法
1.本发明涉及农业技术领域,尤其涉及一种沙打旺组织的培养再生方法。
背景技术:
2.沙打旺为豆科黄芪属多年生草本植物。现主要在我国的东北、西北、华北地区等种植利用,可与粮食作物轮作或在林果行间及坡地上种植,是一种绿肥、饲草和水土保持兼用型草种。目前,专门针对沙打旺的组织培养体系尚未见公开报道。仅现有公开对于紫花苜蓿等豆科牧草或其它科牧草开展的组织培养研究,是目前为止最接近的技术。
3.现有紫花苜蓿组织培养体系的建立包括无菌苗培养、愈伤组织诱导、愈伤组织分化、生根培养、再生苗移栽五个过程:无菌苗培养操作为取成熟紫花苜蓿种子,纱布包裹,漏土,流水冲洗,然后在超净工作台用75%酒精浸泡2min,再用0.1%升汞溶液浸泡4
‑
5min,最后用无菌水冲洗6
‑
8次;灭菌后将种子接种到1/2ms固体培养基上,每瓶中接种25粒;培养条件为光照16h,光照强度2000lx,温度26℃。愈伤组织诱导操作为取培养1.5个月左右的紫花苜蓿无菌苗,将其真叶边缘切割,将其种到含有2,4
‑
二氯苯氧乙酸(2,4
‑
d,1mg/l)、水解酪蛋白(ch,2mg/l)和kinetin激动素(kt,0.25mg/l)的murashige and skoog(ms,41.74g/l)培养基上;分别种到含不同激素浓度梯度的培养基(m1
‑
m8)上;培养条件为光照16h,光照强度2000lx,温度26℃;每隔15
‑
20d继代1次。愈伤组织分化操作为在愈伤组织形成后,继续在相同的培养条件下持续培养,每隔15
‑
20d继代1次。生根培养操作为将分化出的不定芽转接到1/2ms培养基上进行生根培养以及再生培养。再生苗转移操作为再生苗在生根培养基上长到6~8cm左右,根系发达时打开瓶盖炼苗,2~3d左右转移,刚移栽1~2周内,小苗不可被阳光直射,要求温度较大;2周后,可逐步移入有阳光的地方,置于温室培养。
4.现有技术公开的紫花苜蓿组织培养体系的建立程序中,由愈伤组织直接分化不定芽,培养基中的激素成分未作调整,2,4
‑
d、kt是生长素类激素,主要对细胞分裂有刺激作用;ch虽对胚状体和不定芽分化有作用,但用量至少要达到500mg/l,才能收到较为理想的细胞分化效果。用量过小,对细胞分化作用不大。因此,上述紫花苜蓿组织培养体系在用于沙打旺组织的培养过程中,存在组织培养导向不明确,需要花费较长的时间,降低了组织培养的工作效率
5.因此,本领域的技术人员在上述紫花苜蓿组织培养方法的现有技术基础上进行优化,对植物组织培养再生体中的激素成分与用量做调整,开发一种沙打旺组织的培养再生方法,以提高沙打旺组织培养再生效率。
技术实现要素:
6.有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是目前现有技术中,沙打旺组织的培养再生过程中存在组织培养导向不明确,周期长,导致组织培养工作效率低的缺陷问题。
7.为实现上述目的,本发明提供了一种沙打旺组织的培养再生方法,包括在愈伤组
织诱导和愈伤组织分化阶段采用含有不同种类和浓度的激素培养基进行培养;
8.所述愈伤组织诱导阶段,诱导培养基为ph值为5.8~6.8的ms培养基中,加入1~3ml/l用量的2.4
‑
d以及1~2ml/l用量的kt;
9.所述愈伤组织分化阶段,分化培养基为ph值为5.8~6.8的ms培养基中,加入1~2ml/l用量的naa以及1~3ml/l用量的6
‑
ba;
10.进一步地,所述沙打旺组织的培养再生方法,包括以下步骤:
11.步骤1、取培养10~15d的沙打旺无菌苗的茎段,剪成3~5mm长的小段作为沙打旺外植体;
12.步骤2、将步骤1得到的沙打旺外植体接种到愈伤组织诱导培养基上进行诱导培养10~15d,得到愈伤组织;
13.步骤3、将步骤2得到的愈伤组织转入继代培养基上进行继代培养,继代培养至愈伤组织变为绿色;
14.步骤4、将步骤3的继代培养的绿色愈伤组织转入分化培养基进行分化培养,待长出类胚状体后,转入成株与生根培养;
15.步骤5、将步骤4的长至2cm左右的小苗转入生根配培养基中,进行生根培养,生根培养至主根长≥3cm;
16.步骤6、将步骤5中生根良好的植株进行炼苗,然后用无菌水冲洗培养基,并用灭菌薄棉包裹根部,栽入花盆中,浇水,放入温室,常规管理;
17.进一步地,所述沙打旺组织的培养再生方法,所述培养的条件为:培养室温度为昼夜25℃和18℃变温,光照时间16h/d,光照强度1000lux~2000lux;
18.进一步地,所述沙打旺组织的培养再生方法,所述步骤1中,所述沙打旺无菌苗的培养方式为:将完整饱满的沙打旺种子用75%的酒精消毒10min,无菌水冲洗3次,再用30%次氯酸钠消毒15min,无菌水冲洗5~6次后,用灭菌的滤纸吸干种子表面的液体,接种到1/2ms无菌苗培养基上进行培养得到沙打旺无菌苗;
19.进一步地,所述沙打旺组织的培养再生方法,所述步骤3中,继代培养基为ms培养基,并按2ml/l的用量加入2.4
‑
d和1ml/l的用量的kt;
20.进一步地,所述沙打旺组织的培养再生方法,所述步骤5中,所述生根配培养基为1/2ms培养基;
21.进一步地,所述沙打旺组织的培养再生方法,所述步骤6中,所述炼苗为在自然光、室温下暴露炼苗2~3d;
22.在本发明的较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基为ph值为5.8~6.8的ms培养基中,加入1ml/l用量的2.4
‑
d;
23.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基为ph值为5.8~6.8的ms培养基中,加入2ml/l用量的2.4
‑
d;
24.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基为ph值为5.8~6.8的ms培养基中,加入3ml/l用量的2.4
‑
d;
25.在本发明的较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基为ph值为5.8~6.8的ms培养基中,加入1ml/l用量的kt;
26.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培
养基为ph值为5.8~6.8的ms培养基中,加入1.5ml/l用量的kt;
27.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基为ph值为5.8~6.8的ms培养基中,加入2ml/l用量的kt;
28.在本发明的较佳实施方式中,所述沙打旺组织的培养再生方法,所述分化培养基为ph值为5.8~6.8的ms培养基中,加入1ml/l用量的naa;
29.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述分化培养基为ph值为5.8~6.8的ms培养基中,加入1.5ml/l用量的naa;
30.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述分化培养基为ph值为5.8~6.8的ms培养基中,加入2ml/l用量的naa;
31.在本发明的较佳实施方式中,所述沙打旺组织的培养再生方法,所述分化培养基为ph值为5.8~6.8的ms培养基中,加入1ml/l用量的6
‑
ba;
32.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述分化培养基为ph值为5.8~6.8的ms培养基中,加入2ml/l用量的6
‑
ba;
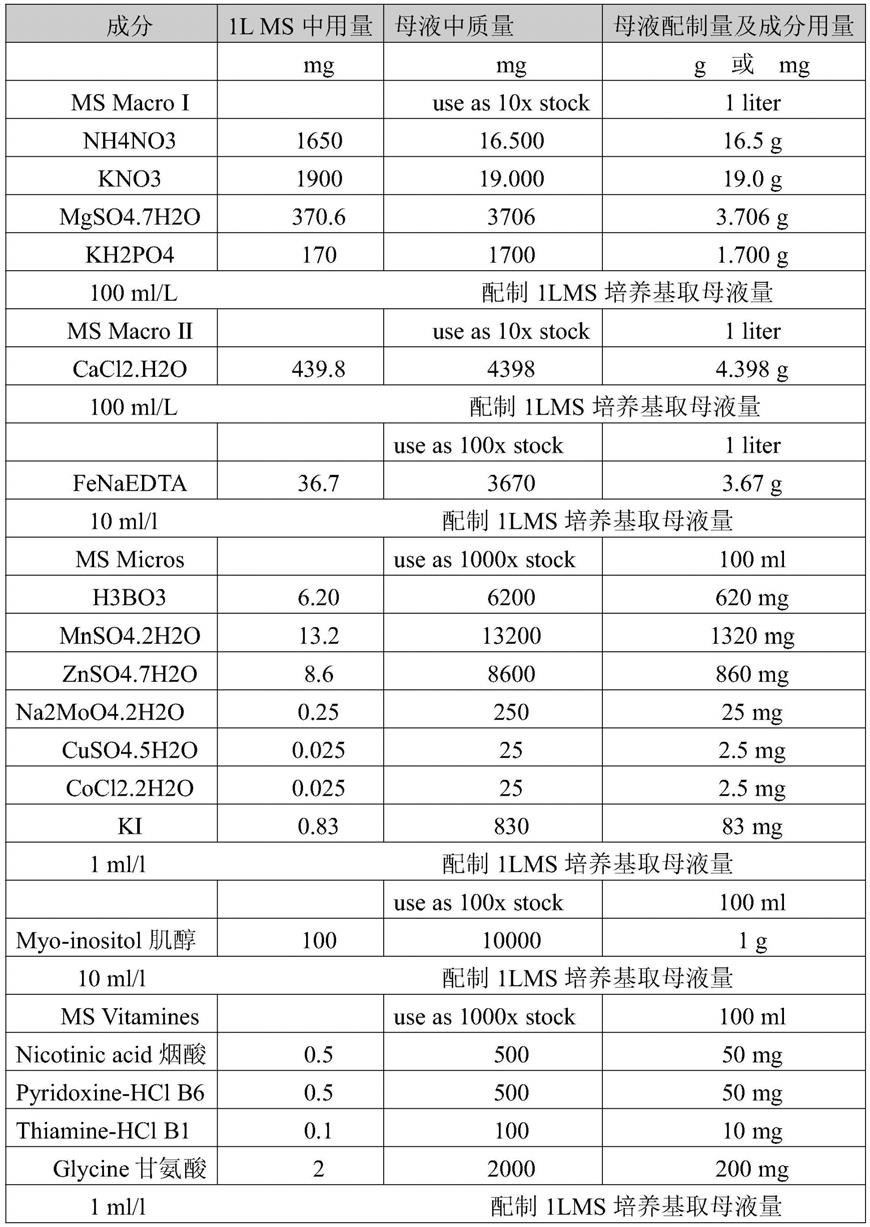
33.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述分化培养基为ph值为5.8~6.8的ms培养基中,加入3ml/l用量的6
‑
ba;
34.在本发明的较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基和分化培养基中,ms培养基的ph值为5.8;
35.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基和分化培养基中,ms培养基的ph值为6;
36.在本发明的另一较佳实施方式中,所述沙打旺组织的培养再生方法,所述诱导培养基和分化培养基中,ms培养基的ph值为6.8;
37.上述沙打旺组织的培养再生方法中,
38.ms培养基,是murashige和skoog于1962年为烟草细胞培养设计的,其特点是无机盐和离子浓度较高,是较稳定的离子平衡溶液,它的硝酸盐含量高,其养分的数量和比例合适,能满足植物细胞的营养和生理需要,因而适用范围比较广,植物组织培养快速繁殖用它作为培养基的基本培养基;
39.ms培养基的配方组分包括:
40.大量元素为:
41.nh4no3、kno3、cacl2·
2h2o、mgso4·
7h2o、kh2po4;
42.微量元素为:
43.ki、h3bo3、mnso4·
2h2o、znso4·
7h2o、na2moo4·
2h2o、cuso4·
5h2o、cocl2·
2h2o;
44.铁盐为:
45.fena
‑
edta;
46.有机物质为:
47.肌醇、烟酸、盐酸吡哆醇(维生素b6)、盐酸硫胺素(维生素b1)、甘氨酸;
48.其他物质:
49.琼脂和蔗糖;
50.上述沙打旺组织的培养再生方法中,
51.1/2ms培养基为把ms培养基中的微量元素减少到原来的1/2;通常采用用母液减半
方法进行制备,比如要配1l的1/2ms,就先配500mlms,再加500ml水即得到;
52.与现有技术相比,本发明沙打旺组织的培养再生方法采用茎段作为外植体,分别使用不同激素组合诱导培养基以及分化培养基,对培养基进行ph值的控制;提高了愈伤组织的培养率,诱导分化率高;极大的提高了沙打旺胚状体成生率,为沙打旺的遗传育种提供了坚实的基础;本发明的沙打旺组织的培养再生方法安全可靠,周期短,效率高,有利于广泛推广应用;
53.本技术沙打旺再生繁殖体系的构建,使转基因育种中目标基因的转入成为可能,实现基因的重新整合与遗传转化,大大提高沙打旺分子育种的可行性,为基于沙打旺遗传体系的改造和新物种创制提供技术保障;
54.本技术沙打旺组织培养体系的建立,为该物种转基因育种构建稳定高效的目标基因转入平台,也为物种改良的实现提供了技术保障;
55.以下将结合实施例对本发明的构思、具体技术方案及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
具体实施方式
56.以下介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,这些实施例为示例性描述,本发明的保护范围并非仅限于文中提到的实施例。
57.如若有未注明具体条件的实验方法,通常按照常规条件,如相关说明书或者手册进行实施。
58.缩略语和关键术语定义:
59.植物组织培养(plant tissue culture):在无菌和人工控制的环境条件下,利用适当的培养基,对离体的植物器官、组织、细胞及原生质体进行培养,使其再生细胞或完整植株的技术;
60.外植体(explant):用于离体培养的那部分植物器官、组织或细胞;
61.愈伤组织(callus):外植体因受伤或在离体培养时其细胞进行活跃的分裂增殖而形成的一种无特定结构和功能的组织;
62.实施例、沙打旺组织的培养再生,具体实施操作如下:
63.(1)首先,环境器具消毒灭菌:
64.接种室和培养室消毒灭菌:接种室和培养室用75%乙醇喷雾使空气的灰尘沉降。每个月使用臭氧发生器或紫外灯照射消毒2h。每3个月密闭条件下采用甲醛:高锰酸钾5:3混合薰蒸消毒10~12h,消毒后通风换气;
65.超净工作台消毒灭菌:接种前用臭氧紫外灯照射消毒30~40min,再用70%~75%酒精喷洒消毒超净工作台面;定期清洗超净工作台的过滤膜;
66.接种器具消毒灭菌:接种工具用纸包好,置于高压灭菌锅灭菌,接种时在超净工作台取出,用接种工具灭菌器直接灭菌;
67.(2)培养基配制:
68.基本培养基:ms培养基、1/2ms(ms基本培养基大量元素减半,其余不变)。
69.母液的配制和保存:配制成常用药品浓度的10、100、1000倍母液,具体ms培养基配
方见表1;母液配制好分别贴上标签,注明溶液名称、配制倍数、配置日期、配置者。母液贮存在4℃的冰箱中。贮藏时间在3个月之内,有霉菌和沉淀产生,不再使用;
70.培养基的配制:配置1l培养基,取蒸馏水600ml~700ml,再加入8琼脂粉,加热搅拌使琼脂融化后加入30g蔗糖,搅拌使糖溶解后再分别加入母液,搅拌均匀,加蒸馏水定容至1l;
71.ph值调节:用酸度计或精密ph试纸测定配制好培养基ph值,用1mol/l的naoh或1mol/l的hcl调到ph值为5.8;
72.分装和灭菌:配制好的培养基趁热分装。分装量以占培养容器的1/4~1/3为宜。切勿将培养基沾到瓶口和外壁上,以免招致杂菌污染。分装后立即加盖,不同的处理做好标记。分装后进行灭菌,121℃状态下保持20min;
73.表1
[0074][0075]
(3)外植体制备:
[0076]
无菌苗的培养:将完整饱满的沙打旺种子用75%的酒精消毒10min,无菌水冲洗3次,再用30%次氯酸钠消毒15min,无菌水冲洗5~6次后,用灭菌的滤纸吸干种子表面的液体,接种到1/2ms无菌苗培养基上进行培养;
[0077]
外植体制备:培养10d左右的无菌苗,取茎段,分别将他们剪成3mm~5mm长的小块或小段作为外植体备用;
[0078]
(4)愈伤组织诱导培养:
[0079]
培养基:愈伤组织诱导使用ms培养基,并按2ml/l的用量加入2.4
‑
d和1ml/l的用量kt;
[0080]
接种:将外植体接种在愈伤组织诱导培养基上,每个培养皿放置10~20个外植体,封口,标注名称和日期;
[0081]
诱导培养:在培养条件下经过10~15d的诱导培养,外植体出现结构疏松,颜色浅绿而透明的细胞团块,即愈伤组织;
[0082]
(5)继代培养:
[0083]
培养基:愈伤组织继代培养使用ms培养基,并按2ml/l的用量加入2.4
‑
d和1ml/l的用量kt;
[0084]
接种:在超净工作台上,将愈伤组织转到继代培养基上,每个培养皿放置10~20个愈伤组织,封口,标注名称和日期;
[0085]
在培养条件下培养,待愈伤组织变为绿色,可转入分化培养;
[0086]
(6)分化培养:
[0087]
培养基:愈伤组织分化培养使用ms培养基,分别按1ml/l和2ml/l用量加入naa与6
‑
ba两种激素;
[0088]
接种:在超净工作台上,挑选状态较好的胚性愈伤组织转入分化培养基,每个培养器皿放置5~10个愈伤组织,封口,标注名称和日期;
[0089]
在培养条件下培养,待长出类胚状体后,转入成株与生根培养;
[0090]
(7)成株与生根培养:
[0091]
培养基:生根培养基为1/2ms;
[0092]
接种:在超净工作台上,将长至2cm左右的小苗转入生根培养基,每瓶放置1~3苗,封口,标注名称和日期;
[0093]
待主根长至大于3cm后,转入移栽过程;
[0094]
(8)移栽:
[0095]
基质:土:草碳:蛭石按照3:2:1混合作为基质,装入花盆,经高压灭菌后备用;
[0096]
炼苗:选择生长健的组培苗,打开封口膜,在自然光、室温下炼苗2~3d;
[0097]
移栽:从培养基中取出小植株,用无菌水冲洗培养基,并用灭菌薄棉包裹根部,栽入花盆中,浇水,放入温室,常规管理;
[0098]
上述操作中,培养条件为:培养室温度为昼夜25℃和18℃变温,光照时间16h/d,光照强度1000lux~2000lux。
[0099]
在另一具体的实施例操作中,
[0100]
将ms培养基的ph值调节为6;
[0101]
将诱导培养基中,2.4
‑
d按1ml/l的用量加入;kt按1.5ml/l的用量加入;
[0102]
将分化培养基中,naa按1.5ml/l的用量加入;6
‑
ba按1ml/l用量加入;
[0103]
其他操作相似或相同,进行沙打旺组织的再生培养;
[0104]
在另一具体实施例操作中,
[0105]
将ms培养基的ph值调节为6.8;
[0106]
将诱导培养基中,2.4
‑
d按3ml/l的用量加入;kt按2ml/l的用量加入;
[0107]
将分化培养基中,naa按2ml/l的用量加入;6
‑
ba按3ml/l用量加入;
[0108]
其他操作相似或相同,进行沙打旺组织的再生培养;
[0109]
试验例、沙打旺在现有技术公开的紫花苜蓿组织培养体系方法下的再生培养
[0110]
采用现有技术公开的紫花苜蓿组织培养体系方法,用于对沙打旺进行无菌苗培养、愈伤组织诱导、愈伤组织分化、生根培养、再生苗移栽的再生培养,具体操作为:
[0111]
(1)无菌苗培养:取成熟沙打旺种子,纱布包裹,漏土,流水冲洗,然后在超净工作台用75%酒精浸泡2min,再用0.1%升汞溶液浸泡4
‑
5min,最后用无菌水冲洗6
‑
8次。灭菌后将种子接种到1/2ms固体培养基上,每瓶中接种25粒;培养条件为光照16h,光照强度2000lx,温度26℃;
[0112]
(2)愈伤组织诱导:取培养1.5个月左右的沙打旺无菌苗,将其真叶边缘切割,将其种到含有2,4
‑
二氯苯氧乙酸(2,4
‑
d,1mg/l)、水解酪蛋白(ch,2mg/l)和kinetin激动素(kt,0.25mg/l)的murashige and skoog(ms,41.74g/l)培养基上;分别种到含不同激素浓度梯度的培养基(m1
‑
m8)上;培养条件为光照16h,光照强度2000lx,温度26℃;
[0113]
(3)愈伤组织分化:在愈伤组织形成后,继续在相同的培养条件下持续培养,每隔15
‑
20d继代1次;
[0114]
(4)生根培养:分化出的不定芽转接到1/2ms培养基上进行生根培养及再生培养;
[0115]
(5)再生苗转移:再生苗在生根培养基上长到6~8cm左右,根系发达时打开瓶盖炼苗,2~3d左右转移,刚移栽1~2周内,小苗不可被阳光直射,要求温度较大;2周后,可逐步移入有阳光的地方,置于温室培养,完成整个再生过程;
[0116]
将上述实施例与试验例培养过程中各阶段数据进行整理并对比,结果如下:
[0117]
试验例中现有技术公的紫花苜蓿组织培养体系的培养再生方法,在用于进行沙打旺组织的培养再生时,培养过程中,培养基所用激素为2,4
‑
二氯苯氧乙酸(2,4
‑
d,1mg/l)、水解酪蛋白(ch,2mg/l)和和kinetin激动素(kt,0.25mg/l)未作调整,由愈伤组织直接诱导分化为不定芽,诱导分化率为75%,从愈伤诱导到细胞分化需要花费2160~2880小时。
[0118]
本技术技术方案的实施例,在愈伤组织形成后,即转入分化培养,培养基所用激素由2,4
‑
d+kt调整为naa+6
‑
ba,经过培养,可以形成大量的胚状体,诱导分化率≥100%(每个愈伤组织团块都可以分化,而且可以分化多个胚状体);从愈伤诱导到细胞分化需要1440~2160小时。
[0119]
本技术技术方案实施例,相对于试验例,通过对细胞分化培养基的激素调整,用6
‑
ba和naa取代2,4
‑
d和kt,刺激胚状体的大量生成,使分化率高于100%,高于试验例的分化率;大量胚状体在继代培养中发育为完整的沙打旺枝叶,缩短了分化培养时间,极大提高了沙打旺组织培养效率。
[0120]
由上述表明,相对于现有技术,使用本发明沙打旺组织的培养再生方法,愈伤组织的诱导分化率提高了25%以上;诱导分化周期缩短了33%以上;有利于提高沙打旺组织培养效率与成苗机率;本发明的实施例方法明显优于试验例的现有技术方法。
[0121]
本发明其他实施例的沙打旺组织的培养再生方法具有与上述相似的有益效果。
[0122]
本发明其他实施方式技术方案得到的沙打旺组织的培养再生方法也具有与上述相似的有益效果。
[0123]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创
造性劳动就可以根据本发明的构思做出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的试验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1