在环境温度下稳定凝血细胞的制作方法
在环境温度下稳定凝血细胞
1.本技术是申请号为201580042850.0、发明名称为“在环境温度下稳定凝血细胞”且申请日为2015年6月9日的中国发明专利申请(pct申请号为pct/us2015/034967)的分案申请。
2.交叉引用
3.本技术要求提交于2014年6月10日的第62/010,151号美国临时申请的权益,该申请通过引用而全文并入于此。
4.发明背景
技术领域
5.本发明总体上涉及在环境温度下稳定一种或多种凝血细胞(thrombocyte)。具体而言,本发明涉及用于使一种或多种代谢活性凝血细胞在环境温度下基本稳定储存的制剂、组合物、制品、试剂盒及方法。
背景技术:
6.全血是细胞、核酸、蛋白质和多种其它分析物的复杂混合物。具体来说,血液成分包括但不限于:细胞,诸如白细胞(单核细胞、淋巴细胞及粒细胞)、红细胞、凝血细胞及循环肿瘤细胞;核酸分子,诸如循环游离dna(cfdna);多肽,诸如脂蛋白、白蛋白及血清蛋白,以及其它多种分析物。
7.凝血细胞或血小板是在血液的凝结中起到关键作用的无核细胞。凝血细胞是在哺乳动物血液中循环且参与止血的圆盘状小细胞。凝血细胞分泌有助于促进血液凝结及组织再生的各种各样的生长因子。
8.健康个体中循环凝血细胞的水平被控制在每mm3约(150
–
400)
×
103个的生理学范围内。低于最佳水平的凝血细胞(血小板减少)可导致过度出血,而超过最佳浓度的水平可导致形成可堵塞血管的血栓(血块),并且可导致患中风、肺栓塞或心肌梗死的较高风险。
9.循环凝血细胞通常以未激活状态存在,并且被衬于血管腔内层的内皮细胞产生的因子维持在未激活状态下。一旦破坏或损伤该内皮层,凝血细胞便与胶原或von wildebrand因子接触,这激活凝血细胞,从而使凝血细胞聚集(即凝块)。该激活和聚集还可以通过凝血酶的酶活性或在adp的存在下发生。一旦激活,凝血细胞便释放α和致密颗粒的内容物,包括生长因子和血纤蛋白原,其有助于凝块形成并帮助促进成纤维细胞的募集以促进伤口愈合。激活的凝血细胞因其更具球形/星形的形状而可与未激活的凝血细胞相区分。
10.在采集全血的过程中凝血细胞的许多生长因子及其它细胞内组分的激活、聚集和/或释放可以极大地阻碍这些细胞的定量及分析。添加各种抗凝剂以在环境温度下维持未激活的凝血细胞导致在24小时时仅有约13%
‑
52%的未激活的凝血细胞,使得在该时间点对总凝血细胞的准确定量分析基本上不可行。因此,对于使凝血细胞在环境温度下稳定足以储存和运送凝血细胞以用于研究、诊断及治疗目的的时间的改良制剂及方法存在需
求。
技术实现要素:
11.本发明的制剂、组合物及方法有利地提供了凝血细胞在环境温度下的稳定,并且在血液采集后这些细胞保持功能性且保留将被激活的能力达至少24小时的时间,从而显著增加了储存及运送基本稳定的凝血细胞以用于研究、诊断及潜在的治疗应用的时间。在一些实施方案中,本文公开了用于使一种或多种凝血细胞在环境温度下基本稳定储存的制剂,其中所述一种或多种凝血细胞稳定至少六小时的时间。在一些实施方案中,所述一种或多种凝血细胞稳定在未激活状态下。在一些实施方案中,所述一种或多种凝血细胞在血液样品中。在一些实施方案中,所述一种或多种凝血细胞在血液样品中呈未激活状态。在一些实施方案中,所述一种或多种凝血细胞从血液样品中分离出。在一些实施方案中,至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,至少90%的凝血细胞在未激活状态下稳定至少九小时的时间。在一些实施方案中,该凝血细胞在未激活状态下稳定至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。在一些实施方案中,所述制剂包含:(i)ph缓冲剂(buffer);(ii)抗凝剂;(iii)至少一种非还原糖或多元醇;以及(iv)官能化碳水化合物。在一些实施方案中,该制剂包含选自二醇(glycol)、甘油、赤藓糖醇、苏糖醇、阿拉伯糖醇、木糖醇、核糖醇、侧金盏糖醇(adonitol)、甘露糖醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇和肌醇及其组合的多元醇。在一些实施方案中,该多元醇是戊糖多元醇或己糖多元醇。在一些实施方案中,该戊糖多元醇是侧金盏糖醇。在一些实施方案中,该官能化碳水化合物是硫糖铝(sucralfate)或蔗糖八硫酸酯。在一些实施方案中,该官能化碳水化合物是蔗糖八硫酸酯。在一些实施方案中,该非还原糖是蔗糖或海藻糖。在一些实施方案中,该非还原糖是海藻糖。在一些实施方案中,该抗凝剂是edta或蛭素。在一些实施方案中,该ph缓冲剂是2x磷酸盐缓冲盐水或tris
‑
hcl。
12.在本发明的一方面,提供了用于使血液样品中呈未激活状态的一种或多种凝血细胞在环境温度下基本稳定储存的制剂,其中所述一种或多种凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,该凝血细胞在未激活状态下稳定至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。在某些实施方案中,该制剂包含(i)ph缓冲剂,(ii)抗凝剂,(iii)至少一种非还原糖或多元醇,以及(iv)官能化碳水化合物。在一些实施方案中,该多元醇选自二醇、甘油、赤藓糖醇、苏糖醇、阿拉伯糖醇、木糖醇、核糖醇、侧金盏糖醇、甘露糖醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇、肌醇及其组合。在一些实施方案中,该多元醇是戊糖多元醇或己糖多元醇。在一些实施方案中,该多元醇是侧金盏糖醇。在一些实施方案中,该官能化碳水化合物是硫糖铝或蔗糖八硫酸酯。在一些实施方案中,该官能化碳水化合物是蔗糖八硫酸酯。在一些实施方案中,该非还原糖是蔗糖或海藻糖。在一些实施方案中,该非还原糖是海藻糖。在一些实施方案中,该抗凝剂是edta或蛭素。在一些实施方案中,
该抗凝剂是edta,该官能化碳水化合物是硫糖铝或蔗糖八硫酸酯,并且该非还原糖是蔗糖或海藻糖。在其它的实施方案中,该抗凝剂是edta,该官能化碳水化合物是蔗糖八硫酸酯,并且该非还原糖是海藻糖。在一些实施方案中,该ph缓冲剂是2x磷酸盐缓冲盐水或tris
‑
hcl。在一些实施方案中,本文公开了用于使一种或多种凝血细胞在环境温度下基本稳定储存的制剂,其包含卤化二糖衍生物和抗凝剂,其中所述一种或多种凝血细胞稳定至少六小时的时间。在一些实施方案中,所述一种或多种凝血细胞稳定在未激活状态下。在一些实施方案中,所述一种或多种凝血细胞在血液样品中。在一些实施方案中,所述一种或多种凝血细胞以未激活状态稳定在血液样品中。在一些实施方案中,所述一种或多种凝血细胞从血液样品中分离出。在一些实施方案中,所述抗凝剂是蛭素。在一些实施方案中,所述卤化二糖衍生物选自三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)、三氯化麦芽糖、1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十二烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷、1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十四烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷及其组合。在一些实施方案中,所述制剂基本上由蛭素和三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)组成。
13.在一些实施方案中,提供了用于使血液样品中呈未激活状态的一种或多种凝血细胞在环境温度下基本稳定储存的制剂,其包含卤化二糖衍生物,其中所述一种或多种凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,该卤化二糖衍生物优选地选自三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)、三氯化麦芽糖、1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十二烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷和1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十四烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷,且更优选地,该卤化二糖衍生物为三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)。在一些实施方案中,所述制剂进一步包含抗凝剂,优选蛭素。在一些实施方案中,该抗凝剂为蛭素。在一些实施方案中,所述制剂基本上由蛭素和三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)组成。
14.在一些实施方案中,本文公开了基本稳定储存的一种或多种凝血细胞的组合物,其包含与所公开的制剂相混合的一种或多种凝血细胞。在一些实施方案中,所述一种或多种凝血细胞在血液样品中。在一些实施方案中,所述一种或多种凝血细胞为分离的凝血细胞。在一些实施方案中,所述一种或多种凝血细胞呈未激活状态。
15.在一些实施方案中,本文公开了制品,其包含容纳在采血管中的本文所述制剂。在一些实施方案中,该采血管是抽空的采血管。
16.在一些实施方案中,本文公开了包含本文所述制品和包装说明书的试剂盒。
17.在一些实施方案中,本文公开了用于使一种或多种凝血细胞在环境温度下基本稳定储存的方法,其包括:使来自受试者的一种或多种凝血细胞与本文提供的制剂相混合,其中所述一种或多种凝血细胞稳定至少六小时的时间。在一些实施方案中,所述一种或多种凝血细胞稳定在未激活状态下。在一些实施方案中,所述一种或多种凝血细胞在来自该受试者的血液样品中。在一些实施方案中,所述一种或多种凝血细胞以未激活状态稳定在来自该受试者的血液样品中。在一些实施方案中,所述一种或多种凝血细胞从来自该受试者
的血液样品中分离出。在一些实施方案中,至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,至少90%的凝血细胞在未激活状态下稳定至少九小时的时间。在一些实施方案中,该方法进一步包括通过添加激活剂激活呈未激活状态的所述一种或多种凝血细胞以促进凝血细胞聚集。在一些实施方案中,该激活剂为adp。在一些实施方案中,该方法进一步包括通过添加激活剂激活所述一种或多种凝血细胞以促进凝血细胞聚集。在一些实施方案中,该激活剂为adp。在一些实施方案中,该受试者为动物。在一些实施方案中,该受试者为哺乳动物。在一些实施方案中,该哺乳动物为人。
18.在一些实施方案中,本文公开了用于使血液样品中呈未激活状态的一种或多种凝血细胞在环境温度下基本稳定储存的方法,其包括使来自受试者的血液样品与本文提供的制剂相混合,其中所述一种或多种凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。在一些实施方案中,使凝血细胞在未激活状态下稳定至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。在一些实施方案中,在从受试者中采集血液样品时使该血液样品与所述稳定制剂相混合,以使所述一种或多种凝血细胞在从该受试者中采集后基本稳定在未激活状态下。在一些实施方案中,该方法进一步包括通过添加激活剂激活所述一种或多种凝血细胞。在一些实施方案中,该激活剂为adp。在该方法的进一步的实施方案中,该受试者为动物,更优选哺乳动物,且更优选人。
具体实施方式
19.本发明涉及用于使一种或多种凝血细胞在环境温度下基本稳定储存的制剂、组合物、制品、试剂盒及方法。在一些实施方案中,使一种或多种凝血细胞在血液样品中以未激活的但可激活的状态储存。在一方面,本文所述的制剂有益地维持未激活的、代谢活性的凝血细胞的完整性,所述凝血细胞随后可进行激活分析或可在治疗应用中用于促进患者中的血液凝结。
20.除非上下文中另有明确规定,否则如本说明书及随附的权利要求书中所用的,单数形式“一个”、“一种”和“该/所述”包括其复数提法。因此,例如,提及“该/所述方法”包括本领域技术人员在阅读此公开内容等之后将会明白的一种或多种方法和/或本文描述的这种类型的步骤。
21.如本文所使用的“约”在提及可测值如量、时距等时,意在包括指定值的
±
20%或
±
10%或
±
5%或甚至
±
1%的偏差,因为此类偏差对于所公开的组合物或实施所公开的方法是合适的。
22.除非另有定义,否则本文中所采用的所有技术和科学术语具有与本发明所属领域的技术人员所普遍理解的相同的含义。本文提及的所有专利、专利申请和出版物均通过引用全文并入本文。
23.在一些实施方案中,提供了用于使代谢活性的凝血细胞在环境温度下基本稳定储存的制剂。在一些实施方案中,所述凝血细胞从血液样品中分离出。在一些实施方案中,所述凝血细胞在血液样品中。在一些实施方案中,所述凝血细胞是未激活的。在某些实施方案
中,所述凝血细胞稳定制剂包含ph缓冲剂、抗凝剂、非还原糖、多元醇和官能化碳水化合物。在某些其它的实施方案中,该凝血细胞稳定制剂包含ph缓冲剂、抗凝剂、多元醇和官能化碳水化合物。在某些其它的实施方案中,该稳定制剂包含ph缓冲剂、抗凝剂、非还原糖和官能化碳水化合物。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物和抗凝剂。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物、抗凝剂和ph缓冲剂。该制剂能够使血液样品中至少60%、70%、80%或甚至90%的未激活的、代谢活性的凝血细胞在环境温度下稳定至少6小时、至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。
24.如本文中所使用的术语“环境温度”是指平常的室内室温。在一些实施方案中,环境温度为15℃到32℃。在一些实施方案中,环境温度为20℃到27℃。
25.在本发明的另一方面,提供了用于使血液样品中未激活的、代谢活性的凝血细胞在环境温度下基本稳定储存的制剂。在某些实施方案中,该凝血细胞稳定制剂包含ph缓冲剂、抗凝剂、非还原糖、多元醇和官能化碳水化合物。在某些其它的实施方案中,该凝血细胞稳定制剂包含ph缓冲剂、抗凝剂、多元醇和官能化碳水化合物。在某些其它的实施方案中,该稳定制剂包含ph缓冲剂、抗凝剂、非还原糖和官能化碳水化合物。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物和抗凝剂。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物、抗凝剂和ph缓冲剂。该制剂能够使血液样品中至少60%、70%、80%或甚至90%的未激活的、代谢活性的凝血细胞在环境温度下稳定至少6小时、至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。
26.在另一方面,本文提供了组合物,其中使血液样品与凝血细胞稳定制剂相混合以在全血制剂中产生基本稳定的一种或多种未激活的凝血细胞。还在其它的实施方案中,提供了一种包含与本发明的稳定制剂相混合的纯化或基本上纯化的一种或多种凝血细胞的组合物。
27.配制试剂
28.ph缓冲剂
29.根据某些实施方案,本文描述的用于使一种或多种凝血细胞基本稳定储存的制剂和组合物包含一种或多种ph缓冲剂。在一些实施方案中,该ph缓冲剂是因其对抗溶液的ph变化的能力而为本领域所知的大量化合物中的任意化合物,诸如在存在ph缓冲剂的水溶液中。用于包含在稳定储存组合物中的一种或多种具体ph缓冲剂的选择可基于本公开内容以及根据本领域的常规实践来进行,并且可受到多种因素的影响,包括须维持的ph、生物样品的性质、将采用的溶剂条件、将采用的制剂的其它成分以及其它条件。例如,一般而言,ph缓冲剂以在质子解离常数(pk
a
)的约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9或1.0个ph单位以内的ph使用,质子解离常数为缓冲液的一个特征。
30.ph缓冲剂的非限制性实例包括柠檬酸、酒石酸、苹果酸、磺基水杨酸、磺基间苯二甲酸、草酸、硼酸盐、caps(3
‑
(环己基氨基)
‑1‑
丙磺酸)、capso(3
‑
(环己基氨基)
‑2‑
羟基
‑1‑
丙磺酸)、epps(4
‑
(2
‑
羟乙基)
‑1‑
哌嗪丙磺酸)、hepes(4
‑
(2
‑
羟乙基)哌嗪
‑1‑
乙磺酸)、mes
(2
‑
(n
‑
吗啉基)乙磺酸)、mops(3
‑
(n
‑
吗啉基)丙磺酸)、mopso(3
‑
吗啉基
‑2‑
羟基丙磺酸)、pipes(1,4
‑
哌嗪二乙磺酸)、taps(n
‑
[三(羟甲基)甲基]
‑3‑
氨基丙磺酸)、tapso(2
‑
羟基
‑3‑
[三(羟甲基)甲基氨基]
‑1‑
丙磺酸)、tes(n
‑
[三(羟甲基)甲基]
‑2‑
氨基乙磺酸)、bicine(n,n
‑
二(2
‑
羟乙基)甘氨酸)、tricine(n
‑
[三(羟甲基)甲基]甘氨酸)、tris(三(羟甲基)氨基甲烷)以及bis
‑
tris(2
‑
[二(2
‑
羟乙基)氨基]
‑2‑
(羟甲基)
‑
1,3
‑
丙二醇)。在一些实施方案中,包括表1中列出的任何实施方案中,其具有约4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9或9.0的ph。
[0031]
多元醇
[0032]
同样如本文所述,某些实施方案包括在用于使全血样品中活的、未激活的凝血细胞在环境温度下基本稳定储存的组合物中的至少一种多元醇。多元醇为含有两个或更多个羟基基团的多羟基醇,并且具有通式h(choh)
n
h,其中n为选自2到7(含)的整数。多元醇在链长上存在差异,其中大多数多元醇具有源自戊糖(五碳糖)和己糖(六碳糖)的五碳或六碳链;但是也存在更短或更长的碳链的多元醇。示例性的多元醇包括但不限于二醇、甘油、赤藓糖醇、苏糖醇、阿拉伯糖醇、木糖醇、核糖醇、侧金盏糖醇、甘露糖醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇和肌醇。用于包含在基本稳定储存组合物中的一种或多种具体多元醇的选择可基于本公开内容以及根据本领域的常规实践来进行,并且其可受到包括其它制剂组分在内的多种因素的影响。在某些实施方案中,存在于制剂中的多元醇为戊糖多元醇。在一些实施方案中,该多元醇为侧金盏糖醇。在一些实施方案中,该多元醇以20
–
100mm或约25
–
75mm的浓度存在。在一些实施方案中,该多元醇为戊糖多元醇,且以20
–
100mm或约25
–
75mm的浓度存在。在一些实施方案中,该多元醇为侧金盏糖醇,且以20
–
100mm或约25
–
75mm的浓度存在。
[0033]
二糖衍生物
[0034]
在某些实施方案中,用于使全血样品中的一种或多种未激活的凝血细胞在环境温度下基本稳定储存的制剂或组合物,包括表1中的那些制剂或组合物,包含至少一种卤化二糖衍生物。在一些实施方案中,该卤化二糖衍生物是二氯化二糖或三氯化二糖。在一些实施方案中,此类二氯化二糖或三氯化二糖出乎意料地能够使单独的或在仅缓冲液存在下的未激活的凝血细胞得到基本稳定的储存。卤化二糖衍生物是已知的,例如,参见美国专利公开第2014/0065062号,并且包括三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)、三氯化麦芽糖、1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十二烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷和1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十四烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷。选择一种或多种具体卤化二糖衍生物以包含在基本稳定储存组合物中可以基于本公开内容以及根据本领域的常规实践进行,并且可能受包括其它制剂组分在内的多种因素的影响。在一些实施方案中,所述官能化碳水化合物是三氯蔗糖并且以约1.0
–
50.0mm存在。在一些实施方案中,所述官能化碳水化合物是三氯蔗糖并且以约10.0
–
30.0mm存在。在一些实施方案中,所述官能化碳水化合物是三氯蔗糖并且以约25.0mm存在。
[0035]
官能化碳水化合物
[0036]
在本文所述的一些实施方案中,包括表1中的那些在内的制剂包含官能化碳水化合物。示例性官能化碳水化合物包括硫糖铝或蔗糖八硫酸酯,并且应当理解,基于本公开内容,技术人员可以选择其它的官能化碳水化合物以在用于活的、可激活的凝血细胞的稳定储存制剂及组合物中使用,并且可根据采用的组合物的其它组分而变化。在一些实施方案中,包括表1中列出的那些在内的本发明制剂及组合物中官能化碳水化合物的浓度为约0.005
–
1.0mm。在一些实施方案中,包括表1中列出的那些在内的本发明制剂及组合物中官能化碳水化合物的浓度为约0.25
–
0.5mm。
[0037]
非还原糖
[0038]
在一些实施方案中,用于使凝血细胞在环境温度下基本稳定储存的制剂和组合物包含至少一种非还原糖。在一些实施方案中,用于使全血样品中活的、未激活的凝血细胞在环境温度下基本稳定储存的制剂和组合物包含至少一种非还原糖。如本文所用的,“非还原糖”是指缺乏醛官能团的碳水化合物分子。示例性非还原糖包括蔗糖和海藻糖。在一些实施方案中,该非还原糖是蔗糖。在一些实施方案中,该非还原糖是海藻糖。在一些实施方案中,海藻糖以约1.0
–
50mm的浓度存在。在一些实施方案中,海藻糖以约10.0
–
30mm的浓度存在。在一些实施方案中,海藻糖以约25mm的浓度存在。
[0039]
抗凝剂
[0040]
在一些实施方案中,本文所述的制剂或组合物中包含抗凝剂。此类抗凝剂是本领域已知的。示例性抗凝剂包括乙二胺四乙酸(edta)、蛭素、肝素和柠檬酸钠。在一些实施方案中,该抗凝剂是蛭素。在一些实施方案中,蛭素以约1.0
–
50μg/ml的浓度存在。在一些实施方案中,蛭素以约1.0
–
25μg/ml的浓度存在。在一些实施方案中,蛭素以约10
–
20μg/ml的浓度存在。
[0041]
用于使凝血细胞在环境温度下稳定的示例性制剂
[0042]
在一些实施方案中,本发明的制剂、组合物及方法有利地使凝血细胞在环境温度下基本稳定储存至少六小时的时间。在一些实施方案中,本发明的制剂、组合物及方法有利地使凝血细胞在血液样品中以其自然循环的、未激活的状态在环境温度下基本稳定储存,其中所述细胞在收集后保留可被激活的能力至少六小时的时间。在其它实施方案中,使至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。在其它实施方案中,使凝血细胞在未激活状态下稳定至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。
[0043]
在某些实施方案中,用于使凝血细胞在环境温度下基本稳定储存的制剂包含ph缓冲剂、抗凝剂、非还原糖、多元醇和官能化碳水化合物。在某些实施方案中,该稳定制剂包含ph缓冲剂、抗凝剂、多元醇和官能化碳水化合物。在某些实施方案中,用于使凝血细胞基本稳定储存的制剂包含ph缓冲剂、抗凝剂、非还原糖和官能化碳水化合物。在一些实施方案中,用于使凝血细胞基本稳定储存的制剂包含卤化二糖衍生物和抗凝剂,并且可进一步包含ph缓冲剂。在一些实施方案中,在从受试者采集血液样品之前将抗凝剂喷涂在采血管、采血容器或采血器皿上并进行干燥。在一些实施方案中,将抗凝剂直接添加至本文所述的制剂中。
[0044]
在某些实施方案中,所述ph缓冲剂是tris
‑
hcl,所述多元醇是戊糖醇,所述非还原
糖是海藻糖,所述抗凝剂是edta或蛭素,并且所述官能化碳水化合物是蔗糖八硫酸酯。在某些实施方案中,所述ph缓冲剂是tris
‑
hcl,所述多元醇是侧金盏糖醇,所述非还原糖是海藻糖的d+异构体,所述抗凝剂是edta或蛭素,并且所述官能化碳水化合物是蔗糖八硫酸酯。在某些实施方案中,所述ph缓冲剂是tris
‑
hcl,所述多元醇是侧金盏糖醇,所述非还原糖是海藻糖的d+异构体,所述抗凝剂是蛭素,并且所述官能化碳水化合物是蔗糖八硫酸酯。在一些实施方案中,所述二糖衍生物是卤化二糖,并且所述抗凝剂是蛭素。在一些实施方案中,所述卤化二糖是三氯蔗糖,并且所述抗凝剂是蛭素。
[0045]
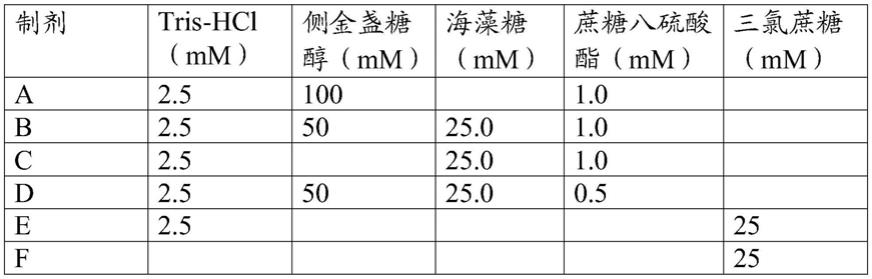
在一些实施方案中,用于使未激活的凝血细胞在环境温度下基本稳定储存的制剂包括表1中提供的示例性制剂。
[0046]
表1.用于使人血液样品中未激活的、代谢活性的凝血细胞在环境温度下稳定的示例性制剂
[0047][0048]
用于制备示例性制剂的方法
[0049]
在一些实施方案中,采用从供应商商购可得的材料制备表1的示例性制剂a
‑
f,并且此类制剂的制备是通过利用本文公开的方法以及本领域技术人员已知的其它方法来实现的。
[0050]
在一些实施方案中,将预称重的固体组分添加至合适的器皿如方瓶中,向其中添加水性组分。例如通过摇动搅拌反应混合物直到固体组分完全溶解,随后采用适宜的酸,例如盐酸,将该混合物的ph调节至所需ph。随后例如利用0.22微米过滤器对所得制剂进行除菌,并储存在室温下。
[0051]
在一个实例中,如下制备20x制剂a的50ml制剂:将15.2034g侧金盏糖醇(calbiochem,目录号121739)和1.251g蔗糖八硫酸酯钾盐(toronto research chemicals,目录号s69900)添加至方瓶中。添加30ml体积的水,然后添加2.5ml的tris
‑
hcl(invitrogen,目录号15567
‑
027)。向制剂适量添加另外的水以达到50ml的最终总体积。摇动该混合物直到完全溶解,并添加盐酸调节ph至7.51。该溶液在真空下进行过滤除菌(0.22μm孔径)以得到生成的制剂。
[0052]
在另一个实例中,如下制备20x制剂b的50ml制剂:将7.5994g侧金盏糖醇、9.4997g d
‑
(+)
‑
海藻糖二水合物(fluka,目录号90210)和1.25g蔗糖八硫酸酯钾盐添加至方瓶中。添加30ml体积的水,然后添加2.5ml的tris
‑
hcl(invitrogen,目录号15567
‑
027)。向制剂适量添加另外的水以达到50ml的最终总体积。摇动该混合物直到完全溶解,并添加盐酸调节ph至7.51。该溶液在真空下进行过滤除菌(0.22μm孔径)以得到生成的制剂。
[0053]
在另一个实例中,如下制备20x制剂c的50ml制剂:将9.5003gd
‑
(+)
‑
海藻糖二水合
物(d
‑
(+)
‑
trehalose dehydrate)和1.2502g蔗糖八硫酸酯钾盐添加至方瓶中。添加30ml体积的水,然后添加2.5ml的tris
‑
hcl(invitrogen,目录号15567
‑
027)。向制剂适量添加另外的水以达到50ml的最终总体积。摇动该混合物直到完全溶解,并添加盐酸调节ph至7.52。该溶液在真空下进行过滤除菌(0.22μm孔径)以得到生成的制剂。
[0054]
在另一个实例中,如下制备20x制剂d的50ml制剂:7.5994g侧金盏糖醇、9.5003g d
‑
(+)
‑
海藻糖二水合物和0.625g蔗糖八硫酸酯钾盐。添加30ml体积的水,然后添加2.5ml的tris
‑
hcl(invitrogen,目录号15567
‑
027)。向制剂适量添加另外的水以达到50ml的最终总体积。摇动该混合物直到完全溶解,并添加盐酸调节ph至7.51。该溶液在真空下进行过滤除菌(0.22μm孔径)以得到生成的制剂。
[0055]
在另一个实例中,如下制备20x制剂e的50ml制剂:将9.9997g三氯蔗糖(sigma,目录号69293)添加至方瓶中。添加30ml体积的水,然后添加2.5ml的tris
‑
hcl(invitrogen,目录号15567
‑
027)。向制剂适量添加另外的水以达到50ml的最终总体积。摇动该混合物直到完全溶解,并添加盐酸调节ph至7.54。该溶液在真空下进行过滤除菌(0.22μm孔径)以得到生成的制剂。
[0056]
在另一个实例中,如下制备20x制剂f的50ml制剂:将9.9993g三氯蔗糖(sigma,目录号69293)添加至方瓶中。向制剂适量添加水以达到50ml的最终总体积。摇动该混合物直到完全溶解,提供了ph为7.54的溶液。该溶液在真空下进行过滤除菌(0.22μm孔径)以得到生成的制剂。
[0057]
纯化的稳定的凝血细胞
[0058]
在一些实施方案中,利用本领域技术人员采用的公知方法纯化血液样品中在环境温度下基本稳定的一种或多种凝血细胞。用于从血液中纯化凝血细胞的设备和试剂盒是公知的(例如,参见第5,234,593号、第6,315,706号和第7,708,152号美国专利)。在某些实施方案中,利用在将血液采集在袋子中后制备的一袋pc(血小板浓缩液)纯化凝血细胞,并且通过使用血液成分采集装置获得单采血液成分术(apheresis)pc。这些方法利用离心分离从血液中分离凝血细胞。在一些实施方案中,使用针对天然野生型膜蛋白质和受体的抗体,通过亲和色谱法或通过荧光激活细胞分选术(facs)分析有利地纯化基本稳定的、完整的、代谢活性的活细胞,并且该方法在使用使这些细胞蛋白质变性的其它储存制剂时是不可行的。
[0059]
在一些实施方案中,随后将纯化的一种或多种凝血细胞在分析或使用之前储存在本文所述的制剂中延长的时间。
[0060]
制品
[0061]
在某些实施方案中,提供了制品,其包含容纳在合适的采血管、采血容器或采血器皿中的本文提供的制剂。在一些实施方案中,该制剂选自在表1中列出的那些制剂。在一些实施方案中,这些制品通过在采血时稳定一种或多种血液成分来用于使一种或多种血液成分得到基本稳定储存。在某些实施方案中,该采血管为具有低于大气压的气压的抽空采血管以抽出预定体积的全血。在一些实施方案中,这些制品在本文描述的试剂盒及方法中使用。
[0062]
试剂盒
[0063]
在某些实施方案中,提供了包含任意本文所述制品和包装说明书的试剂盒。在一
些实施方案中,该试剂盒的组件以包装的方式提供,诸如带隔室的塑料包围体,优选具有可严密密封的盖子,使得该试剂盒的内容物可消毒并密封储存。
[0064]
用于使血液样品中的一种或多种凝血细胞在环境温度下基本稳定储存的方法
[0065]
在一些实施方案中,本文描述了用于使一种或多种凝血细胞在环境温度下基本稳定储存的方法。在一些实施方案中,所述方法用于使血液样品中呈未激活状态的一种或多种凝血细胞在环境温度下基本稳定储存。
[0066]
在某些实施方案中,所述方法包括使血液样品与用于使一种或多种凝血细胞在环境温度下基本稳定储存至少六小时的时间的制剂相混合。在一些实施方案中,所述一种或多种凝血细胞从血液样品中分离出。在一些实施方案中,使所述一种或多种凝血细胞稳定在未激活状态下。在一些实施方案中,使至少90%的凝血细胞保持在未激活状态下至少六小时的时间。在其它的实施方案中,使凝血细胞在未激活状态下稳定至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时或至少24小时的时间。在某些实施方案中,所述制剂是表1中列出的制剂之一。
[0067]
在某些实施方案中,所述方法包括使血液样品与用于使活的凝血细胞基本稳定储存的制剂相混合,其中该制剂包含ph缓冲剂、抗凝剂、非还原糖、多元醇和官能化碳水化合物。在某些实施方案中,该凝血细胞稳定制剂包含ph缓冲剂、抗凝剂、多元醇和官能化碳水化合物。在某些实施方案中,该稳定制剂包含ph缓冲剂、抗凝剂、非还原糖和官能化碳水化合物。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物和抗凝剂。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物和抗凝剂,进一步包含ph缓冲剂。在某些实施方案中,该制剂是表1中列出的制剂之一。
[0068]
在某些实施方案中,所述方法包括使血液样品与用于使血液样品中活的、可激活的凝血细胞基本稳定储存的制剂相混合,其中该制剂包含ph缓冲剂、抗凝剂、非还原糖、多元醇和官能化碳水化合物。在某些实施方案中,该凝血细胞稳定制剂包含ph缓冲剂、抗凝剂、多元醇和官能化碳水化合物。在某些其它的实施方案中,该稳定制剂包含ph缓冲剂、抗凝剂、非还原糖和官能化碳水化合物。在又另一个实施方案中,该稳定制剂包含卤化二糖衍生物和抗凝剂。在又另一个实施方案中,该稳定制剂进一步包含ph缓冲剂。在某些实施方案中,该制剂是表1中列出的制剂之一。
[0069]
采血管、采血袋、采血容器和采血器皿是本领域公知的,并且已经被执业医师使用了几十年。为了使一种或多种血液成分基本稳定储存而采集的血液可以利用本领域技术人员通常采用的任何方法或设备如静脉穿刺或手指针刺从受试者、供体或患者获得。在一些实施方案中,当通过静脉穿刺采集血液时,在从供体或患者获得血液样品时,将本文所述的制剂置于采血管内,例如,抽空的管(vacutainer,becton dickenson或vacuette,greiner)内。在一些实施方案中,将稳定制剂添加至已获得的全血样品中,优选在全血样品抽取后立即或不久添加。
[0070]
在一些实施方案中,本文所述的方法采用所公开的制品和试剂盒。
[0071]
以说明而非限制的方式给出以下实施例。
[0072]
实施例1:人血液样品中的未激活的凝血细胞在环境温度下稳定至少22小时的时
间
[0073]
本实施例描述了用于稳定未激活的凝血细胞的本发明制剂,所述未激活的凝血细胞在环境温度下储存22小时的时间之后仍然能够被激活。
[0074]
采用商购可得的涂有蛭素的采集管(roche diagnostics)从六个人类供体中采集全血样品,合并血液样品,并在采集的三小时内处理血液样品。在添加稳定剂制剂之前或之后,将各个全血样品的300μl等份与15μl的表1的稳定剂制剂a、b、c或d以1:20的比例一起转移至eppendorf管,并且在分析之前使该混合物在环境温度下保持预设的一段时间。将等体积的全血添加至各个对照样品中,并且在不存在稳定剂制剂的情况下将各个样品储存在室温下并与测试样品平行地进行处理。
[0075]
向300μl的各混合物和对照中添加300μl的nacl 0.9%和20μl所提供的adp溶液以促进凝血细胞的激活,并利用多板分析仪(roche diagnostics)分析样品。在样品设置后立即(时间0)根据制造商的使用说明利用多板分析仪和adp测试测量各个条件下的凝血细胞活性。还在3小时、6小时、9小时和22小时时间点处测量凝血细胞活性。将各个条件下的凝血细胞活性相对于其时间0处的测量值进行归一化。然后对来自六个供体的数据取平均值。数据示于表2中。
[0076]
表2.人血液样品中活的、可激活的凝血细胞稳定至少22小时
[0077]
时间(hr)对照制剂a制剂b制剂c制剂d0100*10010010010039311011296986821071111019597711511410193225991927490
[0078]
*值显示为相对于时间0处保留的当前活性
[0079]
如表2所示,在9小时温育期之后,在nf对照条件下的凝血细胞活性的平均减少量为
‑
23%,与之相比,表2的制剂a、b、c和d分别为+15%、+14%、+1%和
‑
7%。在22小时温育期之后,仍然检测到显著的凝血细胞活性,在nf对照条件下的凝血细胞活性的平均减少量为
‑
41%,与之相比,表2的制剂a、b、c和d分别为
‑
9%、
‑
8%、
‑
26%和
‑
10%。
[0080]
包含卤化二糖衍生物、三氯蔗糖的表1的制剂如上所述进行表征,并且还被鉴定为在全血中具有稳定的凝血细胞活性至少22小时(表3)。在本研究中,在抽血之前将如表1中列出的这些制剂纳入蛭素真空采血管中。
[0081]
表3.人血液样品中活的、可激活的凝血细胞稳定至少22小时
[0082]
制剂时间03小时6小时9小时22小时对照10089695860e100100999897f10094878073
[0083]
*值显示为相对于时间0处保留的当前活性
[0084]
在室温血液温育期间,到22小时时间点时nf对照条件下的凝血细胞活性降低了
‑
40%,与之相比,表1的制剂e为
‑
3%,制剂f为
‑
27%。
[0085]
综上,本发明涉及以下方面:
[0086]
1.一种用于使一种或多种凝血细胞在环境温度下基本稳定储存的制剂,其中所述一种或多种凝血细胞稳定至少六小时的时间。
[0087]
2.根据项1所述的制剂,其中所述一种或多种凝血细胞稳定在未激活状态下。
[0088]
3.根据项1或项2所述的制剂,其中所述一种或多种凝血细胞在血液样品中。
[0089]
4.根据项1
‑
2中任一项所述的制剂,其中所述一种或多种凝血细胞从血液样品中分离出。
[0090]
5.根据项1
‑
4中任一项所述的制剂,其中至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。
[0091]
6.根据项1
‑
5中任一项所述的制剂,其中至少90%的凝血细胞在未激活状态下稳定至少九小时的时间。
[0092]
7.根据项1
‑
6中任一项所述的制剂,其包含:
[0093]
(i)ph缓冲剂;
[0094]
(ii)抗凝剂;
[0095]
(iii)至少一种非还原糖或多元醇;以及
[0096]
(iv)官能化碳水化合物。
[0097]
8.根据项1
‑
7中任一项所述的制剂,其中所述制剂包含选自二醇、甘油、赤藓糖醇、苏糖醇、阿拉伯糖醇、木糖醇、核糖醇、侧金盏糖醇、甘露糖醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇、肌醇及其组合的多元醇。
[0098]
9.根据项1
‑
7中任一项所述的制剂,其中所述制剂包含戊糖多元醇或己糖多元醇。
[0099]
10.根据项9所述的制剂,其中所述戊糖多元醇是侧金盏糖醇。
[0100]
11.根据项7
‑
10中任一项所述的制剂,其中所述官能化碳水化合物是硫糖铝或蔗糖八硫酸酯。
[0101]
12.根据项7
‑
10中任一项所述的制剂,其中所述官能化碳水化合物是蔗糖八硫酸酯。
[0102]
13.根据项7
‑
12中任一项所述的制剂,其中所述非还原糖是蔗糖或海藻糖。
[0103]
14.根据项7
‑
12中任一项所述的制剂,其中所述非还原糖是海藻糖。
[0104]
15.根据项7
‑
14中任一项所述的制剂,其中所述抗凝剂是edta或蛭素。
[0105]
16.根据项7
‑
15中任一项所述的制剂,其中所述ph缓冲剂是2x磷酸盐缓冲盐水或tris
‑
hcl。
[0106]
17.一种用于使一种或多种凝血细胞在环境温度下基本稳定储存的制剂,其包含卤化二糖衍生物和抗凝剂,其中所述一种或多种凝血细胞稳定至少六小时的时间。
[0107]
18.根据项17所述的制剂,其中所述一种或多种凝血细胞稳定在未激活状态下。
[0108]
19.根据项17或项18所述的制剂,其中所述一种或多种凝血细胞在血液样品中。
[0109]
20.根据项17
‑
18中任一项所述的制剂,其中所述一种或多种凝血细胞从血液样品中分离出。
[0110]
21.根据项17
‑
20中任一项所述的制剂,其中所述抗凝剂是蛭素。
[0111]
22.根据项17
‑
21中任一项所述的制剂,其中所述卤化二糖衍生物选自三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)、三氯化麦芽糖、1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十二烷酸酯
‑
α
‑
d
‑
吡喃半
乳糖苷、1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑6‑
o
‑
单十四烷酸酯
‑
α
‑
d
‑
吡喃半乳糖苷及其组合。
[0112]
23.根据项17所述的制剂,其中所述制剂基本上由蛭素和三氯蔗糖(1,6
‑
二氯
‑
1,6
‑
二脱氧
‑
β
‑
d
‑
呋喃果糖基
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
吡喃半乳糖苷)组成。
[0113]
24.一种基本稳定储存的呈未激活状态的一种或多种凝血细胞的组合物,其包含与项1
‑
23中任一项所述的制剂相混合的一种或多种凝血细胞。
[0114]
25.根据项24所述的组合物,其中所述一种或多种凝血细胞在血液样品中。
[0115]
26.根据项24所述的组合物,其中一种或多种凝血细胞是分离的凝血细胞。
[0116]
27.一种制品,其包含容纳在采血管中的项1
‑
23中任一项所述的制剂。
[0117]
28.根据项20所述的制品,其中所述采血管是抽空的采血管。
[0118]
29.一种试剂盒,其包含项27或项28所述的制品和包装说明书。
[0119]
30.一种用于使一种或多种凝血细胞在环境温度下基本稳定储存的方法,其包括:使来自受试者的一种或多种凝血细胞与项1
‑
23中任一项所述的制剂相混合,其中所述一种或多种凝血细胞稳定至少六小时的时间。
[0120]
31.根据项30所述的方法,其中所述一种或多种凝血细胞稳定在未激活状态下。
[0121]
32.根据项30或项31所述的方法,其中所述一种或多种凝血细胞在来自所述受试者的血液样品中。
[0122]
33.根据项30
‑
31中任一项所述的方法,其中所述一种或多种凝血细胞从来自所述受试者的血液样品中分离出。
[0123]
34.根据项30
‑
33中任一项所述的方法,其中至少90%的凝血细胞在未激活状态下稳定至少六小时的时间。
[0124]
35.根据项30
‑
34中任一项所述的方法,其中至少90%的凝血细胞在未激活状态下稳定至少九小时的时间。
[0125]
36.根据项30
‑
35中任一项所述的方法,其进一步包括通过添加激活剂激活所述一种或多种凝血细胞以促进凝血细胞聚集。
[0126]
37.根据项36所述的方法,其中所述激活剂为adp。
[0127]
38.根据项30
‑
37中任一项所述的方法,其进一步包括通过添加激活剂激活所述一种或多种凝血细胞以促进凝血细胞聚集。
[0128]
39.根据项38所述的方法,其中所述激活剂为adp。
[0129]
40.根据项30
‑
39中任一项所述的方法,其中所述受试者为动物。
[0130]
41.根据项30
‑
40中任一项所述的方法,其中所述受试者为哺乳动物。
[0131]
42.根据项41所述的方法,其中所述哺乳动物为人。
[0132]
除非上下文另有要求,否则在本说明书和权利要求书通篇中,词语“包含”及其变化形式(其可与“包括”、“含有”或“特征在于”互换使用)是包含性或开放式语言,并且不排除另外的、未列举的要素或方法步骤。短语“由
……
组成”排除权利要求中未指明的任何要素、步骤或成分。短语“基本由
……
组成”将权利要求的范围限制于指明的物质或步骤以及那些实质上不影响所请求保护的发明的基本特性及新特性的物质或步骤。本公开内容涵盖对应于这些短语中每一个的范围的本发明组合物及方法的实施方案。因此,包含所列举的要素或步骤的组合物或方法涵盖其中组合物或方法基本由这些要素或步骤组成或者由这
些要素或步骤组成的具体实施方案。
[0133]
本说明书通篇提及的“一个实施方案”或“实施方案”或“方面”意指与该实施方案相关联地描述的具体特征、结构或特性包含在本发明的至少一个实施方案中。因此,短语“在一个实施方案中”或“在实施方案中”在本说明书全文各处的出现并不一定都指的是同一个实施方案。此外,这些具体特征、结构或特性可以在一个或多个实施方案中以任何合适的方式组合。
[0134]
以上描述的各种实施方案可进行组合以提供进一步的实施方案。可根据以上详述的说明对实施方案作出这些和其它改变。总之,在所附的权利要求中,所采用的术语不应解释为将权利要求限制于说明书和权利要求书中公开的具体实施方案,而应解释为包括这些权利要求所请求保护的所有可能的实施方案以及等同方案的全部范围。因此,权利要求不受公开内容的限制。
[0135]
从前述内容应当理解,虽然本文出于说明的目的已描述了本发明的具体实施方案,但在不偏离本发明的精神和范围的情况下可作出多种修改。因此,本发明除了随附的权利要求外不受限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1