一种卵母细胞冷冻保存试剂及其应用
1.本发明涉及生殖工程技术领域,特别是涉及一种卵母细胞冷冻保存试剂及其应用。
背景技术:
2.卵母细胞冷冻技术是重要的生殖生物学技术,广泛应用于种质资源保存、生育力保存及辅助生殖技术中,但解冻后卵母细胞存在发育潜能下降等问题,有报道称至少冷冻20枚成熟卵母细胞方可获得出生后代,严重制约了此项技术的广泛应用,因此,提高冷冻卵母细胞利用效率是亟待解决的问题。
3.卵母细胞冷冻保存所面临的挑战包括其相对较大的尺寸、高含水量、独特的染色体排列和减数分裂纺锤体,这些特性使得卵母细胞在冷冻和解冻过程中特别容易受到冰晶形成的损害,冷冻应激对卵母细胞的损伤包括以下方面:
4.1.冷冻影响卵母细胞能量供应
5.低温诱导的损伤主要包括atp耗竭和酶活性降低,从而导致代谢和氧化还原失衡。这是因为虽然在低温下线粒体产生的atp明显减少,但维持基本的细胞过程仍然需要生物能的不断产生,这导致了细胞内atp相对快速的消耗。研究指出,在0-4℃的条件下,约95%的atp可以在4小时内被水解为一磷酸腺苷。atp的产生减少及快速消耗可以引起一系列细胞有害事件,这包括显著降低的高能量磷酸盐储存水平、膜去极化以及膜脂双分子层完整性和细胞骨架结构的破坏,这些损伤最终引起离子稳态紊乱,导致细胞肿胀和细胞活力的丧失。
6.在卵母细胞的冷冻保存过程中,冷冻/解冻对atp的浓度也有明显的负面影响。对家兔排卵后卵母细胞的慢速冷冻和玻璃化冷冻研究发现,冷冻卵母细胞的atp水平显著低于新鲜卵母细胞,并且与冷冻采用的方法无关。这一结果在人、小鼠、猪和牛的卵母细胞冷冻保存中也得到了验证。
7.2.冷冻影响卵母细胞骨架
8.低温保存已经被证明可以诱导质膜和细胞骨架塌陷导致屏障功能丧失和离子稳态和代谢物供应的异常,从而加速细胞死亡。细胞脂质与细胞骨架成分之间的相互作用是复杂的,这些脂质的硬化会导致细胞骨架的变形和破坏,从而对细胞的生存和发展产生负面影响,细胞骨架的破坏也可能是低温保存过程中脱水和细胞形态变化的内在原因。
9.在卵母细胞中,细胞骨架对卵母细胞的发育和受精十分重要。微丝和微管作为细胞骨架的主要成分,对低温极其敏感,冷冻保存会引起微管的解聚和微丝的错乱分布。已有研究证明玻璃化冷冻会造成卵母细胞微管解聚,进而影响纺锤体的结构和功能。皮质微丝的网络结构也会在冷冻保存过程中出现异常,这会诱导卵母细胞染色体出现错误排列并最终形成非整倍体。
10.为了解决冷冻引起的细胞骨架异常等问题,一些研究使用了膜稳定剂(例如抗冻蛋白和水凝胶)来对细胞进行低温保存。在极地鱼和一些昆虫的血清中发现的抗冻糖蛋白
于1992年首次用于牛卵母细胞的低温保存,并且被证实显著提高了冷冻保存后卵母细胞的生存能力和生物活性。具有与抗冻糖蛋白相同的聚脯氨酸ii螺旋结构的l-脯氨酸低聚体也被证实具有较强的抑制冰生长的活性,防止了大冰晶对卵母细胞的直接伤害和渗透压的增加。
11.3.冷冻诱导卵母细胞氧化应激
12.在生理条件下,内源性细胞抗氧化防御系统清除有害的活性氧以维持细胞内的氧化还原平衡。氧化应激是一种氧化和抗氧化之间的不平衡状态,这是由极端条件下活性氧(reactive oxygen species,ros)的大量产生引起的。例如,低温保存和升温过程伴随着细胞抗氧化能力的降低,低温造成的线粒体损伤也会进一步增强ros的产生,从而诱导细胞氧化应激。
13.冷冻保存期间的氧化应激也可由其他机制产生,例如渗透胁迫(由冰核和脱水诱导)和增加的氧化代谢会诱导质膜和细胞器的损伤。在玻璃化冷冻解冻后的猪卵母细胞和胚胎中观察到的谷胱甘肽(glutathione,gsh)水平的降低和过氧化氢水平的升高,表明冷冻保存损害了猪卵母细胞和胚胎的抗氧化防御系统。
14.为了减轻低温保存过程中潜在的氧化损伤,一些研究已经在常规的冷冻保存溶液中添加了抗氧化剂。白藜芦醇、n-乙酰半胱氨酸、褪黑素等都已经被广泛的用于人和家畜卵母细胞/胚胎的冷冻保存,并对细胞的抗氧化防御系统起到了积极作用。
15.4.冷冻诱导的细胞损伤机制
16.冰晶,即冻结的水,已被证实在宏观层面上对人体或动物有害,在微观层面上对细胞是致命的。在低温生物学中,冰对细胞的致命性一直是限制哺乳动物细胞低温保存发展的一个挑战。mazur首先提出了“两种低温损伤”的假说,包括冰诱导的渗透损伤和机械损伤;近年来,ros对细胞的损伤也在低温保存过程中被证实。
技术实现要素:
17.本发明的目的是提供一种卵母细胞冷冻保存试剂及其应用,以解决上述现有技术存在的问题,本发明通过在冷冻保存液和解冻液中添加原花青素b2,从而降低冷冻卵母细胞冷冻损伤,改善线粒体功能,提高其内在质量,为卵母细胞冻存效果的改进提供新方法。
18.为实现上述目的,本发明提供了如下方案:
19.本发明提供一种卵母细胞的冷冻保存液,所述冷冻保存液包含冷冻平衡液和玻璃化冷冻液,所述冷冻平衡液和玻璃化冷冻液中均含有原花青素b2。
20.进一步地,所述原花青素b2在所述冷冻平衡液和所述玻璃化冷冻液中的浓度均为5μg/ml。
21.进一步地,所述冷冻平衡液还含有二甲基亚砜和乙二醇。
22.进一步地,所述玻璃化冷冻液为含有乙二醇、二甲基亚砜、蔗糖和聚蔗糖的pbs液。
23.本发明还提供一种卵母细胞冷冻保存的解冻液,所述解冻液为含有原花青素b2的pbs液。
24.进一步地,所述原花青素b2在所述解冻液中的浓度为5μg/ml。
25.本发明还提供一种卵母细胞解冻后恢复液,所述恢复液为含有原花青素b2的m2液。
26.进一步地,所述原花青素b2在所述解冻后恢复液中的浓度为5μg/ml。
27.本发明还提供一种卵母细胞的冷冻保存方法,所述方法包括:先将卵母细胞置于上述的冷冻平衡液中,平衡处理后再转移至上述的玻璃化冷冻液中,之后投入液氮,冷冻保存;解冻时,将冷冻保存的卵母细胞置于上述的解冻液中进行解冻,解冻后将卵母细胞置于上述的解冻后恢复液中进行恢复。
28.本发明还提供原花青素b2、上述的冷冻保存液、上述的解冻液或上述的解冻后恢复液在卵母细胞冷冻保存中的应用。
29.原花青素属于多酚类物质,也被称为缩合单宁,是通过干扰素键连接的黄烷-3-醇的低聚物或聚合物[例如(-)-表儿茶素或(+)-儿茶素]。作为植物中最丰富的植物化学物质之一,原花青素广泛存在于水果、蔬菜、谷物、豆类和茶叶等植物中。通常情况下,只含有表儿茶素的原花青素被称为原花青素。研究发现原花青素具有广泛的调节作用,可参与脂质代谢、表观遗传等调节,原花青素b2(dimer procyanidin b2[4,8'-bi-[(+)-epicatechin]](pcb2))是主要的原花青素,鉴于冷冻应激对卵母细胞造成的广泛影响,我们推测原花青素可能有助于降低冷冻损伤。市场上现有冷冻、解冻试剂普遍为渗透性及非渗透性冷冻保护剂,通过置换卵母细胞内水分,防止冷冻解冻过程中冰晶形成以达到保护卵母细胞的目的,缺乏光谱抗冷冻损伤制剂的添加,本发明以小鼠卵母细胞为模型,探讨在冷冻、解冻液中添加原花青素b2对冷冻卵母细胞质量的影响,以期为改善卵母细胞冷冻保存效果提供新方法。
[0030]
本发明公开了以下技术效果:
[0031]
本发明在冷冻保存液和解冻液中添加原花青素b2(pcb2),可减轻卵母细胞冷冻损伤,表现为解冻后存活率提高、线粒体功能改善、ca
2+
稳态的维持、氧化应激水平降低、皮质张力恢复、非整倍率降低、减数分裂进程的正常推进,且原花青素b2可参与糖代谢调控,改善冷冻卵母细胞后续发育能力。
附图说明
[0032]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0033]
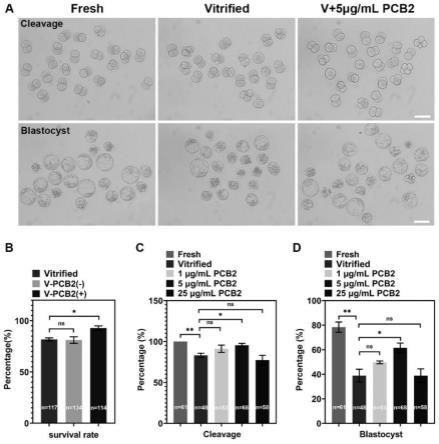
图1为不同浓度原花青素b2对玻璃化冷冻卵母细胞存活和发育的影响,其中,a为各组卵母细胞的卵裂和囊胚发生,标尺:100μm;b为卵母细胞解冻后存活率;c为孤雌激活后胚胎卵裂率;d为孤雌激活后胚胎囊胚率;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,**p<0.01,ns=无统计学差异;
[0034]
图2为原花青素b2对玻璃化冷冻卵母细胞氧化应激的影响,其中,a为各组卵母细胞ros和gsh水平,标尺:100μm;b为卵母细胞内ros荧光强度分析;c为卵母细胞内gsh荧光强度分析;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,***p<0.001;
[0035]
图3为原花青素b2对玻璃化冷冻卵母细胞细胞器分布的影响,其中,a为各组卵母
细胞线粒体分布,标尺:50μm;b为各组卵母细胞线粒体异常分布比例;c为各组卵母细胞内质网分布,标尺:50μm;d为各组卵母细胞内质网异常分布比例;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,ns=无统计学差异;
[0036]
图4为原花青素b2对玻璃化冷冻卵母细胞线粒体功能的影响,其中a为各组卵母细胞线粒体膜电势,标尺:50μm;b为各组卵母细胞线粒体温度,标尺:50μm;c为卵母细胞线粒体膜电势水平分析;d为卵母细胞线粒体温度水平分析;e为线粒体融合(opa1,mfn1,mfn2)和分裂(drp1)基因表达分析;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,***p<0.001,ns=无统计学差异;
[0037]
图5为原花青素b2对玻璃化冷冻卵母细胞钙稳态的影响,其中,a为特异性钙敏感探针与细胞器共定位,标尺:50μm;b为各组卵母细胞胞质钙、线粒体钙和内质网钙水平,标尺:50μm;c为卵母细胞胞质钙水平分析;d为卵母细胞线粒体钙水平分析;e为卵母细胞内质网钙水平分析;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,***p<0.001,ns=无统计学差异;
[0038]
图6为原花青素b2改善玻璃化冷冻卵母细胞的dna损伤,其中,a为卵母细胞内dna损伤水平分析,标尺:50μm;b为各组卵母细胞dna损伤水平;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,**p<0.01;
[0039]
图7为原花青素b2对玻璃化冷冻卵母细胞早期凋亡和自噬的影响,其中,a为各组卵母细胞早期凋亡发生和自噬免疫荧光染色,标尺:50μm;b为卵母细胞内早期凋亡发生比例;c为卵母细胞lc3荧光强度分析;d为qpcr检测beclin1、map1lc3a、ulk1、atg14、lamp1和lamp2的mrna水平;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,**p<0.01,***p<0.001,ns=无统计学差异;
[0040]
图8为原花青素b2重塑冷冻卵母细胞的皮质张力,其中,a为各组卵母细胞perm免疫荧光染色的代表性图片,标尺:100μm;b为各组卵母细胞pmrlc免疫荧光染色的代表性图片,标尺:100μm;c为各组卵母细胞perm的平均荧光强度分析;d为各组卵母细胞pmrlc的平均荧光强度分析;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误。***p<0.001;
[0041]
图9为皮质张力对线粒体功能的影响,其中,a为通过jc-1染色检测线粒体膜电位,在解冻过程中,将cona、pcb2和ml-7添加到恢复培养基中1小时,标尺:50μm;b为线粒体分布的代表图像,卵母细胞用mito-tracker green染色,标尺:50μm;c为各组卵母细胞线粒体膜电势分析;d为各组卵母细胞线粒体分布异常比例分析;e为各组卵母细胞的atp水平;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,**p<0.01,***p<0.001,ns=无统计学差异;
[0042]
图10为原花青素b2通过线粒体电子传递链调节冷冻卵母细胞皮质张力,其中,a为qpcr检测ndufv1、sdhb、uqcrc2、cox1和atp5a1的mrna水平;b为成熟卵母细胞的perm免疫荧光色,标尺:50μm;c为各组卵母细胞的相对perm荧光强度分析;d为qpcr检测ndufv1的mrna水平;e为qpcr检测atp5a1的mrna水平;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,***p<0.001,ns=无统计学差异;
[0043]
图11为原花青素b2对玻璃化冷冻卵母细胞体外成熟的影响,其中,a为各组卵母细
胞的gvbd和pbe发生,标尺:100μm;b为卵母细胞体外培养2h的gvbd比例;c为卵母细胞体外培养12h的pbe比例;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p《0.05,ns=无统计学差异;
[0044]
图12为原花青素b2对冷冻卵母细胞纺锤体定位的影响,其中,a为各组卵母细胞纺锤体定位的代表性图片,标尺:50μm;b为纺锤体极到卵母细胞皮质的距离(长度,l)和卵母细胞直径(d)的比值;c为各组卵母细胞肌动蛋白的代表性图片,标尺:50μm;d为f-actin的相对荧光强度;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,**p<0.01,***p<0.001;
[0045]
图13为原花青素b2降低纺锤体异常比例和非整倍体率,其中,a为各组卵母细胞纺锤体形态的代表性图片,标尺:50μm;b为卵母细胞整倍体和非整倍体的代表性图片,标尺:50μm;c为各组卵母细胞纺锤体形态异常的比例分析;d为各组卵母细胞非整倍体率的比例分析;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,*p<0.05,**p<0.01,***p<0.001;
[0046]
图14为原花青素b2提高冷冻卵母细胞孤雌激活囊胚的质量,其中,a为各组囊胚的cdx2和nanog免疫荧光染色代表性图片,标尺:50μm;b为各组卵母细胞icm:te比值分析;c为各组卵母细胞icm:total cell比值分析;“n”代表实验中使用的卵母细胞数目,所有实验至少进行三次生物学重复,数据表示为平均值
±
标准误,***p<0.001;
[0047]
图15为原花青素b2主要参与了胚胎发育过程中糖代谢的调节,其中,a为靶向代谢组学样品采集示意图;b为l-羟脯氨酸在不同组中的相对含量;c为l-瓜氨酸在不同组中的相对含量;d为l-犬尿酸水合物在不同组中的相对含量;e为l-谷氨酸在不同组中的相对含量;f为阿拉伯糖在不同组中的平均含量;g为果糖在不同组中的平均含量;h为葡萄糖在不同组中的平均含量;i为麦芽糖在不同组中的平均含量;j为木糖在不同组中的平均含量;所有实验至少进行三次生物学重复。ns=无统计学差异。
具体实施方式
[0048]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0049]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0050]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
[0051]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实
施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
[0052]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0053]
实施例1原花青素在mii期卵母细胞冷冻中的应用
[0054]
一、实验方法
[0055]
1.1卵母细胞收集
[0056]
mii期卵母细胞获取:取4-6w icr小鼠,腹腔注射孕马血清促性腺激素(pmsg)10iu,48h后腹腔注射人绒毛膜促性腺激素(hcg)10iu,hcg注射12-14h后颈椎脱臼法处死小鼠,取输卵管,在解剖镜下划破膨大部,获取卵丘卵母细胞复合体,透明质酸酶处理后收集排出第一极体的mⅱ期卵母细胞备用。
[0057]
1.2卵母细胞冷冻
[0058]
卵母细胞玻璃化冷冻解冻方法参照常规步骤,具体为:将卵母细胞置于ed液(冷冻平衡液),即含10%二甲基亚砜、10%乙二醇的pbs液,30sec,随后转移至edfs30液(玻璃化冷冻液),即含15%乙二醇、15%二甲基亚砜、0.5m蔗糖、30%聚蔗糖(ficoll)的pbs液,将卵母细胞置于载杆前端,投入液氮,卵母细胞从进入edfs30液开始到投入液氮的时间控制在25sec内。解冻时,将待解冻的载杆迅速从液氮中取出,置于解冻液(含0.5m蔗糖的pbs)中作用5min,然后用m2液(一种修正的krebs-ringer溶液,成分为:丙酮酸钠0.036g/l,mgso4×
7h2o 0.293g/l,链霉素5.0g/l,kh2po40.162g/l,青霉素g 7.5g/l,kcl 0.356g/l,葡萄糖1.0g/l,nahco30.349g/l,nacl5.533g/l,60%乳酸钠4.349ml/l,hepes 4.969g/l,cacl2×
2h2o 0.252g/l,bsa4.0g/l)清洗三遍后备用。
[0059]
卵母细胞分组:新鲜对照组卵母细胞(ct)、玻璃化冷冻卵母细胞(vt)、pcb2处理组(pcb2-vt),pcb2-vt组即在冷冻保存液(ed液和edfs30液)、解冻液及解冻后恢复液中分别添加5μg/mlpcb2,解冻后卵母细胞在恢复液中培养1h备用。
[0060]
冷冻平衡液的配制方法:pbs溶液中加入10%二甲基亚砜(v:v)和10%乙二醇(v:v),得到ed液,即为冷冻平衡液。
[0061]
玻璃化冷冻液的配制方法:pbs溶液中加入15%二甲基亚砜(v:v)、15%乙二醇(v:v)、0.5m蔗糖、30%ficoll,得到edfs30液,即为玻璃化冷冻液。
[0062]
解冻后恢复液的配置方法:m2液中添加5μg/mlpcb2。
[0063]
1.3卵母细胞氧化应激指标检测
[0064]
1.3.1ros测定
[0065]
采用2’,7
’‑
二氯荧光素二乙酸酯(2
′
,7
′‑
dichlorofluorescin diacetate,dchfda)测定ros,取卵母细胞置于10mm dcfhda液滴中,于37℃培养箱中孵育20min。卵母细胞经含0.1%bsa(牛血清蛋白)的dpbs洗涤三次后置于荧光显微镜下观察,激发光460nm。实验重复三次。
[0066]
1.3.2gsh检测
[0067]
采用4-氯甲基-6,8-二氟-7-羟基香豆素(4-chloromethyl-6,8-difluoro-7-hydroxycoumarin)测定gsh,取卵母细胞置于10μmol/l的gsh染料液滴中,于37℃培养箱中孵育20min。卵母细胞经含0.1%bsa的dpbs洗涤三次后置于荧光显微镜下观察,激发光为370nm。实验重复三次。
[0068]
1.4卵母细胞线粒体功能分析
[0069]
1.4.1线粒体膜电位(
△
ψm)检测
[0070]
采用荧光探针jc-1检测线粒体膜电位。收集各组卵母细胞,用含0.1%bsa的dpbs清洗三次后放入10mm jc-1液滴中,于37℃培养箱中孵育30min。卵母细胞经含0.1%bsa的dpbs洗涤三次后置于荧光显微镜下观察。jc-1单体最大激发波长为514nm,最大发射波长为529nm;聚合物最大激发波长为585nm,最大发射波长为590nm。实验重复三次。
[0071]
1.4.2atp含量检测
[0072]
制备atp标准品。将各组卵母细胞加入到含有atp裂解液的pcr管中,裂解完成后加入atp检测缓冲液,最后加入atp检测预混液,充分混匀,室温下避光孵育30min,用化学发光仪进行检测。根据已知浓度的标准品计算出每个待测样本中atp总量,最后除掉卵母细胞个数,即可得到每个卵内atp含量。实验重复三次。
[0073]
1.4.3线粒体温度检测
[0074]
使用mito thermos yellow(mty)探针检测线粒体温度。首先用m2液将mty稀释为0.5μm,做盘放入37℃培养箱中预热15min,卵母细胞与mty染液于37℃培养箱避光孵育15min;用m2清洗3次,置于m2微滴中于激光共聚焦显微镜下进行拍照。
[0075]
1.5线粒体及内质网分布检测
[0076]
线粒体分布检测:将卵母细胞用m2清洗3次后备用;使用mito-tracker red或mito-tracker green探针检测卵母细胞线粒体分布。首先用m2液将探针稀释为5μm,做盘放入37℃培养箱中预热20min;将卵母细胞与mito-tracker red或mito-tracker green染液于37℃培养箱避光孵育20min;用m2清洗3次,孵育到预热的h33342微滴中,37℃培养箱中孵育10min;用m2液清洗3次,置于微滴中于激光共聚焦显微镜下观察。线粒体均匀分布在卵母细胞的胞质中为正常分布;线粒体成簇状或者在卵母细胞的胞质中呈现不均匀分布则为异常分布。
[0077]
内质网分布检测:将卵母细胞用m2清洗3次后备用;使用er-tracker red探针检测卵母细胞内质网分布。首先用m2液将探针稀释为5μm,做盘放入37℃培养箱中预热20min;将卵母细胞与er-tracker red染液于37℃培养箱避光孵育20min;m2清洗3次后于预热的h33342微滴中,37℃培养箱中孵育10min,孵育完成后用m2清洗3次,置于m2微滴中于激光共聚焦显微镜下进行拍照。统计内质网分布异常:内质网均匀分布在卵母细胞的胞质中为正常分布;内质网成簇状或者在卵母细胞的胞质中呈现不均匀分布则为异常分布。
[0078]
1.6卵母细胞钙含量检测
[0079]
使用胞质钙离子特异性探针fluo 3-am、线粒体钙特异性探针rhod 2-am和内质网钙特异性探针fluo 4-am分别检测卵母细胞内胞质钙、线粒体钙和内质网钙水平。首先用m2液将探针稀释为5μm,做盘放入37℃培养箱中预热20min;将卵母细胞用m2清洗3次,用链霉蛋白酶脱去透明带,于m2中清洗3次备用;将卵母细胞与钙离子探针染液于37℃培养箱避光孵育20min,孵育完成后的卵母细胞,用m2清洗3次,置于m2微滴中于激光共聚焦显微镜下进行拍照,拍照时保持各组之间拍照的参数和曝光时间一致,采用nis-elements ar软件分析荧光值。
[0080]
1.7早期凋亡发生检测
[0081]
将卵母细胞用m2清洗3次后备用;将卵母细胞孵育到含有5μlannexin-v fitc的
100μl缓冲液中,于37℃培养箱中孵育10min;孵育完成后用m2清洗3次,置于m2微滴中于倒置荧光显微镜下进行拍照;统计早期凋亡发生情况:未发生早期凋亡的卵母细胞只有透明带处有微弱的绿色荧光;发生早期凋亡的卵母细胞,在透明带处和卵母细胞的细胞膜处都有绿色荧光。
[0082]
1.8rna提取、反转录及实时荧光定量pcr
[0083]
收集卵母细胞,按每组30-50枚将卵母细胞收集到1.5ml离心管中,吸除多余的液体,保存于-80℃冰箱中;trizol提取卵母细胞rna;进行反转录,反转录体系如表1所示,反应程序如表2所示,反转录完成后,样品cdna保存于-80℃冰箱中备用。按照10倍连续梯度稀释的方法,将反转录后的cdna样品梯度稀释为5个不同浓度的cdna模板,进行引物效率验证,pcr反应体系如表3所示,引物序列如表4所示,qpcr程序如表5所示。实时荧光定量pcr反应结束后,观察溶解曲线,若溶解曲线呈单峰则认为结果可信。以模板浓度的对数为横坐标,以ct值为纵坐标做标准曲线,根据斜率计算引物扩增效率。引物的扩增效率》90%且《110%则引物可用于后续实验。以β-actin作为内参基因,用2
‑△△
ct
的方法分别计算目的基因的相对表达含量。
[0084]
表1反转录体系(20μl)
[0085][0086]
表2反转录程序:
[0087][0088]
表3 qpcr反应(20μl体系):
[0089][0090]
表4引物序列
[0091][0092][0093]
表5荧光定量pcr反应程序
[0094][0095]
1.9免疫荧光染色
[0096]
将卵母细胞置于固定液中室温固定1h以上。若卵母细胞脱去透明带,则将固定液用dpbs按照1:1的比例稀释后再用于固定卵母细胞30min;固定后的卵母细胞用pbs-0.1%pva洗液清洗3遍后置于0.5%triton-pbs-0.1%pva通透液中,室温通透1h。若卵母细胞脱
去透明带,则通透20min;通透后的卵母细胞用0.1%triton-pbs-0.1%pva洗液清洗3遍后置于3%bsa-0.1%triton-pbs-0.1%pva封闭液中,室温封闭1h;封闭后的卵母细胞直接置于配制好的一抗中,4℃过夜孵育或37℃培养箱孵育2.5h,阴性对照组用封闭液或免疫染色一抗稀释液代替一抗;一抗孵育完成后的卵母细胞用0.1%triton-pbs-0.1%pva洗液清洗3遍,随后置于配置好的二抗中,室温孵育1h;二抗孵育完成后的卵母细胞用0.1%triton-pbs-0.1%pva洗液清洗3遍,随后用dapi染核5min;将染核完成后的卵母细胞转移到粘性载玻片上,用盖玻片进行压片观察。若卵母细胞不进行压片,则将染核完成后的卵母细胞用m2清洗3遍,置于玻璃底培养皿的微滴中,覆盖石蜡油进行观察。使用a1 confocal激光共聚焦显微镜进行拍照观察,若数据需要对荧光强度进行统计,则需要控制各组之间的成像参数以及曝光时间一致,控制变量。
[0097]
二、实验结果
[0098]
2.1 pcb2可提高冷冻卵母细胞存活及囊胚发育率
[0099]
分别在冷冻保存液、解冻液中添加不同浓度的pcb2(1μg/ml、5μg/ml、25μg/ml),分析其对冷冻卵母细胞存活及囊胚发育的影响(图1a),结果显示5μg/mlpcb2可显著提高冷冻卵母细胞存活率(图1b),并显著提高孤雌激活后的卵裂率(p《0.05,图1c)及囊胚发育率(p《0.05)(图1d)。
[0100]
2.2 pcb2可降低冷冻卵母细胞氧化应激
[0101]
采用免疫荧光染色法分别检测新鲜、冷冻及pcb2处理组冷冻卵母细胞中ros及gsh含量(图2a),冷冻保存液、解冻液中分别添加5μg/ml pcb2可显著降低冷冻卵母细胞ros水平(p《0.05,图2b),可使冷冻卵母细胞中gsh水平显著升高(p《0.001,图2c)。
[0102]
2.3 pcb2对冷冻卵母细胞细胞器分布的影响
[0103]
如图3a所示,新鲜组卵母细胞线粒体呈现胞质的均匀分布,而冷冻组的卵母细胞线粒体则呈现簇状的异常分布。经pcb2处理后,线粒体异常分布比例显著降低(p<0.05,图3b)。内质网的分布如图3c所示,内质网的异常分布在不同组之间没有统计学差异(p》0.05,图3d)。
[0104]
2.4 pcb2可改善冷冻卵母细胞线粒体功能
[0105]
线粒体膜电势可以直观的反应线粒体的功能,线粒体膜电势的检测如图4a所示,pcb2可以显著提高玻璃化冷冻导致的卵母细胞膜电势降低(p<0.001,图4c)。
[0106]
mty是一种线粒体温度特异性探针,其荧光强度与线粒体温度成反比,mty检测如图4b所示。冷冻后卵母细胞线粒体温度升高,而pcb2的补充可以显著降低线粒体温度(p<0.05,图4d)。研究表明,线粒体动力学受损引起的线粒体聚集也会损害卵母细胞的线粒体功能,分别对线粒体融合(opa1,mfn1,mfn2)和分裂(drp1)基因的mrna水平进行检测。结果显示,与新鲜组卵母细胞相比,冷冻卵母细胞中mfn1、mfn2、drp1表达量显著下降,而pcb2的补充可以显著改善线粒体动力学(图4e)。
[0107]
2.5 pcb2对冷冻卵母细胞钙稳态的影响
[0108]
rhod 2-am和fluo 4-am分别是线粒体钙和内质网钙的特异性荧光探针,细胞器共定位结果显示:rhod 2-am与mito tracker共定位,fluo 4-am与er tracker共定位(图5a)。如图5b所示,分别对卵母细胞内胞质钙、线粒体钙和内质网钙水平进行检测,结果表明:玻璃化冷冻对卵母细胞的胞质钙水平没有明显影响(p》0.05,图5c),但冷冻可以引起卵母细
胞线粒体钙水平异常升高(图5d),pcb2的补充可以显著改善冷冻造成的线粒体钙超载(p<0.001)。与线粒体钙水平相反的是,内质网钙经玻璃化冷冻后异常降低,pcb2的补充可以显著升高冷冻卵母细胞的内质网钙(p<0.001,图5e)。
[0109]
2.6 pcb2对冷冻卵母细胞dna损伤的影响
[0110]
如图6a-b所示,冷冻后卵母细胞dna损伤显著增加(p<0.01),pcb2的添加可以显著降低dna损伤(p<0.01)。
[0111]
2.7 pcb2对冷冻卵母细胞早期凋亡及自噬的影响
[0112]
早期凋亡及自噬免疫荧光染色如图7a所示,pcb2可以显著降低玻璃化冷冻卵母细胞的早期凋亡的发生比例(p<0.01,图7b)和自噬水平(p<0.001,图7c)。对自噬和溶酶体相关基因检测发现,玻璃化冷冻可导致mpa1lc3a和atg14的mrna水平显著升高,而pcb2可以显著降低其表达水平(图7d)。
[0113]
2.8 pcb2对冷冻卵母细胞皮质张力的影响
[0114]
肌动蛋白在介导纺锤体迁移方面的功能部分是通过皮质张力来实现的,perm和pmrlc是两种重要的皮质张力调节蛋白,采用免疫荧光染色检测其表达量(图8a-b)。结果显示perm的平均荧光强度在冷冻组中明显下降(p<0.001,图8c),而玻璃化冷冻后细胞质中pmrlc的荧光信号明显增加(p<0.001,图8d)。研究发现pcb2可重塑冷冻卵母细胞的皮质张力,这表现在升高的perm荧光强度(p<0.001)和降低的pmrlc荧光强度(p<0.001)。
[0115]
2.9皮质张力调节与线粒体功能密切相关
[0116]
cona是一种四价凝集素,通过与细胞膜糖基化蛋白结合而交联在细胞的表面。据报道,cona处理可以增加卵母细胞的皮质张力。在此,我们使用cona或肌球蛋白轻链激酶(mlck)特异性抑制剂ml-7分别诱导皮质张力的增加或降低,并进一步研究它们对线粒体膜电势(图9a)、线粒体分布(图9b)和atp(图9e)的影响。与冷冻组相比,pcb2(p<0.01)和cona(p<0.001)都显著提高了冷冻后卵母细胞的线粒体膜电势。pcb2也可以提高ml-7处理后冷冻卵母细胞的线粒体膜电势(p<0.05,图9c)。此外,pcb2和cona都显著改善了冷冻卵母细胞的线粒体分布异常(p<0.01,图9d)。值得注意的是,与cona相比,pcb2可显著提高冷冻后卵母细胞的atp水平(p<0.05,图e)。上述结果表明,pcb2的处理不仅缓解了线粒体功能异常,还促进了atp的产生。
[0117]
2.10 pcb2通过电子传递链调节冷冻卵母细胞皮质张力
[0118]
对线粒体电子传递链相关基因行qpcr检测发现,玻璃化冷冻可导致ndufv1、cox1和atp5a1的mrna水平显著降低,而pcb2可显著升高其表达水平(图10a)。用鱼藤酮(rotenone,线粒体电子传递链复合体i抑制剂)、二苯基碘(dpi,磷酸戊糖途径抑制剂)和寡霉素(oligomycin,atp合成酶抑制剂)分别处理冷冻卵母细胞并检测各组perm表达水平(图10b)。如图10c所示,与玻璃化冷冻卵母细胞相比,rotenone(p<0.01)、dpi(p<0.001)、寡霉素(p<0.001)处理均可使卵母细胞perm的相对荧光强度均显著降低。其中,寡霉素几乎消除了perm在卵母细胞皮质区的分布。当用pcb2与上述三种抑制剂联合处理冷冻卵母细胞,进一步检测pcb2能否改善抑制剂处理后的皮质张力异常。结果显示,pcb2可以挽救鱼藤酮(p<0.001)或dpi(p<0.001)诱导的皮质张力降低,但不能挽救寡霉素(p》0.05)造成的皮质张力下降。此外,分别检测pcb2与鱼藤酮和寡霉素联合处理后ndufv1和atp5a1的mrna水平。如图2-10d和e所示,鱼藤酮处理后,冷冻卵母细胞ndufv1的表达量显著降低(p<
0.05),pcb2的联合使用可以提高ndufv1的表达(p<0.05);但是寡霉素以及pcb2与寡霉素的联合处理都对冷冻卵母细胞atp5a1的mrna水平无影响。这表明pcb2可以通过线粒体电子传递链和磷酸戊糖途径调节卵母细胞的皮质张力。
[0119]
实施例2原花青素b2在gv期卵母细胞冷冻中的应用
[0120]
一、实验方法:
[0121]
1.1gv期卵母细胞获取:小鼠腹腔注射10iu的孕马血清促性腺激素(pregnant mare serum gonadotropin,pmsg),46-48h后对小鼠进行颈椎脱臼法处死。取出卵巢,置于提前在培养箱平衡好的hx盘中,用1ml注射器针头将卵巢表面的卵泡全部刺破,获得卵丘-卵母细胞复合体(cumulus oocyte complex,cocs)。将卵母细胞表面的颗粒细胞脱去后,获得的gv期卵母细胞入孵到提前在培养箱平衡好的m16培养液(成分为:cacl2×
2h2o 0.25137g/l,mgso40.1649 g/l,kcl 0.35635g/l,kh2po40.162 g/l,nahco32.101 g/l,nacl 5.53193g/l,bsa4.0 g/l,d-葡萄糖1.0g/l,酚红钠0.0106g/l,丙酮酸钠0.0363g/l,dl-乳酸钠2.95g/l,青霉素g钾0.06g/l,硫酸链霉素0.05g/l)中,37℃,5%co2培养箱中培养2h后统计gvbd发生率、培养12h后统计极体排出率。
[0122]
1.2卵母细胞冷冻方法同实施例1。
[0123]
1.3免疫荧光染色方法同实施例1,根据实验目的选择不同抗体。
[0124]
1.4染色体铺片
[0125]
将卵母细胞用m2液清洗3次后备用;配制诺考达唑:将诺考达唑用m2液稀释成为2mg/ml工作浓度,做微滴;将卵母细胞于诺考达唑微滴中,37℃共孵育20min,随后用m2液洗脱干净,用链霉蛋白酶脱去透明带;将脱去透明带的卵母细胞于m2中清洗3次后,用1%柠檬酸钠溶液低渗处理约5min,直到卵母细胞膨胀但不破裂;在原位杂交载玻片上,用疏水笔画圈处理,然后在圆圈内滴加约20μl铺片液,将膨胀的卵母细胞从铺片液的液面顶端吹入,使卵母细胞自由落体至载玻片上到完全溶解;将载玻片于室温中自然风干,风干后在玻片圆圈内滴加dapi,盖上盖玻片后于激光共聚焦显微镜下进行拍照,并统计卵母细胞核型。
[0126]
二、结果:
[0127]
2.1 pcb2对冷冻卵母细胞减数分裂的影响
[0128]
为了探究pcb2能否缓解玻璃化冷冻对小鼠卵母细胞造成的减数分裂损伤,在体外成熟过程中添加5μg/ml的pcb2,评估各组卵母细胞gvbd、pbe比例(图11a)。如图11b所示,冷冻可显著降低gvbd(p<0.05)、pbe(p<0.05)比例,而pcb2可以显著提高冷冻组卵母细胞极体排出率(p<0.05),但对gvbd(p》0.05)的发生无影响。
[0129]
2.2 pcb2对冷冻卵母细胞纺锤体迁移的影响
[0130]
纺锤体定位可通过纺锤体极到卵母细胞皮质的距离(长度,l)和卵母细胞直径(d)来量化。其中,纺锤体向皮层迁移的速率用l/d的比值来反应。如图12a-b所示,当新鲜组卵母细胞的纺锤体迁移到皮质区域时,冷冻组卵母细胞的纺锤体则仍位于细胞中心的位置。此外,l/d反映了冷冻组卵母细胞在体外成熟9h后的纺锤体迁移速率要显著高于新鲜组(p<0.001)。pcb2的补充可以挽救纺锤体的错误定位(p<0.01)。为进一步探究纺锤体定位缺陷的原因,对mi期卵母细胞肌动蛋白的分布和表达进行检测。如图12c-d所示,与新鲜组相比,冷冻组卵母细胞的f-actin的相对荧光强度显著降低,而pcb2的补充可以挽救这一现象(p<0.001)。
[0131]
2.3 pcb2对冷冻卵母细胞纺锤体形态及非整倍体率的影响
[0132]
mii期纺锤体形态检测如图13a、c所示,新鲜组卵母细胞纺锤体呈规则桶形,而冷冻后卵母细胞纺锤体则丧失了正常的形状,与新鲜卵母细胞相比,冷冻卵母细胞纺锤体异常形态比例显著升高(p<0.001),而pcb2的补充可以显著改善这一现象(p<0.01)。减数第二次分裂中期纺锤体的异常形态常伴随着高发的非整倍体。如图13b、d所示,冷冻后卵母细胞的非整倍率较新鲜组显著升高(p<0.001),pcb2的补充可以降低冷冻组卵母细胞的非整倍率(p<0.05)。
[0133]
实施例3原花青素对冷冻卵母细胞后续发育能力的影响
[0134]
一、实验方法:
[0135]
1.1卵母细胞获取同实施例1。
[0136]
1.2卵母细胞冷冻方法同实施例1。
[0137]
1.3卵母细胞孤雌激活
[0138]
平衡胚胎发育盘:提前一晚将ksom培养液(edta 0.38mg/100ml,丙酮酸钠2.2mg/100ml,葡萄糖3.6mg/100ml,kh2po44.75mg/100ml,mgso4×
7h2o 4.95mg/100ml,链霉素5.0mg/100ml,青霉素g 6.3mg/100ml,kcl 18.5mg/100ml,谷氨酰胺14.5mg/100ml,nahco3210.0 mg/100ml,nacl 559.5mg/100ml,60%乳酸钠174μl/100ml,必需氨基酸
×
501000μl/100ml,非必需氨基酸
×
100500μl/100ml,酚红50μl/100ml,cacl2×
2h2o 25mg/100ml,胎牛血清100mg/100ml)做盘,置于37℃,5%co2培养箱中过夜平衡;混合a液配制及激活:取无钙的htf液890μl,加入100μl的srcl2和10μl的cb,充分混匀。将a液做盘并置于37℃,5%co2培养箱中平衡10分钟。平衡后,将mii期的卵母细胞用a液清洗3次后,置于a液中激活2.5小时;混合b液配制及激活:取含钙的htf液990μl,加入10μl的cb,充分混匀。将b液做盘并置于37℃,5%co2培养箱中平衡10分钟。平衡后,将a液激活后的卵母细胞用b液清洗3次后,置于b液中激活3.5小时;统计原核及胚胎培养:将b液激活后的原核用提前一晚平衡好的ksom培养液清洗3次后,统计原核发生率。将原核置于ksom中于37℃,5%co2培养箱中进行后续胚胎培养。此时记为胚胎发育0h,分别在24h和96h后统计卵裂数和囊胚数。
[0139]
1.4囊胚质量检测
[0140]
将囊胚于固定液中室温固定30min,随后使用0.5%tritonx-100-dpbs通透液室温通透1h,经0.1%tritonx-100-0.1%pva-dpbs洗液洗三次后转移至免疫荧光封闭液中室温封闭1h,随后在nanog(1:1000)和cdx2(1:500)一抗中4℃过夜孵育;在fitc-488和alex-594二抗中室温孵育1h,经dapi染核5min后压片观察。通过对内细胞团和滋养层细胞分别计数,统计内细胞团占总囊胚细胞数的比例。实验重复三次。
[0141]
1.5囊胚培养液代谢组学检测
[0142]
将各组胚胎取出,留下胚胎培养液,用1ml注射器吸取培养液并转移至1.5ml离心管中,每个重复取200μl培养液,-80℃冰箱保存;全部样品收集完成后,进行囊胚培养液中氨基酸及糖类靶向代谢组学测序。
[0143]
糖类检测:样品于4℃缓慢解冻,取0.1ml样品加入300μl 80%的甲醇水,涡旋混匀;4℃超声震荡30min,4℃静置60min;4℃,12000rpm离心10min,取上清液进样做lc-ms/ms分析。
[0144]
氨基酸检测:样品于4℃缓慢解冻,取50μl样品置于1.5ml离心管内;加入450μl(含
内标100ng/ml)冰甲醇,充分震荡1min;4℃静置30min,12000rpm离心10min,随后取上清液上机检测。
[0145]
二、实验结果
[0146]
2.1 pcb2对冷冻卵母细胞孤雌激活胚胎发育的影响
[0147]
cdx2(滋养层(te)的细胞系特异性标记)和nanog(内细胞团(icm)的细胞系特异性标记)的免疫荧光染色如图14a所示,可以发现,冷冻后卵母细胞孤雌激活囊胚总icm与te的比率(p<0.001)及icm与总细胞数的比率(p<0.001)均较新鲜组显著下降,pcb2处理后囊胚质量得到了极大的改善(图14b-c)。在pcb2处理中,icm与te的比率(p<0.001)和icm与总细胞数的比率(p<0.001)均显著增加,这表明囊胚质量得到了显著的改善。
[0148]
2.2 pcb2对冷冻卵母细胞孤雌激活胚胎代谢的影响
[0149]
对新鲜组、冷冻组和pcb2处理组冷冻卵母细胞孤雌激活后第4天的培养基行靶向代谢组学分析,样品采集如图15a所示。氨基酸的靶向代谢组结果显示(图15b-e),冷冻组的囊胚培养液中l-羟基脯氨酸、l-瓜氨酸、l-犬尿氨酸水合物的相对含量均显著降低。但是只有l-谷氨酸的相对含量在pcb2处理组中受到显著影响。如图15f-j所示,pcb2的添加对阿拉伯糖、果糖、葡萄糖、麦芽糖和木糖的代谢水平有显著影响,提示pcb2主要参与糖代谢以调节胚胎发育。
[0150]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1