经纯化的人乳低聚糖组合物的制作方法
本申请要求2016年9月19日提交的美国临时申请no.62/396,799的优先权,该临时申请的内容据此全文以引用方式并入。本发明涉及用于制备基本上经纯化的人乳低聚糖(hmo)组合物的工艺、由此制备的基本上经纯化的组合物以及使用所述组合物的方法。
背景技术:
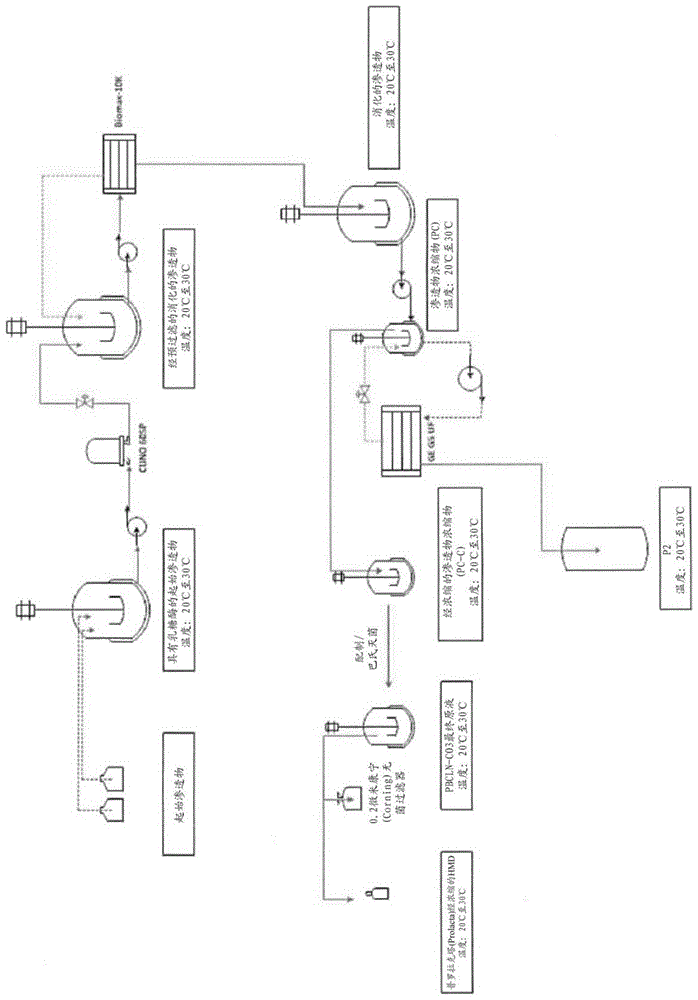
:人乳低聚糖(hmo)是人乳中极为丰富且人乳独有的一类结构多样的未缀合聚糖。最初,hmo被认为是益生元“双歧因子”或人乳聚糖,已发现其能促进肠道双歧杆菌菌种的生长,并且与配方食品喂养的婴儿相比,唯一地存在于母乳喂养的婴儿的粪便中。另外的研究表明,多样的乳聚糖是与母乳喂养相关联的健康益处的部分原因。如今,已明白hmo不仅仅是“虫子的食物”。越来越多的证据表明,hmo是抗粘着抗微生物剂,其用作可溶性诱饵受体,预防病原体附着于婴儿粘膜表面,并且由此降低病毒、细菌和原生动物寄生虫感染的风险。另外,hmo被认为可调节上皮细胞和免疫细胞反应,由此减少过度的粘膜白细胞浸润和炎症,由此降低坏死性小肠结肠炎的风险以及为婴儿提供唾液酸作为脑部发育与认知的潜在必需营养物。hmo由以下五种单糖构成:葡萄糖(glc)、半乳糖(gal)、n-乙酰葡糖胺(glcnac)、岩藻糖(fuc)和唾液酸(sia),其中n-乙酰神经氨酸(neu5ac)是sia的主要(如果不是唯一的话)形式。目前已鉴定了超过两百种不同的hmo,但并非每一名妇女都合成同一组低聚糖,量也不尽相同(在kobata,2010中综述)。因此,hmo的群体多样性通常比任何一名妇女大得多。而且,低聚糖的组成和浓度在哺乳期内也会变化(在kunz等人,2000中综述)。初乳包含高达20g/l至25g/l的hmo,但是当所产乳成熟时,总hmo浓度下降到5g/l至20g/l,通常仍然超过总乳蛋白质的浓度,这使得人乳的hmo级分成为继乳糖和脂肪之后第三丰富的级分。hmo浓度的宽范围和所报道的hmo的多样性不仅反映了妇女间的糖基化途径的已知遗传变异,而且反映了不同学术和合同研究实验室在检测和定量hmo时用到的分析方法的技术差异。然而,可以明确的是,与人乳中的低聚糖相比,存在于其他哺乳动物(诸如奶牛、绵羊和山羊)的乳中的低聚糖具有小得多的丰度,并且结构大不相同。例如,即使牛乳的最富含低聚糖的部分(初乳)也仅包含低聚糖的大约50种分子种类。山羊乳(其被认为包含结构上与hmo最类似的乳低聚糖分布)仅包含约40种分子种类,小于hmo的特征化多样性的25%(thum等人,2015)。除了原料的可用性受限之外,制备乳低聚糖组合物的另一个重大障碍是乳糖和其他矿物的减少,这些乳糖和矿物在低聚糖分离和浓缩期间(特别是在超滤时)往往会随乳的低聚糖部分一起浓缩,这不同于蛋白质沉淀,后者用于去除蛋白质并且这样做不会损失产量。虽然不论待处理的乳的种类如何,这始终是工艺限制,但是任何时候感受到的该问题都不及在人低聚糖组合物的制备时严峻,这是由于原料十分稀缺,使得产量损失不可接受。其他人已尝试通过使用基于溶剂的体系去除蛋白质和其他常量营养物来解决该问题。该方法预防与超滤工艺相关联的乳糖和矿物的积累。事实上,已有报道指出该方法实际上可有助于乳糖去除(参见例如sarney,2000)。然而,该工艺需要使用溶剂并且会有效破坏人乳的其余部分,使之不可用于制备其他救生产品。商品像人乳一样稀缺,这明显不可接受。如本文所用,在避免使用潜在有害的有机溶剂并保留蛋白质级分以用于其他救生产品中的同时,生成人乳渗透物所用到的超滤工艺只会加重乳中的乳糖和矿物的问题。与乳中存在的浓度为≤6%的乳糖水平相比,经浓缩的人乳渗透物的乳糖含量例如在一些情况下可高达10%至15%。即使对于能够通过酶促方式消化乳糖的人来说,这些乳糖水平也难以消化,更不必说没有此功能的人。已使用了若干方法去除乳糖,包括先进行酶消化,然后连续透滤以去除用于消化的酶。即使在通过用有机溶剂沉淀来去除蛋白质(这不同于浓缩乳糖和矿物的超滤)的这些样品中,透滤后仍有显著水平的乳糖,更不必说该组合物的矿物含量。(参见例如sarney,2000和grandison等人,2002)。而且,hmo组合物的透滤还会导致不可接受的低分子量hmo种类(例如,2fl)损失。由于没有天然资源可供获取大量经纯化的hmo,因此市面上的大多数婴儿配方食品并不为新生儿提供任何低聚糖,并且有些婴儿配方食品则提供意在模拟hmo的非天然存在的低聚糖(包括低聚半乳糖(gos)和低聚果糖(fos))、或最近天然存在的hmo的化学合成形式lnnt和2’-fl(bode,2015)。虽然这些组合物可代表对完全不含hmo的组合物的改进,但是它们在hmo的分子种类方面多样性基本上小于普通人乳,并且毫无疑问,在纵观整个群体时多样性比人乳小得多。需要这样的工艺,该工艺允许有效回收、浓缩和纯化在结构和功能上多样的hmo组合物,但基本上减少乳糖和/或矿物含量。技术实现要素:本文提供了制造人乳低聚糖组合物的方法,这些人乳低聚糖组合物保留人乳群体中所见的低聚糖的结构和功能多样性,同时具有基本上减少的乳糖和/或矿物浓度。本文所提供的方法具有可按比例缩放的优点以及不会例如因使用溶剂去除蛋白质而破坏其余乳级分的额外优点。在一个实施方案中,提供了用于制备经纯化的人乳低聚糖(hmo)组合物的方法。在一个实施方案中,该方法包括将人乳渗透物与能够消化乳糖的酶在适用于消化渗透物中的乳糖的条件下混合并且混合足以实现此消化的一段时间。在一些实施方案中,该酶是乳糖酶。在一些实施方案中,在消化之后,从乳糖酶消化的渗透物混合物中去除乳糖酶。在一些实施方案中,在乳糖酶去除之前,例如通过深层过滤器来净化渗透物/乳糖酶混合物。在一些实施方案中,通过过滤从该混合物中去除乳糖酶。在一些实施方案中,该过滤包括通过孔尺寸为约50,000道尔顿的膜的过滤。在一些实施方案中,该方法还包括通过一个或多个另外的过滤器来过滤该混合物。在一个实施方案中,所述一个或多个另外的过滤器包括孔尺寸为约2,000道尔顿至约3,000道尔顿的膜。在一个实施方案中,所述一个或多个另外的过滤器包括孔尺寸为约600道尔顿的膜。在一些实施方案中,在向渗透物中添加乳糖酶之前或同时,调节渗透物的ph和/或热量。在一个实施方案中,将ph调节到约4.3至约4.7。在一个实施方案中,将ph调节到约4.5。在一个实施方案中,在添加乳糖酶之前或同时调节渗透物混合物的热量。在一个实施方案中,将热量调节到约45℃至约55℃的温度。在一个实施方案中,将热量调节到约50℃的温度。在一个实施方案中,将渗透物的ph调节到约4.3至约4.7,并且将热量调节到约45℃至约55℃的温度。在一个实施方案中,以约0.1%w/w至约0.5%w/w的浓度添加乳糖酶。在一些实施方案中,以约0.1%w/w的浓度添加乳糖酶。在一些实施方案中,将乳糖酶与渗透物一起温育约5分钟至约225分钟。在一些实施方案中,将乳糖酶与渗透物一起温育约15分钟至约120分钟。在一些实施方案中,将乳糖酶与渗透物一起温育约30分钟至约90分钟。在一些实施方案中,将乳糖酶与渗透物一起温育约60分钟。在一个实施方案中,在温育之后,将渗透物/乳糖酶混合物冷却到约20℃至约30℃的温度。在一个实施方案中,将渗透物/乳糖酶混合物冷却到约25℃的温度。在一个实施方案中,净化渗透物/乳糖酶混合物。在一个实施方案中,通过深层过滤器来净化渗透物/乳糖酶混合物。在一个实施方案中,深层过滤器包括约1微米至约5微米的过滤器。在一个实施方案中,经由过滤去除乳糖酶。在一个实施方案中,通过孔尺寸为约50,000道尔顿的过滤器经由过滤去除乳糖酶。在一个实施方案中,通过一个或多个另外的过滤器来进一步过滤该组合物。在一些实施方案中,所述一个或多个另外的过滤器包括孔尺寸为约2,000道尔顿至约3,000道尔顿的膜。在一些实施方案中,所述一个或多个另外的过滤器包括孔尺寸≤600道尔顿的膜。在一些实施方案中,通过包括约2,000道尔顿至约3,000道尔顿的膜的过滤器过滤该组合物,然后通过≤600道尔顿的膜过滤。在一些实施方案中,提供了由当前发明的方法制备的经纯化的hmo组合物。在一些实施方案中,与渗透物相比,经纯化的hmo组合物具有减少的乳糖和矿物水平。在一些实施方案中,经纯化的hmo组合物包含小于约5.0%w/w乳糖。在一些实施方案中,hmo组合物包含表1的矿物分布。在一个实施方案中,经纯化的hmo组合物包含约0.5%至约7.5%hmo的hmo浓度。在一些实施方案中,经纯化的hmo组合物包含约1.0%至约2.0%hmo的hmo浓度。在一些实施方案中,经纯化的hmo组合物包含约2.0%至约4.0%hmo的hmo浓度。在一些实施方案中,经纯化的hmo组合物包含约4.0%至约5.0%hmo的hmo浓度。在一些实施方案中,经纯化的hmo组合物包含约5.0%至约7.5%hmo的hmo浓度。在一些实施方案中,经纯化的hmo组合物包含约5.0%w/whmo的hmo浓度。在一个实施方案中,根据本文所述的方法制得的hmo分布包括如图5(e和f)所示的hmo分布。在一些实施方案中,本文提供了用于向对其有需要的受试者施用经纯化的hmo组合物的方法。在一些实施方案中,本文提供了用于治疗或预防对其有需要的受试者的nec的方法。在一些实施方案中,提供了通过施用由本文所述的方法制备的经纯化的hmo组合物来降低全身性炎症的方法。在一些实施方案中,提供了用于治疗或预防对其有需要的受试者的感染的方法。在一些实施方案中,提供了通过施用由本文所述的方法制备的经纯化的hmo组合物来治疗或预防病毒或细菌感染的方法。在一些实施方案中,细菌感染是艰难梭菌(clostridiumdifficile)感染。在一些实施方案中,病毒感染是诺罗病毒或轮状病毒。在一些实施方案中,在另外的药物或治疗剂之前、期间或之后施用经纯化的hmo组合物。在一些实施方案中,在粪便、器官或骨髓移植之前、期间或之后施用经纯化的hmo组合物。在一些实施方案中,在抗生素、抗病毒或抗真菌治疗方案之前、期间或之后施用经纯化的hmo组合物。在一些实施方案中,在益生菌组合物之前、期间或之后施用经纯化的hmo组合物。在一些实施方案中,在化疗和/或放疗之前、期间或之后施用经纯化的hmo组合物。附图说明图1示出了示例性hmo制备工艺的示意图。图2示出了另选的hmo制备工艺的示意图。图3示出了用于从≥8x经浓缩的渗透物从≥8x经浓缩的渗透物制备20x经浓缩的渗透物的工艺的示意图。图4示出了(a)用于配制经纯化的hmo组合物的工艺的示意图以及(b)用于巴氏灭菌和灌装经纯化的hmo组合物的工艺图5示出了来自合并的供体乳(a和b)、人乳渗透物(c和d)和经纯化的hmo组合物(e和f)的中性(a、c和e)和唾液酸化(b、d和f)hmo的hpaec-pad色谱结果。图6示出了使用lc/ms/ms和极性lc获得的、取自施用了hmo的成人的血清、粪便和尿液的全球非靶向代谢组学。结果示出在(a)血清、(b)尿液、(c)粪便和(d)乳中检测出肠胃外hmo和hmo分解产物。图7示出(a)使用lc/ms/ms和极性lc获得的类花生酸代谢途径,以及(b和c)在摄入由本发明方法制备的经纯化的hmo组合物的受试者中随时间推移的类花生酸代谢物的水平。图8示出使用lc/ms/ms和极性lc获得的、在摄入由本发明方法制备的经纯化的hmo组合物的受试者中随时间推移的鞘脂代谢物的血清水平。具体实施方式本发明提供了用于制备具有基本上减少的乳糖和矿物含量的经纯化的人乳低聚糖组合物的工艺、由此制备的新型组合物以及使用此类新型组合物的方法。该工艺以合并的人乳的经过滤的部分开始,因此与任何典型个体妇女相比,本发明的经纯化的hmo组合物可包含hmo的离散分子种类的更为多样的分布。因此,本文的组合物通常被认为是代表性hmo群体,而不是代表性个人的hmo分布。所谓“人乳低聚糖”(本文也称为“hmo”)意指存在于人母乳中的一类结构多样的未缀合聚糖。人乳低聚糖是在还原端处包含乳糖并且通常在非还原端处包含岩藻糖或唾液酸的碳水化合物(morrow等人,2005)。这些末端糖是最强影响细菌的选择性生长以及低聚糖与其他分子或细胞(包括肠腔中的细菌病原体)的相互作用的残基。此外,唾液酸是脑神经节苷脂的结构和功能组分,并且涉及婴儿的神经发育。低聚糖可为游离的或被缀合为糖蛋白、糖脂等,并且被分类为聚糖。它们构成继乳糖和脂质之后的人乳的第三大固体组分(morrow,2005)。然而,大多数乳低聚糖不可被婴儿消化,并且可大体上完好地存在于婴儿粪便中。所谓“渗透物”意指作为超滤产物的乳(例如,合并的人乳)的一部分。具体地讲,(例如,通过约1kda至1000kda的过滤器)超滤后留下的液体。通过该超滤工艺的液体称为渗透物。该工艺的渗余物浓缩人乳蛋白质,然后该人乳蛋白质可用于形成其他救生制剂,例如用于制备人乳强化剂组合物,诸如美国专利no.8,377,455中所述的那些。因此,与依赖于用溶剂沉淀蛋白质的方法(该方法可污染hmo产物)不同,如本文所用,使用超滤来获得基本上不含蛋白质的原料可以保留人乳中有价值的常量营养物的其余部分,同时避免使用有机溶剂。所谓“乳”意指由哺乳动物的乳腺产生并由乳房表达的流体。乳包括所有哺乳性产物,包括但不限于在分娩后任何时间点取得的初乳、全乳和脱脂乳。除非另外指明,如本文所用,“乳”通常是指全人乳。所谓“全乳”意指未去除脂肪的乳(例如,合并的人乳)。所谓“脱脂乳”意指已去除至少75%脂肪的乳(例如,合并的人乳)或另选地已经受离心而去除脂肪的乳。如“基本上减少的乳糖和/或矿物含量”中的所谓“基本上”意指在与尚未经受当前方法的经浓缩的渗透物相比时矿物和/或乳糖水平的减少表现出统计差异。举例来说,在一些实施方案中,乳糖基本上减少的经纯化的hmo组合物包含≤5%的乳糖水平。如本文所用,所谓“基本上由...组成”是指组合物包含特别列举的组分,同时排除其他主要生物活性因子。例如,基本上由hmo组成的组合物将排除诸如蛋白质、脂肪、外源添加物质等物质,但可包含其他惰性或痕量物质,诸如例如水、可接受水平的特定盐、微rna或外来体。如本文所用,术语“经纯化的hmo组合物”意指由本文所提供的方法制备的并且乳糖和/或矿物水平基本上减少的hmo组合物(例如,经浓缩的人渗透物)。图5(e)和(f)中描绘了示例性经纯化的hmo组合物。制备经纯化的hmo组合物的方法人乳渗透物用作原料,由此通过本文所述的工艺制备本发明的经纯化的hmo组合物。用于获得人乳渗透物的方法可见于例如u.s.8,927,027,该专利全文以引用方式并入本文。简而言之,将取自经资格预审的供体的、已进行了药物、污染物、病原体和掺杂物筛查并且过滤去除了耐热细菌孢子的合并的乳(例如,通过离心)分离成奶油和脱脂级分。脱脂级分经历进一步过滤(例如,孔尺寸例如在介于1kda至1000kda之间的超滤),获得富含蛋白质的渗余物和含hmo的渗透物。该工艺的详情可见于例如us8,545,920;us7,914,822;7,943,315;8,278,046;8,628,921;和9,149,052,这些专利均据此全文以引用方式并入。在一个实施方案中,提供了用于制备乳糖水平基本上减少的经纯化的hmo组合物的工艺。该工艺需要从富含乳糖的人乳渗透物级分生化和/或酶促去除乳糖,而不损失产量或改变人乳渗透物的hmo含量的分子分布。并且在一些实施方案中,如果使用酶消化来减少乳糖,则不留下残余灭活的外源蛋白质。在一个实施方案中,用于从人乳渗透物中并因此从经纯化的hmo组合物中减少乳糖的工艺包括以下步骤:a)调节渗透物混合物的ph;b)加热经ph调节的混合物;c)将乳糖酶添加到受热的渗透物混合物中以形成渗透物/乳糖酶混合物并且温育一段时间;d)从混合物中去除乳糖酶并且过滤混合物以去除乳糖酶;以及e)浓缩人乳低聚糖。虽然此处所述的步骤是按时间顺序列出的,但本领域技术人员应当理解,执行步骤(a)至(c)的顺序可改变。也就是说,仅举例来说,可在加热混合物之前或另选地在加热工艺期间的任何时间点添加乳糖酶。类似地,也仅举例来说,可在调节ph之前加热混合物。此外,若干步骤可组合成单个步骤,例如“酶促消化乳糖”或“乳糖酶对乳糖的消化”涉及如上所述的步骤(a)至(c)。可同时或按任何顺序连续执行这些步骤。因此,如本文所用,“乳糖消化”是指以任何顺序、连续或同时执行至少这三个步骤。在一个实施方案中,将渗透物的ph调节到约3至约7.5的ph。在一个实施方案中,将ph调节到约3.5至约7.0的ph。在另一个实施方案中,将ph调节到约3.0至约6.0的ph。在又一个实施方案中,将ph调节到约4至约6.5的ph。在又一个实施方案中,将ph调节到约4.5至约6.0的ph。在再一个实施方案中,将ph调节到约5.0至约5.5的ph。在再一个实施方案中,将ph调节到约4.3至约4.7的ph,优选4.5。可通过添加酸或碱来调节ph。在一些方面,通过添加酸(例如hcl)来调节ph。在又其他方面,通过添加1nhcl并混合一段时间(例如约15分钟)来调节ph。在一个实施方案中,将经ph调节的渗透物加热到约25℃至约60℃的温度。在另一个实施方案中,将渗透物加热到约30℃至约55℃的温度。在另一个实施方案中,将渗透物加热到约40℃至约50℃的温度。在另一个实施方案中,将渗透物加热到约48℃至约50℃的温度。在又一个实施方案中,将渗透物加热到约50℃的温度。在又一个实施方案中,将渗透物加热到小于或等于约40℃的温度。在一个方面,将乳糖酶添加到经ph调节的受热渗透物中,以形成渗透物/乳糖酶混合物并且以便将乳糖分解为单糖。在一个实施方案中,以约0.1%w/w至约0.5%w/w浓度添加乳糖酶。在又一个方面,以约0.1%w/w、或0.2%w/w或0.3%w/w或0.4%w/w或0.5%w/w添加乳糖酶。有许多可使用的市售乳糖酶。因此,乳糖酶可源自任何来源(例如,真菌或细菌来源)。在一些实施方案中,将经ph调节的受热渗透物与乳糖酶一起温育约5至约225分钟。在一些实施方案中,温育时间为约15分钟至约90分钟。在一些实施方案中,温育时间为约30分钟至约90分钟。在一些实施方案中,温育时间为约60分钟。本领域技术人员应当理解,温育时间取决于诸多因素,包括但不限于所使用的酶的来源、混合物的温度和ph以及所使用的酶的浓度。这些变量中的任何一个变量可能要求更长或更短的与乳糖酶一起温育的时间。虽然此处提供的ph、温度和酶温育条件可以对本文所述的工艺发挥最佳效果,但本领域技术人员应当理解,可对这些变量中的一个或多个变量作出修改以实现类似结果。例如,如果使用的酶小于本文所述的约0.1%w/w至约0.5%w/w,则可能需要延长温育时间以实现相同水平的乳糖消化。也可对温度和ph变量两者作出类似调节。在一个实施方案中,在温育之后,将渗透物/乳糖酶混合物冷却到约20℃至约30℃的温度。在特定实施方案中,将渗透物/乳糖酶混合物冷却到约25℃的温度。在一个实施方案中,净化渗透物/乳糖酶混合物以去除不溶性成分。在特定情况下,不溶性物质可在ph和温度改变的过程中形成。因此,在一些实施方案中,可能必要或有利的是,例如通过深层过滤器净化混合物以去除这些不溶性成分。这些过滤器可为0.1微米至10微米过滤器。在一些实施方案中,这些过滤器为约1微米至约5微米过滤器。另选地,可通过离心工艺或离心与膜过滤的组合来实现不溶性成分的去除。净化步骤对制备如本文所述的多样的hmo组合物不是必需的,而是该任选的步骤有助于获得更多经纯化的hmo组合物。此外,净化步骤对滤膜的可重用性很重要,因此对工艺的可缩放性也很重要。在未进行充分净化的情况下,将需要基本上更多的过滤材料,这使得在临床规模下制备hmo组合物既困难又昂贵。然而,应当理解,可在该阶段形成更严格或不太严格的净化以便产生更多或不太纯化的hmo组合物,具体取决于制剂和应用。例如,与用于娇弱群体(例如,新生儿)的一种或多种液体制剂相比,沉淀的矿物对于预定用于冻干的制剂或预定用于健康成人的制剂可不太成问题。此外,在一些情况下可能希望从净化渗透物/乳糖酶混合物去除用过和过量的乳糖酶。然而,有些情况下灭活的外源蛋白质将不会带来生物风险性,并且因此乳糖酶去除或甚至灭活的额外步骤可能并不必要。在一些实施方案中,例如通过高温、高压或两者来灭活用过和过量的乳糖酶。在一些实施方案中,不从该组合物去除灭活的乳糖酶。然而,在其他实施方案中,将需要进一步纯化以去除外源蛋白质。在此类实施方案中,可通过超滤来完成乳糖酶去除。在一些实施方案中,使用超滤膜,例如使用截留分子量≤50,000道尔顿的膜(例如,biomax-50k)来完成超滤。(参见例如图1)在一些实施方案中,通过比截留分子量≤50,000道尔顿的初始膜更小的膜来执行另外的超滤。在一些实施方案中,采用截留分子量为约2,000道尔顿至3,000道尔顿的膜来执行进一步超滤。该另外的任选地过滤步骤通过帮助去除更小的潜在生物活性和/或免疫原性因子(诸如微rna和外来体),进一步提升了hmo产物的总纯度。图3示出采用该另外的过滤步骤的实施方案。在一个实施方案中,对已经历至少一轮且在一些情况下两轮或更多轮超滤(或另选的乳糖酶去除方式)的净化混合物进行进一步过滤,以纯化和浓缩人乳低聚糖并且减少矿物和单糖含量。在一些实施方案中,可使用纳滤膜来完成过滤。在一些实施方案中,该膜具有≤1,000道尔顿的截留分子量。在一些实施方案中,该膜具有≤600道尔顿的截留分子量。在又其他实施方案中,该膜具有约400道尔顿至约500道尔顿的截留分子量。该另外的纳滤是去除单糖、矿物(特别是钙)和更小的分子以产生最终经纯化的hmo组合物的重要步骤。在一些实施方案中,为了去除矿物,可采取另外的或另选的步骤。这种另外的步骤可包括例如对加热(≥40℃)或冷藏/冷冻和解冻的hmo浓缩物进行离心、膜净化(≤0.6微米)、或离心与膜过滤的组合。在一些实施方案中,可使用纳滤膜对这些另外的或另选的步骤的所收集的上清液或滤液进行进一步浓缩。在一些实施方案中,纳滤包括通过截留分子量≤600道尔顿的膜的过滤。在一些实施方案中,这些另外的步骤可在该工艺的任何阶段执行,包括但不限于在巴氏灭菌之前或之后。在一些实施方案中,可对纳滤膜的物理特性进行改性,诸如化学改性,以例如在浓缩的唾液酸化hmo为优选的情况下选择性地浓缩唾液酸化hmo,从而允许更有效地从hmo浓缩物去除中性hmo。在一个实施方案中,对经纯化的hmo组合物进行灭菌。该灭菌可通过本领域已知的任何方式进行。在一些实施方案中,对经纯化的hmo组合物进行巴氏灭菌。在一些方面,在≥63℃下完成最低30分钟的巴氏灭菌。巴氏灭菌后,将该组合物冷却到约25℃至约30℃,并且通过0.2微米过滤器净化以去除任何残余沉淀物质。经纯化的hmo组合物本发明的经纯化的hmo组合物具有基本上减少的乳糖和/或矿物水平。如本文所用,与乳糖水平有关的术语“基本上减少的”意指具有≤5%w/w的乳糖水平。在一些实施方案中,由本文所述的方法制备的经纯化的hmo组合物包含约4.5克至约8.5克的hmo、小于或等于约5%w/w的乳糖以及表1所示的矿物组成:表1:矿物减少的hmo组合物的示例性矿物组成矿物浓度钙(ca)<1000mg/100g铜(cu)<5mg/100g铁(fe)<100mg/g镁(mg)<800mg/100g磷(p)<800mg/100g钾(k)<1500mg/100g钠(na)<10g/100g锌<100mg/100g本领域技术人员应当理解,在一些情况下,诸如当经纯化的hmo产物被配制为例如粉末时,矿物的减少可不太重要。因此,上面给出的值仅作为示例性制剂、并且特别是示例性液体制剂提供,但没有理由该制剂无法制成粉末。在一些实施方案中,经纯化的hmo组合物包含约0.5%至约7.5%。在一些实施方案中,经纯化的hmo组合物包含约1.0%至约2.0%。在一些实施方案中,经纯化的hmo组合物包含约2.0%至约4.0%。在一些实施方案中,经纯化的hmo组合物包含约4.0%至约5.0%。在一些实施方案中,经纯化的hmo组合物包含约5.0%至约7.5%。在一些实施方案中,经纯化的hmo组合物包含小于约2000mosm/kg的渗透度。在一些实施方案中,经纯化的hmo组合物包含小于或等于约10%w/w的葡萄糖。在一些实施方案中,由本文所述的方法制备的经纯化的hmo组合物包含小于或等于约10%w/w的半乳糖。单糖、葡萄糖和半乳糖的存在是乳糖分解的结果,并且当乳糖水平降低时,单糖水平增加。虽然可经由去除矿物和残余乳糖酶的相同过滤工艺来去除大部分单糖含量,但经纯化的hmo产物中仍有低水平的单糖。然而,与二糖乳糖不同,这些单糖的存在对众多个体而言不会带来临床问题,特别是在这些低水平下。本发明的人乳低聚糖组合物在结构和功能上都基本上类似于在全人乳群体中观察到的hmo分布。也就是说,由于这些组合物源自供体合并液而非单独供体,因此hmo系列将比任何一个典型个体中更多样。图5示出合并的人乳(a和b)、人乳渗透物(c和d)以及由本发明的方法制备的经纯化的hmo组合物(e和f)的代表性色谱图。hmo多样性中的最大变量之一源自母亲的刘易斯血型,并且特别是她是否具有活性岩藻糖基转移酶2(fut2)和/或岩藻糖基转移酶3(fut3)基因。当存在活性fut2基因时,产生α1-2连接的岩藻糖,而在fut3基因有活性时岩藻糖残基为α1-4连接的。该“分泌状态”的结果一般是,“分泌型”(即,具有活性fut2基因的那些)产生以α1-2连接的低聚糖为主的更加多样的hmo分布,而“非分泌型”(即,没有活性fut2基因的那些)可包含一系列更多变的例如α1,-4连接的低聚糖(与分泌型相比),但包含多样性过度降低,这是由于它们无法合成分泌型hmo组库的主要组分。在一些实施方案中,可基于例如分泌状态来制造乳合并液。即,在一些实施方案中,可能有利的是将取自分泌型母亲的乳的合并液与取自非分泌型母亲的乳的合并液分开收集。取自分泌型母亲的乳的合并液将包含较大百分比的α1-2连接的hmo,并且可用于例如促进肠道健康或减少炎症。取自非分泌型母亲的乳的合并液将包含一系列更加多样的α1-4连接的低聚糖,并且可用于治疗或预防特定胃肠的病毒感染,包括例如诺罗病毒或轮状病毒。在一些实施方案中,可能有利的是确保用于制备本文所述的经纯化的hmo组合物的任何人乳合并液有特定比例源自分泌型(与非分泌型相比)且反之亦然,从而确保hmo分布有可能最具多样性和代表性。fut2和fut3的多态性仅仅是可用于为特定合并液选择供体的多态性的一般示例。本领域技术人员应当理解,基于任何多态性来分选乳合并液以制造具有特定hmo分布的乳合并液,这可以针对任何多态性进行。可在捐献之前将母亲确定为分泌型或非分泌型,另选地或除此之外,可在母亲成为供体的资格预审期间和/或在接收捐献乳后获得母亲的分泌状态。筛查分泌状态是常规检查,并且可由任何常规方法执行。经纯化的hmo组合物的用途可将本发明的经纯化的hmo组合物添加到人乳强化剂组合物,添加到人乳,添加到婴儿配方食品、非人乳等以增加其营养和/或免疫值。另选地,可将本发明的经纯化的人乳低聚糖组合物配制成口服溶液以供婴儿、大龄儿童和成人食用。在一些实施方案中,可将由本文方法制备的经纯化的hmo组合物冻干或冷冻干燥或以其他方式制成粉末。由于由本文所述的方法制备的经纯化的hmo组合物的抗感染、免疫调节和益生元效应,这些组合物可用于多种多样的生物学和临床环境。此类用途包括但不限于作为抗粘着抗微生物剂、作为肠上皮细胞反应调节剂、作为免疫调节剂和/或抵御坏死性小肠结肠炎(nec)的保护剂。本发明的经纯化的人乳低聚糖组合物可用于正向改变影响抗炎介质生成的人粘膜(例如,胃肠道或泌尿生殖道)的微生物群,和或预防病原细菌粘附在肠上皮表面上。本发明提供了向受试者施用根据本文所述的方法制备的经纯化的hmo组合物的方法。在一些实施方案中,受试者是人早产儿或足月儿。在一些实施方案中,受试者是儿童。在一些实施方案中,受试者是成人。在一些实施方案中,以局部方式、口服方式或直肠方式施用该组合物。在一些实施方案中,经由饲管以口服方式施用该组合物。在一些实施方案中,可在用另一种活性剂治疗之前、期间或之后施用本发明的经纯化的hmo组合物。例如,经纯化的hmo组合物可作为抗生素、抗病毒、抗真菌和/或益生菌疗程的一部分、与抗生素和益生菌剂联合施用。在一个实施方案中,经纯化的hmo组合物可与化疗或放疗相结合地施用。在一些实施方案中,由本文所述的方法制备的经纯化的hmo组合物在与抗生素联合施用时具有协同效应。在一些实施方案中,经纯化的hmo组合物可与粪便移植相结合地施用,或施用给正施用、待施用或最近施用粪便移植的受试者。本发明提供了治疗患有感染或存在患上感染的风险的受试者的方法,所述方法包括向受试者施用经纯化的人乳低聚糖组合物。在一些实施方案中,感染的症状由细菌、细菌毒素、真菌或病毒引起。在一些实施方案中,受试者是人。在一些实施方案中,感染由细菌引起。在一些实施方案中,细菌是艰难梭菌(clostridiumdifficile)。在一些实施方案中,感染由病毒引起。在一些实施方案中,病毒是诺罗病毒或轮状病毒。在另一个实施方案中,病毒是通过炎性爆发引起症状的出血性病毒。在一些实施方案中,病毒是埃博拉病毒或其他出血性热病毒。在一些实施方案中,受试者是人新生儿、婴儿、儿童或成人。在一些实施方案中,治疗包括减轻感染的至少一种症状。在一些实施方案中,治疗包括促进肠道有益菌的发展。在一些实施方案中,肠道有益菌是双歧杆菌(bifidobacteria)、乳酸杆菌(lactobacilli)、链球菌(streptococci)或肠球菌(enterococci)中的一种或多种。在一些实施方案中,本发明的经纯化的hmo组合物可作为抗炎剂施用给对其有需要的受试者。在一些实施方案中,对其有需要的受试者患有炎性病症。在一些实施方案中,受试者患有炎性肠病。在一些实施方案中,受试者患有结肠炎。在一些实施方案中,受试者患有溃疡性结肠炎。在一些实施方案中,受试者患有结肠袋炎。在一些实施方案中,受试者患有克罗恩氏病。在一些实施方案中,受试者患有自身免疫疾病。在一些实施方案中,由当前发明的方法制备的经纯化的hmo组合物可与移植相结合地使用。在一些实施方案中,经纯化的hmo组合物降低了接受移植的患者发生排斥或患上移植物抗宿主病的风险。在一些实施方案中,移植是实体器官移植,并且在一些实施方案中,移植是骨髓移植。实施例实施例1:人乳低聚糖制备用于制备经纯化的hmo组合物的工艺以如上所定义的渗透物开始,该渗透物被解冻和合并。起始渗透物温度介于23℃至28℃之间。通过添加1nhcl并混合约15分钟,将渗透物的ph调节到4.3至4.7(目标4.5)。然后将渗透物加热到约48℃至约55℃,优选50℃。添加乳糖酶(0.1%w/w)以将乳糖分解为单糖,并且然后将溶液混合约60分钟。随后将渗透物/乳糖酶混合物冷却到约20℃至约30℃,优选25℃,并且通过深层过滤器(cuno60sp)进行净化。使用超滤膜(biomax-50k)从经cuno净化的处理流中去除乳糖酶。使用具有标称400至500截留分子量的纳滤膜(geg-5uf)浓缩从biomax-50k收集的渗透物。当渗透物浓缩物(pc)达到人乳低聚糖的目标5%(w/w)时,结束g-5uf浓缩工艺。在灌装之前对配制的pc进行巴氏灭菌并且通过0.2um无菌过滤器进行净化。在产品运输之前,将pc在≤-20℃下储存在容器中,贴上标签并包装。该工艺以图形方式表示于图1中。另选的工艺示于图2中。实施例2:将渗透物浓缩物(pc)处理为经浓缩的渗透物浓缩物(pc-c)将根据实施例1制备的冷冻的渗透物浓缩物(≥8x,称为“pc”)解冻和合并,同时保持约20℃至约30℃的温度范围、优选25℃,并且混合约10分钟。通过超滤(例如使用geg-5uf)进一步浓缩pc以实现≥20x浓缩的目标。将经浓缩的渗透物浓缩物(pc-c)转移到乳储存容器中并且储存在≤-20℃冰箱中以便稍后继续处理。该工艺以图形方式表示于图3中。实施例3:hmo制剂将pc-c解冻和合并,同时保持约20℃至约30℃的温度范围,优选25℃。将计算量的p2-onea或经纯化的水添加到pc-c中以实现5%w/whmo的最终目标。如果不必调节pc-c样品中的hmo浓度,则不需要该步骤。该工艺以图形方式表示于图4(a)中。实施例4:最终容器巴氏灭菌和过滤如果被冷冻的话,则将经浓缩的hmo解冻到约20℃至约30℃,优选25℃。然后在≥63℃下巴氏灭菌约30分钟。巴氏灭菌后,将经浓缩的hmo冷却到约20℃至约30℃的温度、优选25℃以便通过0.2微米无菌过滤器进行净化,然后储存在约2℃至约8℃下。取出代表性样品进行目视检查、总hmo计算、ph、渗透度、矿物和糖分析。当总hmo结果可用时,基于总hmo结果来计算灌装体积以便实现每个剂量的目标hmo范围。当完成hmo结果并形成标签时,将产品从冰箱中取出并转移到iso8洁净室。将标签附连到每个瓶,并且将每个贴有标签的瓶放入气密袋或防窃启气密瓶中并且放在板条箱中。一旦完成板条箱,对板条箱进行双套袋并放回在≤-20℃下的冰箱直到产品准备好运输。该工艺以图形方式表示于图4(b)中。实施例5:经纯化的人乳低聚糖(hmo)成品规格到期日和储存:到期日是自巴氏灭菌之日起一年减一天;储存是在-20℃或更低温度下冷冻。在通过0.2微米过滤器的净化步骤期间,从无菌过滤器容器之一中取出一种代表性样品。该样品用于目视检查、ph、渗透度、糖分布、矿物含量和总hmo计算。该测试的结果汇总于表2中:表2:经纯化的hmo组合物的质量控制测试结果生物负荷最终容器放行测试从灌装工艺中取出代表性样品。每个最终原液批次灌装仅需要一个生物负荷样品。例如:如果将一(1)个最终原液批次灌装到0.1x和0.2x目标剂量中,则仅取出一(1)个样品以同时代表灌装的0.1x和0.2x目标剂量。这些测试的结果在表3中给出。表3:经纯化的hmo产物的生物负荷测试测试规格总需氧菌平板计数(tac)<100cfu/ml1大肠杆菌(e.coli)<1cfu/ml2大肠菌(coliform)<1cfu/ml2沙门氏菌(salmonella)elfa得出呈阴性/25ml1如果结果为≥100cfu/ml,则引发异常条件,并且将测试另外的两(2)个样品。最终报告结果为三个样品的平均值。2如果结果为≥100cfu/ml,则引发异常条件,并且将测试另外的两(2)个样品。最终报告结果为三个样品的平均值。实施例6:经纯化的hmo的生物利用率和生物活性的评估对32名介于18岁和50岁之间的健康成人进行递增剂量对照初始阶段试验,以评估由本发明方法制备且在前述实施例中描述的经纯化的hmo组合物的生物利用率和对免疫系统的潜在效应。研究受试者每天三次经口食用由前述实施例中所述的方法制备的经纯化的hmo浓缩物,并食用连续七天(第1-7天)。四个单独组的男性和女性研究受试者以下列浓度0.1x、0.2x、0.5x和1x接收经纯化的hmo组合物,其中x表示基于人乳中的浓度以及基于体重给予早产儿的剂量计算出的向70kg成人给予的hmo总重量。当前,基于150ml/kg/天的婴儿喂养体积得出这等于0.75g/kg。因此,接收1x的70kg成人将接收52.5g的本文制备的经纯化的hmo组合物。在第1天(其中第1天是摄入经纯化的hmo组合物的第一天)、第7天、第14天和第28天从所有受试者取得血液、尿液、粪便和唾液的样品并且从女性受试者取得阴道试子。测试尿液、血液和粪便中肠胃外hmo3-唾液乳糖以及hmo基料、葡萄糖、岩藻糖、n-乙酰葡糖胺和唾液酸的存在。肠胃外hmo3-唾液乳糖仅完好地存在于尿液中,这表明hmo的再循环,但是hmo的分解产物存在于尿液、血液和粪便所有三种中(图6),从而证实口服递送的经纯化的hmo组合物是生物可利用的。为了确定本研究中施用的口服摄入的经纯化的hmo组合物是否有生物活性,并且特别是经纯化的hmo组合物对全身性炎症标志物是否具有生理效应,测定了血清类花生酸。类花生酸是磷脂酶a作用于细胞膜磷脂而产生的一类多样的免疫激活剂(参见图7(a)),并且其在血清中的升高表示免疫反应的指征。如图7(b)和(c)所示,研究受试者的血清中存在降低的类花生酸及其代谢物水平,并且该降低只会随时间推移变得越来越明显,这表明经纯化的hmo组合物不仅是生物可利用的,而且有生物活性,并且能够降低接收该组合物的受试者的总体炎性特征。为了进一步验证该生物活性,还测定了鞘脂代谢的血清代谢物(炎症的另一种标志物)。如图8所示,与类花生酸类似,若干鞘脂代谢物在接收由此处所述方法制备的经纯化的hmo组合物的受试者中也会随时间推移而减少。总的来说,本文首次提出了有效制备经纯化的hmo组合物的方法,所述经纯化的hmo组合物包含整套hmo,并且乳糖和/或矿物含量大幅减少。而且,该新型经纯化的hmo组合物在本文中示出是生物可利用的,并且有生物活性,对免疫系统有着显著影响。1.baoy,zhul,newburgds.simultaneousquantificationofsialyloligosaccharidesfromhumanmilkbycapillaryelectrophoresis.analbiochem.,2007年,第370卷,第206–214页。2.bode,l.humanmilkoligosaccharides:everybabyneedsasugarmama.glycobiology.,2012年9月,第22卷,第9期,第1147–1162页,于2012年4月18日在线发表。3.14.bode,等人,2016年,nutritionalreviews,第74卷,第10期,第635-644页4.chaturvedip,warrencd,altayem,morrowal,ruiz-palaciosg,pickeringlk,newburgds.fucosylatedhumanmilkoligosaccharidesvarybetweenindividualsandoverthecourseoflactation.glycobiology.,2001年,第11卷,第365–372页。5.coppagv,pieranip,zampinil,carlonii,carluccia,gabriellio.oligosaccharidesinhumanmilkduringdifferentphasesoflactation.actapaediatr.,1999年,第88卷,第89–94页。6.davidsonb,meinzen-derrjk,wagnercl,newburgds,morrowal.fucosylatedoligosaccharidesinhumanmilkinrelationtogestationalageandstageoflactation.advexpmedbiol.,2004年,第554卷,第427–430页。7.gabriellio,zampinil,galeazzit,padellal,santorol,peilac,giulianif,bertinoe,fabrisc,coppagv.pretermmilkoligosaccharidesduringthefirstmonthoflactation.pediatrics.,2011年,第128卷,第e1520–1531页。8.german,jb等人,nestlenutrworkshopserpediatrprogram.,2008年,第62卷,第205-218页。9.grandison,等人,2002年,songklanakarinj.sci.technol.,第24卷(增刊),第91-928页。10.kunzc,rudloffs,baierw,kleinn,strobels.oligosaccharidesinhumanmilk:structural,functional,andmetabolicaspects.annurevnutr.,2000年,第20卷,第699–722页。11.kunzc,rudloffs,schadw,braund.lactose-derivedoligosaccharidesinthemilkofelephants:comparisonwithhumanmilk.brjnutr.,1999年,第82卷,第391–399页。12.kunz等人,“bioactivityofhumanmilkoligosaccharides”第5页infoodoligosaccharides:production,analysisandbioactivity,第一版,editedbydr.f.javiermorenoanddr.luzsanz13.morrowruiz-palaciosgm,jiangx,newburgds.,human-milkglycansthatinhibitpathogenbindingprotectbreast-feedinginfantsagainstinfectiousdiarrhea.j.nutri.,第135卷,第1304-1307页,2005年。14.newburgds,shenz,warrencd.quantitativeanalysisofhumanmilkoligosaccharidesbycapillaryelectrophoresis.advexpmedbiol.,2000年,第478卷,第381–382页。15.sarney,等人,2000年,biotechnol.bioeng.,第69卷,第461-467页16.thum,等人,2015年,jfoodcompandanal.,第42卷,第30-37页。17.ward,2009年,openglycoscience,第2卷,第9-15页18.zivkovic,等人,2011年,proc.natl.acad.sci.,第108卷(增刊1),第4653-4658页。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1