一种代替抗生素预防和治疗猪腹泻及促生长的混合型饲料添加剂及其应用的制作方法
本发明涉及动物营养领域,特别是指一种代替抗生素预防和治疗猪腹泻及促生长的混合型饲料添加剂及其应用。
背景技术
猪腹泻是规模化养殖模式下一种多因素疾病,给养殖厂带来了很大的问题,并对养殖业的可持续发展带来了严重的威胁。猪腹泻造成了猪的成活率下降,饲料转化率降低,猪生长发育迟缓,严重的则造成死亡。抗生素的滥用导致抗药、耐药菌的产生及畜产品中的残留。
益生菌是作为微生物的一种补充剂,它能够改善宿主肠道内有益菌群的平衡,并能给宿主带来有益的积极作用。小檗碱又叫黄连素,是从黄连、黄柏等一些植物中提取出来的,是一种广谱杀菌的中草药,它能够杀灭很多有害菌。本文通过研究对猪腹泻有很好预防和治疗效果的益生菌与小檗碱配伍组合,制成混合型饲料添加剂,探索它对猪生长性能的影响,为抗生素的替代和畜产品的安全生产提供保障。
技术实现要素:
本发明提出一种代替抗生素预防和治疗猪腹泻及促生长的混合饲料及其应用,解决了现有技术中为预防和治疗猪腹泻而大量使用抗生素,造成猪的成活率下降,饲料转化率降低,猪生长发育迟缓的技术问题。
本发明的技术方案是这样实现的:
一种代替抗生素预防和治疗猪腹泻及促生长的混合型饲料添加剂及其应用,该饲料添加剂以猪全价料的用量为基准,包括以下成分0.05-0.11%复合益生菌和0.01%小檗碱。
所述复合益生菌包括干酪乳杆菌、粪肠球菌、枯草芽孢杆菌k4以及布拉迪酵母。
所述复合益生菌中各菌的有效活菌数为干酪乳杆菌1×109cfu/g、粪肠球菌1×1010cfu/g、枯草芽孢杆菌k41×109cfu/g以及布拉迪酵母1×1010cfu/g。
所述小檗碱纯度为98%。
所述的代替抗生素预防和治疗猪腹泻及促生长的混合型饲料添加剂在替代抗生素,提高猪肠道菌群丰度、降低猪腹泻率和死亡率方向的应用。
本发明的有益效果在于:
一、本发明试验选择35d的杜×长×大三元杂交的断奶猪200头,将这些猪随机的分为5个处理组,每个处理组4个重复,每个重复有10头猪(公母各半),进行为期42d的饲养试验。a组:全价料(不含抗生素和氧化锌),b组:全价料+抗生素(喹烯酮、土霉素钙、亚甲基水杨酸)+氧化锌(1600ppm),c组:0.06%益生菌与小檗碱混合物,d组:0.12%益生菌与小檗碱混合物,e组:0.18%益生菌与小檗碱混合物;试验结果表明:各组猪在日增重、采食量、饲料转化率、粗蛋白质、粗脂肪、钙和磷的表观消化率上差异不显著(p>0.05);a组猪的腹泻率和死淘率最高,c组猪的死亡率最低。e组猪粪便中淀粉酶的活性高于a组和c组(p<0.05),d组猪粪便中蛋白酶活性高于c组(p<0.05),其余各组粪便中的淀粉酶和蛋白酶活性无显著差异(p>0.05)。各组猪粪便中总的活菌数、大肠杆菌数和乳酸菌数差异不显著。血清学分析表明,d组血清中igg含量显著地高于a组(p<0.05),b组血清中的尿素氮显著高于c、d组(p<0.05);b组血清中的谷丙转氨酶(alt)和谷草转氨酶(ast)活力分别显著地低于a和c组(p<0.05),b和e组的碱性磷酸酶活力显著低于a组(p<0.05),其它指标各组间差异不显著(p>0.05)。
二、本发明通过微生物的高通量测序可知:3个处理组共产生1540个otu(操作分类单位,表示微生物的多样性,operationaltaxonomocunit),各组otu数量分别为a组598个、b组538个、c组404个,其中共享330个,占总otu数量21.42%,各处理组独有的otu数目仅占3.70%、1.82%、0.71%。各处理组之间优质序列差异不显著(p>0.05),a组菌群丰富度chao指数和ace指数显著地低于b、c组(p<0.05),说明添加抗生素、复合益生菌和小檗碱可提高猪肠道菌群的丰度。各组菌群多样性shannon和simpson指数无显著性差异(p>0.05),说明抗生素、复合益生菌和小檗碱对猪肠道菌群的多样性无显著性影响。覆盖率大于99.57%,说明测定的准确率高,可信度大。在门水平上,各处理组拟杆菌门均为优势菌门,通过添加微生物制剂和抗生素没有改变其优势地位。各处理组拟杆菌门和厚壁菌门分别占序列总数的47.39%-56.7%和41.23%-48.09%;b组蓝细菌门最低、a组次之,c组最高(p<0.05)。另外,a组螺旋菌门、纤维杆菌门以及放线菌门序列含量均比较低,各组间差异不显著(p>0.05)。各处理组之间普雷沃菌属、prevotellaceae_nk3b31_group、巨球型菌属、unclassified_f__lachnospiraceae、乳酸菌属、bacteroidales_s24-7_group、streptococcus、rikenellaceae_rc9_gut_group、bacteroides相对含量无显著差异(p>0.05)。
三、本发明通过研究获得一种复合益生菌与小檗碱组合的混合型饲料添加剂,可以替代抗生素,调节猪胃肠道微生物区系,降低猪腹泻率和死淘率,提高猪生长性能和经济效益,对猪的健康养殖和畜产品安全生产具有重要意义。
附图说明
图1为每个样品的稀释曲线。
图2为猪粪样微生物菌群门水平热图。
图3为猪粪样菌群主坐标分析图。
图4为猪粪样菌群venn分析图。
图5为测序的流程图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明的一种代替抗生素预防和治疗猪腹泻的混合饲料及其应用,具体实验方法如下:
1试验材料与方法
1.1菌种和试验材料的选择
粪肠球菌(enterococcusfaecalis,cgmcc1.125)、干酪乳杆菌(lactobacilluscasei,cgmcc1.29)、枯草芽孢杆菌k4(bacillussubtilisk4,cgmcc1.439)、布拉迪酵母(saccharomycesboulardii,cgmcc2.3951),购自中国普通微生物菌种保藏管理中心(cgmcc),并由河南农业大学动物营养与生物技术实验室保存。小檗碱购自市场,纯度为98%。猪饲养试验所选用的益生菌与小檗碱混合物的组成为:干酪乳杆菌、粪肠球菌、枯草芽孢杆菌k4、布拉迪酵母的有效活菌数分别为:1×109、1×1010、1×109、1×1010cfu/g,小檗碱添加量为全价料的0.01%。
1.2培养基
mrs培养基(g/l):柠檬酸铵2g、硫酸镁0.2g、胰蛋白胨15g、酵母浸粉1g、葡萄糖20g、吐温-801ml、磷酸氢二钾2g、乙酸钠5g、硫酸锰0.05g,固体培养基加入2%的琼脂,用蒸馏水定容至1l,在121℃、0.15mpa高压蒸汽灭菌20min备用。
ypd培养基(g/l):葡萄糖20,蛋白胨20,酵母浸粉10,固体培养基加入2%的琼脂,用蒸馏水定容至1l,在121℃、0.15mpa高压蒸汽灭菌20min备用。
lb培养基(g/l):胰蛋白胨10g、酵母浸粉5g、氯化钠10g,固体培养基加入2%的琼脂,用蒸馏水定容至1l,在121℃、0.15mpa高压蒸汽灭菌20min备用。
伊红美蓝鉴别培养基(emb,)(g/l):称取emb42.5g,加入1l蒸馏水,在121℃、0.15mpa高压灭菌20min备用。
1.3微生物的培养
将试验室保存的干酪乳杆菌、粪肠球菌接种到mrs液体培养基中,37℃培养至浑浊,再按2%的接种量接种于新鲜的培养基中,培养24h后测定活菌数,放到4℃冰箱待用。枯草芽孢杆菌k4接种到lb液体培养基中,37℃培养至浑浊,再按2%的接种量接种于新鲜的培养基中,培养24h后测定活菌数,放到4℃冰箱待用。布拉迪酵母,接种到ypd液体培养基中,30℃培养24h后测定活菌数,再按2%的接种量接种于新鲜的培养基中,培养24h后测定活菌数,放到4℃冰箱待用。
1.4试剂配制
1)ph7.2磷酸盐缓冲液(pbs):称取8.00g氯化钠、0.20g氯化钾、2.90g十二水磷酸氢二钠和0.20g磷酸氢二钾,用900ml蒸馏水溶解后,浓盐酸调ph至7.20,然后定容至1.00l,过0.22μm滤膜后室温保存。
2)1%酪蛋白溶液:称取0.50g(精确到0.001g)干酪素,加入0.10mol的氢氧化钠溶液5ml,在加热条件下使其溶解,然后用ph7.20的磷酸缓冲液定容至100ml,4℃保存。
3)酪氨酸标准溶液的配制:在65℃将酪氨酸烘至恒重,精确称取0.1000g,加入1.00mol/l的盐酸溶液6ml,溶解后再用0.20mol/l的盐酸定容至100ml,此浓度为1000μg/ml,取1.00ml用0.20mol/l的盐酸定容至10ml,即为100μg/ml,然后稀释到所需的酪氨酸浓度。
4)0.4m三氯乙酸:称取65.40g三氯乙酸于烧杯中于1000ml的烧杯中,加入900ml蒸馏水溶解,然后定容至1000ml。
5)0.4m碳酸钠:称取21.20g无水碳酸钠,加入400ml蒸馏水溶解,然后定容至500ml。
6)福林酚试剂(folin)
7)dns试剂(3,5-二硝基水杨酸):称取3.15g3,5—二硝基水杨酸放入到1000ml的烧杯中,加入500ml蒸馏水,在45℃水浴中搅拌溶解,然后逐步加入0.20g/ml的氢氧化钠溶液100ml,每隔1min搅拌一次,直至溶液澄清透明,然后缓慢的加入91g酒石酸钾钠、2.50g苯酚和2.50g无水亚硫酸钠,接着加入300ml蒸馏水,水浴搅拌,直到肉眼看不到固体物质,待其冷却后定容到1000ml,用滤纸过滤,室温避光保存。
1.5试验动物的分组
试验地点在周口市沈丘县永欣饲料厂下属的肖营猪场,试验选用35日龄左右杜-长-大三元杂交断奶猪200头,将试验猪分为5个处理组,每个处理分为4个重复,每个重复有10头猪(公母各半)。试验具体分组如下:
a组(对照组):饲喂全价料(不加抗生素、氧化锌)
b组:全价料+抗生素(喹烯酮、土霉素钙、亚甲基水杨酸)+氧化锌(1600ppm)
c组:全价料+0.05%复合益生菌+0.01%小檗碱
d组:全价料+0.11%复合益生菌+0.01%小檗碱
e组:全价料+0.17%复合益生菌+0.01%小檗碱
1.6饲养管理
本次试验的饲养周期为42d,所选的试验猪都在同一猪舍内,猪舍的温度为10-15℃,湿度为35%-60%。试验期间猪只的饲养管理措施严格按照猪场的标准进行。试验期间严格做好各项试验记录。试验日粮配方如表1。
表1全价料组成及营养水平(%)
注:粗蛋白、钙、磷是实测值,其它是推算值。预混料为每千克全价日粮提供:铜2597mg;铁2945mg;锌2665mg;锰1190mg;碘197mg;硒197mg;维生素a29400iu,维生素d32200iu,维生素e1650iu,维生素k1.03mg,维生素b10.515mg,维生素b214.7mg,维生素b1261.8μg泛酸32.96mg,烟酸61.8mg,胆碱125mg,叶酸1.03mg,生物素0.21mg。
1.7生长性能的测定
饲养试验将要开始时,早上空腹的状态下对每圈猪的总体重进行称重,试验开始后每天记录每圈猪的采食量,试验结束后,计算每组的耗料量。每天上午饲喂后观察猪的腹泻情况,记录下每组的腹泻猪头数,并仔细观察猪的精神状况和健康状况,发现异常猪只立刻采取措施进行预防和治疗。试验结束时,在早晨空腹称取每圈猪的重量,并作记录。测定各组试验猪的生产性能,其主要指标包括:平均日增重(adg),平均日采食量(adfi),料重比(f/g),腹泻率,死亡率,淘汰率。
1.8粪样指标测定
在试验结束的前3d,在早晨饲喂后连续采集粪样,每圈采集2头猪的新鲜粪样,粪样不接触地面,称取50g直接放于-20℃冰箱中用于测定消化酶酶活、粪样微生物区系;另外再取30g装入50ml离心管中,放到4℃冰箱用于测定微生物菌群数量。再取50g加入10%的盐酸溶液10ml,放于-20℃冰箱中,利用内源指示剂法测定常规营养物质的含量。
1.9粪样中酶活的测定
将试验采集的粪样采用合适的比例进行稀释,稀释好之后放到冰箱中保存待测。蛋白酶活力测定采用folin-酚法[89],单位定义:1ml液体酶或1g固体酶粉在一定温度一定ph下,每分钟水解酪蛋白产生1ug酪氨酸,为1个蛋白酶活力单位。淀粉酶活性采用碘—淀粉比色法(周景祥等,2001)测定。单位定义:100ml酶液中的淀粉酶(ams),在37℃温度条件下与底物作用30min,水解10mg淀粉为一个淀粉酶活力单位。
1.10粪样中微生物区系的测定
1.10.1粪样的处理与送检
将饲养试验结束时所采集的粪样从-20℃冰箱当中取出,将a、b、c组的共9头猪的粪样装入放有干冰的泡沫箱中送到上海美吉生物医药科技有限公司进行粪样的微生物多样性分析。
1.10.2测序试验流程
猪粪样样品分别编号为:a组(a1、a2、a3)、b组(b1、b2、b3)、c组(c1、c2、c3)共9个粪样样品,整个测序的流程按如图5所示步骤进行。
1.10.2.1dna抽提
采用基因组提取试剂盒提取粪样中总dna,提取方法参照试剂盒说明书,对基因组dna进行抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组dna。
1.10.2.2pcr扩增
①引物设计据细菌16srdna基因v3-v4区的保守序列,设计上游引物序列为338f(5'-actcctacgggaggcagcag-3')、下游引物序列为806r(5'-ggactachvgggtwtctaat-3');
②pcr扩增条件为了保证后续数据分析的准确性及可靠性,需要两个条件,首先是尽可能使用低循环数扩增;其次保证每个样品扩增的循环数统一。为了达到以上目的,首先随机选取样品进行预试验,以确保在最低的循环数中绝大多数的样品能够扩增出浓度合适的产物,为所有样品的正式试验做充分准备。pcr采用transgenap221-02:transstartfastpfudnapolymerase;pcr仪:abi
③pcr扩增结果鉴定用1%琼脂糖凝胶电泳检测pcr产物。
1.10.2.3荧光定量
参照电泳初步定量结果,将pcr产物用quantifluortm+-st蓝色荧光定量系统(promega公司)
进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
1.10.2.4miseq文库构建
1)通过pcr将illumina官方接头序列添加至目标区域外端;
2)使用凝胶回收试剂盒切胶回收pcr产物;
3)tris-hcl缓冲液洗脱,1%琼脂糖电泳检测;
4)氢氧化钠变性,产生单链dna片段。
1.10.2.5miseq测序
1)dna片段的一端与引物碱基互补,固定在芯片上;
2)以dna片段为模板,芯片上固定的碱基序列为引物进行pcr合成,在芯片上合成目标待测dna片段;
3)变性、退火后,芯片上dna片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥(bridge)”;
4)pcr扩增,产生dna簇;
5)dna扩增产物线性化成为单链。
6)加入改造过的dna聚合酶和带有4种荧光标记的dntp,每次循环只合成一个碱基;
7)用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;
8)将“荧光基团”和“终止基团”化学切割,恢复3'端粘性,继续聚合第二个核苷酸;
9)统计每轮收集到的荧光信号结果,获知模板dna片段的序列。
1.11营养物质消化率的测定
饲料中粗蛋白、脂肪、钙和磷的消化率的测定是以盐酸不溶性灰分作为内源指示剂,饲料和粪样中的盐酸不溶性灰分测定按照国标gb/t23742-2009、gb/t6438-2007和gb/t14699.1-2005进行。饲料和粪样的粗蛋白质(cp)、钙(ca)、磷(p)和粗脂肪(ee)含量参照朱燕等人的方法进行[78]。
饲料中某养分消化率=100-(a1/a2×n2/n1)×100%
a1:混合饲料中4n-hcl不溶灰分的含量;a2:粪样本中4n-hcl不溶灰分的含量;n1:混合饲料样本中某养分的含量;n2:粪样本中某养分的含量。
1.12血清指标的测定
在试验结束的当天上午,对空腹猪进行前腔静脉采血,采血后血液置于10ml离心管中,血液倾斜放置5h,吸取血清于-20℃冰箱保存备用。血清各项指标采用全自动生化分析仪进行的测定。
1.13经济效益
以猪的增重成本作为参考指标,进行经济效益分析。各组的盈利是拿收益减去总支出,计算公式为:盈利=[(每头总增重(kg)×毛猪单价(元/kg)]-[每头日耗料量(kg)×饲料单价(元/kg)+平均医药费用(元)]。
1.14数据处理与分析
数据分析采用spss软件进行anova方差统计分析,结果用平均数±标准差表示,以p<0.05表示差异显著。
微生物区系数据的处理方法采用qiime(版本1.9.1)对序列进行多路分解和质量过滤。首先,设置50bp的窗口,过滤read尾部质量值20以下的碱基;其次,将成对reads拼接(merge)成一条序列,最小overlap长度为10bp;最终,拼接序列的overlap区允许的最大错配比率为0.2,筛选符合要求序列。通过usearch(vsesion7.0)分析平台对优质序列进行生物信息学分析,根据序列相似度为97%的原则,将序列进行操作分类单元(operationaltaxonomicunit,otu)聚类,在聚类过程中去除嵌合体,得到otu的代表序列。为了得到每个otu对应的物种分类信息,通过qiime平台,采用rdpclassifier贝叶斯算法,比对silva数据库,对otu的代表序列进行分类学分析:
domain(域)、kingdom(界)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)、species(种),统计各样本的群落组成。通过i-sanger云平台(http://www.i-sanger.com)对生成的otu信息进行细菌群落的物种注释评估、物种组成、物种差异、样本比较以及功能预测等分析。
2结果与分析
2.1生长性能
由表2可知,各组试验猪在试验期间的平均日增重(adg)、平均日采食量(adfi)和饲料转化率(f/g)方面差异不显著(p>0.05)。c、d组的腹泻率和死亡率与对照组相比差异不显著,但是均有所下降。对照组的猪在这一阶段淘汰率较高。
表2益生菌组合和小檗碱对断奶猪生长性能的影响(n=4)
注:同列小写字母相同表示差异不显著(p>0.05),不同表示差异显著(p<0.05),下同。
2.2粪样中微生物菌群的测定
由表3可知,各组猪的粪样中微生物的总菌数、乳酸菌数和大肠杆菌差异不显著(p>0.05),大肠杆菌数随着益生菌和小檗碱的添加量的增加,数量有减少的趋势。
表3复合益生菌与小檗碱配伍对猪粪样中微生物菌群的影响(lg,cfu/g,n=4)
2.3粪样中消化酶活性的测定
由表4可以得出,d组粪样中蛋白酶活力显著高于c组(p<0.05),e组粪样中淀粉酶活力显著高于a和c组(p<0.05),其余各组间的蛋白酶和淀粉酶活力差异不显著(p>0.05)。
表4复合益生菌与小檗碱对猪粪样中淀粉酶和蛋白酶活性的影响(u/g,n=4)
2.4复合益生菌和小檗碱对猪营养物质消化率的影响
从表5可知,各组在粗蛋白、粗脂肪、磷和钙的消化率方面没有显著差异(p>0.05)。
表5复合益生菌与小檗碱对猪营养物质消化率的影响(%,n=4)
2.5血清指标的影响
由表6可知,d组血清中igg含量显著地高于a组(p<0.05),b组血清中的尿素氮显著高于c、d组(p<0.05);b组血清中的谷丙转氨酶(alt)和谷草转氨酶(ast)活力分别显著地低于a和c组(p<0.05),b和e组的碱性磷酸酶活力显著低于a组(p<0.05),其它指标各组间差异不显著(p>0.05)。
表6复合益生菌和小檗碱对猪血清指标的影响(n=4)
2.6粪样中微生物区系的分析
2.6.1粪样菌群丰富度及多样性分析
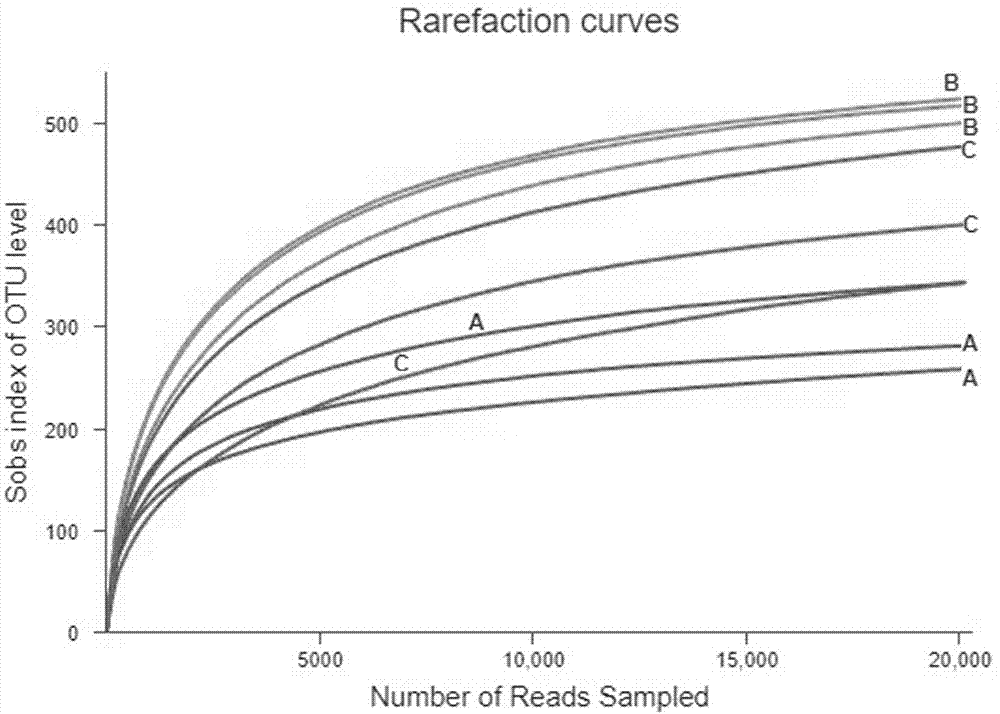
通过illuminamiseq高通量测序平台对采集的9个猪粪样样品进行16srrna基因v3-v4区进行测序,经去除排序错误和嵌合体,读取之后一共产生424914个高质量序列,每个样品平均有47212±9564个序列,序列平均长度441bp。各处理组文库覆盖率均在99.57%以上,且由图1可知,9个猪粪样样品的稀释曲线趋于平缓,随着测序深度增加,otu的数量将不再增加,表明每个样本的测序量比较合理,能够较好地反映各处理组粪样中菌群群落种类和结构的多样性。由表7可知,各处理组之间优质序列差异不显著(p>0.05),a组菌群丰富度chao指数和ace指数显著地低于b、c组(p<0.05),说明添加抗生素、复合益生菌和小檗碱可提高猪肠道菌群的丰度。各组菌群多样性shannon和simpson指数无显著性差异(p>0.05),说明复合益生菌和小檗碱对猪肠道菌群的多样性无显著性影响。覆盖率大于99.57%,说明测定的准确率高,可信度大。
表7不同处理在97%相似水平下对菌群丰富度和多样性的影响
2..6.2猪粪样中菌群组间相似性分析
2.6.2.1猪粪样菌群门水平聚类分析
热图(heatmap)是使用颜色梯度来直观地表现数据的疏密程度或出现地频率高低,并呈现群落物种组成信息。通常根据样本间丰度的相似性进行聚类,并将结果呈现在群落heatmap图上,可使高丰度和低丰度的物种分块聚集,通过颜色变化与相似程度来反映不同处理组在门水平组成的相似性和差异性。由图2可知,将门水平分类信息聚类后得到heatmap,可以纵向将9个样品分为2个大簇,左边大簇包括1个样品,右边大簇包括2个样品。heatmap从上到下可将优势菌门、次优势菌门和其他菌门分别聚类,可以通过颜色深浅明显地区分高丰度区域、中等区域和低丰度区域,直观地表现了17个菌门在各处理组中的相对丰度高低。
2.6.2.2猪粪样菌群主坐标分析
pcoa分析,即主坐标分析(principalco-ordinatesanalysis)是反映样品组间菌群结构的差异性与相似性,不同处理组菌群结构越相似,在pcoa图中样品点间的距离越接近。由主坐标分析图(图3)可知,b组、c组内样品点分布距离较为接近,菌群结构较相似,而a组样品点分布在较为宽阔的区域,表明添加复合益生菌和小檗碱后对猪体内的微生物菌群结构有一定的影响作用。
2.6.2.3猪粪样菌群venn图分析
venn图一般用来统计不同处理组样品中所共有和独有的物种(如otu)数目,可以直观地呈现不同处理组样本的otu数目组成相似性及重叠情况。基于97%相似性的原则进行otu分析。由图4可知,3个处理组共产生1540个otu,各组otu数量分别为a组598个、b组538个、c组404个,其中共享330个,占总otu数量21.42%,各处理组独有的out数目仅占3.70%、1.82%、0.71%。
2.6.3猪粪样菌群组成和结构分析
本试验对9个猪粪样进行对比,共鉴定得到17个门,27个纲,39个目,67个科和187个属。利用qiime对猪粪样中微生物序列进行多路分解和质量过滤可知,在门水平上各处理组拟杆菌门均为优势菌门,微生物饲料添加剂和抗生素没有改变其优势地位。由表8可知,各处理组拟杆菌门和厚壁菌门分别占序列总数的47.39%-56.7%和41.23%-48.09%。b组蓝细菌门最低、a组次之,c组最高(p<0.05)。另外,a组螺旋菌门、纤维杆菌门以及放线菌门序列含量均比较低,各组间差异不显著(p>0.05)。
表8复合益生菌和小檗碱对菌群组成和结构的影响(门水平)
利用qiime对猪粪样中微生物序列进行多路分解和质量过滤可知,在属水平上各处理组均以普雷沃菌属为为优势菌属,且微生物饲料添加剂和抗生素没有改变其优势地位。各处理组之间普雷沃菌属、prevotellaceae_nk3b31_group、megasphaera、unclassified_f__lachnospiraceae、lactobacillus、bacteroidales_s24-7_group、streptococcus、rikenellaceae_rc9_gut_group、bacteroides相对含量无差异(p>0.05)。
表9的结果表明,复合益生菌和小檗碱对普雷沃菌属、巨球型菌属、毛螺旋菌属、乳酸菌属、prevotellaceae、bacteroidales、rikenellaceae、bacteroides的菌群组成和结构无显著性影响(p>0.05)。
表9复合益生菌和小檗碱对菌群组成和结构的影响(属水平)
2.7复合益生菌与小檗碱对经济效益的影响
由表10可知,试验组e组经济效益高于a组,比a组提高了12.65%;从加入死亡和淘汰猪之后算出的每头猪的绝对毛利润可以看出,c、d、e组经济效益和a组相比提高了129%,117%,151%。研究结果表明,添加复合益生菌和小檗碱提高猪场的经济效益,降低其生产成本。
表10益生素和小檗碱对经济效益的影响
注:每头猪的毛利润。绝对毛利润为加入死亡和淘汰猪的后的经济效益。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!