羊肚菌子实体多肽的新用途的制作方法
本发明属于食药用真菌综合利用
技术领域:
,具体涉及一种羊肚菌子实体多肽的新用途。
背景技术:
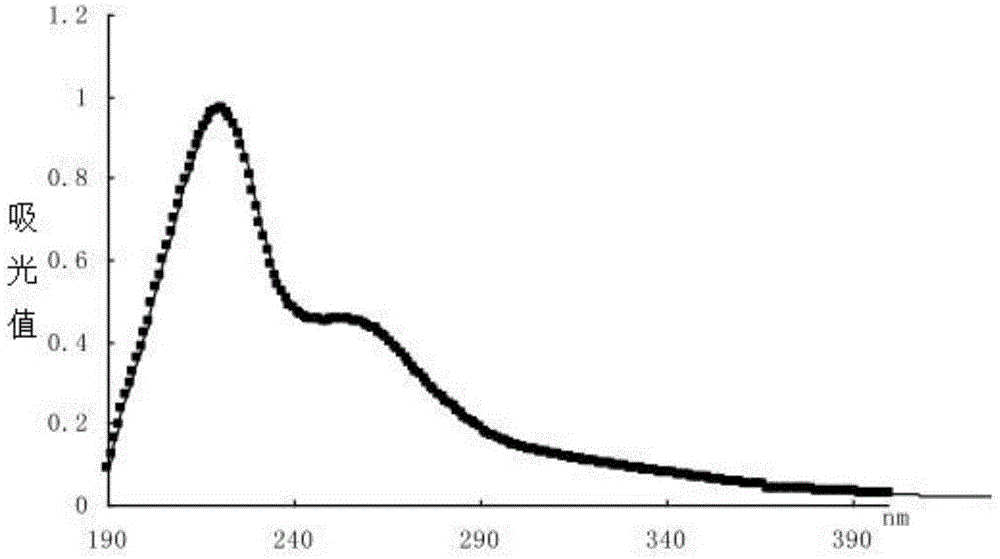
:食药用真菌是一类具有多种保健功效的生物资源。研究发现,食药用真菌含有的功能物质包括多糖、多肽、核苷、萜类等,表现出很强的抗菌、抗氧化、免疫调节、抗肿瘤功效,在治疗糖尿病、心血管病、高胆固醇症及预防肿瘤发生等方面已有一定的应用。近年来,国内外学者们对食用菌中的活性物质研究较为深入,尤其对食用菌中的生物活性多糖、活性蛋白多肽的研究很多,食用菌已作为一种保健食品进入了人们的生活。神经退行性疾病包括阿尔茨海默病、亨廷顿病、帕金森病等,是由于神经元变性、凋亡所导致的进行性发展的致死性复杂疾病。临床表现为进行性记忆认知功能障碍和运动功能障碍,该类疾病患病率日趋上升且低龄化趋势明显。世界卫生组织预测,到2030年,全球范围内罹患神经退行性疾病的人数将高达近1亿人,而到2040年,神经退行性疾病将取代癌症成为人类第二大致死疾病。神经退行性疾病病因复杂,愈后往往较差,一方面,神经细胞无法再生,一旦细胞受到损伤而未得到及时修复,将导致严重的后果。另一方面,神经退行性疾病的病因和发病机制尚未完全明了,使得开发预防或治疗神经退行性疾病药物面临着巨大的挑战。此外,由于人体血脑屏障的存在,使得一般的大分子物质(如某些功效确切的神经营养因子ngf,bdnf,nt~3,gdnf等)无法通过,很难对此类疾病产生较好的治疗效果。因此,寻找具有神经保护作用且能够穿过血脑屏障的小分子物质对于该类疾病的预防和治疗十分重要。多肽(polypeptide)是α~氨基酸以肽键连接在一起而形成的化合物,它也是蛋白质水解的中间产物,是源于蛋白质的多功能化合物,且通常情况下营养和生理功能优于蛋白质(大分子蛋白质)和氨基酸。多肽是涉及生物体内各种细胞功能的生物活性物质,相关研究发现,生物活性多肽可以调节细胞分化、神经激素递质分泌等多种生理活动,且多肽分子量较小,能够穿过人体的血脑屏障,是一类具有很大开发潜力的物质。关于多肽的提取应用,目前报道较多的是从动植物中提取,或用植物蛋白或用动物蛋白酶解制备,而食(药)用真菌活性肽的研究仅局限于灵芝肽、姬松茸肽、云芝肽、茶树菇肽等少量品种,且对于真菌多肽的神经保护作用研究欠缺。羊肚菌morchellaspp.,俗称苞谷菌、羊肚菜、阳雀菌,隶属子囊菌门ascomycota、盘菌亚门pezizomycotina、盘菌纲pezizomycetes、盘菌目pezizales、羊肚菌科morchellaceae,其味道鲜美,营养丰富,是享誉世界的美味食用菌和珍稀药用菌。羊肚菌子实体和菌丝体发酵产物皆有极佳的保健作用。《本草纲目》中记载羊肚菌“甘寒无毒,化痰理气,益肠胃”。现有研究(卢可可,谭玉荣,郑少杰,刘冬,吴素蕊,明建.基于hepg2细胞模型的褐赭色羊肚菌多酚抗氧化及抗增殖活性研究[j].现代食品科技,2015,31(12):6~13.陈彦,潘见,周丽伟,张利平,杨毅.羊肚菌胞外多糖抗肿瘤作用的研究[j].食品科学,2008,29(9):553~556.康宗利,徐萍,杨玉红.羊肚菌发酵菌丝体酚类物质的提取及抗氧化活性的研究[j].食品科技,2014,39(7):219~224)表明,羊肚菌子实体水提物具有优良的抗氧化、抗肿瘤、神经保护及保肝保肾的功效,羊肚菌菌丝体发酵液具有优良的抗氧化、抗衰老作用。功效成分的分离鉴定表明,羊肚菌水提物中的水溶性多糖通过清除自由基实现抗氧化作用,通过增强宿主免疫应答实现抗肿瘤活性。硕士学位论文“陕北羊肚菌菌丝体活性多肽的分离方法及抗氧化性的研究”,(延安大学,姚尧,2015年)公开了陕北羊肚菌菌丝体活性多肽的分离方法及抗氧化性的研究,研究羊肚菌菌丝体活性多肽的自由基清除活性,发现羊肚菌菌丝体多肽对羟基自由基和超氧阴离子自由基以及dpph自由基有一定的清除效果,但该文献仅报道了羊肚菌菌丝体活性多肽具有抗氧化功能,并未研究羊肚菌菌丝体活性多肽与神经保护的关系。技术实现要素:本发明要解决的技术问题为:提供一种羊肚菌子实体多肽的新用途。本发明解决上述技术问题的技术方案为:提供一种羊肚菌子实体多肽在制备预防或治疗神经退行性疾病的食品或药物中的新用途。其中,上述羊肚菌子实体多肽的新用途中,所述的神经退行性疾病包括阿尔茨海默病、亨廷顿病或帕金森病中的至少一种。其中,上述羊肚菌子实体多肽的新用途中,所述的食品包括羊肚菌调味品、羊肚菌速食汤或羊肚菌营养羹中的至少一种。其中,上述羊肚菌子实体多肽的新用途中,所述的药物剂型包括胶囊、片剂、口服液或注射剂中的至少一种。其中,上述羊肚菌子实体多肽的新用途中,所述预防或治疗神经退行性疾病主要是促进神经细胞分化或保护神经细胞免受氧化压力引起的氧化损伤。其中,上述羊肚菌子实体多肽的新用途中,所述的神经细胞包括星形胶质细胞、神经母细胞或嗜铬神经细胞中的至少一种。其中,上述羊肚菌子实体多肽的新用途中,所述的羊肚菌子实体多肽的制备方法为:将羊肚菌子实体干燥、粉碎,得到羊肚菌子实体干品粉末,加入pbs缓冲液,搅拌后离心,得上清液,将上清液透析12~14h,收集透析液,浓缩、干燥,得到羊肚菌子实体多肽提取物干粉。进一步的,上述羊肚菌子实体多肽的新用途中,所述羊肚菌子实体多肽制备时,加入羊肚菌子实体和pbs缓冲液的料液比为1︰10~30;所述离心速度为4000~5000rpm/min,离心时间为5~10min;所述透析为在5000~7500da的透析袋中进行。其中,上述羊肚菌子实体多肽的新用途中,所述的羊肚菌子实体多肽的制备方法还包括纯化步骤;所述纯化过程为:将羊肚菌子实体多肽提取物干粉用无菌水溶解,于凝胶过滤柱过滤,无菌水洗脱,收集洗脱液,220nm下测定吸光值,获得单一峰,收集并冻干,得到纯化的羊肚菌子实体多肽提取物。本发明的有益效果为:本发明从羊肚菌的子实体中提取得到了羊肚菌的子实体多肽,并首次发现该多肽具有较好的促进神经细胞分化或保护神经细胞的作用。该多肽能够有效缓解氧化压力对神经细胞的损伤,能够促进神经细胞分化,减缓神经细胞的衰老。动物实验发现,该多肽还能够提高帕金森综合征小鼠的学习认知能力。为此,本发明提供了一种羊肚菌子实体多肽在制备预防或治疗神经退行性疾病的食品或药物中的用途,为羊肚菌子实体的应用提供了一种新的途径。附图说明图1所示为羊肚菌多肽在210nm和260nm处的特征吸收峰;图2所示为通过分子筛柱纯化后获得的羊肚菌多肽;图3所示为pc12细胞分化比例图,显示羊肚菌多肽能显著提升pc12细胞的分化比例;图4所示为倒置显微镜下pc12细胞的分化情况;a表示正常培养的pc12细胞,b表示添加了80ng/ml神经生长因子的pc12细胞,c表示添加了200μg/ml羊肚菌多肽的pc12细胞;图5所示为倒置荧光显微镜下观察的免疫荧光染色法处理的pc12细胞;a表示正常培养的细胞,b表示添加了80ng/ml神经生长因子的pc12细胞,c表示添加了200μg/ml羊肚菌多肽的pc12细胞,d表示同时添加了80ng/ml神经生长因子和200μg/ml羊肚菌多肽的pc12细胞;图6所示为添加不同蛋白抑制剂后,pc12细胞的分化情况。具体实施方式在本发明之前,本行业对羊肚菌的研究主要集中在对菌丝体部分的研究,而对于羊肚菌子实体部分多肽的提取、功效评价和应用的研究较少,还未见有羊肚菌多肽对神经细胞的作用的报道。本发明创造性的发现了羊肚菌多肽提取物在制备预防或治疗神经退行性疾病的食品或药物中的用途。所述的食品包括羊肚菌调味品、羊肚菌速食汤或羊肚菌营养羹中的至少一种。所述的药物剂型包括胶囊、片剂、口服液或注射剂中的至少一种。本发明所述的神经退行性疾病包括阿尔茨海默病、亨廷顿病或帕金森病等常见疾病。本发明还创造性的发现了羊肚菌多肽提取物在促进神经细胞分化或保护神经细胞免受氧化压力引起的氧化损伤上的用途。所述的神经细胞包括星形胶质细胞、神经母细胞或嗜铬神经细胞中的至少一种。优选的,本发明还提供了一种能够制备得到上述用途的羊肚菌多肽提取物的方法,但并不表示只有下述方法制备的羊肚菌多肽提取物具有此种用途。其他方法制备得到的羊肚菌多肽提取物也同样具有在制备预防或治疗神经退行性疾病的食品或药物中的用途。本发明提供了一种羊肚菌子实体多肽提取物的制备方法,包括以下步骤:a、采收新鲜羊肚菌,于37~45℃烘箱中处理12~16h,使羊肚菌干品含水量≤13%,采用中药材粉碎机粉碎羊肚菌干品,100目筛网过筛,获得羊肚菌子实体干品粉末;b、按照料液比1:10~30,加入羊肚菌子实体干品粉末和pbs缓冲液,搅拌后在6000r/min下离心,得上清液,将上清液于7500da的透析袋透析12~14h,收集透析液,浓缩、干燥,得到羊肚菌子实体多肽提取物干粉;c、将将羊肚菌子实体多肽提取物干粉用无菌水溶解,上样于superdex30increase凝胶过滤柱,无菌水洗脱,收集洗脱液,220nm下测定吸光值,获得单一峰,收集并冻干,得到纯化的羊肚菌子实体多肽提取物。其中,上述步骤b中所述的pbs缓冲液制备方法为:取磷酸二氢钾(kh2po4):0.27g,磷酸氢二钠(na2hpo4):1.42g,氯化钠(nacl):8g,氯化钾(kcl):0.2g,加去离子水800ml充分搅拌溶解,然后加入浓盐酸调ph至7.4,最后定容到1l。下面将通过实施例对本发明的具体实施方式做进一步的解释说明,但不表示将本发明的保护范围限制在实施例所述范围内。实施例1羊肚菌子实体多肽的分离提取称取羊肚菌子实体干品20g,采用中药材粉碎机粉碎,过100目筛网,获得羊肚菌子实体干品粉末。配置磷酸缓冲盐溶液缓冲液(pbs缓冲液):磷酸二氢钾(kh2po4)0.27g,磷酸氢二钠(na2hpo4)1.42g,氯化钠(nacl)8g,氯化钾(kcl)0.2g,加去离子水约800ml充分搅拌溶解,然后加入浓盐酸调ph至7.4,最后定容到1l。按照羊肚菌干品/pbs缓冲液的料液比1:20加样。加样后磁力搅拌器120转搅拌过夜,取上清,6000r/min离心后获得上清液。选择截留分子量为7500da的透析袋透析12h,收集透析液,旋转蒸发仪浓缩,获得的浓缩液采用真空冷冻干燥机冷冻干燥12h,可获得羊肚菌多肽提取物干粉(如图1所示)。取羊肚菌多肽提取物干粉5g,无菌水溶解,配置成50mg/ml的溶液,上样于superdex30increase凝胶过滤柱,无菌水洗脱,部分自动收集器收集洗脱液,220nm下测定吸光值,获得单一峰,收集并冻干,得到羊肚菌子实体多肽(如图2所示)。获得的羊肚菌多肽提取物干粉为5.41g,得率为27.05%(20g羊肚菌子实体粉末提取后可得5.41g羊肚菌多肽提取物),羊肚菌子实体多肽干粉0.64g,得率为3.2%(5g羊肚菌多肽提取物干粉纯化后可得0.64g羊肚菌子实体多肽干粉)。重复上述制备过程,制备足量的羊肚菌子实体多肽干粉。实施例2羊肚菌子实体多肽对神经细胞的保护作用取对数生长期的pc12细胞(大鼠嗜铬细胞瘤,atcc保藏号crl1721.1)以密度1×103个/孔完成96孔板接种,培养16h后,弃去培养基,添加80μmol/lh2o2处理30min,之后弃去h2o2,pbs清洗2遍,加入不同浓度的羊肚菌多肽溶液培养6h(浓度梯度见表1),预冷pbs溶液清洗并重悬pc12细胞。每孔避光加入20μl5mg/ml的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt),co2培养箱37℃培养4h后,吸去上清,每孔加入150μl二甲基亚砜(dmso),振荡10min后,于490nm波长下测定各孔吸光值(od)。计算各组细胞存活率。细胞存活率计算方法为:细胞存活率(%)=(实验组od平均值-空白组od平均值)/(对照组od平均值-空白组od平均值)×100%。实验结果如表1所示,结果表明:羊肚菌多肽对h2o2胁迫损伤的pc12细胞具有很好的保护作用。80mmh2o2处理pc12细胞30min后,pc12细胞出现皱缩,细胞内空泡明显增多,细胞存活率为49.14±2.02%。添加不同浓度的羊肚菌多肽处理细胞后,细胞存活率上升,且随着剂量的增加其存活率升高,给以200μg/ml羊肚菌多肽处理后,细胞存活率达到86.56±4.02%,与h2o2处理组呈现极显著的差异(p<0.01)。可见羊肚菌多肽对于h2o2胁迫损伤的pc12细胞具有保护作用。表1不同浓度羊肚菌多肽保护h2o2诱导的pc12细胞损伤的存活率注:与空白对照组比较,*p<0.05,**p<0.01;与模型组比较,△p<0.05,△△p<0.01。实施例3羊肚菌子实体多肽促进神经细胞分化实验取对数生长期的pc12细胞以2×104个/孔密度接种于24孔板,接种前24孔板用0.01%多聚赖氨酸铺板。实验分6组,分别为对照组(100μlf-12k培养基,含2mml-谷氨酰胺,1.5g/lnahco3+15%马血清+2.5%胎牛血清),5个药物处理组(1ml终浓度分别为800,400,200,100,50μg/ml羊肚菌多肽f~12k培养基)),1个阳性对照组(含80ng/ml神经生长因子ngf的f-12k培养基),以上实验组分别3天换液1次,维持培养液药物浓度,光镜下,观察长度超过胞体直径1倍的细胞突起,连续观察7d,于第7d每个组任取3个视野,每孔统计100个细胞,计算分化率。分化率=(长度超过胞体直径1倍的细胞数/视野中总细胞数)×100%。实验结果如图3、图4所示。图3所示为羊肚菌多肽促进神经细胞分化的统计结果。从柱状图可以看出:正常状态下,pc12细胞的分化率为4.01±0.31%,采用含80ng/mlngf(神经生长因子)的f-12k培养基处理pc12细胞作为阳性对照,其促分化效果最好,达到了12.02±1.01%,与正常情况下pc12细胞的分化比率呈现显著性差异。添加不同浓度的羊肚菌多肽(100~800μg/ml)对pc12细胞分化均有一定的促进作用,其中,200μg/ml浓度效果最好,分化比例达到8.73±0.91%。与正常情况下pc12细胞的分化呈现极显著的差异(p<0.01)。图4所示为pc12细胞的显微图。图4a表示正常培养的pc12细胞,细胞近似圆形,几乎未见分化细胞。b表示添加80ng/mlngf(神经生长因子)的pc12细胞,图中细胞的分化比例明显提高,较多的细胞长出了触手。c表示添加200μg/ml浓度的羊肚菌多肽的pc12细胞,pc12细胞长出触手,分化细胞明显增多。实施例4免疫荧光染色法观察羊肚菌多肽促进神经细胞分化实验采用免疫荧光染色法观察羊肚菌多肽的促进神经细胞分化活性。培养pc12细胞,按照密度5×103个/孔接种12孔板,细胞贴壁后分别加入ngf(神经生长因子)(80ng/ml),200μg/ml羊肚菌多肽(经前实验验证为最适浓度),阴性对照为等量f-12k培养基,培养48h。取出细胞培养板,4%多聚甲醛室温固定20min,pbs清洗后,加入一抗nf-200,4℃冰箱过夜,之后加入二抗anti-rabbitigg-fitc,避光37℃孵育1h,最后dapi(4',6-二脒基-2-苯基吲哚)完成细胞核染色,荧光显微镜观察。荧光观察结果如图5所示。a表示正常培养的pc12细胞,b表示添加了80ng/mlngf(神经生长因子)的pc12细胞,c表示添加了200μg/ml羊肚菌多肽的pc12细胞,d表示同时添加了80ng/mlngf(神经生长因子)和200μg/ml羊肚菌多肽的pc12细胞。由图5可知,采用nf-200抗体处理后,荧光染色观察,pc12细胞核被dapi浸染,发蓝色荧光,神经丝蛋白(触手)由于fitc的存在,发绿色荧光。结果表明:添加ngf和羊肚菌多肽后,pc-12细胞nf-200蛋白表达量明显增加,图中绿色荧光数目明显多于对照组。实施例5羊肚菌多肽促进神经细胞分化的机制研究推测羊肚菌多肽与ngf的作用通路相似。实验采用添加涉及通路的特异性抑制剂完成。选定的3条通路为trka,mek/erk1/2和pi3k/akt,依次对应的抑制剂为gnf5837(trka的抑制剂,添加量10μm)、u0126、pd98059(mek/erk1/2的抑制剂,添加量分别为30μm和40μm)和ly294002(pi3k/akt的抑制剂,添加量30μm),上述特异性抑制剂购买自美国selleck公司。实验分6组,分别为对照组(100μlf-12k培养基),1个阳性对照组(含80ng/mlngf的f-12k培养基)和抑制剂处理4组,抑制剂处理组预先添加200μg/ml羊肚菌多肽处理48h,之后分别添加10μmgnf5837,30μmu0126,40μmpd98059和30μmly294002特异性抑制剂,抑制剂处理1h,观察pc12细胞分化情况,统计分化比例。实验结果参见图6。由实验结果可见,添加特异性抑制剂后,pc12细胞的分化比率都显著下降。阴性对照中,正常培养的pc12细胞的分化率为3.7%,4种抑制剂处理后,分化比例依次降低为1.5%,1.8%,1.9%和2%。阳性对照中,添加80ng/ml的ngf处理后,pc12细胞的分化比例高达15.2%,4种抑制剂处理后,pc12细胞的分化比例依次降低为5.7%,6.4%,5.6%和5.1%。同样的趋势也存在于羊肚菌多肽和ngf协同作用组中。但是在只添加羊肚菌多肽的处理组中,抑制剂gnf5837不能抑制羊肚菌多肽对pc12细胞的促分化作用(抑制剂处理后,分化比率仍高达11.8%)。由于抑制剂gnf5837是ngf的特异性受体trka的抑制剂,trka是ngf从胞外进入胞内的通道,由此可知,羊肚菌多肽可以通过其他通道完成胞外到胞内的转移,而在pc12细胞内的作用通路与ngf一致。实施例6羊肚菌多肽对nano2所致的小鼠记忆障碍的影响取昆明种小鼠(icr小鼠,体重18~22g,购买自华阜康生物技术有限责任公司),随机分为空白对照组、模型组、阳性对照组(金纳多)、羊肚菌多肽组,每组12只小鼠。除空白组和模型组外,其余实验组按给定剂量灌胃给药,空白组和模型组给予等量生理盐水,连续给药一周,给药前进行跳台实验训练。最后一次给药前,除正常组外,其余各组在训练结束后立即皮下注nano2120mg/kg,间隔24小时后进行末次给药,并于给药结束后1小时进行跳台实验,记录动物犯错的潜伏期和错误次数。结果如表2。表2羊肚菌多肽对nano2所致的小鼠记忆障碍的影响组别浓度(mg/kg)潜伏期(s)错误次数(%)对照组0212.7±88.6**0.64±0.57**模型组072.5±69.51.33±0.41金纳多2×10~5174.6±84.5**0.60±0.60**多肽组125176.8±66.4**0.56±0.52**多肽组250188.7±72.6**0.47±0.31**多肽组3100221.6±76.3**0.39±0.37**多肽组4200224.1±79.7**0.40±0.36**注:与模型组比较,*p<0.05,**p<0.01。从表2可以看出,nano2处理实验小鼠后,小鼠犯错的潜伏期明显缩短,错误次数明显增加。通过羊肚菌多肽灌胃后,小鼠犯错的潜伏期明显增加,错误次数明显减少。说明羊肚菌多肽对于nano2所致的小鼠记忆障碍具有明显的改善作用。实施例7羊肚菌多肽对乙醇干扰学习记忆过程的作用取昆明种小鼠(icr小鼠,体重18~22g,购买自华阜康生物技术有限责任公司)72只,随机分6组:空白对照组、阳性对照组(吡拉西坦400mg/kg)、模型组(乙醇组)、羊肚菌多肽处理组,每组12只。乙醇组口服生理盐水;阳性对照组灌服吡拉西坦400mg/kg,羊肚菌多肽处理组灌服羊肚菌多肽;连续给药11d,在第7~10d期间每日于给药后1h进行迷宫训练,连续训练4d,在第11d训练前,模型组(乙醇组)灌服体积分数为50%的乙醇5ml/kg,阳性对照组灌服50%乙醇5ml/kg后立即灌服吡拉西坦400mg/kg,羊肚菌多肽处理组灌服50%乙醇5ml/kg后立即灌服羊肚菌多肽,于给药后1h进行测试。实验结果如表3。表3羊肚菌多肽对对乙醇干扰学习记忆过程的作用组别浓度(mg/kg)训练后达到目标(s)乙醇处理后达到目标(%)模型组07.98±0.1936.46±7.42吡拉西坦4008.27±0.2122.68±7.98**多肽组11008.09±0.1833.82±6.87*多肽组22008.21±0.2531.47±7.31*多肽组34008.02±0.3228.82±7.59**多肽组48008.18±0.2924.49±6.61**注:与模型组比较,*p<0.05,**p<0.01。从表3可以看出,各给药组给予乙醇前水迷宫的反应时间接近。给予乙醇后,小鼠的反应时间明显延长,显示小鼠已出现学习记忆功能缺失。再给以羊肚菌多肽饲养,小鼠的反应时间均小于模型组,说明羊肚菌多肽对乙醇诱导的小鼠学习记忆再现缺失有明显的保护作用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1