富集γ-氨基丁酸的淡豆豉纯种发酵方法及淡豆豉和应用与流程
本发明属于发酵
技术领域:
,尤其涉及一种富集γ-氨基丁酸的淡豆豉纯种发酵方法及淡豆豉和应用。
背景技术:
:γ-氨基丁酸(γ-aminobutyricacid,gaba)是哺乳动物中枢神经系统首要抑制性神经递质,临床和药理动物实验已证实gaba有多种重要生理功效:具有从根本上起到镇静催眠抗抑郁、健脑增强记忆、降血压、抗衰老、改善肝肾功能、缓解动脉硬化、防止肥胖、改善糖尿病和更年期综合症、抗肿瘤、治疗神经退行性疾病、控制哮喘、治疗癫痫等多种功效,有报道gaba还能用于治疗毒瘾。随着研究的深入,gaba的生理功能不断得到阐明,已经发展成为一种新型的功能性因子,正逐渐应用于医药、食品等行业。2009年我国卫生部批准gaba列为新资源食品用于食品生产加工。淡豆豉(sojaesemenpraeparatum)是一味常用传统中药,被列入卫生部首批药食两用中药,为豆科植物大豆glycinemax(l)merr的成熟种子的发酵加工品,以黑色种皮品系大豆为主料,桑叶、青蒿为辅料经自然发酵而成。始载于《名医别录》,历代本草和历版《中国药典》均有记载,作为传统中药应用至少有1700余年历史,功效和主治有深厚的临床实践基础。历版《中国药典》记载淡豆豉的功效为“解表、除烦,宣发郁热,用于感冒、寒热头痛,烦躁胸闷,虚烦不眠”。gaba功效与淡豆豉功效谱相同并超之,现代人们大多只用其解表之功效用于临床,其它功效未得到充分研究和开发利用。传统的淡豆豉发酵炮制多在自然条件下进行,由多菌种混合发酵,生产方式停留在传统小作坊模式,质量不稳定,发酵周期长,且生产受季节的限制,在发酵过程中有害杂菌可能侵入,导致淡豆豉质量难以控制,安全性和有效性难以保证,严重影响淡豆豉的药食两用价值和应用前景。技术实现要素:本发明实施例的目的在于提供一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,旨在解决
背景技术:
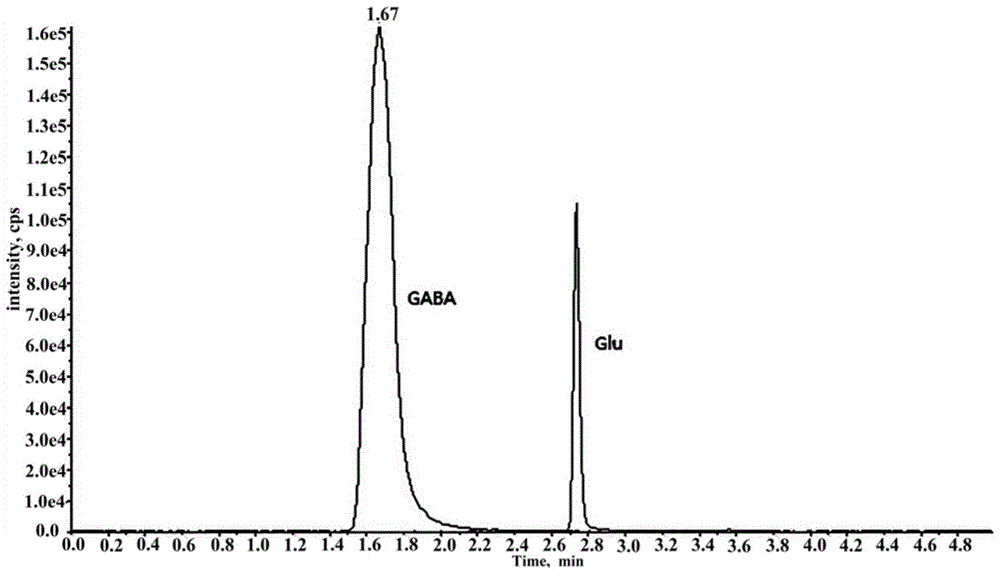
中提出的问题。本发明实施例是这样实现的,一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,其包括以下步骤:将桑叶和青蒿进行混合,用水进行煎煮,得到煎煮液和药渣;将黑大豆置于煎煮液中进行浸泡后,再与药渣进行混合、密封和灭菌处理,得到发酵原料;将枯草芽孢杆菌菌液接种至发酵原料中进行纯种发酵,得到发酵产物;将发酵产物进行蒸制和晒干处理,得到所述淡豆豉。作为本发明实施例的一种优选方案,所述桑叶和青蒿的质量比为1:(0.7~1.0)或(0.7~1.0):1。作为本发明实施例的另一种优选方案,所述黑大豆与煎煮液的质量体积比以g/ml计为1:(0.8~1.2)。作为本发明实施例的另一种优选方案,所述黑大豆的质量与桑叶和青蒿的总质量的比值为1:(0.14~0.20)。作为本发明实施例的另一种优选方案,所述步骤中,灭菌处理的温度为121℃,灭菌时间为15~30分钟。作为本发明实施例的另一种优选方案,所述枯草芽孢杆菌菌液的菌体浓度为106~108cfu/ml;所述枯草芽孢杆菌菌液与黑大豆的质量比为(0.02~0.06):1。作为本发明实施例的另一种优选方案,所述步骤中,纯种发酵的温度为31~37℃,湿度为60%~80%,发酵时间为12~15天。本发明实施例的另一目的在于提供一种通过上述纯种发酵方法发酵得到的淡豆豉。作为本发明实施例的另一种优选方案,所述淡豆豉中γ-氨基丁酸的含量用高效液相色谱-质谱法不低于6.03mg/g。本发明实施例的另一目的在于提供一种上述的淡豆豉在制备药食两用药物中的应用。本发明实施例提供的一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,通过枯草芽孢杆菌等有益微生物对黑大豆进行纯种发酵,不仅可以使得到的富集gaba的淡豆豉产品的性状和品质达到或超过传统生产工艺水平,而且还可以缩短发酵时间,并生产出质量稳定且安全有效的高富集gaba的淡豆豉。另外,与传统液态发酵工艺相比,本发明实施例提供的为纯种固态发酵方法,具有生产工艺简单、能耗低、废渣、废水少、环境污染小等优势,有助于生产企业实现节能减排和清洁生产。本发明实施例提供的高富集γ-氨基丁酸的淡豆豉纯种发酵方法对实现高产gaba的淡豆豉标准工业化生产,对保证淡豆豉的质量稳定和安全有效、拓宽淡豆豉药食两用价值和临床应用范围、使其成为摄取gaba的新资源等有重要意义,同时可发挥传统中药在富含gaba新产品开发方面的独特优势。附图说明图1为本发明实施例1得到的淡豆豉中γ-氨基丁酸hplc-ms图谱。图2为传统自然发酵方法得到的淡豆豉中γ-氨基丁酸hplc-ms图谱。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。实施例1该实施例提供了一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,其包括以下步骤:s1、将85g的桑叶和85g的青蒿进行混合,用18倍的水进行煎煮3次,每次煎煮60min,经过滤,合并3次滤液,并将滤液浓缩至1000ml,得到煎煮液和药渣。s2、将1000g的黑大豆置于上述1000ml的煎煮液中进行浸泡6h至黑大豆膨胀饱满,将煎煮液吸尽后,再与上述药渣进行混合,置于发酵瓶中,并进行密封和置于121℃的温度下进行灭菌处理25min,得到发酵原料。s3、将菌体浓度为107cfu/ml的枯草芽孢杆菌菌液以4%的接种量(质量比)接种至上述发酵原料中,并置于34℃的温度以及70%的湿度条件下进行纯种发酵14天,得到发酵产物。其中,枯草芽孢杆菌为本实验室从自然发酵淡豆豉中分离纯化经分子生物学方法鉴定,具体可选用枯草芽孢杆菌(bacillussubtilis)jx2。s4、将上述发酵产物进行略蒸和晒干处理,即可得到淡豆豉。实施例2该实施例提供了一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,其包括以下步骤:s1、将70g的桑叶和90g的青蒿进行混合,用16倍的水进行煎煮3次,每次煎煮50min,经过滤,合并3次滤液,并将滤液浓缩至800ml,得到煎煮液和药渣。s2、将1000g的黑大豆置于上述800ml的煎煮液中进行浸泡5h至黑大豆膨胀饱满,将煎煮液吸尽后,再与上述药渣进行混合,置于发酵瓶中,并进行密封和置于121℃的温度下进行灭菌处理20min,得到发酵原料。s3、将菌体浓度为106cfu/ml的枯草芽孢杆菌菌液以2%的接种量(质量比)接种至上述发酵原料中,并置于31℃的温度以及60%的湿度条件下进行纯种发酵12天,得到发酵产物。其中,枯草芽孢杆菌为本实验室从自然发酵淡豆豉中分离纯化经分子生物学方法鉴定,具体可选用枯草芽孢杆菌(bacillussubtilis)jx2。s5、将上述发酵产物进行略蒸和晒干处理,即可得到淡豆豉。实施例3该实施例提供了一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,其包括以下步骤:s1、将100g的桑叶和70g的青蒿进行混合,用20倍的水进行煎煮3次,每次煎煮70min,经过滤,合并3次滤液,并将滤液浓缩至1200ml,得到煎煮液和药渣。s2、将1000g的黑大豆置于上述1200ml的煎煮液中进行浸泡7h至黑大豆膨胀饱满,将煎煮液吸尽后,再与上述药渣进行混合,置于发酵瓶中,并进行密封和置于121℃的温度下进行灭菌处理30min,得到发酵原料。s3、将菌体浓度为108cfu/ml的枯草芽孢杆菌菌液以6%的接种量(质量比)接种至上述发酵原料中,并置于37℃的温度以及80%的湿度条件下进行纯种发酵15天,得到发酵产物。其中,枯草芽孢杆菌为本实验室从自然发酵淡豆豉中分离纯化经分子生物学方法鉴定,具体可选用枯草芽孢杆菌(bacillussubtilis)jx2。s4、将上述发酵产物进行略蒸和晒干处理,即可得到淡豆豉。实施例4该实施例提供了一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,其包括以下步骤:s1、将100g的桑叶和100g的青蒿进行混合,用20倍的水进行煎煮3次,每次煎煮70min,经过滤,合并3次滤液,并将滤液浓缩至1100ml,得到煎煮液和药渣。s2、将1000g的黑大豆置于上述1100ml的煎煮液中进行浸泡6h至黑大豆膨胀饱满,将煎煮液吸尽后,再与上述药渣进行混合,置于发酵瓶中,并进行密封和置于121℃的温度下进行灭菌处理15min,得到发酵原料。s3、将菌体浓度为107cfu/ml的枯草芽孢杆菌菌液以5%的接种量(质量比)接种至上述发酵原料中,并置于35℃的温度以及70%的湿度条件下进行纯种发酵13天,得到发酵产物。其中,枯草芽孢杆菌为本实验室从自然发酵淡豆豉中分离纯化经分子生物学方法鉴定,具体可选用枯草芽孢杆菌(bacillussubtilis)jx2。s4、将上述发酵产物进行略蒸和晒干处理,即可得到淡豆豉。实施例5该实施例提供了一种高富集γ-氨基丁酸的淡豆豉纯种发酵方法,其包括以下步骤:s1、将70g的桑叶和100g的青蒿进行混合,用17倍的水进行煎煮3次,每次煎煮55min,经过滤,合并3次滤液,并将滤液浓缩至900ml,得到煎煮液和药渣。s2、将1000g的黑大豆置于上述900ml的煎煮液中进行浸泡7h至黑大豆膨胀饱满,将煎煮液吸尽后,再与上述药渣进行混合,置于发酵瓶中,并进行密封和置于121℃的温度下进行灭菌处理30min,得到发酵原料。s3、将菌体浓度为108cfu/ml的枯草芽孢杆菌菌液以3%的接种量(质量比)接种至上述发酵原料中,并置于36℃的温度以及70%的湿度条件下进行纯种发酵15天,得到发酵产物。其中,枯草芽孢杆菌为本实验室从自然发酵淡豆豉中分离纯化经分子生物学方法鉴定,具体可选用枯草芽孢杆菌(bacillussubtilis)jx2。s4、将上述发酵产物进行略蒸和晒干处理,即可得到淡豆豉。实验例:一、运用高效液相色谱-质谱法(highperformanceliquidchromatography-massspectrometry,hplc-ms)分别对上述实施例1得到的淡豆豉以及传统自然发酵方法得到的淡豆豉(多菌种混合自然发酵)中的gaba含量进行测定。1、hplc-ms检测方法学建立:色谱条件:sciexexionlc型高效液相色谱仪。色谱柱:xbridgebehamidecolumn柱(2.1mm×100mm,3.5µm),0.2%甲酸水溶液(a)-0.2%甲酸乙腈溶液(b)为流动相梯度洗脱(0-1.5min,15%a;1.5-1.8min,15%-35%a;1.8-3.0min,35%-40%a;3.0-3.1min,40%-10%a;3.1-5min,10%a),进样量为2µl,柱温室温,线性洗脱流速0.5ml/min。质谱条件:使用absciexqtrap5500三重四极杆线性离子肼串联质谱仪在电喷雾正离子(esi+)模式,进行多反应检测(mrm),气帘气为40psi,碰撞气为9psi,喷雾电压为5500v,离子化温度为500℃,gs1为45mpa,gs2为mpa,去簇电压40v,碰撞电压15v;离子对m/z104→m/z87。对照品溶液的制备:精密称取0.0010ggaba标准品粉末,超纯水溶解并定容至100ml,再取1ml定容至100ml,即得浓度为100ng/ml的标准品储备液,置4℃冰箱中保存,备用。供试品溶液的制备:分别对上述实施例1得到的淡豆豉以及传统自然发酵方法得到的淡豆豉进烘干后,再进行粉碎,过60目筛,并密封放置干燥箱中保藏,得到淡豆豉粉末。接着,精密称取0.500g已粉碎的淡豆豉粉末,精密加入6ml的超纯水,放入超声仪器中超声40min,8000r/min离心10min,收集上清液,将沉淀再次加入超纯水,重复操作,合并上清液,即得供试品溶液。放置4℃的冰箱中保存,备用。(1)线性关系考察:以各浓度(mg/ml)标准品为横坐标x,对应的峰面积为纵坐标y,计算得出gaba的标准曲线方程为:y=20194x+13929(r2=0.9999),表明标准品浓度在0.1-250ng/ml之间线性关系良好。(2)重复性考察:gaba的相对标准偏差(relativestandarddeviation,rsd)(n=6)为2.42%,结果显示重复性良好。(3)稳定性考察:gaba的rsd为4.21%,结果显示稳定性良好。(4)精密度考察:gaba的rsd为0.73%,结果显示精密度良好;(5)加样回收率考察:gaba平均加样回收率为96.25%rsd(n=6)为3.34%,表示该方法可用于淡豆豉中gaba的含量测定。2、γ-氨基丁酸的测定结果:上述实施例1得到的淡豆豉以及传统自然发酵方法得到的淡豆豉(多菌种混合自然发酵)中的gaba的hplc-ms图谱分别如附图1和2所示。根据附图1和2,并采用线性回归方程可计算上述实施例1得到的淡豆豉中的gaba含量高达6.03mg/g,传统自然发酵方法得到的淡豆豉中的gaba含量6.33mg/g,其表明本发明实施例提供的纯种发酵方法发酵得到的淡豆豉中的gaba含量与传统自然发酵方法的相当。二、对上述实施例1得到的淡豆豉以及传统自然发酵方法得到的淡豆豉(多菌种混合自然发酵)分别进行感官性状评价。1、感官性状评价方法:参照食品感官评定标准《gb/t15682-2009粮油检验、稻谷、大米蒸煮食用品质感官评价方法》,制订评分标准如表1所示。表12、感官性状评价结果:上述实施例1得到的淡豆豉以及传统自然发酵方法得到的淡豆豉的各项感官性状评价分数如表2所示。其中,上述实施例1得到的淡豆豉的感官性状评价的总得分为32.20;传统自然发酵方法得到的淡豆豉的感官性状评价的总得分为33.90,二者相差不大。表2项目传统自然发酵淡豆豉纯种发酵淡豆豉形态8.78.5色泽8.38.6香气8.87.3滋味8.17.8总得分33.932.2三、对上述实施例1得到的淡豆豉进行安全性评价。1、实验动物:清洁级昆明小鼠,雌雄各半,体重(20±2g),江西中医药大学动物中心提供,许可证号[scxk(赣)2019-0003]。购入后正常饮食及饮水适应环境3-5天,饲养环境室温20-25℃。2、实验方法2.1上述实施例1得到的淡豆豉的煎煮液的制备:将上述实施例1得到的淡豆豉进行粉碎,过60目筛,得到样品粉末;接着,精密称取样品粉末45.05g,加入1000ml蒸馏水浸泡1h,煎煮20min,过滤,重复3次,合并3次滤液,浓缩至20ml,得到淡豆豉煎煮液;然后,用蒸馏水稀释成高、中、低三个浓度梯度。2.2预试验:将昆明小鼠随机分为三组,每组6只,雌雄各半,分为上述淡豆豉煎煮液高、中、低剂量三个组,以灌胃体积20.0ml/kg进行一次给药,给药前禁食不禁水12h,灌胃后密切观察24h内小鼠死亡情况。2.3最大耐受量实验:取20只昆明小鼠,每组10只,雌雄各半,分别为对照组和给药组;给药组在给药前禁食不禁水12h,采用上述淡豆豉煎煮液高剂量组为给药浓度,以最大灌胃体积40.0ml/kg进行给药,每隔4h给药一次,每日两次,对照组以相同的方式灌胃蒸馏水,给药2h后提供食物。观察14d,比较各组小鼠的活动状态、体重、饮水和进食、皮毛颜色、大小便和死亡数目。2.4小鼠急性毒性实验观察:各组灌胃给药后,按照常规饲养。灌胃给药后2h之内,每15min观察1次;2-4h内,每0.5h观察1次;4~6h内,每1h观察1次;每天同时段观察小鼠的体重、活动、饮水和进食、皮毛颜色、大小便、死亡等情况。若小鼠死亡,解剖观察各脏器改变情况。然后将存活的小鼠颈椎脱臼处死,同时解剖和观察小鼠主要脏器的变化。2.5统计学方法:采用prismgraphpad7.0统计软件对数据进行处理,各组体重用均数加减标准差(±s)表示,用t检验分析各组数据间差异性,p<0.05表示差异具有统计学意义。3、实验结果3.1预试验结果:各组小鼠进行一次性灌胃给药,给药后连续观察24h。从给药开始到观察结束期间,各组小鼠行为活动、精神状态良好,未表现出任何异常反应。3.2最大耐受量实验结果3.2.1小鼠状态变化:对照组:给药后1~14d期间小鼠的各项观察指标均正常。给药组:给药后2h内小鼠活动和进食饮水量减少,未出现抽搐、呼吸困难等现象。1~14d期间,小鼠活动、进食饮水、皮毛颜色、大小便均正常,未出现小鼠死亡现象。3.2.2小鼠体重变化与对照组比较,给药组的小鼠体重增长正常,无统计学差异(p>0.05)。将两组中雌雄两组分别计算均值,再进行比较,其体重变化情况见下表3。其中,与初始值比较,*p<0.05,**p<0.01。表33.2.3小鼠解剖脏器变化14d观察期结束后,将所有小鼠进行颈椎脱臼处死,解剖后发现各组小鼠各脏器均无异常。由上可知,本发明实施例得到的淡豆豉在急性毒性实验中,小鼠未出现死亡情况,ld50低于最低定量限,因此,以2.25g/ml为最大给药浓度、40.0ml/kg为最大给药体积灌胃两次,进行最大耐受量实验,连续观察14d,未出现小鼠死亡或其他毒性反应。通过小鼠经口急性毒性实验对本发明实施例得到的高富集γ-氨基丁酸的淡豆豉进行安全性评价,小鼠经口给药剂量为90.10g/kg,等效剂量相当于人的50倍,与对照组相比小鼠均未出现毒性反应和死亡现象,表明本发明实施例提供的纯种发酵方法得到的淡豆豉毒性极小或者没有毒性。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1