一种α-淀粉酶抑制剂与植物多酚的复合方法
一种
α
‑
淀粉酶抑制剂与植物多酚的复合方法
技术领域
1.本发明属于食品生物技术领域,特别是涉及一种α
‑
淀粉酶抑制剂与植物多酚的复合方法。
背景技术:
2.目前,慢性病已成为威胁我国居民健康的主要疾病,肥胖人群也呈现逐年增加的趋势,其中糖尿病、尤其 ii 型糖尿病已经成为继癌症、心脑血管疾病之后的严重威胁人类健康的第三大疾病。因此预防和控制糖尿病和肥胖症具有重要的社会价值和经济价值。尽管市场上许多化学合成产品如阿卡波糖、伏格列波糖等具有良好的降血糖作用,但这些产品都有着一定的副作用。相比于药物治疗,饮食结构的调整及干预,能够在源头对血糖加以控制,预防大于治疗,开发安全、无毒副作用、具有功能和营养双重特性的保健食品一定会受到市场和消费者的认可。
3.α
‑
淀粉酶抑制剂(α
‑
amylase inhibitor, α
‑
ai)是一类能与 α
‑
淀粉酶结合并改变其构象,从而降低 α
‑
淀粉酶活力的含氮碳水化合物或大分子蛋白质,普遍存在于各种豆类和谷物之中。其中白芸豆(white kidney bean)α
‑
淀粉酶抑制剂是一种蛋白类抑制剂,能特异性地抑制人体唾液和肠道内 α
‑
淀粉酶活力,阻碍食物中碳水化合物的水解和消化,从而减少人体热量来源,延缓糖类的吸收,有效地降低餐后血糖浓度。α
‑
ai 具有抑制活性强,生物安全性高等优点,因而在防控糖尿病和肥胖症方面具有更为广阔的前景。
4.但现有技术多针对于不同来源 α
‑
淀粉酶抑制剂的提取及纯化工艺的研究,在工业化生产过程中对设备及操作人员的要求较高,在一定程度上限制了α
‑
淀粉酶抑制活性的提升,无法将实验室所得的结果推广至工业化。本技术人团队一直致力于植物蛋白的提取和改性研究,通过对α
‑
淀粉酶抑制机理及协同作用的研究,利用蛋白质和多酚形成的复合物的机理,不仅能提高复合物对 α
‑
淀粉酶的抑制能力,还能有效增强其可加工特性,为促进国内农产品资源的开发与利用提供技术支持,同时也为肥胖和糖尿病患者的预防和控制带来福音。
技术实现要素:
5.本发明旨在于克服现有技术的不足,提供了一种α
‑
淀粉酶抑制剂与植物多酚的复合方法,所述α
‑
ai的浓缩和纯化采用了二级膜超滤工艺;所述复合物为α
‑
ai分别与egcg、葡萄籽多酚和黑果腺肋花楸多酚复合而成的非共价化合物。
6.本发明的一种α
‑
淀粉酶抑制剂与植物多酚的复合方法,是通过下列步骤实现的:(1)α
‑
淀粉酶抑制剂的提取a、将白芸豆去杂、加水浸泡12~24h、浸泡温度控制在3~5℃;b、将经a步骤处理的物料进行低温烘干后粉碎过筛,得到白芸豆粉;c、取经b步骤制得的粉料加水浸提,料液重量比为1:8~12,浸提温度为30~40℃,浸提时间为2~3h,得到α
‑
淀粉酶抑制剂粗提液;
d、将经c步骤制得的α
‑
淀粉酶抑制剂粗提液冷却后经双联过滤器过滤,得到滤液;e、将经d步骤制得的滤液进行二级膜超滤,得到超滤液;(2)α
‑
淀粉酶抑制剂的前处理:将步骤(1)制得超滤液的ph调至6.7~7.0,进行超声处理,即制得α
‑
淀粉酶抑制剂处理液,备用;(3)植物多酚的配制:将植物多酚配制成浓度为0.5~1.5mg/ml的母液,备用;(4)复合:将步骤(3)和步骤(2)分别制得的植物多酚母液与α
‑
淀粉酶抑制剂处理液以1:4~6的体积比混合,避光搅拌30~50min,在
‑
50~
‑
70℃干燥36~48h,即完成α
‑
淀粉酶抑制剂与植物多酚的复合。
7.作为本发明的进一步改进,上述步骤e中所述滤液进行二级膜超滤,第一级超滤膜的截留分子量为30~100kda,第二级超滤膜的截留分子量为10~50kda;两次膜超滤的进口压力均设定为0.15~0.25mpa。循环流量为3~5l/min,其中一级超滤的回流液为α
‑
淀粉酶抑制剂提取液,收集膜内透过液,重复操作2~4次,二级膜超滤则以一级膜超滤后收集液作为回流液进入超滤系统,超滤结束后收集回流液,重复操作2~4次,得α
‑
淀粉酶抑制剂超滤液。
8.作为本发明的进一步改进,上述e步骤中的二级膜超滤工艺,所述超滤膜截留分子量分别为50kda和30kda;所述α
‑
淀粉酶抑制剂分子量为34kda。
9.作为本发明的进一步改进,所述的植物多酚为egcg、葡萄籽多酚及黑果腺肋花楸多酚中的任一种。
10.作为本发明的进一步改进,所述的超声处理的功率为400~600w,超声时间为3~7min。
11.本发明提供的一种α
‑
淀粉酶抑制剂与植物多酚的复合方法,其制得的α
‑
ai具有较高的生物活性,特别是对α
‑
淀粉酶的抑制活性,且纯度较高;α
‑
ai与植物多酚的复合物热稳定性增强;在人体生理ph时能较好地保存其活性,制备成本低,适合工业化生产,具有良好的开发应用前景。
附图说明
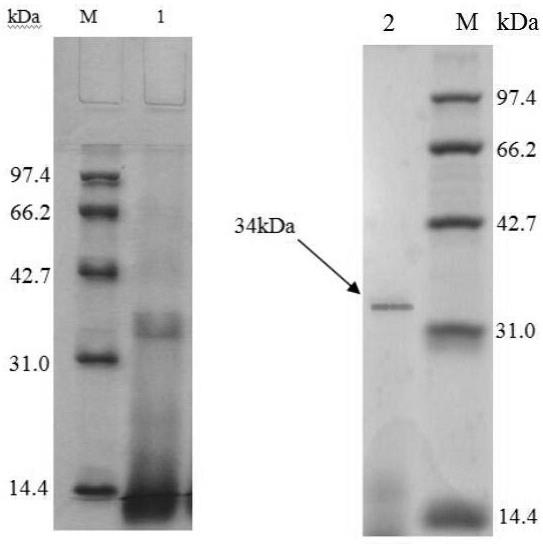
12.图1为实施例1中α
‑
ai sds
‑
page电泳图(其中m为标准蛋白质;1为α
‑
ai提取液;2为α
‑
ai超滤液);图2为α
‑
ai及其与三种植物多酚的复合物荧光光谱图。
具体实施方式
13.实施例1α
‑
淀粉酶抑制剂与egcg的复合方法,是通过下列步骤实现的:(1)α
‑
淀粉酶抑制剂的提取a、将白芸豆去杂、在4℃条件下加水浸泡18h,捞出白芸豆,沥干备用;b、将经a步骤处理的白芸豆采用常规烘干和粉碎过筛的方法,经40℃烘干,粉碎,过60目筛,得白芸豆粉;c、取经b步骤制得的粉料加水浸提,料液重量比为1:10,浸提温度为35℃,浸提时间为2.5h,得到α
‑
淀粉酶抑制剂粗提液;
d、将经c步骤制得的α
‑
淀粉酶抑制剂粗提液冷却后经双联过滤器过滤,得滤液;过滤滤芯精度为0.05~0.2微米、优选为0.1微米,滤袋精度为0.25~1.0微米、优选为0.5微米,过滤压力为0.08~0.12mpa,优选为0.1mpa;e、将经d步骤制得的滤液进行二级膜超滤,一级超滤膜的截留分子量为30~100kda、优选50kda,二级超滤膜的截留分子量为10~50kda、优选30kda的超滤膜,两次膜超滤中超滤的进口压力为0.15~0.25mpa、优选0.20mpa,循环流量为3~5l/min、优选4l/min;其中,一级超滤的回流液为α
‑
ai提取液,收集膜内透过液,重复操作优选次数为2~4次、优选3次,二级超滤则以一级超滤后收集液作为回流液进入超滤系统,超滤结束后收集回流液,重复操作次数为2~4次,优选3次,得到超滤液;(2)α
‑
淀粉酶抑制剂的前处理:利用磷酸二氢钾和磷酸氢二钾凋节超滤液的ph至6.8,进行超声处理,超声功率为400~600w、优选为500w,超声时间为3~7min、优选为5min,即制得α
‑
淀粉酶抑制剂处理液,备用;(3)植物多酚的配制:将egcg制成浓度为1mg/ml的母液,备用;egcg(表没食子儿茶素没食子酸酯)是一类属于黄酮类的多酚类化合物,是茶多酚的主要成分;(4)复合:将步骤(3)和步骤(2)分别制得的egcg母液与α
‑
淀粉酶抑制剂处理液以1:5的优选体积比混合,避光搅拌40min,在
‑
60℃干燥42h,即完成α
‑
淀粉酶抑制剂与egcg的复合。
14.实施例2α
‑
淀粉酶抑制剂与葡萄籽多酚的复合方法,葡萄籽多酚含有大量的低聚原花青素,与蛋白质具有较好的结合能力,同时具有显著的自由基清除能力及众多有益人体健康的生物活性。该方法利用磷酸二氢钾和磷酸氢二钾调整α
‑
ai超滤液的 ph值为 6.9,进行超声处理,超声功率为500w,超声时间为5min,即制得α
‑
淀粉酶抑制剂处理液。其它步骤同实施例1。
15.实施例3α
‑
淀粉酶抑制剂与黑果腺肋花楸多酚的复合方法,黑果腺肋花楸果实营养丰富,具有含量较高的多酚、维生素和矿物质等主要营养物质,可以预防和控制糖尿病的发生和发展。该方法利用磷酸二氢钾和磷酸氢二钾调整α
‑
ai超滤液的 ph值为 6.9,进行超声处理,超声功率为500w,超声时间为5min,即制得α
‑
淀粉酶抑制剂处理液。其它步骤同实施例1。
16.将实施例1
‑
3制得的α
‑
ai与植物多酚的复合物,利用dns法测定其对α
‑
淀粉酶的抑制活性和复合物在生理ph条件下的稳定性,利用示差扫描热法确定复合物的热稳定性:α
‑
ai的抑制活性(ic
50
)的测定:取 50 μl的α
‑
淀粉酶(2.5u/ml)与 50 μl 的经过稀释的淀粉酶抑制剂,再添加100 μl 磷酸盐缓冲溶液(0.1mol/l,ph6.9),在37℃下水浴10min,再添加100 μl 浓度为 1% 的可溶性淀粉溶液,精确反应5min,最后加入100 μl dns试剂终止反应,沸水浴10min,冷却至室温,加入1 ml去离子水,混合均匀后于520nm处测定其吸光值。在试验过程中另外设置空白组,空白对照组和样品对照组,其中,空白组中不添加样品,空白对照组中不添加淀粉酶液和样品,样品对照组中不加淀粉酶液,体积不足的组分均以磷酸盐缓冲溶液补足。α
‑
ai对α
‑
淀粉酶抑制率按下式计算:
式中,a1、a2、a3和a4分别为 520 nm下空白对照组、空白组、样品组和样品对照组的吸光值;ic
50
值为当抑制率为50%时所对应的样品浓度。
17.热稳定性分析:取 4 mg复合物样品于坩埚中密封,以密封的空坩埚作为空白对照,测试温度范围是 25~150 ℃,升温速率为 10 ℃/min,氮气流速为 30 ml/min;结论:实施例1
‑
3制备的α
‑
ai与植物多酚的复合物对α
‑
淀粉酶的抑制活性的ic
50
值分别为0.54mg/ml、0.58mg/ml和0.72mg/ml,而未经复合反应的单独的α
‑
ai抑制活性的ic
50
值为1.21mg/ml(ic
50
值越低说明其对α
‑
淀粉酶的抑制活性越高),可见,复合后的α
‑
ai活性较单独的α
‑
ai活性得到了显著提高,且试验证明α
‑
ai与植物多酚的复合物在人体生理ph值时能较好地保存其活性。另一方面,实施例1
‑
3复合物相较于单独的α
‑
ai的热变性温度(81.05℃)分别提高了12.18℃、13.27℃和11.13℃,说明多酚的引入提高了α
‑
ai的热稳定性。
18.利用sds
‑
page电泳法测定实施例1中制备的α
‑
ai提取液和超滤液的纯度。电泳图见图1(m为标准蛋白质;1为α
‑
ai提取液;2为α
‑
ai超滤后溶液)。由图可知,白芸豆中α
‑
ai的分子量为34kda,二级膜超滤后样品的电泳条带清晰,且杂质较少,说明采用本发明中所述的提取及纯化方案效率较高。
19.再利用荧光光谱法测定实施例1
‑
3中复合物在不同波长下的荧光强度:将制备的α
‑
ai及实施例1
‑
3中的复合物稀释约 50 倍,用 f
‑
6000 荧光分光光度计进行荧光光谱的测定,参数设定为 λex=280 nm,λem为 300
‑
500 nm,增长间隔为 1 nm,扫描速度为 600 nm/min:α
‑
ai属于蛋白类抑制剂,由于蛋白质和多酚结合过程实质是蛋白的侧链基团(如色氨酸)和多酚小分子的官能团(如酚羟基) 发生非共价/共价结合,可以通过荧光分光光度计测定色氨酸的数量来确定α
‑
ai内部结构的打开程度以及与植物多酚的结合程度。结果见图2:当色氨酸在蛋白质内部没有暴露出来时,荧光强度较低,荧光峰位会发生蓝移,当蛋白质结构展开色氨酸暴露出来时,荧光强度增加并发生红移。由图可知,随着egce、葡萄籽多酚及黑果腺肋花楸多酚的加入,复合物的荧光强度下降程度逐渐增大,同时发生了明显的红移,说明三种植物多酚均与α
‑
ai形成复合作用,使得部分色氨酸基团被掩盖,改变了色氨酸附近的疏水环境,降低了荧光强度。其中egcg与白芸豆蛋白的结合能力最强,其次为葡萄籽多酚及黑果腺肋花楸多酚。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1