抗氧化剂至肠道的直接递送的制作方法
1.本发明涉及将包含至少两种抗氧化剂(例如维生素c、维生素b2、β-胡萝卜素和维生素e)的组合物直接递送至肠道微生物群系。发现所述组合物具有微生物群系调节/益生元活性,从而导致短链脂肪酸产量增加、有益细菌丰度增加和微生物群系活性增加。
背景技术:
2.已经描述了各种维生素和其他活性成分至肠道的直接递送。参见例如us 9,433,583 b2,其涉及一种用于预防结直肠腺瘤性息肉和结直肠癌的包含维生素d和任选的其它维生素的结肠靶向单一剂型;以及wo2014/070014,其涉及核黄素(维生素b2)用于刺激普拉氏粪杆菌(faecalibacterium prausnitzii)群体的用途。
3.期望具有以协同方式起作用以改善肠道微生物活性的活性成分的组合。
技术实现要素:
4.根据本发明,已经发现,抗氧化剂的组合,特别是维生素c、维生素b2、维生素e和β-胡萝卜素的组合,当直接递送至肠道时,可以对肠道微生物群系具有协同的微生物群调节效应。因此,本发明的一个方面是一种增强肠道健康的方法,所述方法包括将抗氧化剂的组合直接施用至肠道。
5.优选地,所述抗氧化剂是以下中的至少两种,更优选全部:维生素c、维生素e、核黄素和β-胡萝卜素。
6.因此,本发明的一个实施方式是一种组合物,所述组合物基本上由以下组成:
7.有效剂量的至少两种抗氧化剂,所述至少两种抗氧化剂选自由以下项组成的组:维生素c、维生素b2、β-胡萝卜素和维生素e
8.所述抗氧化剂用于改善包括人在内的动物的肠道健康,其中所述改善包括以下或由以下组成:
9.i.增加微生物群系的活性;
10.ii.增加肠道中的至少一种短链脂肪酸或其盐的浓度;
11.iii.减少肠道中形成的氨的量;
12.iv.增加肠道中的微生物群系多样性;
13.v.增加肠道中有益细菌的丰度;
14.vi.改善肠道的屏障功能;和/或
15.vii.减少肠道内病原体的丰度;
16.所述组合物将抗氧化剂递送至大肠。
17.本发明的另一个实施方式是以下物质在制备将抗氧化剂输送至大肠的药物或营养制剂中的用途:
18.基本上由至少两种抗氧化剂组成的有效剂量,所述至少两种抗氧化剂选自由以下项组成的组:维生素c、维生素b2、β-胡萝卜素和维生素e,所述抗氧化剂用于改善包括人在
磷酸酯。
44.可与“抗坏血酸”互换使用的术语“维生素c”还包括其药学上可接受的盐(例如抗坏血酸钠和抗坏血酸钙)及其药学上可接受的酯(特别是棕榈酸抗坏血酸酯)。
45.术语“β-胡萝卜素”是指β-胡萝卜素或前维生素a。
46.术语“维生素e”包括四种形式的生育酚(α-生育酚、β-生育酚、γ-生育酚和δ-生育酚)和四种形式的生育三烯酚(α-生育三烯酚、β-生育三烯酚、γ-生育三烯酚和δ-生育三烯酚)。
47.如本文所用的术语“短链脂肪酸”(scfa)是指具有2至6个碳原子的脂肪酸。scfa包括甲酸、乙酸、丙酸、丁酸、2-甲基丙酸、3-甲基丁酸和己酸。最重要的scfa是乙酸、丙酸和丁酸。
[0048]“增加短链脂肪酸(scfa)产量”包括增加以下中的任何一者或全部:乙酸、丙酸和丁酸产量,以及增加乳酸产量,因为乳酸是scfa的前体。“增加scfa”还可以包括减少铵和支链scfa(异丁酸、异戊酸和异己酸,它们是蛋白水解发酵的标志物,通常对宿主健康有不利影响)。
[0049]“微生物群系活性增加”包括碱消耗增加,还包括scfa总产量增加,乙酸、丙酸和丁酸产量中的任一者或全部增加,以及乳酸产量增加。微生物群系活性降低,例如肠道scfa产量降低,与包括肥胖症和炎症性肠病在内的疾病相关。
[0050]
短链脂肪酸增加
[0051]
动物结肠中一种或多种scfa浓度的“增加”是相对于未施用活性抗氧化剂的动物的scfa浓度而言的。未施用活性抗氧化剂的动物在本文中被称为“对照动物”。优选地,动物结肠中一种或多种scfa浓度的增加是相对于未施用活性抗氧化剂的相同动物的scfa浓度而言的。也就是说,在这种情况下,对照动物通常是与开始施用活性抗氧化剂之前相同的动物。优选地,对照动物已经至少28天没有接受营养补充剂形式的本文所述的活性抗氧化剂。
[0052]
在一个实施方式中,在单次施用活性抗氧化剂后,一种或多种scfa的浓度增加。在另一个实施方式中,在连续两天施加的两次活性抗氧化剂的施用后,一种或多种scfa的浓度增加。在另一个实施方式中,在连续七天施加的七次活性抗氧化剂的施用后,一种或多种scfa的浓度增加。在另一个实施方式中,在连续14天施加的14次活性抗氧化剂的施用后,一种或多种scfa的浓度增加。优选地,在连续21天施加的21次活性抗氧化剂的施用后,一种或多种scfa(例如,乙酸、丙酸和/或丁酸)的浓度增加。最优选地,在每天一次连续28天施加的28次活性抗氧化剂的施用后,一种或多种scfa(例如,乙酸、丙酸和/或丁酸)的浓度增加。
[0053]
相对于对照的结肠中的scfa浓度,结肠中的scfa浓度可增加至少5%,优选至少10%、或至少15%、或至少20%。在对照中,尚未施用活性抗氧化剂。
[0054]
结肠中的scfa浓度可以通过从施用活性抗氧化剂的哺乳动物获得粪便样本并测量一种或多种scfa的浓度来确定。
[0055]
用于例如通过气相色谱法来测量通常已知的scfa的浓度的方法,是本领域技术人员已知的。例如,de weirdt等人(2010)(doi:10.1111/j.1574-6941.2010.00974.x)描述了合适的方法。
[0056]
或者,施用活性抗氧化剂后一种或多种scfa的增加可以使用反应器和粪便悬浮液作为体外模型来确定,如本技术的实施例中所述。
[0057]
还观察到,scfa增加伴随着致病性细菌(例如脆弱拟杆菌)丰度的降低。
[0058]
本发明的另一个实施方式是选自由维生素c、维生素b2、维生素e和β-胡萝卜素组成的组的至少两种,优选地四种抗氧化剂在改善包括人在内的动物的肠道健康中的用途,其中所述改善包括增加肠道中至少一种短链脂肪酸或其盐的浓度;并且其中短链脂肪酸选自由以下项组成的组:乙酸、丙酸和丁酸或其盐。
[0059]
本发明的另一个实施方式是一种活性抗氧化剂组合物,其中所述活性抗氧化剂是选自由以下项组成的组中的至少两者:β胡萝卜素、维生素c、维生素e和核黄素,所述活性抗氧化剂组合物用于增加肠道内至少一种短链脂肪酸或其盐的浓度。
[0060]
本发明的另一个实施方式是一种用于改善包括人在内的动物的肠道健康的活性抗氧化剂组合物,其中所述改善包括增加肠道中至少一种短链脂肪酸或其盐的浓度;其中所述包括人在内的动物正经历选自由以下项组成的组的病症:代谢疾患、2型糖尿病、肥胖症、克罗恩氏病、溃疡性结肠炎、炎症性肠病、肠易激综合征、肠漏症、营养不良、慢性炎症和心血管疾病。
[0061]
提高微生物群系的多样性
[0062]
本发明的另一个实施方式是抗氧化剂组合物用于增加微生物群系的多样性,和/或增加肠道,特别是结肠中有益细菌的量的用途。已知存在于结肠中的有益菌包括氨基酸球菌属(acidaminococcus)、阿克曼菌属种属(akkermansia sp.)、椭圆形拟杆菌(bacteroides ovatus)、双歧杆菌属种属(bifidobacterium spp.)、长生布劳特氏菌(blautia producta)、耳蜗形梭菌(clostridium cocleatum)、产气柯林斯菌(collinsella aerofaciens)、长链多尔氏菌(dorea longicatena)、大肠杆菌(escherichia coli)、真杆菌属种属(eubacterium spp.)、普拉氏粪杆菌(faecalibacterium prausnitzii)、裂果胶毛螺菌(lachnospira pectinoshiza)、乳杆菌属种属(lactobacillus spp.)、狄氏副拟杆菌(parabacteroides distasonis)、拉乌尔菌属种属(raoultella spp.)、罗斯氏菌属种属(roseburia spp.)、瘤胃球菌属种属(ruminococcus spp.)和链球菌属种属(streptococcus spp.)。
[0063]
优选地,增加的细菌选自由以下项组成的组:双歧杆菌属、阿克曼菌属、粪杆菌属(faecalibacterium)和拟杆菌属(bacteriodes)。更优选地,在施用本发明的抗氧化剂后,青春双岐杆菌(bifidobacterium adolescentis)、长双歧杆菌(bifidobacterium longum)、椭圆形拟杆菌(bacteroides ovatus)、解木聚糖拟杆菌(bacteroides xylanisolvens)、lachnoclostridium种属、嗜黏蛋白阿克曼菌(akkermansia muciniphila)、韦氏布劳特氏菌(blautia wexlerae)、和/或普拉氏粪杆菌(faecalibacterium prausnitzii)增加。
[0064]
当包括人在内的动物正在经历选自由以下项组成的组的病症时,增加细菌的多样性和/或增加有益细菌的量特别有帮助:代谢疾患、2型糖尿病、肥胖症、克罗恩氏病、溃疡性结肠炎、炎症性肠病、肠易激综合征、肠漏症、营养不良、慢性炎症和心血管疾病。
[0065]
改善肠道的屏障功能
[0066]
本发明的另一个实施方式是抗氧化剂组合物用于增加肠道的屏障功能的用途。当包括人在内的动物正在经历屏障功能受损的病症时,屏障功能的改善是特别重要的,所述病症为例如选自由以下项组成的组的病症:代谢疾患、2型糖尿病、肥胖症、克罗恩氏病、溃
疡性结肠炎、炎症性肠病、肠易激综合征、肠漏症、营养不良、慢性炎症和心血管疾病。scfa充当肠上皮细胞的燃料,并且已知支持肠屏障功能,丁酸盐尤其具有免疫调节效应。
[0067]
剂量:
[0068]
优选地,核黄素以一定的量施用,使得其在结肠中的局部浓度为至少0.05g/l,优选地至少0.1g/l,更优选地0.125g/l。结肠中优选的局部浓度范围为约0.1g/l至约0.5g/l或约0.1g/l至约0.2g/l,优选地约0.125g/l。一种优选的每日剂量是至多200mg。
[0069]
优选地,β-胡萝卜素以一定的量施用,使得其在结肠中的局部浓度为至少0.1g/l,优选地至少0.15g/l,最优选地至少0.2g/l。结肠中优选的局部浓度范围为约0.05g/l至约0.4g/l,更优选地约0.15g/l至约0.25g/l。一种优选的每日剂量为至多150mg。
[0070]
优选地,维生素e(50%)以一定的量施用,使得其在结肠中的局部浓度为至少0.005g/l,优选地至少0.05g/l,最优选地至少0.15g/l。结肠中优选的局部浓度范围为约0.005g/l至约2.5g/l,更优选地约0.15g/l至约1.75g/l。一种优选的每日剂量为至多1000mg。
[0071]
优选地,抗坏血酸以一定的量施用,使得其在结肠中的局部浓度为至少0.05g/l,优选地至少0.1g/l,最优选地至少0.8g/l。结肠中优选的局部浓度范围为约0.05g/l至约1.5g/l,更优选地约0.5g/l至约1g/l,最优选地约0.8g/l至约0.9g/l。一种优选的每日剂量为至多2000mg。
[0072]
优选地,抗氧化剂以如下比率存在:
[0073][0074]
更优选地,核黄素/抗坏血酸/维生素e/β-胡萝卜素的比率为1.0/6.6/1.3/1.6。
[0075]
在优选的实施方式中,将组合物施用达延长的时间段,例如每天至少一次持续至少3天、至少一周、至少两周和至少4周。
[0076]
抗氧化剂优选以允许活性氧化剂在肠道中释放的制剂形式施用。此类形式在本领域中是已知的。或者,并且对于非人类施用可能优选地,向动物施用足够高剂量的抗氧化剂,以使其存在于肠道中。
[0077]
给出以下非限制性实施例以更好地说明本发明
实施例
[0078]
本研究的目的是比较直接递送的抗氧化剂与以下两种既定益生元低聚木糖(xos)和低聚果糖(fos)的效应。
[0079]
选择两名供体进行长期实验,其中评估重复摄入测试产品对腔肠微生物群系的活性(如通过scfa、乳酸盐、直链scfa和氨产量所评定的)和组成(如通过16s illumina测序所评定的)的影响。
[0080]
实验的设计
[0081]
的典型反应器装置代表成年人的胃肠道。它具有五个连续的反应器,模拟人胃肠道的不同部分。前两个反应器是填充和抽取原理,以模拟食物摄入和消化的不同步骤,用蠕动泵分别向胃(v1)和小肠(v2)隔室中加入限定量的shime进料(140ml3x/天)和胰腺和胆汁液体(60ml 3x/天),并在规定的间隔后清空相应的反应器。最后三个隔室模拟大肠。这些反应器被连续搅拌;它们具有恒定的体积和ph控制。选择不同容器的保留时间和ph,以模拟结肠不同部分的体内条件。在接种粪便微生物菌群后,这些反应器模拟升结肠(v3)、横结肠(v4)和降结肠(v5)。接种物制备、保留时间、ph、温度设置和反应器进料组成已在别处描述。在结肠的不同区域中的微生物群落稳定化后,在三个结肠隔室中建立代表性的微生物群落,所述微生物群落在不同结肠区域中的组成和功能都不同。
[0082]
将传统shime设置由twinshime配置改为配置(图1),从而允许并行比较四种不同的条件。在这个特定的项目期间,使用两个健康成人供体的微生物菌群,以两个并行的配置评估三种不同测试成分和空白对照的特性,这意味着每个供体都在单独的实验中进行测试。作为附加测试条件的折衷,结肠区域限于两个区域,相比之下在twinshime中为三个区域。优化保留时间和ph范围,以获得代表完全git模拟的结果。在实践中,在实验中,不是使用2个单元,每个单元由ac-tc-dc配置(升结肠、横结肠和降结肠)构成,而是使用4个pc-dc单元。在接种成人的粪便微生物菌群后,这些反应器模拟近端结肠(pc;ph 5.6-5.9;保留时间=20h,体积为500ml)和远端结肠(dc;ph 6.6-6.9;保留时间=32h,体积为800ml)。
[0083]
本研究的实验由两个阶段组成(表1,以下):
[0084]
稳定期:在用合适的粪便样本接种结肠反应器后,两周的稳定化期允许微生物群落根据局部环境条件在不同的反应器中区分。在此时段期间,向shime提供基础营养基质,以支持最初存在于粪便接种物中的肠道微生物菌群的最大多样性。在此时段结束时对样本的分析允许确定不同反应器中的基线微生物群落组成和活性。
[0085]
处理期:在此两周时段期间,shime反应器在标称条件下运行,但是饮食中补充有测试产品。在此时段中从结肠反应器中取出的样本允许研究对驻留微生物群落组成和活性的特定影响。对于空白对照条件,将标准shime营养基质进一步投加到模型中,持续14天的时段。对这些反应器的样本的分析允许确定不同反应器中的标称微生物群落组成和活性,所述组成和活性将被用作评估处理效应的参考。
[0086]
表1:在本研究中应用的不同阶段的概述。
[0087]
第1周第2周第3周第4周稳定稳定处理处理
[0088]
在以下时间点收集样本,以跟进微生物菌群对不同测试产品的适应性:
[0089]-稳定期的最后三天;
[0090]-第一处理周的最后两天;
[0091]-第二处理周的最后两天。
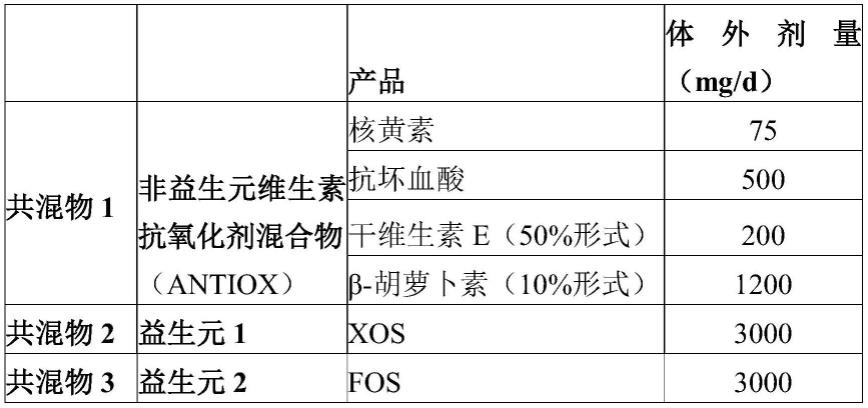
[0092]
微生物群落组成和活性的分析
[0093]
shime的一个重要特征是可以与稳定的微生物群落一起工作,并定期从不同的肠道区域收集样本以供进一步分析。结肠区域中的大体积允许每天收集足够体积的液体,而
不会扰乱微生物群落或危及实验的其余部分。在整个shime实验中,对许多微生物参数进行了监测。这些测量对于评估模型的性能是必要的,并且允许监测由于益生元处理引起的微生物群落组成和活性的基本变化。
[0094]
总发酵活性:
[0095]
酸/碱消耗:结肠反应器中微生物代谢产物的产生改变了ph。在没有连续ph控制(通过添加酸或碱)的情况下,ph将超出固定的区间。连续地监测酸/碱消耗。
[0096]
微生物群落活性:
[0097]
短链脂肪酸(scfa):分析了乙酸、丙酸和丁酸的浓度。
[0098]
乳酸盐:scfa的前体和潜在的抗微生物剂。
[0099]
铵和支链scfa(异丁酸、异戊酸和异己酸)是蛋白水解发酵的标志物,对宿主健康有相当不利的影响。
[0100]
微生物群落组成:
[0101]
收集样本用于16s靶向illumina测序。
[0102]
微生物群落组成的分析
[0103]
将两种技术结合起来以非常详细地定位不同处理引起的群落偏移:
[0104]
·
16s靶向illumina测序,一种基于pcr的方法,通过该方法将微生物序列扩增至饱和,由此提供不同系统发育水平(微生物门、科和otu水平)的不同分类群的成比例丰度。由prodigest应用的方法涉及跨越16s rdna的2个高变区(v3-v4)的引物。使用成对测序方法,2
×
250bp的测序产生424bp的扩增子。与在分类学上信息量较少的较小片段相比,此类片段在分类学上更有用。
[0105]
·
通过流式细胞术准确定量样本中的细菌细胞总数。将16s靶向illumina的高分辨率系统发育信息与通过流式细胞术对细胞计数的精确计数相结合,可以获得反应器内不同分类实体的高度精确的定量丰度。
[0106]
从每个反应器中取出附加样本,将所述样本等分并于4℃以10,000rpm离心10分钟,然后滤过0.2μm过滤器。将上清液和沉淀物运送到dsm。此外,收集100ml的shime营养培养基和100ml的胰液并运送至dsm。
[0107]
使用假设方差相等的学生t检验,对不同稳定周和处理周的微生物代谢标志物和微生物群落参数的正态分布数据进行比较。如果p《0.05,则差异被认为是显著的。
[0108]
试验
[0109]
与空白对照相比,此项目中测试了三种不同的测试产品。测试产品及其体外测试剂量可在表2中找到。
[0110]
表2:长期shime实验中的测试产品及其体外测试剂量的列表。
[0111][0112]
结果
[0113]
如稳定期结束时所要求的,酸/碱消耗、scfa、乳酸盐、铵和微生物菌群组成在每个shime单元内都非常稳定,并可在各个shime单元之间再现。这表明shime模型在其最佳条件下操作,从而导致稳定和可再现的结肠微生物菌群。这种稳定性是确定处理期间观察到的效应确实是由所施用的测试产品导致的前提条件,与此同时高再现性允许不同测试产品之间的直接比较。
[0114]
微生物活性结果
[0115]
与对照相比,antiox补充显著增加了所有测试供体两个结肠区域中的碱消耗。在近端结肠中,在用xos处理后观察到了最强的酸化。有趣的是,在供体b中,antiox和fos处理组的酸碱消耗彼此相当,表明所测试的antiox组合物的作用类似于确定的益生元fos。在远端结肠中,在用fos处理后,在两个所测试的供体中都观察到了最强的酸碱消耗。有趣的是,在供体a中,antiox和xos处理中的微生物活性(酸碱消耗)是相当的,表明所测试的antiox组合物的作用类似于确定的益生元xos。
[0116]
短链脂肪酸结果(图2)
[0117]
如图2所示,有趣的是,与对照孵育相比,非益生元维生素抗氧化剂混合物增加了乙酸盐和丁酸盐,但没有增加丙酸盐的水平。对于供体a,如果与对照和益生元fos处理的容器相比,在抗氧化剂混合物处理的近端结肠容器中观察到了增加的乙酸盐浓度。对于供体b,如果与对照和益生元fos处理的容器相比,在近端和远端结肠容器中观察到了增加的scfa丁酸盐。
[0118]
scfa总产量
[0119]
对于总scfa也看到了类似的效应。与对照孵育相比,非益生元抗氧化剂混合物增加了总scfa,其效应的量值与使用公认的益生元时看到的效应相似。
[0120]
乳酸盐
[0121]
同样,对于所测试的两个供体,与对照孵育相比,在近端结肠中,在补充antiox和xos共混物后,观察到了乳酸盐水平的显著增加。
[0122]
铵和支链scfa
[0123]
抗氧化剂共混物的添加导致两个结肠区域(近端结肠和远端结肠)中的铵水平均降低,尽管作为益生元测试产品不太明显。在同一系列中,与对照相比,抗氧化剂共混物的
施用导致供体a的近端结肠中支链scfa的产量减少。
[0124]
微生物群系
[0125]
1.多样性
[0126]
表3.微生物多样性
[0127][0128]
用antiox处理导致远端结肠和近端结肠中的多样性增加。
[0129]
有趣的是,如与空白对照相比,在用益生元共混物2(xos)和益生元共混物3(fos)处理的处理期结束时,在近端结肠中观察到了显著降低的多样性。
[0130]
2.增加的有益细菌丰度(图3)
[0131]
如果与对照相比,则用抗氧化剂处理近端和远端结肠容器导致长双歧杆菌丰度增加。对于供体a和供体b,此观察结果是一致的。有趣的是,对于供体a,此增加甚至大于益生元xos和fos处理的近端结肠容器。对于供体a,在远端结肠中,如果与xos相比,则antiox处理的容器中长双歧杆菌的丰度更高。对于供体b,antiox处理的容器中的长双歧杆菌的丰度高于fos处理的近端结肠容器,而antiox处理的远端结肠容器中的长双歧杆菌的丰度高于益生元xos和fos处理的容器。
[0132]
3.减少的病原菌(图4)
[0133]
对于供体a,如果与对照近端和远端结肠相比,在抗氧化剂混合物处理的容器中观察到条件致病菌脆弱拟杆菌的丰度降低。有趣的是,这种丰度的降低大于益生元fos。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1