一种青稞蛋白-多酚复合物及其制备方法与应用与流程
1.本发明涉及一种青稞蛋白-多酚复合物及其制备方法与应用,属于蛋白质改性技术领域。
背景技术:
2.青稞营养物质丰富,具有“三高”“两低”的特点,即高蛋白、高膳食纤维、高维生素、低脂和低糖。其中,蛋白质含量约6.35%~23.40%,平均值为12.43%,高于小麦、水稻、玉米,特别是人体必需8种氨基酸含量均高于这3种谷物,是一种优质的蛋白质资源。
3.青稞是青藏高原极端环境条件下植物适应性进化的典型代表,青稞产品具有很强的地区性,很难被大众所熟知,除去青稞酿酒产业,在面制品产业中,由于青稞粉无法形成面团的原因,应用也很局限,以青稞面粉为原料加工面条、蛋糕、饼干,其蒸煮品质和感官品质相对较差,口感粗糙,而青稞蛋白以谷蛋白为主,主要为不溶性蛋白,其溶解性、起泡性、乳化性等功能性质相对较差,这些原因均限制了以青稞为主要原料的产品开发。
4.酚类化合物是一类含苯多羟基化合物,普遍存在于谷类、果蔬、茶等植物中,具有极强抗氧化性、抗癌、抗肿瘤等多种生物活性功能,是目前最受关注的天然抗氧化剂。
5.现有技术中有采用茶多酚与肉类蛋白结合,用于改善肉类蛋白的抗氧化性能;而多酚对植物蛋白性能的影响的研究相对较少,并且不同来源的蛋白性能存在较大的差异,与多酚的相互作用能力也会不同,两者相互结合对蛋白的性能影响也就会不同,进而使其显示出不同的活性差异。
6.因此,研究多酚对青稞植物蛋白的结构和功能的影响,用于提高青稞的应用价值是目前亟待解决的问题。
技术实现要素:
7.为了解决目前青稞蛋白存在难以利用的问题,本发明提供了一种青稞蛋白-多酚复合物的制备方法,有效提高了青稞蛋白的抗氧化性能和表面疏水性能,有利于青稞蛋白在食品加工中的应用。
8.本发明的第一个目是提供一种青稞蛋白-多酚复合物的制备方法,所述方法包括如下步骤:
9.(1)青稞总蛋白的提取和脱色:取脱脂青稞粉,加水混匀,调节ph、离心、取上清;然后向上清液中加入过氧化氢溶液,混匀、静置过夜;再离心、取沉淀并用水制成蛋白混悬液,透析、冷冻干燥,即得青稞总蛋白hpbs;
10.(2)青稞总蛋白的复溶:取hpbs,分散于水中,形成青稞总蛋白溶液,调节青稞总蛋白溶液ph值为11~12,持续搅拌,然后再调节青稞总蛋白溶液ph值至7~8,透析,即得hpbs复溶溶液;
11.(3)多酚的溶解:取原花青素(procyanidins,pc)或橙皮苷(hesperidin,he),溶于相应的溶液中,超声使其完全溶解,即得到pc溶液或he溶液;
12.(4)将步骤(3)中得到的pc溶液或he溶液加入步骤(2)的hpbs复溶溶液的稀释液中,调节ph值至7~8,避光搅拌反应,透析,得hpbs-多酚复合物溶液,将hpbs-多酚复合物溶液冷冻干燥,即得hpbs-多酚复合物。
13.在本发明的一种实施方式中,步骤(1)中所述加水混匀是以脱脂青稞粉和水按照质量体积比为1~5:20g/ml的比例混匀。
14.在本发明的一种实施方式中,步骤(1)所述调节ph的值为11~12。
15.在本发明的一种实施方式中,步骤(1)所述过氧化氢溶液的加入量为上清液体积的2%~3%,所用过氧化氢溶液为质量浓度为30%的过氧化氢溶液。
16.在本发明的一种实施方式中,步骤(1)所述再离心之前需要将待离心的溶液的ph值调节至4~5。
17.在本发明的一种实施方式中,步骤(1)所述蛋白混悬液在透析之前调节ph至7~8。
18.在本发明的一种实施方式中,步骤(2)所述持续搅拌时间为2~5h。
19.在本发明的一种实施方式中,步骤(2)所述hpbs的浓度为5mg/ml~10mg/ml。
20.在本发明的一种实施方式中,步骤(3)所述pc溶液或he溶液浓度为1mg/ml~8mg/ml。
21.在本发明的一种实施方式中,步骤(3)所述溶液为体积分数为70%的乙醇水溶液或体积分数为70%的甲醇水溶液。
22.在本发明的一种实施方式中,步骤(4)所述hpbs复溶溶液的稀释液的浓度为1~2mg/ml。
23.在本发明的一种实施方式中,步骤(4)所述避光搅拌反应参数为:200~500rpm,时间为10~20min。
24.在本发明的一种实施方式中,步骤(4)所述hpbs与pc或he质量比为1:0.05~0.5。
25.本发明的第二个目的是提供一种有上述所述方法制备得到的hpbs-多酚复合物。
26.本发明的第三个目的是提供一种由上述所述的hpbs-多酚复合物在功能食品制备中的应用。
27.本发明的第四个目的是提供一种改善青稞总蛋白疏水性能的方法,其特征在于,所述方法包括如下步骤:
28.1)青稞总蛋白的提取和脱色:取脱脂青稞粉,加水混匀,调节ph、离心、取上清;然后向上清液中加入过氧化氢溶液,混匀、静置过夜;再离心、取沉淀并用水制成蛋白混悬液,透析、冷冻干燥,即得青稞总蛋白hpbs;
29.2)青稞总蛋白的复溶:取hpbs,分散于水中,形成青稞总蛋白溶液,调节青稞总蛋白溶液ph值为11~12,持续搅拌,然后再调节青稞总蛋白溶液ph值至7~8,透析,即得hpbs复溶溶液;
30.3)多酚的溶解:取原花青素pc或橙皮苷he,溶于相应的溶液中,超声使其完全溶解,即得到pc溶液或he溶液;
31.4)将步骤(3)中得到的pc溶液/和he溶液加入步骤(2)的hpbs复溶溶液的稀释液中,调节ph值至7~8,避光搅拌反应,透析,得hpbs-多酚复合物溶液,将hpbs-多酚复合物溶液冷冻干燥,即可。
32.本发明的有益效果:
33.1)将多酚与青稞蛋白复合后可以显著改善青稞蛋白的抗氧化性能和表面疏水性能。
34.2)本发明hpbs-多酚复合物的制备方法简单,经济实惠,易于操作、条件温和,制备得到的hpbs-多酚复合物对abts自由基清除能力和铁离子还原能力呈现出一加一大于2的效果,表现出较强的协同抗氧化作用。
35.3)本发明制备的hpbs-多酚复合物,不仅可以为协同抗氧化提过新的思路,还提供了一种谷物蛋白的合理利用方式,是青稞资源开发和利用的有效途径之一。
附图说明
36.图1为本发明实施例1~8制备的青稞蛋白-多酚复合物表面疏水性变化图以及表面疏水性变化率示意图(a为表面疏水性变化图;b为表面疏水性变化率示意图);
37.图2为本发明实施例1~8制备的青稞蛋白-多酚复合物的荧光光谱图以及分子间作用力示意图(a、b分别为hbps-pc、hbps-he荧光光谱图;c、d分别为hbps-pc、hbps-he分子间作用力示意图)。
具体实施方式
38.为了使本发明的上述目的、特征和优点更明显易懂,下面对本发明实施例中的技术方法进行更清楚、完整地描述。
39.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但不限于下面的具体实施案例。
40.本发明中的使用的原料与试剂:
41.青稞,青海新丁香粮油有限责任公司;原花青素、茶多酚,上海麦克林生化科技有限公司;橙皮苷,上海阿达玛斯试剂有限公司;氢氧化钠、盐酸、无水乙醇、过氧化氢、碳酸钠、十二烷基硫酸钠、氯化钠等,国药集团化学试剂有限公司,以上化学试剂均为分析纯。
42.本发明中使用的仪器与设备:
43.电子分析天平(ax224zh/e),奥豪斯仪器(常州)有限公司;高速离心机(lxj-iib),上海安亭科学仪器厂;紫外分光光度计(uv-3200),上海美谱达仪器有限公司;荧光光谱仪(f7000),日本日立公司。
44.1、多酚含量测定
45.吸取经过透析的hbps-多酚复合物样品125μl于试管中,再加入500μl去离子水和125μl福林酚试剂,摇匀,反应6min后加入1.25ml 7%na2co3溶液,再加入1ml去离子水,室温下避光放置1.5h,以去离子水代替样品溶液为空白调零,在波长765nm下测定吸光度。
46.同时以没食子酸(gallic acid,ga)为标准品进行标准曲线的绘制,根据标准曲线计算出样品中多酚含量,并以mg ga/100ml protein表示。
47.2、dpph自由基清除能力测定
48.吸取样品溶液100μl于96孔板中,加入100μl 4mg/ml 1,1-二苯基-2-三硝基苯肼工作液(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitro-phenyl)hydrazyl,dpph,40mg dpph完全溶解于1l乙醇中即为dpph工作液),同时以无水乙醇代替dpph工作液与样品混合作为空白组,以无水乙醇和dpph工作液混合作为对照组,避
光反应30min后,测定517nm下的吸光值,并根据公式(1)计算dpph自由基清除能力。
[0049][0050]
3、abts自由基清除能力测定
[0051]
吸取样品溶液30μl于96孔板中,加入270μl 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐工作液(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),abts,8mmol/l abts溶液与19.6mmol/l过硫酸钾溶液以7:1体积混合,室温下避光静置12~16h后,以水或乙醇稀释至734nm下吸光值达到0.70
±
0.02,即为abts工作液),避光反应6min后,测定734nm下的吸光值,并根据公式(2)计算abts自由基清除能力。
[0052][0053]
4、frap抗氧化性测定
[0054]
吸取样品36μl于96孔板中,加入270μl铁离子还原能力工作液(ferric ion reducing antioxidant power,frap,每1l frap工作液含3.1g无水乙酸钠、16ml乙酸、0.31mg二硫苏代糖醇、2ml 2mol/l hcl和0.54g fecl3·
6h2o),37℃恒温、避光反应8min后,测定593nm下的吸光值。同时用feso4标准溶液替代样品进行标准曲线的绘制。
[0055]
实施例1
[0056]
一种协同抗氧化的多酚-青稞蛋白复合物的制备方法,具体包括如下步骤:
[0057]
(1)青稞总蛋白(hpbs)的提取和脱色:称取100g脱脂青稞粉,加入2000ml去离子水,混匀,用1mol/l naoh调节ph至11,40℃水浴磁力搅拌30分钟,离心(4000r/min,10min),取上清;向上清液中缓慢加入45ml(约等于上清液体积的2.5%)的30%过氧化氢溶液,混匀,室温静置过夜,用1mol/l hcl调节ph至4.5,离心(4000r/min,10min),取沉淀并用去离子水制成蛋白混悬液,用0.05mol/l hcl调节ph至7,于3.5kda透析袋中透析24h,冷冻干燥备用;
[0058]
(2)青稞总蛋白的复溶:称取1g hpbs,分散于100ml去离子水中,用1mol/l naoh调节ph至12,室温下以200rpm转速搅拌2h后,用0.05mol/l hcl缓慢(每分钟15滴)调节ph至7,于3.5kda透析袋中透析24h,备用;
[0059]
(3)多酚的溶解:称取100mg原花青素(procyanidins,pc)溶于100ml 70%(v/v)乙醇-水中,超声5min使其完全溶解;
[0060]
(4)取步骤(2)的hpbs稀释液(稀释至1mg/ml)100ml,加入5ml步骤(3)中的多酚溶液,调节ph至7,在避光的条件下200rpm搅拌反应10min,将hpbs-多酚复合物在室温下避光透析24h(透过分子量1kda),得hbps-0.05mg/ml pc溶液,冷冻、干燥即得hbps-pc复合物。
[0061]
实施例2
[0062]
一种协同抗氧化的多酚-青稞蛋白复合物的制备方法,具体包括如下步骤:
[0063]
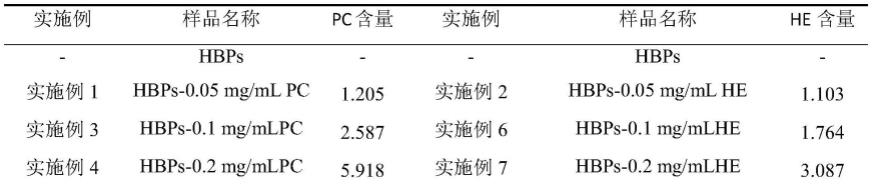
(1)青稞总蛋白(hpbs)的提取和脱色:称取100g脱脂青稞粉,加入2000ml去离子水,混匀,用1mol/l naoh调节ph至11,40℃水浴磁力搅拌30分钟,离心(4000r/min,10min),取上清;向上清液中缓慢加入55ml(约等于上清液体积的3%)的30%过氧化氢溶液,混匀,室温静置过夜,用1mol/l hcl调节ph至4.5,离心(4000r/min,10min),取沉淀并用去离子水制成蛋白混悬液,用0.05mol/l hcl调节ph至7,于3.5kda透析袋中透析24h,冷冻干燥备用;
[0064]
(2)青稞总蛋白的复溶:称取1g hpbs,分散于100ml去离子水中,用1mol/l naoh调节ph至12,室温下以200rpm转速搅拌2h后,用0.05mol/l hcl缓慢(每分钟15滴)调节ph至7,于3.5kda透析袋中透析24h,备用;
[0065]
(3)多酚的溶解:称取100mg橙皮苷(hesperidin,he)溶于100ml 70%(v/v)甲醇-水(外加5滴1mol/l naoh)中,超声5min使其完全溶解;
[0066]
(4)取步骤(2)的hpbs稀释液(稀释至1mg/ml)100ml,加入5ml步骤(3)中的多酚溶液,调节ph至7,在避光的条件下200rpm搅拌反应10min,将hpbs-多酚复合物在室温下避光透析24h(透过分子量1kda),得hbps-0.05mg/ml he溶液,冷冻干燥、即得hbps-he复合物。
[0067]
实施例3
[0068]
与实施例1的区别是仅需要步骤(3)中原花青素的称样量调整为200mg,其他均相同。
[0069]
实施例4
[0070]
与实施例1的区别是仅需要步骤(3)中原花青素的称样量调整为400mg,其他均相同。
[0071]
实施例5
[0072]
与实施例1的区别是仅需要步骤(3)中原花青素的称样量调整为800mg,其他均相同。
[0073]
实施例6
[0074]
与实施例2的区别是仅需要步骤(3)中橙皮苷的称样量调整为200mg,其他均相同。
[0075]
实施例7
[0076]
与实施例2的区别是仅需要步骤(3)中橙皮苷的称样量调整为400mg,其他均相同。
[0077]
实施例8
[0078]
与实施例2的区别是仅需要步骤(3)中橙皮苷的称样量调整为800mg,其他均相同。
[0079]
实施例1~8制备的hpbs-多酚复合物性能测试
[0080]
1.多酚含量测定
[0081]
分别收集实施例1~8(4)中透析后内外液体,采用福林酚法测定结合后蛋白的多酚总量。
[0082]
由表1可知,随着多酚浓度的增加,每100mg hbps结合的多酚数量显著增加,其中hbps-pc在0.4mg/ml时每100mg蛋白可结合13.504mg ga当量的pc,相比不同多酚,其pc的结合量显著高于he。
[0083]
表1 hbps-多酚复合物中多酚含量(mg ga/100mg protein)
[0084][0085][0086]
2.表面疏水性测定
[0087]
采用ans荧光探针法测定蛋白复合物的表面疏水性。
[0088]
取实施例1~8中的最终制备的产物,分别将产物溶液稀释为0.0025~0.5mg/ml系列浓度溶液。以hbps作为空白对照,量取不同浓度hbps-多酚复合物稀释液4ml,加入50μl 8mmol/l ans溶液,混匀,室温避光静置3min。在激发波长为390nm,发射波长为470nm,狭缝宽度为5nm条件下测定荧光强度;以荧光强度对蛋白质浓度作曲线,曲线初始阶段的斜率即为蛋白质的表面疏水性。
[0089]
结果如图1-a所示,hbps-多酚复合物的表面疏水性随多酚添加量的增加逐渐降低,随着添加量增加降低趋于平缓,其中hpbs-pc在添加量为0.1mg/ml(对应实例3)时基本达到最低,大于0.1mg/ml添加量时基本保持不变。表面疏水性的变化率如图1-b所示,与空白对照相比,表面疏水性均降低,所以其变化率数值即为降低率,变化率计算方式为:变化率(%)=(h
空-h
样
)/h
样
×
100。在添加量为0.05mg/ml和0.1mg/ml时,hpbs-pc的变化率为20.03%和35.34%,高于hpbs-he,在添加量为0.2mg/ml和0.4mg/ml时,hpbs-he变化显著,分别为59.36%和86.4%,明显高于hpbs-pc。
[0090]
多酚加入hbps溶液中,与暴露的蛋白质疏水基团相互作用,使hbps结构变得松散,使蛋白更容易暴露于溶液中,进而增加蛋白的溶解度,提高蛋白的功能特性,增加青稞蛋白的广泛应用价值。
[0091]
3.荧光光谱扫描
[0092]
取实施例1~8中的最终制备的产物样品溶液加入到样品池中,以激发波长为290nm,狭缝宽度为5nm,进行发射波长290~450nm荧光光谱扫描。
[0093]
荧光光谱法是研究小分子与蛋白质相互作用较为普遍的方法。由于荧光基团与猝灭剂分子的相互作用使得量子产率减小,从而产生荧光猝灭现象。
[0094]
由图2-a和2-b可知,hbps分别与pc和he作用后,hbps最大荧光强度显著降低,且随pc和he浓度的增加而降低,表明pc和he对hbps荧光强度具有猝灭作用。此外,hbps-pc复合物、hbps-he复合物的最大荧光波长均发生了明显的红移,表明hbps与pc和he发生相互作用后,导致hbps色氨酸周围微环境倾向于亲水性环境。
[0095]
4.分子间作用力测定
[0096]
在多酚作用前分别加入相同体积的去离子水(water)、脲(urea)溶液、十二烷基硫酸钠(sds)溶液和氯化钠(nacl)溶液,使urea、sds、nacl的最终浓度达到10mm,加入多酚作用后进行荧光光谱扫描(条件设置同荧光光谱扫描)。
[0097]
由荧光光谱扫描实验可知,多酚具有淬灭作用,与多酚作用后其复合物荧光强度降低,在多酚与蛋白作用前加入分别加入nacl、urea、sds等物质去阻止其发生作用,其中加入nacl仅可阻断静电作用,尿素可阻断静电作用和氢键的形成,sds可阻断非共价键的形成,复合物的荧光强度越接近加入去离子水的样品,表明蛋白和多酚之间的相互作用越完全,相反则表示蛋白和多酚之间的相互作用被阻断剂阻止。
[0098]
在2-c中,在hbps-pc复合物中其nacl和urea与water表现出近似的荧光强度,表明静电作用和氢键并不能阻断pc与hbps的相互作用,而sds表现出很强的荧光强度,说明疏水作用是pc与hbps的主要作用力;在2-d中,在hbps-he复合物中加入不同阻断剂出现不同的荧光强度,不同阻断剂间的荧光强度差值较均一,因此he与hbps间的作用由氢键、静电作用和疏水作用共同驱动。
[0099]
5.抗氧化性能测试
[0100]
对hbps本身进行抗氧化性测定,结果由表2可知,hbps的抗氧化性很弱,其dpph自由基清除能力、abts自由基清除能力和铁离子还原能力frap值仅为20.33%、1.893%和0.267μmol/l。
[0101]
表2 hbps的抗氧化性
[0102][0103]
测定实施例1~8制备的hbps-pc复合物的抗氧化性能,结果如表3和表4所示;
[0104]
由表3和表4对比分析hbps-多酚复合物和相应多酚的抗氧化性,蛋白质在与多酚作用后其抗氧化性均高于相应浓度多酚,但hbps-多酚复合物在不同抗氧化性表现出不同的强度。
[0105]
hbps-pc和hbps-he对dpph自由基清除能力具有一定差异,hbps-pc表现出较高的dpph自由基清除能力,在hbps-0.4mg/mlpc样品时可以达到92.11%,而hbps-he自由基清除能力较弱,清除率仅21%~26%,造成这种现象的原因可能是由于he自身能与dpph自由基结合的基团较少。
[0106]
由表5可知,dpph抗氧化性对比数值均小于1,表明其不具有协同抗氧化性效果,但对比相应标品的抗氧化数值,其复合物保留了多酚自身的抗氧化性。
[0107]
由表3可知,hbps-pc复合物的abts自由基清除能力和铁离子还原能力在0~0.4mg/ml的范围内与添加量成正相关,hbps-0.4mg/ml pc的abts清除能力和铁离子还原能力达到34.97%和160.68μmol/l;由表5可知,hbps-pc复合物与相应多酚对比的数值均大于1,说明abts自由基清除能力和铁离子还原能力呈现出一加一大于2的效果,其中在hbps-0.05mg/ml pc时abts和frap的对比数值最大,分别为1.72和17.52倍。
[0108]
表4可知,he自身的抗氧化性较差,在低浓度时基本不具有抗氧化性,而hbps-he复合物的abts自由基清除能力和铁离子还原能力显著提高,表现出高于he 5~10倍的抗氧化性,其中在hbps-0.4mg/ml he样品时可达到88.14%和398.45μmol/l,显著高于其相应浓度下标准品的抗氧化值(14.14%和58.86μmol/l);在hbps-0.1mg/ml he时abts和frap的对比数值最大,分别为相应多酚抗氧化性的10.5和125.45倍,表现出协同抗氧化效果。
[0109]
由上可知,hbps-pc和hbps-he多酚复合物在保持自身dpph抗氧化性的同时,abts自由基清除能力和铁离子还原能力均提高,表现出一加一大于2的效果,hbps和多酚呈现出协同抗氧化性。
[0110]
表3 hbps-pc以及相应浓度pc的抗氧化性
[0111][0112]
表4 hbps-he以及相应浓度he的抗氧化性
[0113][0114]
表5抗氧化性与相应多酚对比的数值
[0115][0116]
注:抗氧化性与相应多酚对比的数值计算为(样品抗氧化性-蛋白抗氧化性)/多酚抗氧化性(例如hbps-0.2mg/mlhe的frap比值为(222.99-0.267)/8.18=27.22。
[0117]
综上所述,青稞蛋白可与原花青素、橙皮苷进行非共价结合(通过氢键、静电作用和疏水作用),其青稞蛋白-多酚复合物结合率较高,表面疏水性降低,使得蛋白溶解度增加,并且其抗氧化性较于原蛋白、多酚均显著提高,表现出较强的协同抗氧化作用,使得青稞蛋白的性质得到明显的改善。
[0118]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1