miR‑329在制备预防和/或治疗缺血性眼部疾病的药物中的应用的制作方法与工艺
miR-329在制备预防和/或治疗缺血性眼部疾病的药物中的应用技术领域本发明涉及miR-329在制备预防和/或治疗缺血性眼部疾病的药物中的应用。
背景技术:
缺血可引起多种代谢物质的缺乏,但最为紧急、损害最重的病变是由缺氧所致。在绝大多数情况下,缺血性病变的核心为缺氧性损害。大量研究报道,视网膜和脉络膜缺血、缺氧是缺血性眼部疾病的重要驱动因素,是导致视力下降和丧失的重要原因(1,2)。常见的该类眼部疾病包括早产儿视网膜病变(retinopathyofprematurity,ROP)、年龄相关性黄斑病变(age-relatedmaculardegeneration,AMD)、糖尿病视网膜病变(diabeticretinopathy,DR)、新生血管性青光眼(neovascularglaucoma,NVG)等。上述疾病在全球发病率呈上升趋势,是儿童、成年人和老年人各年龄段致盲的首要原因(3-6)。氧诱导的视网膜病变小鼠模型(OIR小鼠)是经典的缺血性眼部疾病的动物模型。OIR小鼠模型诱导过程中,小鼠眼睛组织内的缺血缺氧引起VEGF和TNF-α等促血管生成因子的过度分泌,进而导致眼底血管异常成簇状生长,血管迂曲、扩张和渗漏。这些缺血性眼部病变会导致眼底出血、视力模糊和视野缺失等临床症状。(2,7)1.DorrellM,Uusitalo-JarvinenH,AguilarE,FriedlanderM.2007.Ocularneovascularization:basicmechanismsandtherapeuticadvances.SurvOphthalmol52Suppl1:S3-19.2.SapiehaP,JoyalJS,RiveraJC,Kermorvant-DucheminE,SennlaubF,HardyP,LachapelleP,ChemtobS.2010.Retinopathyofprematurity:understandingischemicretinalvasculopathiesatanextremeoflife.JClinInvest120:3022-3032.3.GilbertC.2008.Retinopathyofprematurity:aglobalperspectiveoftheepidemics,populationofbabiesatriskandimplicationsforcontrol.EarlyHumDev84:77-82.4.XuJ,WeiWB,YuanMX,YuanSY,WanG,ZhengYY,LiYB,WangS,XuL,FuHJ,ZhuLX,PuXL,ZhangJD,DuXP,LiYL,JiY,GuXN,LiY,PanSF,CuiXL,BaiW,ChenYJ,WangZM,ZhuQS,GaoY,LiudeY,JiYT,YangZ,JonasJB.2012.Prevalenceandriskfactorsfordiabeticretinopathy:theBeijingCommunitiesDiabetesStudy6.Retina32:322-329.5.CheungCM,TaiES,KawasakiR,TayWT,LeeJL,HamzahH,WongTY.2012.Prevalenceofandriskfactorsforage-relatedmaculardegenerationinamultiethnicAsiancohort.ArchOphthalmol130:480-486.6.OlmosLC,LeeRK.2011.Medicalandsurgicaltreatmentofneovascularglaucoma.IntOphthalmolClin51:27-36.7.GrossniklausHE,KangSJ,BerglinL.2010.Animalmodelsofchoroidalandretinalneovascularization.ProgRetinEyeRes29:500-519.
技术实现要素:
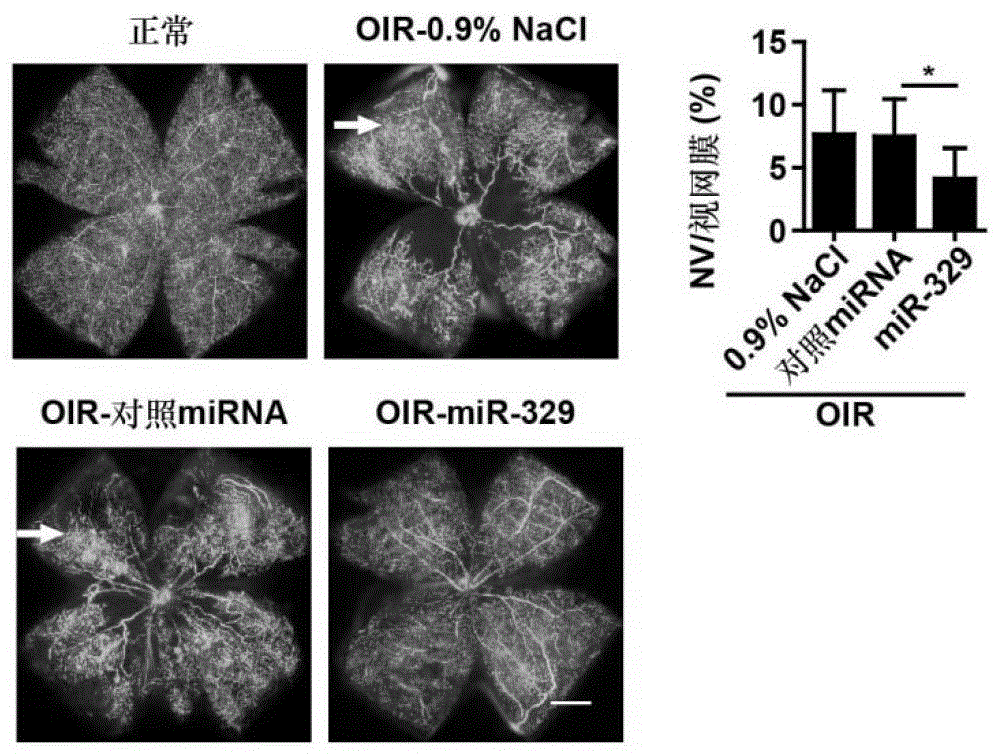
本发明的目的是提供miR-329的一种新用途。本发明所提供的miR-329的新用途之一为miR-329或miR-329修饰物在制备预防和/或治疗缺血性眼部疾病的药物中的应用;所述miR-329的序列为SEQIDNo.1或SEQIDNo.3所示。上述应用中,所述缺血性眼部疾病可为早产儿视网膜病变、糖尿病视网膜病变、年龄相关性黄斑病变或新生血管性青光眼。上述应用中,所述缺血性眼部疾病可为缺血性眼底病变。上述应用中,所述缺血性眼底病变可为视网膜病变或脉络膜病变。上述应用中,所述视网膜病变可为视网膜血管迂曲扩张或视网膜血管渗漏或视网膜出血。上述应用中,所述视网膜病变可为视网膜血管新生或视网膜血管从视网膜迁移到玻璃体腔。上述应用中,所述脉络膜病变可为脉络膜血管迂曲扩张或脉络膜血管渗漏或脉络膜出血。上述应用中,所述脉络膜病变为脉络膜血管新生。本发明所提供的miR-329的新用途之二为miR-329或miR-329修饰物在制备抑制血管内皮细胞生成血管或抑制血管内皮细胞迁移的药物中的应用;所述miR-329的序列为SEQIDNo.1或SEQIDNo.3所示。上述任一所述应用中,miR-329修饰物为将miR-329进行如下修饰中的至少一种:硫代磷酸骨架修饰;甲基化或氟代核糖修饰;胆固醇、聚乙二醇或短肽末端修饰。本发明首次提出miR-329是预防或/和治疗缺血性眼部疾病的新型药物。因此,本发明提供miR-329或miR-329修饰物在制备预防和/或治疗缺血性眼部疾病的药物中的应用。实验证明,miR-329基因治疗显著减轻了缺血性眼部疾病的严重程度,表现为有效缓解了发病小鼠视网膜的血管迂曲扩张、出血渗漏以及血管簇状异常生长等症状;显著减少了视网膜新生血管数量以及从视网膜迁移到玻璃体腔的异常血管数量。这种视网膜结构与形态的正常化,可以缓解眼底出血、视力模糊和视野缺失等临床症状,并抑制疾病的发生发展。miR-329治疗缺血性眼部疾病的作用机理在于miR-329可以抑制内皮细胞中促血管生成因子VEGF诱导的下游信号通路SKF、p38MAPKs和NF-κB的激活以及多种促血管生成基因的表达,进而显著抑制内皮细胞的血管生成及迁移能力,从而改善了缺血性眼部疾病的异常血管新生及迁移。这些结果表明miR-329可以作为预防和/或治疗缺血性眼部疾病的新的手段。附图说明图1为正常小鼠和OIR小鼠的视网膜表型,显示OIR小鼠模型构建成功。图2为miR-329治疗后OIR小鼠视网膜血管的形态结构正常化。图3为miR-329治疗后显著减轻OIR小鼠视网膜异常血管新生和血管迁移。图4为miR-329抑制内皮细胞中VEGF诱导的下游信号通路的激活。图5为miR-329抑制内皮细胞中VEGF和TNF-α联合诱导的NF-κB信号通路的激活。图6为miR-329抑制内皮细胞中多种促血管生成效应基因的表达。图7为miR-329抑制内皮细胞的血管生成及细胞迁移能力。图8为miR-329抑制小鼠异种移植物中内皮细胞的血管生成。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实验中使用的视网膜荧光铺片实验按照如下方法进行:(一)将小鼠麻醉,左心室心脏灌流600μl50mg/ml的FITC荧光标记的dextran,此时小鼠的全身血管都灌注有荧光分子。(二)将小鼠眼睛剥离,4%多聚甲醛固定1小时。(三)小心剥离视网膜,并用剪刀剪成四叶草状。用荧光体式显微镜观察并拍照。下述实验中使用的组织免疫荧光实验按照如下方法进行:(一)剥离小鼠的眼球进行石蜡包埋切片。(二)取出切片,放入二甲苯溶液脱蜡三次,每次5分钟。(三)放入100%-95%-80%-70%-50%乙醇和蒸馏水中水化。(四)将样品放入0.01MpH6.0的柠檬酸缓冲液中,100℃沸水浴30分钟进行抗(五)5%羊血清封闭1小时。(六)加入一抗(5%羊血清稀释的CD31腹水,体积比为1:50)37℃孵育过夜,PBS洗3次。(七)加入荧光标记的二抗,37℃孵育1小时,PBS洗3次。(八)DAPI染核,并用抗荧光淬灭封片剂封片。Matrigel(不含生长因子)购自BDBiosciences。实施例1、miR-329能够有效治疗缺血性眼部疾病小鼠miR-329序列:5’-AACACACCCAGCUAACCUUUUU-3’(SEQIDNo.1);对照miRNA为线虫miR-239b,与人、小鼠、大鼠的miRNA具有最小同源性。对照miRNA序列:5’-UUUGUACUACACAAAAGUACUG-3’(SEQIDNo.2);以下实验均使用双链的小鼠miR-329和对照miRNA,并分别对其序列进行如下修饰:2’-甲氧基修饰,硫代磷酸骨架修饰和序列5’端连接胆固醇。上述修饰过的小鼠miR-329序列和修饰过的对照miRNA序列均购自广州锐博生物公司。一、构建OIR小鼠模型将出生后第7天的C57BL/6J乳鼠(P7)和母鼠放入含75%氧气的高氧培养箱中5天,在第12天(P12)将其从氧箱中取出,放在正常氧气(21%氧气)中饲养,造成相对低氧的环境,在第17天(P17)的乳鼠即为模型鼠。将正常鼠(正常C57BL/6J小鼠)和OIR模型鼠进行视网膜荧光铺片实验,结果如图1所示。结果显示,与正常鼠相比,OIR小鼠的视网膜血管呈现明显的迂曲、扩张和渗漏并成血管簇状异常生长。视网膜血管的荧光渗漏点表示视网膜出血严重。以上视网膜形态结构的异常说明模型构建成功。二、构建OIR小鼠治疗模型将出生后第7天的C57BL/6J乳鼠(P7)和母鼠放入含75%氧气的高氧培养箱中5天,在第12天(P12)将其从氧箱中取出,将修饰过的鼠miR-329(5μg/μl,1μl)、修饰过的鼠对照miRNA(5μg/μl,1μl)或0.9%NaCl的水溶液(1μl)分别注射到乳鼠眼睛玻璃体腔内,继续饲养。三、视网膜荧光铺片分析在第17天对各组OIR小鼠及正常C57BL/6J小鼠(每组8只)的视网膜进行荧光铺片分析。对异常新生血管,即迂曲、扩张的血管及血管渗漏点,进行面积的统计分析,以正常小鼠为对照,最终判定疾病的治疗情况。结果如图2所示。图2中:NV为新生血管。结果表明,与对照miRNA组相比,miR-329注射组小鼠的视网膜血管迂曲、视网膜血管扩张、视网膜血管出血渗漏以及血管簇状异常生长的症状显著减轻,呈现较好的视网膜结构,并且miR-329注射后视网膜血管新生的面积显著减少。这种视网膜形态的正常化,可以缓解眼底出血、视力模糊和视野缺失等临床症状,减轻疾病的发病程度。四、组织免疫荧光分析在第17天剥离各组OIR小鼠及正常C57BL/6J小鼠(每组9-14只)的眼球分别进行石蜡包埋切片,进行组织免疫荧光分析。结果如图3所示。图3中:GCL为视网膜神经节细胞层;VC为玻璃体腔;INL为视网膜内核层;绿色标记物为血管内皮标志物CD31。结果表明,正常小鼠中,只有极少数血管从视网膜迁移到玻璃体腔。与正常小鼠相比,OIR小鼠中视网膜新生血管数量以及从视网膜异常迁移到玻璃体腔的血管数量明显增多。并且与对照miRNA组相比,miR-329注射组小鼠视网膜血管数量以及从视网膜迁移到玻璃体腔的血管数量明显减少。从荧光图片可以看出注射miR-329会改善拉长的不规则呈簇状生长的异常血管形态(箭头所示)。综合以上结果,表明miR-329能够有效减轻缺血性眼部疾病的发病程度,可以作为该疾病有效的治疗手段。以下实施例2-4中使用的miR-329为人miR-329的双链模拟物,人对照miRNA为无义序列。上述人miR-329序列和人对照miRNA序列均购自上海吉玛公司。人miR-329序列:5’-AACACACCUGGUUAACCUCUUU-3’(SEQIDNo.3)人对照miRNA序列:5’–UUCUCCGAACGUGUCACGUTT–3’(SEQIDNo.4)以下实施例2-4中使用的内皮细胞为人脐静脉内皮细胞系HUVEC。实施例2、miR-329抑制内皮细胞中VEGF诱导的下游信号通路的激活。缺血性眼部疾病发生发展过程中,眼睛组织内的缺血缺氧引起VEGF和TNF-α等促血管生成因子的过度分泌,进而导致眼底血管异常成簇状生长,血管迂曲、扩张和渗漏。因此,我们关注miR-329能否抑制促血管生成因子刺激内皮细胞引起的信号通路的激活。一、VEGF刺激HUVEC条件下,miR-329抑制VEGF下游信号通路的激活(一)实验分为下列3组(1)转染对照miRNA并且不刺激HUVEC;(2)转染对照miRNA并用促血管生成因子VEGF刺激HUVEC;(3)转染miR-329并用VEGF刺激HUVEC。(二)将上述的各组对照miRNA或miR-329分别转染HUVEC细胞。(三)转染后24小时,刺激细胞:先将各组的HUVEC细胞用无血清1640培养基培养,饥饿12小时。内皮细胞生长密度达80%左右时,第(2)和(3)组加入终浓度为50ng/ml的细胞因子VEGF刺激。(四)在VEGF刺激下,继续培养20分钟,检测SKF或p38MAPKs信号通路中的蛋白磷酸化水平。或在VEGF刺激下,继续培养12小时,检测NF-κB信号通路中的蛋白磷酸化水平。(五)在上述时间点收集各组细胞,进行westernblot。实验结果如图4所示。图4A为VEGF下游SKF信号通路中的蛋白磷酸化水平。图4B为VEGF下游p38MAPKs信号通路中的蛋白磷酸化水平。图4C为VEGF下游的NF-κB信号通路中的蛋白磷酸化水平。图4表明,对照miRNA转染HUVEC细胞,并用VEGF刺激之后,VEGF下游SKF,p38和NF-κBp65的磷酸化水平升高,IκBα发生降解。而miR-329的过表达可以抑制VEGF下游SKF,p38和NF-κBp65的磷酸化以及IκBα的降解。二、VEGF和TNF-α联合刺激HUVEC的条件下,miR-329抑制下游NF-κB通路的激活在体内病理性血管生成中,VEGF和TNF-α通常是过度分泌并且在微环境中同时存在的。本实验为了更好的模拟体内的病理环境,在VEGF和TNF-α联合刺激下研究miR-329是否可以抑制NF-κB通路的激活。(一)实验分为下列3组(1)转染对照miRNA并且不刺激HUVEC;(2)转染对照miRNA并用细胞因子刺激HUVEC;(3)转染miR-329并用细胞因子刺激HUVEC。(二)将上述的各组对照miRNA或miR-329分别转染HUVEC细胞。(三)转染24小时后,刺激细胞:先将各组的HUVEC细胞用无血清1640培养基培养,饥饿12小时。内皮细胞生长密度达80%左右时,第(2)和(3)组加入终浓度为50ng/ml的细胞因子VEGF和TNF-α共同刺激。(四)在VEGF和TNF-α共同刺激下,继续培养12小时,检测NF-κB信号通路中的蛋白磷酸化水平。(五)收集各组细胞,进行westernblot。结果如图5所示。图5和图4C相比较表明,以VEGF和TNF-α联合刺激HUVEC细胞,NF-κB通路的激活比单独刺激更为显著,并且miR-329同样可以显著抑制联合刺激下的NF-κBp65的磷酸化以及IκBα的降解,即抑制NF-κB通路的激活。三、VEGF和TNF-α共同刺激HUVEC的条件下,miR-329抑制促血管生成效应基因mRNA的表达。(一)实验分为下列3组(1)转染对照miRNA并且不刺激HUVEC;(2)转染对照miRNA并用细胞因子刺激HUVEC;(3)转染miR-329并用细胞因子刺激HUVEC。(二)将上述的各组对照miRNA或miR-329分别转染HUVEC细胞。(三)转染8小时后,刺激细胞:先将各组的HUVEC细胞用无血清1640培养基培养,饥饿12小时。内皮细胞生长密度达80%左右时,第(2)和(3)组加入终浓度为50ng/ml的细胞因子VEGF和TNF-α共同刺激。(四)在VEGF和TNF-α共同刺激下,继续培养24小时,(五)实时荧光定量PCR检测miR-329对促血管生成效应基因mRNA表达水平的影响,以GAPDH为内参,每组实验中未刺激组细胞的RNA相对表达量设为1。所检测的基因及相对应的引物如下:PCR扩增条件:95℃,5分钟;95℃30s,55℃30s,72℃20s,40个循环。结果如图6所示。图6表明,miR-329可以抑制所检测基因的RNA表达量,证实miR-329可以抑制多种促血管生成基因的表达。以上结果表明,miR-329能够显著抑制血管内皮细胞中促血管生成因子VEGF及VEGF与TNF-α联合诱导的下游信号通路的激活,进而抑制多种促血管生成因子的表达,提示miR-329治疗在血管内皮细胞中的重要作用。实施例3、miR-329抑制内皮细胞的血管生成及细胞迁移能力缺血性眼部疾病发生发展过程中,眼睛组织内的缺血缺氧将会导致眼底血管异常成簇状生长,血管迂曲、扩张和渗漏。而这些眼底的异常血管新生是导致眼底出血、视力模糊和视野缺失等临床症状的重要原因。因此,我们关注miR-329能否抑制血管内皮细胞的功能。一、血管生成实验(一)实验分为下列3组(1)转染对照miRNA并且不刺激HUVEC;(2)转染对照miRNA并用细胞因子刺激HUVEC;(3)转染miR-329并用细胞因子刺激HUVEC。(二)将上述的各组对照miRNA或miR-329分别转染HUVEC细胞。(三)在96孔板中包被70μl/孔冰浴的Matrigel,37℃固化30分钟。(四)将转染后24小时的HUVECs以1x105个/ml重悬于1640培养基(含10%血清)(五)将三种细胞悬液向96孔板的每个孔中加入100μl,每种细胞悬液设三个平行孔,VEGF和TNF-α(使用浓度50ng/ml)在接种细胞的时候同时加入。在培养箱中37℃孵育过夜。(六)倒置显微镜下观察,拍照。(七)用图像处理软件ImageProPlus计算每孔血管状细胞总长度。结果如图7A所示。结果表明,VEGF和TNF-α联合刺激可以显著增强内皮细胞HUVEC的血管生成能力,而miR-329能够显著抑制联合刺激引起的HUVEC血管生成。二、细胞迁移实验(一)实验分为下列3组(1)转染对照miRNA并且不刺激HUVEC;(2)转染对照miRNA并用细胞因子刺激HUVEC;(3)转染miR-329并用细胞因子刺激HUVEC。(二)将上述的各组对照miRNA或miR-329分别转染HUVEC细胞。(三)将转染后24小时的HUVEC以1x105个/ml重悬于无血清1640培养基。(四)Transwell上室分别加入细胞悬液(100μl/孔,每种处理设三个平行孔),VEGF和TNF-α(使用浓度50ng/ml)在接种细胞的时候同时加入。下室加入200μl含10%血清的培养基。Transwell系统在37℃二氧化碳培养箱中放置过夜。(五)将膜上层的细胞用棉签擦掉,将膜揭下。下层细胞以4%多聚甲醛固定后,用1%结晶紫染色,显微拍照。用ImageJ软件统计每孔迁移的细胞数量。结果如图7B所示。图7表明,miR-329能够显著抑制VEGF和TNF-α联合刺激引起的HUVEC内皮细胞的迁移能力。实施例4、miR-329抑制小鼠异种移植物中内皮细胞的血管生成。(一)实验分为下列3组(1)转染对照miRNA并且不刺激HUVEC;(2)转染对照miRNA并用细胞因子刺激HUVEC;(3)转染miR-329并用细胞因子刺激HUVEC。(二)将上述的各组对照miRNA或miR-329分别转染HUVEC细胞。(三)在转染HUVECs细胞20小时之后,将细胞消化并用60μlPBS重悬。(四)将细胞悬液(5×106个/样)与500μlMatrigel,15U的肝素,VEGF和TNF-α(使用浓度50ng/ml)混合。(五)将混合物皮下注射到SCID/Beige雌性小鼠(年龄4周)的侧背部。(六)6天以后,内皮细胞将在体内Matrigel中形成血管。处死小鼠,将异种移植物剥离,放入4%多聚甲醛固定并进行石蜡切片和免疫组化实验。(七)利用ImageJ软件计算体内成血管数量。结果如图8所示。结果表明,与第(2)组相比,第(3)组能显著抑制小鼠中内皮细胞血管的生成,与体外实验结果一致。以上体外及体内结果表明,miR-329可以抑制内皮细胞的血管生成及细胞迁移能力,揭示了miR-329抑制缺血性眼部疾病视网膜上的血管新生及迁移并最终治疗该疾病的作用机制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1