一种三维组织结构体的制备方法及其应用与流程
本发明属于生物技术领域,具体涉及一种三维组织结构体的制备方法及其应用。
背景技术:
医疗行业面临着许多紧迫的问题。例如,每年都有大量患有严重心脏、肾脏、肝脏、肺等疾病的患者等待器官移植,而且由于可供移植的器官来源有限,其中大多数患者最终都因等不到移植而死亡。所以,对适用于创伤修复、组织增大、器官修复和器官置换的可植入组织和器官存在迫切的需求。此外,对能促进再生医学和组织工程学技术应用的材料、工具和技术存在需求。与此同时,平均一种新药的研发成本约是50亿美元,历时12年,其中大部分经费和时间都花费在化合物筛选和药物检测阶段。药物安全性检测是临床前试验与临床试验之间的一道重要环节。体外仿生的三维复杂组织模型对于药物筛选、药致器官损伤的机理研究和疾病治疗等领域具有重要意义。
技术实现要素:
本发明的一个目的是提供细胞微球在制备组织结构体中的应用;或细胞微球和基质材料在制备组织结构体中的应用。
上述应用中,所述组织结构体为三维组织结构体。
上述应用中,所述细胞微球的直径为100~1000μm;所述基质材料的直径为50~1000μm。
上述应用中,所述细胞微球与基质材料的质量比为100:1~1:100。
上述应用中,所述细胞微球按照如下方法1)或2)或3)制备:
1)将细胞A悬浮于载体材料中,得到的细胞微球;
2)将涂覆材料均匀涂覆在1)制备的细胞微球表面,得到的细胞微球;
3)将细胞B均匀粘附在2)制备的细胞微球外周,得到的细胞微球;
所述细胞A和细胞B为相同的细胞或不同细胞。
上述应用中,所述细胞A或细胞B为如下细胞中的至少一种:神经细胞、血管细胞、内皮细胞、成纤维细胞、全能干细胞、多能干细胞、专能干细胞、免疫细胞、软骨细胞、骨来源细胞、平滑肌细胞、骨骼肌细胞、心肌细胞、肝细胞、肝来源的干细胞或祖细胞、肝巨噬细胞、星状细胞、胆管上皮细胞、肿瘤细胞、肝窦内皮细胞和其他各种组织和器官来源细胞;
所述基质材料为基质微丝材料或所述基质材料为将细胞和基质微丝材料混合得到的材料;
所述载体材料、所述基质微丝材料和所述涂覆材料均为天然生物材料和/或人工合成生物材料;
所述天然生物材料为水凝胶生物材料,所述水凝胶生物材料为如下材料中的至少一种:明胶、明胶衍生物、藻酸盐、藻酸盐衍生物、琼脂、基质胶、胶原、蛋白多糖、糖蛋白、透明质酸、壳聚糖、层连接蛋白、纤连接蛋白和纤维蛋白;
所述人工合成生物材料为如下材料中的至少一种:聚丙烯、聚苯乙烯、聚丙烯酰胺、聚丙交酯、聚乙交酯、聚乳酸、聚乳酸-羟基乙酸共聚物、聚羟基酸、聚乳酸醇酸共聚物、聚二甲基硅氧烷、聚酸酐、聚酸酯、聚酰胺、聚氨基酸、聚缩醛、聚氰基丙烯酸酯、聚氨基甲酸酯、聚吡咯、聚酯、聚甲基丙烯酸酯、聚乙烯、聚碳酸酯或聚氧化乙烯;
所述组织结构体为器官或微器官;所述器官或微器官为肝、肾、胰、脾、肺、心肌、胃、输尿管、泌尿导管、肝门十二指肠肠导管、输卵管、子宫、气管、支气管、淋巴管、尿道、肠、食道、膀胱、胆囊或其一部分。
上述应用中,所述载体材料具体为藻酸盐,所述藻酸盐尤其具体为海藻酸钠溶液。
上述应用中,所述基质微丝材料具体为藻酸盐和明胶,所述基质微丝材料尤其具体由海藻酸钠溶液和明胶溶液组成。
上述应用中,所述细胞A具体为间充质干细胞,更具体为脂肪来源间充质干细胞。
上述应用中,所述细胞B具体为内皮细胞,更具体为人脐静脉内皮细胞。
上述应用中,所述细胞为内皮细胞和/或成纤维细胞,更具体为人脐静脉内皮细胞和/或人表皮成纤维细胞。
本发明的另一个目的是提供一种组织结构体的制备方法。
本发明的组织结构体的制备方法为以上述细胞微球和上述基质材料为原料,制备组织结构体。
上述方法中,所述方法的步骤为:将上述细胞微球和上述基质材料进行生物打印,得到组织结构体;
所述组织结构体为器官或微器官;所述器官或微器官为肝、肾、胰、脾、肺、心肌、胃、输尿管、泌尿导管、肝门十二指肠肠导管、输卵管、子宫、气管、支气管、淋巴管、尿道、肠、食道、膀胱、胆囊或其一部分。
上述方法中,所述生物打印为三维生物打印;所述组织结构体为三维组织结构体。
上述方法中,所述三维生物打印方法是通过生物打印机将上述细胞微球和上述基质材料进行生物打印的。
上述方法中,所述生物打印机为单喷头生物3D打印机、双喷头生物3D打印机或多喷头生物3D打印机。
上述方法中,所述通过单喷头生物3D打印机将上述细胞微球和上述基质材料进行生物打印包括如下步骤:将将上述细胞微球和上述基质材料混合,得到混合物;将 所述混合物装载到单喷头生物3D打印机的注射器中;打印,得到所述三维组织结构体;
所述通过双喷头生物3D打印机将上述细胞微球和上述基质材料进行生物打印包括如下步骤:将上述细胞微球装载到双喷头生物3D打印机的一个注射器中作为双喷头生物3D打印机的一个喷头;将上述基质材料装载到双喷头生物3D打印机的另一个注射器中作为双喷头生物3D打印机的另一个喷头;打印,得到所述三维组织结构体。
所述通过多喷头生物3D打印机将上述细胞微球和上述基质材料进行打印包括如下步骤:将多种不同的上述细胞微球分别装载到多喷头生物3D打印机的多个注射器中作为多喷头生物3D打印机的多个不同喷头;将多种不同的基质材料装载到多喷头生物3D打印机的另外多个注射器中作为多喷头生物3D打印机的另外多个不同喷头;打印,得到所述三维组织结构体。
上述方法中,所述生物打印后还包括如下步骤:将生物打印得到的产物用交联溶液浸泡处理,培养,得到所述三维组织结构体。
上述方法中,所述交联溶液为氯化钙溶液;所述氯化钙溶液的浓度为100mmol-1~1000mmol-1;所述浸泡处理的时间为10s~10min。
本发明的最后一个目的是提供由上述方法制备得到的组织结构体。
上述组织结构体在如下(1)-(5)中至少一种中的应用也属于本发明的保护范围:
(1)制备用于治疗疾病或病症的材料;
(2)制备组织修复或再生的材料;
(3)制备矫形或整形的材料;
(4)药物开发、药物筛选、药物检测或药物测试;
(5)构建药理模型、病理模型、组织/器官模型或肿瘤模型。
本发明制备的组织结构体的优点是:
1、细胞存活率高
由于细胞微球的载体材料是生物材料水凝胶,具有粘弹性,在生物打印过程中保护微球内部的细胞免受挤压力的影响,而挤压力正是生物打印过程中对细胞造成影响和伤害的最主要因素之一,因此本发明制备的组织结构体的细胞存活率大大提高,接近常规二维细胞培养,而与普通生物打印工艺条件下存在显著性差异。
2、可体外仿生复杂组织和器官的精细微结构
由于细胞微球直径稳定在50-1000微米之间可调,最低可达到30-50微米,细胞微球中可包括一种或多种细胞,细胞微球外周可粘附另外一种或多种细胞,形成具有多种细胞共培养环境的精细结构,是对体内复杂微结构,特别是小叶、小泡和岛状结构的体外仿生结构体;将数量可控的细胞微球组装成的一个宏观活性组织,是对体内 复杂组织的体外仿生构建结构体。
3、可体外仿生体内的复杂组织和器官
生物3D打印技术将一定数量和种类的细胞微球和一定数量和种类的基质材料打印在计算机设定的空间位置,形成多种成分有机组合的多细胞仿生结构体,是对体内复杂组织的体外高度仿生构建结构体。
本发明通过生物3D打印技术将细胞微球和基质材料打印在计算机设定的空间位置,形成多种成分有机组合的多细胞仿生三维组织结构体,是对体内复杂组织的体外高度仿生构建结构体。通过实验证明:本发明的组织结构体细胞存活率大大提高,不仅可应用于药物开发、药物筛选、药物检测、药物测试、构建药理模型、病理模型、组织/器官模型和肿瘤模型,还可用于治疗疾病或病症、组织修复或再生以及矫形或整形的植入物。
附图说明
图1为细胞微球结构的示意图。其中,图1A是无外壳细胞微球,1表示细胞,2表示载体材料;图1B是有外壳微球,1表示细胞,2表示载体材料,3表示外壳材料,4表示外壳细胞。
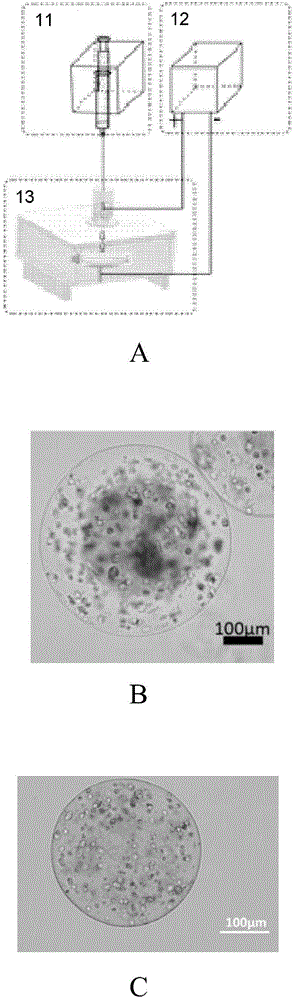
图2为细胞微球制备的示意图。其中,图2A是细胞微球制备装置示意图,11表示微量注射泵,12表示高压发电器,13表示收集装置;图2B是海藻酸盐/胶原细胞微球的照片;图2C是海藻酸盐/基质胶细胞微球的照片。
图3为单喷头细胞微球三维打印设备示意图。其中,21表示喷头;22表示打印形成的含有细胞微球、单个细胞、细胞团簇和生长因子的基质材料微丝;23表示可三维运动的成形平台。
图4为双喷头细胞微球三维打印设备示意图。其中,31表示第一喷头;32表示第二喷头;33表示可三维运动的辅助成形微流控芯片。
图5为使用本发明的方法三维打印得到的组织结构体的照片。
图6为本发明组织结构体的生物学活性。其中,图6A为与二维培养细胞相比,三维肝组织结构体的白蛋白分泌随着时间的变化;图6B为与二维培养细胞相比,三维肝组织结构体的尿素分泌随着时间的变化。
图7为二维种植细胞、细胞微球三维打印、细胞三维打印的细胞存活率。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
3%海藻酸钠溶液的制备方法:将海藻酸钠粉末与去离子水按照质量比为3︰97的比例混合,在80℃条件下加热3小时使其均匀溶解,之后分装,于4℃或者-20℃低 温保存。每次使用前在细胞培养箱中保温10min后使其融化为均匀溶液。
海藻酸钠粉末是Sigma公司的产品。
5%海藻酸钠溶液的制备方法:将明胶粉末与去离子水按照质量比为5︰95的比例混合,在80℃条件下加热3小时使其均匀溶解,之后分装,于4℃或者-20℃低温保存。每次使用前在细胞培养箱中保温20min后使其融化为均匀溶液。
明胶粉末是Sigma公司的产品。
DMEM培养液是hyclone公司的产品。
二维种植细胞、细胞三维打印组织结构体在文献“Three-dimensional printing of Hela cells for cervical tumor model in vitro.Zhao Y,Yao R,Ouyang L,Ding H,Zhang T,Zhang K,Cheng S,Sun W.Biofabrication.2014,6(3):035001”中公开过。
实施例1、细胞微球三维组织结构体的制备方法
一、实验仪器和材料的准备
1、实验仪器
(1)细胞微球生成装置
本发明的细胞微球生成装置在文献“Rui Yao,et al.,Alginate and alginate/gelatin microspheres for human adipose-derived stem cell encapsulation and differentiation,Biofabrication 4,2012”中公开过,主要包括三个部分:注射泵(微量注射泵)(如图2A中的11所示)、高压发电器(如图2A中的12所示)和收集装置(如图2A中的13所示)。上述高压发电器的型号为SA167-6,购自中国天津,具有0-40kV的ad/dc输出电压;上述注射泵为TS2-60,购自Longer Pump Ltd,泵送速度为0-90ml/分钟;上述收集装置的主要部分是有机玻璃盒,其前面是一块滑动的玻璃。在上部面板的中间设置套管,平端注射针头和注射管通过上述套管与注射泵相连接。上述套管确保是垂直的,并且协助调节针头与固化溶液的距离。套管的底部是开口的,使得便于正电极连接。将具有把手的铜片嵌入到底部面板的中心,并将其与负电极相连。将位于培养皿中的固化溶液置于铜片之上。然后以特定的速率挤出含有细胞的载体溶液(例如海藻酸盐、海藻酸盐/明胶、海藻酸盐/胶原溶液、海藻酸钠/基质胶溶液),使得溶液落至固化溶液。
(2)生物三维打印机在文献“Rui Yao,et al.,In Vitro Angiogenesis of 3D Tissue Engineered Adipose Tissue,Journal of Bioactive and Compatible Polymer,2009,24:5”中公开过。包括单喷头生物3D打印机(单喷头3D打印机的示意图如图3所示)、双喷头生物3D打印机(双喷头3D打印机的示意图如图4所示)和多喷头生物3D打印机。多喷头、双喷头生物3D打印机的结构基本与单喷头3D打印机相同,区别仅在于有两 套或者多套喷头系统(即包括两个或者多个喷头以及与各个喷头相连的管路和独立或者联动的驱动机构)。
(3)聚二甲基硅氧烷微流控生物芯片在文献“Juliana M.Chan,et al.,Engineering of In Vitro 3D Capillary Beds by Self-Directed Angiogenic Sprouting,PLOS ONE,2012,7(12):e50582”中公开过。
2、实验材料
(1)脂肪来源间充质干细胞(hADSC)是Invitrogen公司的产品。
(2)人脐静脉内皮细胞(HUVEC)是Invitrogen公司的产品。
(3)人表皮成纤维细胞(HDF)是ScienCell公司的产品。
二、细胞微球的制备
1、I型胶原/海藻酸钠细胞微球的制备
将0.2mL的I型胶原溶液(4mg/mL)轻柔地加入到7mL海藻酸钠溶液(2.5%)(Sigma-Aldrich),将PH调节至7.2,得到胶原/海藻酸钠溶液,将其作为细胞微球的载体材料。
将hADSC细胞均匀悬浮于上述胶原/海藻酸钠溶液,使其密度为106细胞/mL,然后通过上述细胞微球生成装置来产生细胞微球。细胞微球生成装置的参数为10kV电压、10mL/h的推送速率、35mm电极距离以及27号针。从固化溶液中收集细胞微球后,将其用PBS溶液(Sigma-Aldrich)清洗两次,然后在增殖培养基(含有10%胎牛血清的DMEM培养液)中培养3天,再在分化培养基(含有10%胎牛血清、1μM地塞米松、10μg/ml胰岛素,200μM吲哚美辛和0.5mM IBMX的DMEM培养液)中培养16天。在实验过程中培养基每2-3天更换一次。图1A为根据上述方法制备得到的细胞微球的示意图,图2B为根据上述方法制备得到的I型胶原/海藻酸钠细胞微球的照片。
2、基质胶/海藻酸钠细胞微球的制备
在冰上将1mL的基质胶溶液(在DMEM培养液中15倍稀释)轻柔地加入到1mL海藻酸钠溶液(6%)(Sigma-Aldrich),得到基质胶/海藻酸钠溶液,将其作为细胞微球的载体材料。
将hADSC细胞均匀悬浮于上述基质胶/海藻酸钠溶液中,使其密度为106细胞/mL,然后通过细胞微球生成装置来产生细胞微球。细胞微球生成装置的参数为10kV电压、10mL/h的推送速率、35mm电极距离以及27号针。从固化溶液中收集细胞微球后,将其用PBS溶液清洗两次,然后在增殖培养基中培养3天,再在分化培养基中培养16天。在实验过程中培养基每2-3天更换一次。图2C为根据上述方法制备得到的基质胶/海藻酸钠细胞微球的照片。
3、外周粘附细胞的I型胶原/海藻酸钠细胞微球的制备
将0.2mL的I型胶原溶液(4mg/mL)轻柔地加入到7mL海藻酸钠溶液(2.5%)(Sigma-Aldrich),将PH调节至7.2,得到胶原/海藻酸钠溶液,将其作为细胞微球的载体材料。
将hADSC细胞均匀悬浮于上述胶原/海藻酸钠溶液,使其密度为106细胞/mL,然后通过上述细胞微球生成装置来产生细胞微球。细胞微球生成装置的参数为10kV电压、10mL/h的推送速率、35mm电极距离以及27号针。从固化溶液中收集细胞微球后,将其用PBS溶液(Sigma-Aldrich)清洗两次,然后在增殖培养基(含有10%胎牛血清的DMEM培养液)中培养3天,再在分化培养基(含有10%胎牛血清、1μM地塞米松、10μg/ml胰岛素,200μM吲哚美辛和0.5mM IBMX的DMEM培养液)中培养16天。第17天时,将在1mL的I型胶原溶液(0.2mg/mL)与细胞微球均匀混合后在室温下静置30min,使胶原纤维通过自组装作用在细胞微球表面均匀涂覆一层。之后将人脐静脉内皮细胞(ScienCell公司产品)以105细胞/mL的密度均匀悬浮在内皮细胞专用培养基中(ScienCell公司产品)形成内皮细胞悬浮液,将1mL内皮细胞悬浮液与细胞微球均匀混合,并在共培养培养基(内皮细胞专用培养基与分化培养基1:1混合)中共培养3天,形成内皮细胞均匀粘附在胶原/海藻酸钠细胞微球的外周。实验过程中培养基每2-3天更换一次。图1B为根据上述方法制备得到的含有外周粘附细胞的细胞微球的示意图。
三、单喷头细胞微球组织结构体的制备方法
1、将密度为106个细胞/mL的hADSC细胞与3%的海藻酸钠溶液(细胞微球载体材料)均匀混合后,加入到上述细胞微球生成装置中,生产得到细胞微球。装置的参数为:7kV电压、15mL/h推进速度、45mm液面高度、27#针头。
2、将密度为105个细胞/mL的人脐静脉内皮细胞(HUVEC)(购自Invitrogen)与基质微丝材料均匀混合,得到含HUVEC的基质材料;上述基质微丝材料的制备方法:将0.5%的海藻酸钠与5%的明胶按照体积比为1:1的比例混合,得到基质微丝材料。
3、将步骤1中得到的细胞微球与步骤2中得到的含HUVEC的基质材料按质量比1:1的比例混合,得到混合物,将其装载到1mL一次性无菌注射器中,利用压力挤出单喷头生物3D打印机,在步进电机速度2mm/s,扫描速度10mm/s的参数条件下,在无菌的平面平台上三维打印,形成体积为1cm/1cm/0.5cm的预凝胶组织结构体。
4、用100mmol-1的氯化钙溶液浸泡上述预凝胶组织结构体30s,完成交联过程,之后用生理盐水润洗三次,得到单喷头细胞微球组织结构体;将其培养在添加20%FBS的DMEM培养液的生物反应器中37℃浸泡培养
四、双喷头细胞微球组织结构体的制备方法
1、将密度为106个细胞/mL的hADSC细胞与3%的海藻酸钠溶液(细胞微球载体材料)均匀混合后,加入到上述细胞微球生成装置中,生产得到细胞微球。装置的参数为:7kV电压、15mL/h推进速度、45mm液面高度、27#针头。
2、将密度为5000个细胞/mL的步骤1得到的细胞微球与添加20%FBS的DMEM培养基均匀混合,得到待打印的细胞微球,将其装载到1mL一次性无菌注射器中作为双喷头生物3D打印机的一个喷头(细胞微球喷头)。
3、将密度为105个细胞/mL的人脐静脉内皮细胞(HUVEC)(购自ScienCell)与基质微丝材料(0.5%的海藻酸钠与5%的明胶混合物按体积比1:1的比例混合)均匀混合,得到含有HUVEC的基质材料,将其装载到1mL一次性无菌注射器中作为双喷头生物3D打印机的另一个喷头(基质材料喷头)。
4、采用双喷头生物3D打印机,在计算机软件(Microsoft,AT640,Redmond,WA)控制下,将待打印的细胞微球和基质材料分别打印在特定位置,在无菌的平面平台上三维打印,形成体积为1cm/1cm/0.5cm的预凝胶组织结构体。其中细胞微球喷头为压电驱动,二次方曲线驱动波形,电压100V,80Hz振动频率;基质材料喷头采用压力挤出驱动,在步进电机速度2mm/s,扫描速度10mm/s的参数条件下完成打印。
5、用100mmol-1的氯化钙溶液浸泡预凝胶组织结构体30s,完成交联过程,之后用生理盐水润洗三次,得到双喷头细胞微球组织结构体,将其培养在添加20%FBS的DMEM培养液的生物反应器中。
五、多喷头细胞微球组织结构体的制备方法
1、将密度为106个细胞/mL的hADSC细胞与3%的海藻酸钠溶液(细胞微球载体材料)均匀混合后,加入到上述细胞微球生成装置中,生产得到细胞微球。装置的参数为:7kV电压、15mL/h推进速度、45mm液面高度、27#针头。
2、将密度为5000个细胞/mL的步骤1得到的细胞微球与添加20%FBS的DMEM培养基均匀混合,得到待打印的细胞微球,将其装载到1mL一次性无菌注射器中作为多喷头生物3D打印机的一个喷头(细胞微球喷头)。
3、将密度为106个细胞/mL的人脐静脉内皮细胞(HUVEC)(购自ScienCell)与基质微丝材料(0.5%的海藻酸钠与5%的明胶混合物按体积比1:1的比例混合)均匀混合,得到含有HUVEC的基质材料,将其装载到1mL一次性无菌注射器中作为多喷头生物3D打印机的另一个喷头(基质材料喷头1)。
4、将密度为106个细胞/mL的人表皮成纤维细胞(HDF)(购自ScienCell)与基质微丝材料(1%的海藻酸钠与15倍稀释的基质胶按体积比1:1的比例混合)均匀混合,得到含有HDF的基质材料,将其装载到1mL一次性无菌注射器中作为多喷头生 物3D打印机的第三个喷头(基质材料喷头2)。
5、采用多喷头细胞打印机,在计算机软件(Microsoft,AT640,Redmond,WA)控制下,将步骤2、3、4中待打印的细胞微球和基质材料分别打印在特定位置,在无菌的平面平台上三维打印,形成体积为1cm/1cm/0.5cm的预凝胶组织结构体。其中细胞微球喷头为压电驱动,二次方曲线驱动波形,电压100V,80Hz振动频率;基质材料喷头采用压力挤出驱动,在步进电机速度2mm/s,扫描速度10mm/s的参数条件下完成打印。
6、用100mmol-1的氯化钙溶液浸泡预凝胶组织结构体30s,完成交联过程,之后用生理盐水润洗三次,得到多喷头细胞微球组织结构体,将其培养在添加20%FBS的DMEM培养液的生物反应器中。
六、借助芯片的细胞微球组织结构体的制备方法
1、制备聚二甲基硅氧烷微流控生物芯片
使用本领域公知的光刻蚀和软光刻的方法制备聚二甲基硅氧烷微流控生物芯片。采用AutoCAD 2009软件(Autodesk,San Rafael,CA)设计芯片装置的构图,之后采用高分辨率打印机(深圳市路维电子有限公司)将芯片装置的负模印刷在透明掩膜表面。采用标准的光刻蚀技术制备晶片(Seoulin Biosciences,Seoul,South Korea)。具体步骤如下:
(1)将SU-8光致抗蚀剂均匀旋涂在清洁的硅晶片表面;
(2)将光掩模放置在晶片上方,通过紫外光照射交联暴露部分的SU-8光致抗蚀剂。晶片形成后经过硬化、清洗、风干等步骤形成母模。
(3)制备微流控芯片装置
将聚二甲基硅氧烷(Sylgard 184,Dow Corning,Midland,MI)弹性体脱气后倒入晶片,并在80℃的烤箱内过夜烘烤形成聚合的聚二甲基硅氧烷芯片装置。将聚二甲基硅氧烷芯片从硅晶片上剥离,切除边角,用压缩空气清洗、高温灭菌后备用。使用前30min之内采用等离子处理机(Harrick Expanded Plasma Cleaner,Harrick Plasma,Ithaca,NY)处理聚二甲基硅氧烷芯片2min以提高其亲水性和细胞亲和力。
2、将密度为106个细胞/mL的hADSC细胞与3%的海藻酸钠溶液(细胞微球载体材料)均匀混合后,加入到上述细胞微球生成装置中,生产得到细胞微球。装置的参数为:7kV电压、15mL/h推进速度、45mm液面高度、27#针头。
3、将密度为105个细胞/mL的人脐静脉内皮细胞(HUVEC)(购自Invitrogen)与基质微丝材料(0.5%的海藻酸钠与5%的明胶混合物按体积比为1:1混合)均匀混合,得到含有HUVEC的基质材料。
4、将步骤2中得到的细胞微球与步骤3中得到的含HUVEC的基质材料按质量比 1:1的比例混合,得到混合物,将混合物装载到1mL一次性无菌注射器中,利用压力挤出单喷头生物3D打印机,在步进电机速度2mm/s,扫描速度10mm/s的参数条件下,将所述混合物打印到聚二甲基硅氧烷芯片的预定位置。采用等离子处理机(Harrick Expanded Plasma Cleaner,Harrick Plasma,Ithaca,NY)处理盖玻片(泰州市华亿康医疗器械有限)2min以提高其亲水性和细胞亲和力。将盖玻片与聚二甲基硅氧烷芯片轻压封片后形成体积与芯片对应的预凝胶组织结构体。
5、在微流控生物芯片中,以10mL/h流速,用100mmol-1的氯化钙溶液浸泡预凝胶组织结构体10s,完成交联过程,之后用生理盐水润洗三次,得到借助芯片的细胞微球组织结构体,将其在芯片流体条件下培养在添加20%FBS的DMEM培养液中。
实施例2、细胞微球三维组织结构体的细胞存活率测定
本发明的细胞微球三维组织结构体细胞存活率的检测方法有两种:
一、细胞微球三维组织结构体荧光染色死活检测
利用Calcein-AM细胞活性试剂盒(SIGMA)检测细胞微球三维组织结构体中细胞存活率,具体步骤如下:
1、将1μM Calcein-AM和2μM碘化丙啶配置为荧光染液,采用磷酸缓冲液分别轻柔清洗实施例1中制备的多喷头细胞微球三维组织结构体(细胞微球三维打印)、二维种植细胞(二维种植)、细胞三维打印组织结构体(细胞三维打印)3次后,避光浸泡在荧光染液中15min。
2、采用激光共聚焦显微镜(LSM710META,Zeiss)分析获取红色和绿色荧光图片。
3、采用Image Pro Plus软件的图像分析计数功能计算细胞存活率:绿色细胞数/细胞总数。
二、组织结构体溶解为二维细胞/材料混合物荧光染色死活检测
利用Calcein-AM细胞活性试剂盒(SIGMA)检测细胞微球三维组织结构体中细胞存活率,具体步骤如下:
1、将1μM Calcein-AM和2μM碘化丙啶配置为荧光染液,采用磷酸缓冲液轻柔清洗实施例1中制备的多喷头细胞微球三维组织结构体(细胞微球三维打印)、二维种植细胞(二维种植)、细胞三维打印组织结构体(细胞三维打印)3次后,加入55mM柠檬酸钠溶解结构体和细胞微球。
2、1000rpm,10min离心收集细胞,将细胞避光悬浮在荧光染液中15min。
3、采用荧光显微镜(Nikon 90I,Nikon)分析获取红色和绿色荧光图片。
4、采用Image Pro Plus软件的图像分析计数功能计算细胞存活率:绿色细胞数/细胞总数。
方法一的检测结果如图7所示:二维种植细胞(二维种植)的存活率95%±0.8%,细胞微球三维打印组织结构体(细胞微球三维打印)中细胞存活率为93%±1.5%,且与二维细胞种植结果相比没有显著性差异;细胞三维打印组织结构体(细胞三维打印)的细胞存活率为91%±1.2%,且与二维种植细胞(二维种植)结果和细胞微球三维打印组织结构体(细胞微球三维打印)相比都有显著性差异。方法二的检测结果和方法一无显著差异。
实施例3、细胞微球三维组织结构体的生物活性测定
本实施例在不同时间点收集实施例1中单喷头细胞微球三维组织结构体,通过测定其细胞代谢活性来确定本发明的组织结构体的生物学活性。以二维种植细胞为对照,二维种植细胞使用常规二维培养的细胞培养方法(常规二维培养的细胞培养方法在文献“Three-dimensional printing of Hela cells for cervical tumor model in vitro.Zhao Y,Yao R,Ouyang L,Ding H,Zhang T,Zhang K,Cheng S,Sun W.Biofabrication.2014,6(3):035001”中公开过)培养得到二维培养物。
分别在培养后第1、2、3、4和5天收集单喷头细胞微球三维组织结构体和二维培养物,3000rpm离心5分钟,使用Hitachi 7600系列自动生化分析仪(Hitachi,Tokyo,Japan)来分析单喷头细胞微球三维组织结构体和二维培养物的白蛋白(ALB)和尿素(UREA)分泌情况。
部分结果如图6所示:图6A为二维培养细胞与三维组织结构体的白蛋白分泌随着时间的变化;图6B为二维培养细胞与三维组织结构体的尿素分泌随着时间的变化。结果表明:在相同条件下培养的三维组织结构体的生物学活性显著高于二维培养物。
双喷头生物3D打印机准备的三维组织结构体和多喷头生物3D打印机准备的三维组织结构体与单喷头生物3D打印机准备的三维组织结构体的生物活性无显著差异。
实施例4、细胞微球三维组织结构体在检测药物毒性中的应用
将实施例1中步骤四的双喷头生物3D打印机准备的三维组织结构体在制备完成并培养10天后进行药物毒性检测。具体步骤如下:
1、采用磷酸缓冲液轻柔清洗双喷头生物3D打印机准备的三维组织结构体3次,分别加入血药浓度的降脂药物--非诺贝特(DMEM培养基+200μM棕榈酸+25μM非诺贝特)、DMEM培养基(正常培养组)、普通非诺贝特(DMEM培养基+25μM非诺贝特),培养48h后,分别从培养基中取出双喷头生物3D打印机准备的三维组织结构体。
2、分别将取出双喷头生物3D打印机准备的三维组织结构体3000rpm离心5分 钟,使用Hitachi 7600系列自动生化分析仪(Hitachi,Tokyo,Japan)来分析样品的白蛋白(ALB)分泌情况,以检测药物对其的急性毒性。
检测结果如图6所示:在24h、48h、72h、96h、120h时,二维种植细胞和细胞微球三维打印结构体分泌的白蛋白浓度分别为0.1、2、1.1、1.3、0.8μg/mL和5、4.9、5.1、12.4、22.3μg/mL。
- 还没有人留言评论。精彩留言会获得点赞!