功能性光学相干断层成像的装置、方法和系统与流程
本发明是根据由美国国立卫生研究院授予的资助号1RC4EY021357和1R01EY019951;以及由美国国家科学基金会授予的授予号CBET-1055379和CBET-1240416在政府支持下做出的。政府对本发明享有一定的权利。
交叉参考
本申请要求于2014年4月28日提交的美国专利申请序列号No.61/985278的优先权,其全部内容通过引用并入本文。
背景技术:
光学相干断层成像(Optical Coherence Tomography)(OCT)是一种非侵入性光学成像技术,其通过使用低相干干涉仪系统来产生样品的深度解析反射成像。OCT成像允许在通过其它成像技术不容易获得的各种生物系统和非生物系统中的结构的三维(3D)可视化。在一些情况下,OCT可以在不干扰或伤害目标或样品的情况下提供评估信息的非侵入性、非接触手段。例如,在医学中,OCT应用包括但不限于在眼睛的视网膜中的疾病的诊断、介入性心脏病学治疗和评估、以及用于皮肤病的皮肤损伤的诊断的非侵入性手段。
通常,OCT用于生成各种结构(包括诸如血脉管系统(blood vasculature)的脉管)的3D图像。先前描述的OCT的方法提供用于获得结构信息的方法,所述获得结构信息是指(direct at)获取关于脉管的外部结构的尺寸、形状、拓扑和物理属性的信息。然而,关于脉管和结构内部的物理和化学属性的信息也可以是有用的,产生关于系统的更多功能和潜在有用的信息。
例如在医学诊断中,脉管可视化和关于血液属性的量化信息对于许多疾病的诊断和治疗可能是重要的。例如,大约50%的美国人会得癌症,其中的大约50%会死于癌症。在诸如糖尿病性视网膜病变、年龄相关性黄斑变性(AMD)、青光眼的眼部疾病的示例中,美国近1000万人以及全世界超过2亿人可能存在视力丧失或失明的风险。怀疑影响眼睛和周围肿瘤的血液供应的异常形态的脉管重塑和生化途径可能分别与这些疾病的发作和预后相关。在一些示例中,通过异常血管增殖所例示的代谢中的异常增加或减少也可能与疾病相关。
允许获取关于与疾病病因相关的组织属性的信息的非侵入性方法可以致使预防这样的疾病。测量血流量以及血流内的其它各种生化分析物(诸如氧(pO2)、葡萄糖或其它生物标志物)的能力可以帮助指示目标组织的功能状态,诸如代谢活动。在一些示例中,理解目标组织的功能状态的能力可用于疾病的治疗、监测或预防。当同时测量诸如血流和氧的属性时尤其如此。目前,没有非侵入性三维(3D)成像技术来测量组织中的体内氧代谢。在本领域中需要用于针对(包括但不限于疾病的治疗和诊断的)多种应用的代谢和其它目标功能的非侵入性3D量化成像的改进的方法和装置。
技术实现要素:
在第一方面,本公开提供了一种用于对目标进行成像的方法,所述方法包括以下步骤:用一个或更多个低相干光束对目标执行光学相干断层成像(OCT)扫描,其中,所述一个或更多个光束包括一个或更多个波长;从由OCT扫描生成的反射信号获取光学信息;在目标中进行量化3D成像;根据所获取的光学信息确定流体的流速以及一种或更多种分析物的浓度;以及确定目标中的一种或更多种分析物浓度的变化速率。
本公开的另一方面提供了一种用于对象的疾病的诊断或治疗的方法,所述方法包括以下步骤:获取步骤,获取目标的3D OCT扫描;确定步骤,确定所述目标中的体液中的一种或更多种分子标志物的状态,同时根据所生成的3D扫描量化所述体液的流量;以及提供步骤,提供医疗决策。在一些示例中,OCT扫描包括不可见光、可见光或近红外(NIR)光。
通过引用并入
本说明书中所提及的所有出版物、专利和专利申请都通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请被具体和单独地指明通过引用并入。
附图说明
在所附权利要求中具体地阐述了本公开的装置的新颖特征。通过参考以下详细描述以及附图将获得对本公开的特征和优点的更好的理解,所述详细描述阐述了其中利用了本公开的装置的原理的例示性示例,在附图中:
图1a是使用反向对比(inversed contrast)的着色的大鼠(rat)眼睛的体内B扫描图像的示例。
图1b是短时傅里叶变换(STFT)OCT光谱的示例。
图1c是来自脉管壁底部的STFT OCT提取的光谱的示例。
图1d是来自脉管底部的反射光谱的示例。
图2a是自由空间vis-OCT装置的示例性示意图。
图2b是自由空间vis-OCT装置的示例性照射光谱。
图2c是自由空间vis-OCT装置的理论和轴向分辨率的示例。
图3是双光束扫描的示例性示意图。同时或顺序地用一个或多个光束照射目标。
图4是示例性fOCT装置的示意图。
图5是示例性fOCT装置的示意图。
图6是多光束扫描的示例性示意图。同时或顺序地用一个或更多个光束照射目标。
图7是具有两个或更多个光束的多光束扫描的示例性示意图。同时或顺序地用一个或更多个光束照射目标。
图8是示例性fOCT装置的示意图。
图9是示例性fOCT装置的示意图。
图10a是示例性vis-OCT眼底图像。白色圆形线表示B扫描轨迹。
图10b是主要脉管的示例性融合的脉管图像和氧图的示例。
图10c是视网膜B扫描的示例。
图10d是示出每个个体脉管的sO2的示例性量化的图。
图10e是平均动脉和静脉sO2值的示例。
图11a是示例性vis-OCT眼底图像。白色圆形线表示B扫描轨迹。
图11b是示例性B扫描。
图11c是示例性相移B扫描图像。
图11d是测量的多普勒角的示例性示意图和曲线图。
图11e是拟合血流速率数据的示例性曲线图。
图11f是动脉和静脉的血流速率数据的示例性曲线图。
图11g是动脉和静脉的总血流速率数据的示例性曲线图。
图12是用于代谢功能OCT的示例性方法的流程图。
图13是根据所获取的光学信息在目标中对流体的流速和氧浓度进行量化3D成像以及基于氧消耗确定代谢变化速率的示例性过程的流程示意图。
图14是根据所获取的光学信息在目标中对流体的流速以及一种或更多种分析物的浓度进行量化3D成像以及确定目标中的一种或更多种分析物浓度的变化速率的示例性过程的流程示意图。
图15a是示出移动细胞的示例性流量对比的图。复反射系数信号的相移与投射到光束的流速成正比。
图15b是用于计算多普勒角的示例性几何形状的示意图。
图15c是示例性B扫描。
图15d是相移B扫描的示例。
图16a是具有vis-OCT的示例性眼底图像,并且圆形白线表示B扫描轨迹。
图16b是指示视网膜的各种组织层的示例性B扫描。
图16c是示出各个脉管的示例性B扫描。
图17是示出大鼠中主要小动脉与静脉之间的视网膜流量测量的示例性差异的曲线图。
图18a是关于sO2的示例性纵向稳定性研究。
图18b是血流量的示例性纵向稳定性研究。
图18c是rMRO2的示例性纵向稳定性研究。
图19是作为视网膜深度的函数的示例性模拟氧气张力PO2分布的曲线图。视网膜色素上皮层(RPE)/感光器的外段(OS)层(层1)和外核层(ONL)/外网状层(OPL)(层3)具有PO2的线性分布;而感光器的内段(OS)层(层2)具有二次PO2分布。实线是正常空气呼吸下的PO2分布,虚线是PaO2=72mmHg时的全身缺氧下的PO2分布。脉络膜氧压(Pc)与全身PaO2成比例。由于视网膜循环的自动调节,外部和内部视网膜(PL)之间的界面处的氧张力被认为是相同的。
图20是示例性vis-OCT装置的示意图。
图21a是用于流量测量的示例性扫描图案示意图的表示。两个同心圆扫描穿过源自视盘视盘的所有血管。
图21b是具有同步EKG图案的示例性脉动流图案的曲线图。
图21c是脉动流图案的示例性傅里叶变换的曲线图。
图21d是显示通过vis-OCT和spO2(脉搏血氧定量法)的动脉sO2测量的示例性相关性的曲线图。
图21e是对吸入空气的变化的氧含量的示例性动脉和静脉sO2响应的曲线图。
图22a例示出了在缺氧情况下的示例性视网膜脉管系统变化。常氧情况下视盘周围的平均强度投影图像。
图22b例示出了在常氧情况下的视盘周围的示例性平均强度投影图像。
图22c例示出了常氧和缺氧中的主动脉(A)和静脉(V)的平均直径的示例。
图22d例示出了图22a中的插入件的示例性放大视图。
图22e例示出了图22b中的插入件的示例性放大视图。
图22f例示出了在常氧和缺氧情况下的小动脉直径的示例性比较。
图23a反映了源自视网膜循环和响应于全身氧气张力的示例性视网膜氧消耗。图23a提供了缺氧协议的示例性示意图表示。吸入氧含量分六步从21%逐步减少到9%。在每个步骤测量动脉和静脉sO2、血流量和血管直径。
图23b例示出了在降低氧含量下的示例性sO2变化。
图23c例示出了在降低氧含量下的示例性PO2变化。
图23d例示出了示例性对应的动静脉氧合差异的进展。
图23e例示出了主要视网膜血管的示例性平均直径。
图23f例示出了示例性视网膜血流。
图23g例示出了从动脉血管输送氧气的示例。
图23h例示出了示例性氧摄取分数。
图23i例示出了来自视网膜循环的视网膜氧代谢的示例。
图24a示出了在缺氧情况下视网膜和脉络膜循环之间氧供应平衡变化的示例性示意图。在全身缺氧情况下,视网膜循环为外视网膜提供更多的氧以补偿脉络膜循环的不足。
图24b示出了大鼠视网膜的示例性解剖结构。
图24c示出了跨视网膜的示例性模拟PO2分布。
图25例示出了可以从媒体读取指令、连接到网络并存储由fOCT装置生成的数据的示例性逻辑设备的示意图。
图26a例示出了使用OCT的粘液厚度的示例性动态监测。图26a示出了台式vis-OCT系统的示例性示意图。
图26b例示出了示例性内窥镜NIR-OCT探针的示例性示意图和照片。
图26c示出了用内窥镜NIR-OCT探针成像的示例性宫颈内组织样品/目标。
图26d示出了放置在OCT物镜下方的示例性宫颈内组织样品/目标。
图26e指示执行三维内窥镜OCT扫描的示例性过程。BS,分束器;DC、色散补偿;GM、电流计镜;L,物镜;M1、M2,反射镜;F,带尾纤维;FC,光纤耦合器;GL,自聚焦透镜;P,棱镜;NIR,近红外;OCT,光学相干断层成像;vis-OCT,可见光光学相干断层成像。
图27a例示出了在分泌和酶水解期间粘液层厚度变化的示例性动态监测。图27a包括示出宫颈内组织的解剖特征的单个vis-OCT B扫描。
图27b示出在37℃下在PBS溶液中孵育40分钟期间测量的最大粘液厚度的示例图。
图27c示出了添加神经氨酸酶后测量的最大粘液厚度的示例图。图27c的示例是在15分钟的时间内观察到的。**,与时间=0相比,P<0.01。箭头,粘液表面;E,上皮;LP,固有层;vis-OCT,可见光光学相干断层成像。
图28a示出了体外完整猕猴阴道的示例性内窥镜NIR-OCT成像。(A)阴道管的360°圆形B扫描图像(缩放,刻度条表示扫描轴的半径,单位mm)。
图28b示出了覆盖45°的示例性高密度角扫描,示出了阴道表面结构的细节。如图28b的示例所示,刻度条表示100μm。
图28c示出了具有0.8mm纵向位移的相同45°圆形扫描的示例性3维渲染,示出了阴道上皮的粗糙结构。R,阴道褶皱;G,保护壳玻璃表面;M,颗粒状图案表示粘液;NIR,近红外;OCT,光学相干断层成像。
图29是例示出可以结合fOCT装置使用的计算机系统的第一示例性架构的框图。
图30是示出具有多个计算机系统的示例性网络以及配置有fOCT装置的多个蜂窝电话和个人数字助理的图。
图31是配置有fOCT装置的示例性多处理器计算机系统的框图。
当结合附图阅读时,将更好地理解本发明的某些示例的以下详细描述。为了例示本发明的目的,在附图中示出了某些示例。然而,应当理解,本发明不限于附图中所示的布置和手段。
具体实施方式
I、总体概述
本公开的方法、装置和系统提供功能性光学相干断层成像(fOCT)。通常,fOCT可以包括用于确定目标的功能性状态(例如身体组织的健康)的非侵入性、非接触方法。在一些示例中,fOCT可以用于确定组织的代谢变化,进而指示关于疾病状态或健康的一些情况。
通常,fOCT采用本领域已知的OCT的任何方法。fOCT提供了一种从OCT光谱提取全套光学性质并同时地或基本同时地提取光学信息以计算目标中流体的流速以及目标中特定分析物的浓度的方法。在一些示例中,从OCT扫描产生的相同或单个A扫描可用于计算流量(flow)和分析物浓度。例如,目标可以是人类视网膜,其中可以使用fOCT确定或量化血流和氧。在一些示例中,目标可以是皮肤,并且用葡萄糖的量化来计算汗液的流速。
通常,在图13中提供了用于确定代谢速率的示意图并且所述示意图作为示例被提供。在一些示例中,从OCT扫描获取干涉测量数据(1302),并且将其转换成3D复反射系数(complex reflectance)数据(1304)。然后使用该相同的A扫描数据来执行流量和分析物浓度的同时或基本同时的计算或确定。在一些示例中,执行3D脉管分割(1306)、光谱提取(1308)以量化氧饱和度(sO2)(1310)。在一些示例中,这可以表示为氧分压pO2。同时,使用圆形亮度扫描(B扫描)方差(1312)、投射速率(1314)和微脉管系统可视化(1322)确定血液流速。同时,圆形B扫描幅度(1316)、血管直径(1318)和血管方向性(1320)可用于确定绝对流量(1324)。总之,这些计算可以帮助确定组织中氧消耗的准确变化,或总氧代谢速率(1326)。
在一些示例中,流量参数和分析物浓度的准确量化可用于确定目标功能的状态的变化。例如,人类视网膜的代谢或氧消耗的变化可以指示视网膜疾病。在皮肤监测和汗液中的葡萄糖的示例中,针对糖尿病的血糖水平监测可以使用本公开的方法、装置和系统来执行。
考虑到本公开的无标签、非侵入性、非接触方法,可以采用多种医学应用,包括癌症和各种其它眼部疾病的疾病监测和诊断。
在一些示例中,目标中的量化3D成像在不使至少一种分析物与外源试剂或标签(label)接触的情况下来执行。在一些示例中,一个或更多个光束包括不可见光、可见光或近红外(NIR)光。在一些示例中,OCT扫描生成一个或更多个A扫描(振幅调制扫描)。
在本公开的另一方面中,对目标中的流体的流速以及目标中的流体中的一种或更多种分析物的浓度进行量化成像,以及确定一种或更多种分析物浓度的变化速率使用相同的A扫描的光谱分析。在一些示例中,相同的OCT A扫描的振幅、强度或相位被用于确定一种或更多种分析物浓度的变化速率。在一些示例中,流速、一种或更多种分析物的浓度、以及所述确定变化的速率或一种或更多种分析物浓度使用目标的多个OCT A扫描。
在本公开的另一方面,对目标中的多个区域执行OCT。在一些示例中,一个或更多个光束被用于执行多光束或多频带扫描OCT。在一些示例中,用于照射的光源被配置为具有至多1.0mW的功率。在一些示例中,一个或更多个光束同时或顺序地照射目标。在一些示例中,量化成像目标中的流体的流速以及目标中的流体中的一种或更多种分析物的浓度基本上同时发生。在一些示例中,一个或更多个光束以圆形图案或者两个或更多个同心圆形图案照射目标。
在本公开的另一方面,目标选自由组织、健康组织、患病组织、视网膜、肿瘤、癌症、生长、纤维瘤、病变、皮肤、粘膜内层、器官、移植物、血液供应以及一个或更多个血管组成的组。在一些示例中,使用近红外(NIR)光来执行目标中的流体的流速的量化成像。在一些示例中,使用可见光来执行目标中的流体中的一种或更多种分析物的浓度的量化成像。
在本公开的另一方面,流体可以包括但不限于全血、血浆、血清、尿、精液、眼泪、汗液、唾液、淋巴液、胸腔积液、腹膜液、脑膜液、羊水、腺体液、脊髓液、结膜液、玻璃体、水、阴道液、胆汁、粘液、唾液和脑脊液。在本公开的另一方面,分析物选自由氧、血红蛋白、氧合血红蛋白、脱氧血红蛋白、葡萄糖、糖、血尿素氮(blood area nitrogen)、乳酸盐、血细胞比容、生物标志物以及核酸组成的组。
在本公开的另一方面,通过比较或使用参考来执行确定一种或更多种分析物的变化的速率。在一些示例中,参考是健康组织。在一些示例中,参考是其中流体的流速以及一种或更多种分析物的浓度先前已被量化的目标。在一些示例中,生成目标的一个或更多个图像。在一些示例中,一个或更多个图像以及分析物浓度的速率的变化被用于计算目标的功能或目标的功能的变化。在一些示例中,目标的功能是组织中的病理性改变。在一些示例中,目标的功能是代谢功能。在一些示例中,在一个或更多个图像中确定动脉和静脉。在一些示例中,在目标的一个或更多个区域中计算代谢功能。在本公开的另一方面,外源试剂与目标接触。在一些示例中,外源试剂是造影剂(contrast reagent)。在一些示例中,所述量化目标中的流体的流速包括确定包含流体的一个或更多个脉管的横截面积。
在本公开的另一方面,通过确定目标中的一种或更多种分析物浓度的变化速率来进行医学决策。
在本公开的另一方面,执行光谱分析以提取目标的全套光学性质。
在本公开的另一方面,该方法被配置用于从由探针、手持装置、可穿戴装置、内窥镜、导管探针、腹腔镜工具、外科手术工具以及针组成的组中选择的装置。
本公开的另一方面提供确定一种或更多种分子标志物的状态包括计算目标中的代谢活动或代谢活动的变化。在一些示例中,通过测量针对所生成的多个区域中的每一个区域在多个深度处反射的可见光的强度、振幅或相位,来执行确定目标中的体液中的一个或更多个分子标记物的状态。在一些示例中,量化体液的流量包括测量针对所生成的多个区域中的每一个区域在多个深度处反射的NIR光的强度、振幅或相位。
在本公开的另一方面,获取一个或更多个A扫描。在一些示例中,使用相同A扫描的光谱分析来确定流速和一种或更多种分子标志物的状态。在一些示例中,提供医疗决策包括基于一个或更多个分子标志物的状态在报告中对一个或更多个治疗决策选择方案进行分级。在一些示例中,医疗决策是施用药物。在一些示例中,目标选自以下的组:患病组织、疑似患病组织和健康组织。在一些示例中,医疗决策是改变药物的剂量、选择药物施用的频率或进行药物选择。在一些示例中,确定目标中的体液中的一种或更多种分子标志物的状态同时量化体液的流量指示疾病的存在或不存在。在一些示例中,目标选自由组织、健康组织、患病组织、视网膜、肿瘤、癌症、生长、纤维瘤、病变、皮肤、粘膜内层、器官、移植物、血液供应以及一个或更多个血管组成的组。在一些示例中,确定一种或更多种分子标志物的状态包括对血流或血液供应进行成像。在一些示例中,成像包括将患病或疑似患病组织的血流或血液供应的图像与来自正常组织的血流或血液供应的图像或者来自同一组织的血流或血液供应的先前图像进行比较;以及当与来自正常组织的血流或血液供应的图像或者来自同一组织的血流或血液供应的先前图像中的分子标志物的水平相比,如果所述疑似患病组织的血流或血液供应的图像包括一种或更多种分子标志物的增加的或异常的水平,则诊断所述患病组织。
在本公开的另一方面,目标是疑似包括癌症的组织。在一些示例中,癌症选自由皮肤癌、肺癌、结肠癌、食管癌、胃癌、卵巢癌、甲状腺癌、心脏癌、鳞状细胞癌、纤维肉瘤、肉瘤样癌(sarcoid carcinoma)、黑色素瘤、乳腺癌、肺癌、结肠直肠癌、肾癌、骨肉瘤、皮肤黑色素瘤、基底细胞癌、胰腺癌、膀胱癌、肝癌、脑癌、前列腺癌、白血病、黑色素瘤或淋巴瘤组成的组。
本公开的另一方面提供确定一种或更多种分子标志物的状态,其用于诊断、监测或治疗眼部疾病,所述眼部疾病选自由以下疾病组成的组:年龄相关性黄斑变性(AMD)、湿性AMD、干性AMD、青光眼、视网膜静脉闭塞、视网膜分支静脉闭塞和糖尿病性视网膜病变。在一些示例中,在不使至少一种分析物与外源试剂或标签接触的情况下来执行确定一种或更多种分子标记物的状态。
本公开的另一方面提供了代谢光学相干断层成像系统,其包括目标的可见光照射和近红外照射,以确定血液流速以及氧饱和速率的变化。
II、用于功能性OCT(fOCT)的一般方法
A、术语和OCT方法
本文所述的术语“光学相干断层成像”和“OCT”通常是指在一些示例中用微米横向分辨率对样品成像的干涉测量技术。这种非侵入性光学断层扫描成像技术用于各种医疗和工业应用,以提供目标的横截面或3D图像。
本文所述的术语“功能性OCT”和“fOCT”通常是指OCT成像的方法,如本文所述,其提供关于目标的结构(3D、断层扫描和横截面信息)和功能信息两者的获取。在一些示例中,fOCT可以被称为“可见光OCT”或“vis-OCT”。Vis-OCT通常是指包括可见光的一种类型的fOCT。
fOCT可以利用OCT的任何方法。通常,fOCT可以配置有干涉仪,如针对许多其它OCT方法的示例一样。来自光源(例如,宽带光源)的光被分裂(例如,通过分束器),并且沿着样品臂(通常包括样品)和参考臂(通常包括镜子)行进。来自样品臂的照射目标的光的一部分被目标反射。光也从参考臂中的镜子反射。(来自测试臂和参考臂的光例如通过分束器重新组合。)当样品臂中的光行进的距离在在参考臂中的光行进的距离的相干长度内时,发生光学干涉,其影响重组光的强度。合成的反射光的强度根据目标特性而变化。因此,所测量的反射的强度的变化是被成像的目标的物理特征或属性的指示。
在一些示例中,本公开的装置、方法和系统可以利用时域OCT,其中参考臂的长度可以改变(例如,通过移动一个或更多个参考镜)。随参考臂距离变化而观察到的反射率指示在样品的不同深度处的样品性质。在一些示例中,替代参考臂长度的变化或者除了参考臂长度的变化之外,改变样品臂的长度。在一些示例中,所述装置、方法和系统可以利用频域OCT,其中参考臂的距离可以是固定的,并且然后可以在不同的频率测量反射率。例如,从光源发射的光的频率可以在一个频率范围上或者诸如光栅的色散元件上扫描,并且检测器阵列可以用于分离和检测不同的波长。傅里叶分析可将频率依赖性(frequency-dependent)反射性质转换为距离依赖性(distance-dependent)反射性质,从而指示在不同样品深度处的样品性质。在某些示例中,OCT可以示出不能从其它形式的成像获得的附加信息或数据。
在一些示例中,本公开的装置、方法和系统可以利用频域光学相干断层成像,其中参考臂和样品臂是固定的。来自包括多个波长的宽带光源的光从样品反射并干扰由参考镜反射的光。可以获得反射信号的光谱。例如,光可以被输入到分光仪或光谱仪,包括例如光栅和检测在不同频率处的光的强度的检测器阵列。
例如,可以通过处理器执行傅立叶分析,并且可以将对应于多个频率的数据转换为对应于样品内的多个位置的数据。因此,可以同时收集来自多个样品深度的数据,而无需扫描参考臂(或样品臂)。在Vakhtin等人(Vakhtin A B,Kane D J,Wood W R和Peterson KA),“Common-path interferometer for frequency-domain optical coherence tomography”,Applied Optics.42(34),6953-6958(2003))中描述了与频域光学相干断层成像有关的附加细节,并且其通过引用并入本文。
执行光学相干断层成像的其它方法是可能的。例如,在频域光学相干断层成像的一些示例中,从光源发射的光的频率随时间改变。因此,作为时间的函数的光强度的差异与不同的光频率相关。当使用光谱时变光源时,检测器可以检测作为时间的函数的光强度,以获得干涉信号的光谱。可以如本文所述采用光谱的傅立叶变换。本公开的装置、方法和系统可以利用OCT的任何方法,包括但不限于本领域已知的光谱域OCT、傅立叶域OCT、时间编码频域OCT、或扫描源OCT、单点OCT、共焦OCT、平行OCT、或全场OCT。
通常,术语“A扫描”或“A线”描述与不同样品深度相关联的光反射率。本文所使用的术语“B扫描”或“B线”是指使用由多个A扫描的集合形成的组织的横截面视图。在癌症检测的fOCT方法的示例中,由癌组织目标反射的光被转换成电信号,并且可以用于产生横截面或3D结构图像和关于目标组织(例如癌生长,病变,或肿瘤)的代谢功能信息二者。在眼科学的示例中,由眼组织反射的光被转换为电信号,并且可以用于提供关于眼中组织的3D结构和视网膜中的代谢活动的数据。在许多示例中,包括但不限于癌症检测和眼科学,A扫描和B扫描例如可以用于区分正常组织和异常组织。
对于一般方法,A扫描通常可以包括在z轴方向上的多个深度处的数据,并且B扫描可以包括从内侧边界到外侧边界或(x,y)轴方向上的横截面数据。在皮肤癌病变的fOCT的示例中,例如,A扫描通常可以包括从病变的表皮的外部区域到包括脉管系统的内部区域的数据,而B扫描可以包括在(x,y)平面中从一个病变边界到另一个病变边界的横截面数据。在眼科实例中,A扫描通常可以包括从角膜到视网膜的数据,并且B扫描可以包括从眼睛的内侧边界到外侧边界以及从角膜到视网膜的横截面数据。3D C扫描可以用于通过在各种示例中组合多个B扫描来生成一个或更多个3D图像。
在本公开中,“目标”可以指示适于成像的任何样品、物体或对象。在一些示例中,目标可以包括但不限于诸如如为了fOCT的工业应用而发现的和如本文所述的金属、合金、聚合物以及矿物的无机材料。在一些示例中,目标可以是有生命的物质,如包括但不限于如将适用于如本文所述的fOCT的医学和农业应用的胚胎、种子、细胞、组织、移植物、血管、器官或生物的任何合适的生物材料。
B、fOCT系统配置
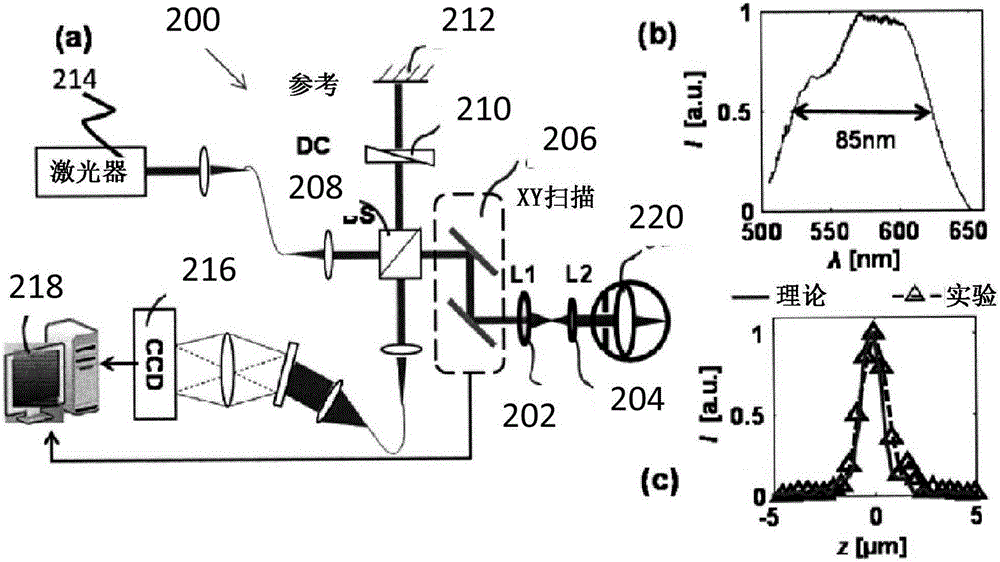
用于数据收集的fOCT系统可以以各种方式进行配置,通常适合于任何类型的OCT。图1和图2(a)例示出了由配置用于代谢成像的示例性系统200生成的数据的示例。示例性自由空间vis OCT系统200包括透镜L1 202、透镜L2 204、x-y轴线性扫描镜单元206(例如,诸如压电驱动的电流计镜(GM)的用于操纵激光束的一对可旋转镜,或诸如共振扫描镜等的其它旋转机构)、分束器208、色散控制(DC)210、参考镜(REF)212、激光器214(例如,由超连续谱源产生的,诸如连续波(CW)氩离子激光器等)、电荷耦合器件(CCD)照相机216(例如,二维CCD或诸如CMOS照相机等的其它检测器)以及计算机或其它处理器218。
透镜L1 202和L2 204将由激光器214产生的光束中继到目标瞳孔220上。分束器208与包括参考镜212的具有色散控制210的参考臂一起工作,以调整来自激光器214的光束。光束由镜子206引导通过透镜202、204以冲击瞳孔220。所获得的图像信息由CCD 216捕获并转发到计算机218。例如,计算机218可以被用于控制CCD 216和/或系统200的其它部件。
图2(b)例示出使用系统200获得的示例性照射光谱。图2(c)示出了使用示例性系统200获得的理论和实验轴向分辨率的比较。
图20提供了fOCT或vis-OCT配置的另一示例。在一些示例中,超连续谱源2097用于目标的照射。在一些示例中,由于最小色散,可以采用开放空间迈克尔逊(Michelson)干涉测量配置。光束也可以被立方体分束器准直并分裂到参考臂和样品臂中。样品臂可以包含用于操纵光束的二维电流计镜,以及(可选地)用于将光束从电流计镜中继到目标的0.2倍放大的开普勒望远镜。参考臂可以包括色散控制玻璃板和用于例示出光束的镜子。来自参考臂和样品臂的两个光束在分束器处重新组合并且可以由光纤收集。光纤可以将光传送到光谱仪,该光谱仪可以由准直透镜、衍射光栅、物镜和线扫描CCD照相机2098(例如Balser,sprint slp2k)组成。照相机曝光和扫描电流计镜可以通过模拟输出卡同步。
本公开的装置、方法、组合物、系统和药剂盒可以使用适于OCT的任何光源,包括但不限于超连续谱激光器、超发光二极管、连续波激光器或超短脉冲激光器。光源可以用于产生一个或更多个低相干光束以照射目标。在一些示例中,光源可以用于产生一定范围的光束。在一些示例中,光源可以产生1到10个光束之间的光束。在其它示例中,光源可以产生2到5个光束之间的光束。在其它示例中,光源可以产生5到20个光束之间的光束。在其它示例中,光源可以产生10到15个光束之间的光束。在其它示例中,光源可以产生1到1000个光束之间的光束。在其它示例中,光源可以产生10到1000个光束之间的光束。在其它示例中,光源可以产生20到100个光束之间的光束。在其它示例中,光源可以产生30到100个光束之间的光束。在其它示例中,光源可以产生40到100个光束之间的光束。在其它示例中,光源可以产生50到100个光束之间的光束。在其它示例中,光源可以产生60到1000个光束之间的光束。在其它示例中,光源可以产生70到100个光束之间的光束。在其它示例中,光源可以产生1到80个光束之间的光束。在其它示例中,光源可以产生90到100个光束之间的光束。本领域技术人员将理解,光束的数量可以落入由这些值中的任何值界定的任何范围内(例如从约1个光束到约1000个光束)。
通常,一个或更多个光束的波长范围可以在约500nm至约620nm的范围内。在一些示例中,波长可以在200nm至600nm之间的范围内。在一些示例中,波长可以在300nm至900nm之间的范围内。在一些示例中,波长可以在500nm至1200nm之间的范围内。在一些示例中,波长可以在500nm至800nm之间的范围内。在一些示例中,一个或更多个光束的波长范围可以具有在500nm、510nm、520nm、530nm、540nm、550nm、560nm、570nm、580nm、590nm、600nm、610nm和620nm处或附近的波长。通常,一个或更多个光束的波长范围可以在200nm至1500nm的范围内。在一些示例中,一个或更多个光束的波长范围可以在200nm至1500nm的范围内。一个或更多个光束的波长范围可以在300nm至1500nm的范围内。一个或更多个光束的波长范围可以在400nm至1500nm的范围内。一个或更多个光束的波长范围可以在500nm至1500nm的范围内。一个或更多个光束的波长范围可以在600nm至1500nm的范围内。一个或更多个光束的波长范围可以在700nm至1500nm的范围内。一个或更多个光束的波长范围可以在800nm至1500nm的范围内。一个或更多个光束的波长范围可以在900nm至1500nm的范围内。一个或更多个光束的波长范围可以在1000nm至1500nm的范围内。一个或更多个光束的波长范围可以在1100nm至1500nm的范围内。一个或更多个光束的波长范围可以在1200nm至1500nm的范围内。一个或更多个光束的波长范围可以在1300nm至1500nm的范围内。一个或更多个光束的波长范围可以在1300nm至1500nm的范围内。在一些示例中,fOCT和本公开的装置、方法和系统包括波长在可见光谱或近红外(NIR)光谱中的两个或更多个光束。在一些示例中,fOCT包括具有在可见光谱和NIR光谱中的波长的光束。本领域技术人员将理解,光的波长可落在由这些值中的任何值界定的任何范围内(例如,从约200nm光束到约1500nm光束)。
在一些示例中,fOCT可以包括多频带扫描。在一些示例中,频带可以包括在有界范围内包含光的连续波长的一个或多个波长范围。在一些示例中,频带可以包括具有波长的上限和波长的下限的包含光的连续波长组的一个或更多个波长范围。在一些示例中,频带内的有界范围可以包括本文所述的波长范围。在一些示例中,fOCT可以包括重叠的频带。在一些示例中,fOCT可以包括基本上分离的频带。在一些示例中,频带可以部分重叠。在一些示例中,fOCT可以包括范围从1个频带到100个频带的一个或更多个频带。在一些中,频带的数量可以包括1-5个频带。在一些中,频带的数量可以包括5-10个频带。在一些中,频带的数量可以包括10-50个频带。在一些中,频带的数量可以包括25-75个频带。在一些中,频带的数量可以包括25-100个频带。
通常,用于照射目标的一个或更多个光束可以以任何合适的图案配置。在一些示例中,光束可以是一个或更多个多边形图案。在一些示例中,照射图案600(图6)可以是一个或更多个光束610、620的矩形。在一些示例中,光束可以利用一个或更多个光束396和397作为一个或更多个圆(图3)或者两个或更多个同心圆395照射目标。在一些示例中,可以基于要在目标中成像的脉管或流体流量的图案来选择合适的图案。例如,在视网膜中,发现血管以圆形图案或基本上圆形的图案径向地在视盘周围。例如,对于视网膜的fOCT成像,可以使用一个或更多个同心圆的光束或基本上圆形的光束照射目标视网膜。在一些示例中,可以利用相同或不同的预定义扫描轨迹来执行fOCT。在一些示例中,轨迹可以包括多边形形状。在一些示例中,轨迹可以同时或顺序地施加到目标。
此外,与其它OCT或成像方法相比,本公开的装置、方法和系统可以允许产生fOCT扫描的各种功率要求。在一些示例中,fOCT装置被配置为用具有从0.01mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用大约0.8mW的光源照射目标。在一些示例中,fOCT装置被配置为用大约0.5mW-0.8mW的光源照射目标。在一些示例中,fOCT装置被配置为用大约0.1mW-1.2mW的光源照射目标。在一些示例中,fOCT装置被配置为用大约0.2mW-1.5mW的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.01mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.02mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.03mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.04mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.05mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.06mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.07mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.08mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.09mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.1mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.2mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.3mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.4mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.5mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.6mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.7mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.8mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从0.9mW到1mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从1.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从2.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从3.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从4.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从5.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从10.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从20.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从30.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从50.0mW到100mW的功率范围的光源照射目标。在一些示例中,fOCT装置被配置为用具有从75.0mW到100mW的功率范围的光源照射目标。本领域技术人员将理解,光源功率可以落入由这些值中的任何值界定的任何范围内(例如,从约0.01mW至约100mW)。
在一些示例中,本公开的装置、方法和系统允许配置fOCT装置以比其它OCT或成像方法更快的速率获取A扫描。在一些示例中,A扫描获取速率可以在1kHz至10,000kHz的范围内。在一些示例中,A扫描获取速率可以在5kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在10kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在20kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在30kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在40kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在50kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在60kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在70kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在80kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在90kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在100kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在200kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在300kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在400kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在500kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在600kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在700kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在800kHz至1000kHz的范围内。在一些示例中,A扫描获取速率可以在900kHz至1,000kHz的范围内。在一些示例中,A扫描获取速率可以在1000kHz至10000kHz的范围内。在一些示例中,A扫描获取速率可以在约35kHz至约70kHz的范围内。在一些示例中,A扫描获取速率可以在约20kHz至约100kHz的范围内。在一些示例中,A扫描获取速率可以在约75kHz至约200kHz的范围内。在一些示例中,A扫描获取速率可以在约100kHz至约500kHz的范围内。在一些示例中,A扫描获取速率可以包括10kHz、15kHz、20kHz、25kHz、30kHz、35kHz、40kHz、45kHz、50kHz、60kHz、70kHz、75kHz、80kHz、85kHz、90kHz或100kHz的频率。本领域技术人员将理解,A扫描获取频率可以落入由这些值中的任何值界定的任何范围内(例如,从约1kHz至约10000kHz)。
每个B扫描可以具有多个A扫描,范围从1个到1000个。在一些示例中,每个B扫描可以具有1-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有10-1000个A扫描的范围。在一些示例中,每个B扫描可以具有100-1000个A扫描的范围。在一些示例中,一个B扫描可以具有256个A扫描。在一些示例中,每个B扫描可以具有200-1000个A扫描的范围。在一些示例中,每个B扫描可以具有300-1000个A扫描的范围。在一些示例中,每个B扫描可以具有400-1000个A扫描的范围。在一些示例中,每个B扫描可以具有500-1000个A扫描的范围。在一些示例中,每个B扫描可以具有600-1000个A扫描的范围。在一些示例中,每个B扫描可以具有700-1000个A扫描的范围。在一些示例中,每个B扫描可以具有800-1000个A扫描的范围。在一些示例中,每个B扫描可以具有900-1000个A扫描的范围。在一些示例中,每个B扫描可以具有1000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有2000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有3000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有4000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有5000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有6000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有7000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有8000-10,000个A扫描的范围。在一些示例中,每个B扫描可以具有9000-10,000个A扫描的范围。在一些示例中,一个B扫描可以包括2410个A扫描。在一些示例中,一个B扫描可以包括2500个A扫描。
在一些示例中,可以利用为了在目标中量化3D成像而生成的1-100,000,000个A扫描的范围来执行fOCT。在一些示例中,生成的A扫描可以在100-100,000,000个的范围内。在一些示例中,生成的A扫描可以在1000-100,000,000个的范围内。在一些示例中,生成的A扫描可以在10000-100,000,000个的范围内。在一些示例中,生成的A扫描可以在100000-100,000,000个的范围内。在一些示例中,生成的A扫描可以在1000000-100,000,000个的范围内。在一些示例中,生成的A扫描可以在10,000,000-100,000,000个的范围内。在一些示例中,生成约65,000个A扫描用于在目标中量化3D成像。在一些示例中,生成约50,000个A扫描用于在目标中量化3D成像。在一些示例中,生成约75,000个A扫描用于在目标中量化3D成像。在一些示例中,生成约25,000个A扫描用于在目标中量化3D成像。
在一些示例中,除了fOCT成像之外,还可以使用用于收集心电图(EKG)信号的EKG放大器。在一些示例中,当配置用于血管的代谢成像的fOCT装置时,EKG信号可能是有用的,例如图20中所示的2099。EKG信号收集可以与模拟输出卡的扫描同步,以使得EKG的收集和OCT图像是同时的。在一些示例中,脉搏血氧计也可以与fOCT一起使用,如图20中所示的2094。在一些示例中,帧捕获器与fOCT一起使用,如图20中所示的2096。在一些示例中,PC处理器(2095)或机器可以配置有fOCT。在一些示例中,PC计算机处理器可以包括但不限于个人计算机、大型机、蜂窝电话、移动装置、可穿戴装置或手表。
C、fOCT信号处理和量化
本公开的装置、方法和系统根据如本文所描述的且在先前步骤中获取的光学信息提供在目标中对流体的流速以及一种或更多种分析物的浓度进行量化3D成像。在一些示例中,从A扫描提取光学信息。与先前描述的成像方法不同,可以仅从OCT产生的光学信息中提取足以在目标中对流体的流速以及一种或更多种分析物的浓度进行量化3D成像的数据。另外,可以从相同的光学信息中提取在目标中对流体的流速以及一种或更多种分析物的浓度进行量化3D成像。在一些示例中,相同的光学信息可以是相同的A扫描。在一些示例中,来自单个或相同的A扫描的信息可用于在目标中对流体的流速以及一种或更多种分析物的浓度进行量化3D图像。在一些示例中,在目标中对流体的流速的量化3D成像以及对一种或更多种分析物的浓度的量化3D成像两者同时或基本同时地发生。在一些示例中,同时(或基本上同时,考虑到一些数据传输、存储和/或处理等待时间等)可以指并行(或基本上并行,考虑到一些数据传输、存储和/或处理等待时间等)计算。在一些示例中,同时可以指利用相同的OCT装置或相同的算法处理器进行的在目标中对在相同系统中、相同目标中存在的流体的流速以及一种或更多种分析物的浓度的量化3D成像。
i、3D成像
图14提供了用于在目标中对流体的流速以及一种或更多种分析物的浓度的量化3D成像的信号处理量化的方法的示例性处理方案。在某些示例中,获得一个或更多个OCT扫描(1401)。然后从一个或更多个OCT扫描获得原始光谱数据(1402)。然后获得A扫描复反射系数(1403)。根据相同的A扫描复反射系数,本公开的装置、方法和系统提供目标中的流体的流速的计算(1404),以及目标中的一种或更多种分析物浓度的计算(1405)。可以基于目标中流体的流速的计算来执行目标功能的变化的确定(1406)。
在下游量化过程要素(process element)之前,在一些示例中,配置有fOCT装置的CCD照相机的一个或更多个曝光可以记录干涉光谱。在一些示例中,在获得A扫描之前执行过程要素。在一些示例中,DC光谱背景可以为光谱信号的一部分或全部的平均。剩余的光谱可以以相等的间隔被重新采样到k空间中。关于深度(“A线”或“A扫描”)的复反射系数信号可以通过对k空间光谱的快速傅里叶变换(FFT)获得。可以针对本文所述的收集的A线的全部或一部分重复该过程。可以使用快速傅立叶变换(FFT)或任何合适的方法来生成3D复反射系数数据。在一些示例中,复反射系数的振幅可以用于获得3D形态图像。
ii、量化分析物浓度
本公开的装置、方法和系统提供信号处理,其提供要从由fOCT生成的以及如本文所述的3D图像量化的一种或更多种分析物浓度。一般来说,该方法包括:3D图像脉管分割、光谱提取以及拟合。
在一些示例中,可以通过强度阈值来分割或识别包含流体的脉管。在一些示例中,脉管包括但不限于血管。在一些示例中,可以对每个B扫描图像执行强度直方图调整以最大化对比度。接着,可以使用Otsu的方法计算全局图像阈值,并且用于二值化一个或更多个图像。在一些示例中,来自每个A扫描的第一非零边界的深度位置可以被记录为该点处的表面。可以对在此生成和描述的B扫描的全部或一部分重复相同的过程。
然后可以定位脉管的横向坐标。可以采取从距表面约150至200f.m深度的板(slab)的平均强度投影。在一些示例中,板的范围可以从1f.m到10000f.m。在一些示例中,板的范围可以从100f.m到400f.m。在一些示例中,板的范围可以从100f.m到900f.m。在一些示例中,板的范围可以从200f.m到800f.m。在一些示例中,板的范围可以从300f.m到700f.m。在一些示例中,板的范围可以从400f.m到600f.m。在一些示例中,板的范围可以从200f.m到600f.m。在一些示例中,板的范围可以从100f.m到10000f.m。在一些示例中,板的范围可以从200f.m到10000f.m。在一些示例中,板的范围可以从300f.m到10000f.m。在一些示例中,板的范围可以从400f.m到10000f.m。在一些示例中,板的范围可以从500f.m到10000f.m。在一些示例中,板的范围可以从600f.m到10000f.m。在一些示例中,板的范围可以从600f.m到10000f.m。在一些示例中,板的范围可以从700f.m到10000f.m。在一些示例中,板的范围可以从800f.m到10000f.m。在一些示例中,板的范围可以从900f.m到10000f.m。在一些示例中,板的范围可以从1000f.m到10000f.m。在一些示例中,板的范围可以从1200f.m到10000f.m。在一些示例中,板的范围可以从1300f.m到10000f.m。在一些示例中,板的范围可以从1400f.m到10000f.m。在一些示例中,板的范围可以从1500f.m到10000f.m。
接着,可以使用自适应阈值处理过程来二值化图像。为了消除噪声,可以对具有3个像素弧度圆盘图案的二值化图像执行图像扩大和侵蚀处理。然后可以单独分离和选择每个脉管。然后可以记录脉管的3D坐标(轴向和横向),以进一步从这些脉管提取光谱。
在可以确定每个血管的3D坐标之后,可以从原始数据中选择相应的干涉光谱,并且可以针对光谱提取和拟合执行短时傅立叶变换(STFT)。可以应用任何合适的高斯窗口大小。在一些示例中,kw=0.32f.m-1(在585nm下为17nm)可用于STFT中。在一些示例中,可以使用将轴向分辨率放松(relax)到至少9f.m.或至多9f.m。然后可以从脉管壁的底部获取光谱。各种光谱拟合模型在本领域中是已知的。
通常,OCT信号可以通过与分析物有关的不同方程(equation)来建模。在一些示例中,分析物可以是氧、血红蛋白、脱氧血红蛋白或氧合血红蛋白。例如,为了确定视网膜中的代谢功能,可以使用以下方程来对氧消耗进行建模:
I2=I02R0r exp[-2ndμHbO2(sO2)-2ndμHb(1-sO2)]
其中I0是视网膜上的入射强度。在一些示例中,可以忽略由眼晶状体和玻璃体腔引起的光学衰减,并且因此可以将I0视为源光谱;R0是参考臂反射率;d[mm]是脉管直径;r[无量纲(dimensionless)]是脉管壁处的反射率,其散射光谱可以被建模为在一阶玻恩近似(Born approximation)r(A)AA下的幂次定律,其中,A是常数。光学衰减系数f.1[mm-1]组合了流体的吸收(f.1a)和散射系数(f.1s)。在一些示例中,这可以是针对全血,其可以是波长和氧合依赖性的。在氧合血红蛋白和脱氧血红蛋白的示例中,下标Hb和HbO2分别表示脱氧血液和氧合血液的贡献。然后,可以在光谱上使用数据的对数线性回归以返回sO2的值。任何合适的分析物的浓度都可以通过目标中的3D成像量化获得。
iii、流量量化
使用OCT量化流体流速的方法先前已经描述并且是本领域已知的。在一些示例中,相位敏感多普勒OCT可以用于流量测量。相位是沿成像系统的光路长度的反射的高分辨率位置测量的一种类型,其是成像光的波长的一半的频率的循环。成像波长的一半的深度位置变化将产生相同的相位测量。相位的变化与轴向流成比例,平行于由v(cosθ)指定的成像方向的流分量,其中,v是流体的速率,θ是流动方向与成像光之间的角度。
在来自两个相邻A线的相位敏感多普勒OCT信号中(图15),可以用于提取流体的速率,流体中的分析物的速率或流体粘度。在一些示例中,可以通过确定红细胞的速率来测量血流。血流速率可以被表示为:
其中,fsample是OCT A线扫描频率;A0[nm]是光源的中心波长;Δφ是相邻A扫描之间的复反射系数的相移[弧度(radian)];n是样品的折射率;以及e[弧度]是多普勒角;血管与探测光之间的角度。投射到探测光束方向的速率vp与Δφ成正比,
总血流量等于速率和脉管横截面积的乘积:
因此,血流的后处理可以包括以下步骤:计算投影血流速率vp、多普勒角θ和脉管直径Dia。
本公开的装置、方法和系统提供利用用于量化一种或更多种分析物浓度的相同光学信息来用于流体流量计算。可以使用光学信息,或者,在一些示例中,可以使用来自干涉光谱的傅立叶变换的复反射系数A线信号。在一些示例中,相邻A线之间的复信号的相位项的导数(derivative)可以用于量化脉管中的流体流量。在一些示例中,中值滤波器可以应用在一个或更多个B扫描相位图像上以去除椒盐噪声。Δφ通过每个脉管腔内的相移的积分来计算。
在一些示例中,为了计算多普勒角,具有半径r1和r2的双圆扫描在两个不同脉管中心点S(x1,y1,z1)和E(x2,y2,z2)处与脉管相交。脉管的方向可以表示为矢量ES:
在视网膜的fOCT的示例中,探测光的方向是NS’,其中,N是眼睛的交点(nodal point)。如果眼睛直径为h,则N的坐标为(0,0,h),并且S’的坐标为(x1’,y1’,0)。探测光方向为:
然后可以在给定所有矢量的坐标的情况下计算多普勒角θ:
其中r1和r2分别是视网膜上的外部和内部圆形扫描的半径,并且<1和<2是圆形扫描的方位角。可以直接从B扫描OCT图像测量z坐标。考虑到与眼球直径(对于大鼠,h=6mm)相比视网膜是薄的(200f.m),E'和S'的坐标可以表示为:
在一些示例中,可以使用水平地从<=0到360度的圆形B扫描图像。垂直轴z是深度,其中B扫描图像的下边界被设置为z=0。可以从外部和内部扫描圆形B扫描图像分割脉管。可以测量z坐标以及rp1和rp2。r1和r2可以通过以下公式计算:
r1=h·tan(φ1),r2=h·tan(φ2)。
扫描角度φl和可以分别由电流计镜设置为4度和6度。给定所有坐标,可以根据以下公式计算多普勒角θ:
为了计算流量,也可以使用横截面直径和面积。脉管高度H可以从振幅B扫描图像轴向获得。血管的直径Dia则可以等于:
Dia=H×sin(θ)
并且可以求解出Dia。
如本文所述的分析物可以指适于成像的任何化学或生物化学部分。在一些示例中,这可以包括但不限于可适合成像以确定目标功能的氧、血红蛋白、氧合血红蛋白、脱氧血红蛋白、葡萄糖、糖、血尿素氮、乳酸盐、血细胞比容、生物标志物、分子标志物或核酸。分析物也可以是分子,包括但不限于:多肽、蛋白质、抗体、酶、核酸、糖类、小分子、药物等。
在一些示例中,本公开的装置、方法和系统提供在目标中对流体的流速以及一种或更多种分析物的浓度的“无标签”量化3D成像。在该示例中,在不使用与分析物或目标接触的外源试剂的情况下计算分析物和流量。例如,已描述了多种成像方法,描述使用可结合到一种或更多种分析物的造影剂或附加化学标志物或信号来量化分析物或流量。本公开的装置、方法和系统提供成像系统,其中成像的一种或更多种分析物是无标签的。
然而,在一些示例中,一种或更多种造影剂可以与本公开的装置、方法和系统结合使用。在该示例中,可以在没有标签的情况下获得在目标中对流体的流速和一种分析物的浓度的量化3D成像,同时可以通过使一种或更多种分析物与诸如造影剂的外源试剂接触来确定一种或更多种另外的分析物浓度。
目标可以包括可包含待成像的流体的任何脉管或结构,包括但不限于组织、健康组织、患病组织、视网膜、肿瘤、癌症、生长、纤维瘤、病变、皮肤、粘膜内层、器官、血液供应以及一个或更多个血管。
在一些示例中,流体可以包括但不限于全血、血浆、血清、尿、精液、眼泪、汗液、唾液、淋巴液、胸腔积液、腹膜液、脑膜液、羊水、腺体液、脊髓液、结膜液、玻璃体、水、阴道液、胆汁、粘液、唾液和脑脊液。
iv、确定分析物和目标功能的变化的速率
通常,本公开的装置、方法和系统提供了确定分析物的浓度变化速率的方法。可以在一个时间点或在一系列时间点上执行量化成像目标中的流体的流速以及目标中的流体中的一种或更多种分析物的浓度。在一些示例中,可以在至少1毫秒、1秒、1分钟、1小时、1天、1星期、1个月、1年和10年的时间段内监测目标。在一些示例中,可以在至多1毫秒、1秒、1分钟、1小时、1天、1星期、1个月、1年和10年的时间段内监测目标。在一些示例中,可以监测目标20-60分钟。在一些示例中,可以在1至5年内监测目标。在一些示例中,可以监测目标1至60秒。在一些示例中,可以监测目标1毫秒至500毫秒。
在一些示例中,目标功能可以包括但不限于生物标志物或分析物的代谢活动、生物标志物或分析物的代谢速率、生物标志物或分析物的氧消耗、生物标志物或分析物的组织消耗、病理生理改变、病理改变、组织改变(诸如组织重塑、一种或更多种血管的异常生长或异常组织生长)、坏死、细胞凋亡、坏死、血管生成、细胞增殖、神经调节、神经活性、伤口愈合、感染、烧伤、瘢痕、放射性损伤、缺氧、氧化应激等。
在一些示例中,目标功能的变化可以通过将来自在目标中对流体的流速以及一种或更多种分析物的浓度的3D成像的信息与参考进行比较来确定。在一些示例中,参考可包括但不限于健康图像或来自健康对象的信息的平均值。在一些示例中,参考可以包括来自在不同时间生成的3D图像的信息。在一些示例中,一个或更多个参考可与其它参考进行比较以确定一种或更多种分析物浓度的速率变化。
III、功能OCT和代谢活动
在一些示例中,fOCT可以具体用于一个或更多个组织的代谢成像。在某些示例中,代谢成像可以提供关于对象中组织的健康状态的诊断信息。
使用图2(a)的示例性系统200,可见光光学相干断层成像(vis-OCT)可以通过并行测量来自视网膜循环的血流和sO2来量化体内rMRO2。使用OCT光谱分析,可以在体内测量sO2。3D成像能力使得vis-OCT具体地能够从血管中恢复光谱并消除来自其它视网膜层的混杂信号。代谢速率rMRO2可以通过将sO2测量与OCT流量测量相结合来获得。
在操作中,例如,可以通过使聚焦的宽带激光穿过视网膜来扫描视网膜的三维(3D)结构,以提供横向(x,y)鉴别。基于反射光与参考光之间的干涉来重建深度(z)处的反射率(A线)。
每个3D测量(例如,x,y,z中的2.8mm×2.8mm×1mm)可以仅以高帧速率(例如,98fps)进行几秒(例如2.5s),允许用高时间分辨率监测rMRO2。为了量化rMRO2(例如,每单位时间消耗的氧气的气体体积,mL/min),从视网膜循环测量两个参数:总视网膜血流量F[J.L/min]和相对sO2[百分比]。可以根据以下方程计算rMRO2:
其中,CHb是血红蛋白浓度[g/J.L],并且1.34是血红蛋白的氧结合能力[mL/g]。下标w和v表示动脉和静脉sO2。血流是横截面脉管面积(s)和速率(v)的乘积,其中s是根据断层扫描图像计算的,v是基于来自移动血细胞的相位变化测量的。sO2的对比度来自例如氧合血红蛋白和脱氧血红蛋白的不同吸收光谱。通过拟合从血管提取的血液光谱,例如可以计算总血红蛋白中氧合血红蛋白的百分比(按照定义为sO2)。
在操作中,某些示例提供了实现代谢成像的双光束扫描方法。使用可见光生成第一光束,并且使用NIR光生成第二光束。可见光OCT束测量sO2,并且NIR光OCT束测量血流量。双光束OCT系统和相关联的扫描图案可以以多种方式设计。图2(a)提供了能够生成和测量各种波束图案和所获得的照射的一个示例性系统200。例如,图3示出了圆形双光束扫描方法395。如图3的示例所示,第一光束396是用于测量目标瞳孔中的sO2的可见光束,并且第二光束397是用于测量瞳孔中的血流量的近红外光束。使用双光束圆形扫描方法,光束396、397围绕视盘(ONH)以圆周运动移动。因为视网膜血管从ONH径向延伸,所以光束的每个圆圈穿过附接到视网膜的所有动脉和静脉并且使得能够捕获全部视网膜血流量。在两个圆形扫描之间的脉管的位移也为绝对流量提供脉管方向性。例如,高速扫描还便于捕获血流的脉动图谱。
图4例示出了设计有作为基于开放空间的系统的一个OCT和作为基于光纤的系统的另一个OCT的另选双光束圆形扫描系统400。示例系统400包括控制两个光谱仪402、404以分析由超连续谱激光器406产生的照射的计算机或其它处理器401。激光器406使用滤波器408,其将激光分离成可见光410和NIR 412波长。
可见光束410被引导通过分束器415,并且利用例示出的DC 413、光圈414和镜子416从热镜(HM)418调节到XY扫描镜420并且到目标眼睛440上。NIR光束412穿过光纤422,并且使用偏振控制(PC)424、DC 426、光圈428和镜子430的组合来进行调节。NIR光束412通过XY扫描镜432例示出到HM 418,然后经由XY扫描镜420到目标眼睛440上。
图5例示出了设计有两个基于OCT的光纤的系统的另选双光束圆形扫描系统500。示例系统500包括控制两个光谱仪502、504以分析由超连续谱激光器506产生的照射的计算机或其它处理器501。激光器506使用滤波器508,其将激光分离成可见光510和NIR 512波长。
可见光束510通过光纤514被引导到HM 516。可见光510利用PC 518、DC 520、光圈522和镜子524来进行调节。可见光510从HM 516引导到XY扫描镜526并到达目标540上。NIR光束512穿过光纤528,并且使用偏振控制(PC)530、DC 532、光圈534和镜子536的组合来进行调节。NIR光束512被XY扫描镜538反射到HM516,并然后经由XY扫描镜526反射到目标540上。
虽然示例系统500和600实现代谢OCT的相同目的,但系统500、600使用不同的vis-OCT设计实现该结果。基于双光纤OCT的系统600可以比系统500更紧凑,但是两个系统500、600的输出之间的数据处理是等效的。系统200、500、600中的任一个都可以用于实现各种波束图案,但是系统200更适合于圆形波束图案300。
图6示出了另选的双光束线性扫描方法600。如图6的示例所示,第一光束610是用于测量目标瞳孔中的sO2的可见光束,并且第二光束620是用于测量瞳孔中的血流量的近红外光束。每个光束610、620沿着单独的路径移动以扫描视网膜血管的一部分。示例系统200、400、500中的任一个都可以用于执行区别(distinctive)路径双光束方法600。
图7示出了另选的双光束线性扫描方法700。如图7的示例所示,第一光束710是用于测量目标瞳孔中的sO2的可见光束,并且第二光束720是用于测量瞳孔中的血流量的近红外光束。在示例方法700中,光束710和720沿着被隔开确定的距离的相同路径移动,以扫描视网膜血管的一部分。示例系统200、400、500中的任一个都可以用于执行空间分离双波束方法700。
图8例示出了另选的双光束圆形扫描系统800。双光束圆形扫描系统800包括作为基于开放空间的系统的一个OCT和作为基于光纤的系统的另一个OCT,并且代表系统400的设计的变型。具体来说,示例系统800不使用HM 412和第二XY扫描单元432,而是仅使用一个XY扫描单元820,并且替代地使用楔形棱镜850和第三镜子852来将可见光810和NIR光束812经由XY扫描单元820引导到目标840。
图9例示出了示例性双光束圆形扫描系统900。双光束圆形扫描系统900包括两个基于光纤的OCT,并且代表系统500的设计的变型。具体来说,示例系统900不使用HM 516和第二XY扫描单元538,而是仅使用一个XY扫描单元920,并且替代地使用楔形棱镜950和第三镜子952来将可见光910和NIR光束912经由XY扫描单元920引导到目标940。
图10(a)至图10(d)示出了使用可见光OCT从对象的眼睛无创地获取的示例性sO2信息。图10(a)以反向对比的灰度显示眼底图像。明亮的血管结构对应于血液中的强光学衰减。
为了比较,将3D OCT体积分段并用于投射平均强度。图10(b)例示出了所获得的相对于眼睛的微脉管系统的增强的对比。此外,可以量化主要脉管中的平均sO2值,获得如图10(b)所示的sO2伪色图叠加。
在图10(a)的示例中,在视盘周围采用圆形扫描图案(例如,利用4096A线)来对眼睛中的所有主要血管进行取样。图10(c)表示展开成B扫描图像的图10(a)的圆形扫描,其中脉管指数对应于图10(a)中的圆形扫描上的数字。各个脉管中的sO2值在图10(d)中示出。在彩色图像中,红色和蓝色可分别标记动脉和静脉。
图11(a)至图11(g)示出了通过双扫描NIR光OCT获得的示例性血流速率和流量测量信息。图11(a)示出了光谱域光学相干断层成像(SD-OCT)的示例性视网膜眼底图像。白色环表示进行双光束激光扫描的位置,每对包括一个大圆扫描和一个小圆扫描。图11(b)示出了样品幅度SDOCT图像。图11(c)示出了图11(b)的对应相位SD-OCT图像。
图11(d)表示血管的多普勒角。图11(d)的上部示出了一个样品脉管的多普勒角(在图11(c)中的黑色虚线内所表示的)。图11(d)的下部提供了8对数据的多普勒角的统计结果。
图11(e)提供了样品脉管内(例如,在图11(c)中的黑色虚线正方形内)的血流速率的分析。图11(e)的上部示出了整个样品脉管的速率分布。图11(e)的下部示出了沿图11(e)中的虚线所表示的方向的横向速率分布。在图11(e)的示例中,通过二次函数拟合原始数据。
图11(f)示出了在8对数据中12个视网膜脉管的血流速率的示例性统计结果。图11(g)示出了在8对数据的视网膜静脉和动脉中的血流量的示例性统计结果。在图11(g)的示例中,每个条为200μm。
因此,某些示例基于描述来自全血的散射和吸收以及血管散射的综合分析模型,通过vis-OCT提供体内视网膜血氧定量法。氧消耗基于血流速率和基于用可见光和NIR光的同时扫描的氧饱和率(sO2)的变化。然后可以导出视网膜代谢速率。某些示例提供参数测量,而不是估计。某些示例提供与目标视网膜相关联的血管中的总血流量和/或局部血流量。
微脉管系统可视化1322还可以基于体积数据集和先前计算的表面形貌来确定。根据3D体积数据集(例如,距离视网膜表面150至200!Jm深)切割板,并且从所述板生成2D平均强度投影图。接着,用径向圆盘图案(例如,3个像素)执行形态学闭合以获得不均匀强度背景。然后,通过该背景对2D平均强度投影图进行标准化,以增强与微脉管系统的对比度。
IV、医学应用
在各种示例中,一个或更多个fOCT图像可以提供可以根据其来进行诊断和/或评估的数据。在一些示例中,这样的测定可涉及生物组织结构、脉管系统和/或微循环。例如,在一些示例中,生物组织的3D体内成像以及量化通过其中各个脉管的血流量可用于理解许多疾病发展和治疗之后的机理,包括例如缺血、变性、创伤、癫痫发作和各种其它神经疾病。在其它示例中,本文所公开的OCT图像和技术可用于识别癌症、肿瘤、痴呆和眼科疾病/病症(包括例如青光眼、糖尿病性视网膜病变、年龄相关性黄斑变性)。此外,在各种示例中,如本文所公开的OCT技术可用于内窥镜成像或其它内部医学应用。在一些示例中,fOCT可用于分级治疗方案,诸如个性化或定制患者治疗特定治疗方案。在一些示例中,fOCT可用作针对一种或更多种药物的伴随诊断。在一些示例中,fOCT还可用于在监测疾病期间评估药物治疗的功效。在一些示例中,fOCT还可用于在药物开发期间筛选药物功效。前述诊断和/或评估的例示性示例是示例性的,并因此本发明的示例不限于所讨论的示例。
A、fOCT和医疗决策
在一些示例中,fOCT可用于提供医疗决策。在一些示例中,医疗决策可以包括但不限于治疗步骤、诊断、监测、随访、评估、诊断确认、预后、为患者选择药物、将药物治疗改变为另一种药物、停止药物治疗、改变治疗或药物剂量、增加或减少治疗或药物施用的频率、或建议进一步评估。在一些示例中,医疗决策可以是外科工具或外科手术的指导。在一些示例中,医疗决策可以是布置一个或更多个医疗器械或工具,诸如布置支架或布置缝合线。在一些示例中,医疗决策可以是在切除肿瘤时确定手术切缘。
B、分子标志物、造影剂和体液
在一些示例中,fOCT可用于检测或量化可能与疾病相关联的多种分子标志物。本文所定义的术语分子标志物包括但不限于可能需要跟踪其分布或识别的分子或生物分子、全细胞或商业上重要的基质(substrate)。分子和生物分子包括核酸、肽、蛋白质、寡糖、脂质、抗原和小分子。商业上重要的基质包括但不限于有机和无机聚合物、小分子或化学部分(chemical moieties)或由其制成的产物。在一些示例中,分子标志物可包括但不限于氧、血红蛋白、氧合血红蛋白、脱氧血红蛋白、葡萄糖、糖、血尿素氮、乳酸盐、血细胞比容、生物标志物以及核酸。
在一些示例中,一种或更多种造影剂可以与本公开的装置、方法和系统结合使用。通常,本公开提供目标中流体的流速以及一种或更多种分析物的浓度的量化,其中至少一种分析物不与外源试剂相接触。在其它示例中,可以包括造影剂或标签以除了对流体的流速以及未与造影剂或标记物接触的一种或更多种分析物的浓度的量化之外,或者与对流体的流速以及未与造影剂或标签接触的一种或更多种分析物的浓度的量化相结合,量化一种或更多种分析物。
本领域已知,许多类型的造影剂和标签可用于检测和量化不同的分析物。在一些示例中,造影剂、外源试剂可以是可以提供光谱信号以使得通过OCT能够扫描和量化分析物或流速的任何合适的化学制品、部分(moiety)或分子。在一些示例中,造影剂或标签可以包括化学连接的部分、配体、抗体、小分子、有机分子、放射性探针、核酸等。
在一些示例中,可以在一种或更多种体液中测定一种或更多种分子标志物的浓度。一般来说,任何体液都可适于用fOCT成像。在一些示例中,体液可包括但不限于全血、血浆、血清、尿、精液、眼泪、汗液、唾液、淋巴液、胸腔积液、腹膜液、脑膜液、羊水、腺体液、脊髓液、结膜液、玻璃体、水、阴道液、胆汁、粘液、唾液和脑脊液。
C、治疗决策的分级
所提供的公开的方法可以包括使用在目标中确定的一种或更多种分子标志物的状态来针对对象分级(排序)治疗选项。在一些示例中,治疗可以包括如本文所描述的任何医疗决策。在一些示例中,可基于由fOCT确定的信息对一种或更多种药物进行分级。药物治疗的分级可以基于关于分子标志物的科学信息。例如,科学信息可以是来自一个或更多个科学期刊(例如,新英格兰医学期刊(New England Journal of Medicine)(NEJM)、Lancet等)中公开的一个或多个研究的数据。科学信息可以是在商业数据库中提供的数据(例如,存储在由 Systems提供的数据库中的数据)。一个或更多个科学信息可以用于对治疗进行分级。在一些示例中,数据或科学信息可能不被公布。在一些示例中,数据或科学信息被保持在私人数据库中,并且用于跨选择的患者或患者子群的比较。
i、药物类别
药物治疗选择方案可以基于目标中的一种或更多种分子标志物的状态分成几类。例如,第一类药物治疗选择方案可以是科学信息预测药物对于其目标具有特定状态的一种或更多种分子标志物的对象将是有效的那些选择方案。这第一类的药物可以是为对象推荐的药物治疗选择方案。
第二类药物治疗选择方案可以是一些科学信息预测药物对具有特定状态的一种或更多种分子标志物的对象将是有效的那些选择方案,并且基于来自对象的样品中特定状态的一种或更多种分子标志物,一些科学信息不支持对对象使用药物。例如,样品可能包含其状态指示药物在对象中将是有效的标志物和或者可能指示药物对该对象而言还将具有毒性作用的另一种标志物(例如,指示特定疾病状态或阶段的特定代谢图谱)。
该第二类还可以包括针对药物在对象中的功效有间接科学支持的药物(例如,药物靶向与目标中分子标志物在相同的分子途径中的蛋白质)。例如,该类中的药物可靶向在VEGF的过表达变体的下游起作用的激酶,该激酶与通过fOCT确定的目标中的较高代谢速率相关。该第二类中的药物可以是为对象推荐的药物治疗选择方案。
第三类药物可以是针对该第三类药物基于来自对象的样品中的一种或更多种分子标志物的状态,科学信息指示药物在对象中将是无效的那些药物。例如,如果由fOCT成像提供的信息如果功效不相关的话,靶向细胞表面受体的药物可能不显示功效。可以推荐不用该第三类中的药物治疗对象。
药物治疗选择方案可以使用基于算法的方法进行分级。确定患者样品中一种或更多种分子标志物的状态。针对与分子标志物的状态以及一种或更多种不同药物的功效相关的信息,分析关于一个或更多个对象的一个或更多个相似目标的科学文献或策展(curated)fOCT扫描的数据库。如果分子标志物的状态与药物的功效相关,则可以建议用该药物治疗该对象。如果分子标志物的状态与药物的功效不相关,则可以建议不用该药物治疗该对象。计算机和计算机可读介质可以用于对药物治疗选择方案进行分级。
可以以报告的形式提供分级药物治疗选择方案的列表。药物治疗选择方案的分级可以通过颜色编码来指示。例如,第一类药物可以用绿色进行颜色编码,第二类药物可以用黄色进行颜色编码,第三类药物可以用红色进行颜色编码。
针对对象的药物治疗选择方案的推荐可以基于疾病的阶段(例如对象的癌症,例如晚期癌症、AMD、晚期AMD)。药物治疗选择方案也可以基于其它因素进行分级,例如疾病的类型、对象的年龄、药物代谢基因(参与吸收、分布、代谢和排泄的基因)的状态、患者已接收的其它药物的功效、关于对象的临床信息以及家族病史。
在一些示例中,特定类别的药物可用于治疗。在一些示例中,当fOCT用于确定组织的代谢速率是异常血管增殖或减少的结果时,已知影响血液脉管系统的药物可能是合适的。在一些示例中,这可包括但不限于血管生成抑制剂,例如VEGF(脉管内皮生长因子)途径抑制剂、例如本文所描述的VEGF途径(pathway)抑制剂、例如VEGF抑制剂、例如小分子抑制剂、蛋白,例如融合蛋白(例如,阿柏西普(aflibercept))或针对VEGF的抗体、例如贝伐单抗(bevacizumab);或者VEGF受体抑制剂(例如VEGF受体1抑制剂或VEGF受体2抑制剂),例如小分子抑制剂、例如索拉非尼(sorafenib)、舒尼替尼(sunitinib)、帕唑帕尼(pazopanib)或布洛尼尼(brivanib)或抗VEGF受体的抗体。
B、疾病
fOCT可用于与多种疾病相关的医学决策。这些可包括神经疾病,其可包括但不限于痴呆、脑震荡、阿尔茨海默氏病、帕金森病、周围神经病、癫痫和多发性硬化。在一些示例中,这些可包括脉管疾病,包括但不限于糖尿病、外周血管疾病、中风、心血管疾病、心肌梗塞和动脉瘤。
在一些示例中,fOCT可用于为眼部疾病提供医疗决策,所述眼部疾病可包括但不限于常染色体性视网膜色素变性、常染色体显性白点状视网膜炎(autosomal dominant retinitis punctual albescens)、中心凹蝶形色素上皮营养不良(butterfly-shaped pigment dystrophy of the fovea)、成人型卵黄性黄斑营养不良、诺里氏病(Norrie's disease)、蓝色锥体性全色盲、无脉络膜症(choroideremia)、回旋形萎缩、年龄相关性黄斑变性、视网膜母细胞瘤、前和后葡萄膜炎、视网膜血管疾病、白内障、角膜营养不良、视网膜脱离、虹膜变性和萎缩以及糖尿病性视网膜病变、单纯疱疹病毒感染、巨细胞病毒、过敏性结膜炎、干眼症、溶酶体贮积病、糖原贮积病、胶原蛋白病(disorders of collagen)、糖胺聚糖和蛋白聚糖疾病(disorders of glycosaminoglycans and proteoglycans)、括约肌脂质沉积(sphinogolipodoses)、粘脂脂症、氨基酸代谢障碍、甲状腺功能障碍性眼病(dysthyroid eye diseases)、前角膜和后角膜营养不良、视网膜感光器障碍、角膜溃疡以及眼伤口。
在一些示例中,fOCT可用于与癌症相关的医疗决策,例如急性骨髓性白血病;膀胱癌,包括上尿路肿瘤和前列腺的尿路上皮癌;骨癌,包括软骨肉瘤、尤文氏肉瘤和骨肉瘤;乳腺癌,包括非侵入性、侵入性、叶状肿瘤、佩吉特氏病(Paget's disease)和妊娠期乳腺癌;中枢神经系统癌、成人低级浸润性上皮内星形细胞瘤(adult low-grade infiltrative supratentorial astrocytoma)/少突神经胶质瘤、成人颅内室管膜瘤、间变性星形细胞瘤/间变性少突胶质细胞瘤/多形性成胶质细胞瘤、有限的(1-3)转移性病变、多发性(>3)转移性病变、癌性淋巴瘤性脑膜炎、非免疫抑制原发性CNS淋巴瘤和转移性脊柱肿瘤;宫颈癌;慢性粒细胞白血病(CML);结肠癌、直肠癌、肛门癌;食道癌;胃部(胃)癌;头颈部癌,包括筛窦瘤、上颌窦肿瘤、唾液腺肿瘤、唇癌、口腔癌、口咽癌、下咽癌、隐匿性原发癌、声门性喉癌、声门上型喉癌、鼻咽癌和晚期头颈癌;肝胆癌,包括肝细胞癌、胆囊癌、肝内胆管癌和肝外胆管癌;霍奇金病/淋巴瘤;肾癌;黑素瘤;多发性骨髓瘤、系统性轻链淀粉样变性、瓦尔登斯特伦氏巨球蛋白血症(Waldenstrom's macroglobulinemia);骨髓增生异常综合征;神经内分泌肿瘤,包括多发性内分泌瘤(1型)、多发性内分泌瘤(2型)、类癌瘤、胰岛细胞瘤、嗜铬细胞瘤、低分化/小细胞/非典型肺类癌;非霍奇金淋巴瘤,包括慢性淋巴细胞性白血病/小淋巴细胞性淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤、套细胞淋巴瘤、弥漫性大B细胞淋巴瘤、伯基特淋巴瘤、成淋巴细胞淋巴瘤、AIDS相关B细胞淋巴瘤、外周T细胞淋巴瘤和蕈样真菌病/Sézary综合征;非黑素瘤皮肤癌,包括基底和鳞状细胞皮肤癌、隆突皮肤纤维肉瘤、梅克尔细胞癌;非小细胞肺癌(NSCLC),包括胸腺恶性肿瘤;隐匿的主卵巢癌,包括上皮性卵巢癌、边缘性上皮性卵巢癌(低恶性潜能)和较不常见的卵巢组织学;胰腺腺癌;前列腺癌;小细胞肺癌和肺神经内分泌肿瘤;软组织肉瘤,包括软组织末端、腹膜后、腹内肉瘤和硬纤维瘤;睾丸癌;胸腺恶性肿瘤,包括甲状腺癌,结节评估、乳头状癌、滤泡癌、Hürthle细胞肿瘤、髓样癌和退行性癌;子宫肿瘤,包括子宫内膜癌和子宫肉瘤。
药物筛选和开发的方法
所提供的本公开的装置、方法和系统还可以包括用于研究药物对样品或测试对象的功效的装置。通常,fOCT的装置和方法可以用于药物的平台筛选,药物可以包括生物制剂或小分子。在一些示例中,fOCT可用于确定潜在药物目标的功效,其可被设计为增加或减少目标中的特定分子标志物或分析物。例如,如果筛选用于视网膜中的VEGF抑制剂,则fOCT可用于评估候选分子的潜在功效、毒性和剂量。
在一些示例中,样品可以包括体外培养的组织移植物、收获的移植物(例如来自尸体或人工生长的组织)。在一些示例中,测试对象可以包括动物或转基因的生物体。在一些示例中,转基因的生物体可展现一种或更多种测试药物功效的疾病状态或症状。所提供的方法还可以包括对FDA批准的脱标标记药物、实验药物、治疗方案或药物试剂的高通量筛选。
V、用于fOCT的软件和计算机系统
在各种示例中,某些方法和系统可以进一步包括计算机系统上的软件程序及其使用。因此,用于诸如激光系统操作、流体控制功能和/或数据获取步骤的系统功能的同步的计算机化控制在本发明的范围内。计算机系统可以被编程为控制将样品输送到检测系统的定时和协调,以及控制用于将所选样品转移到不同流路中的机构。在本发明的一些示例中,计算机还可以被编程为存储从检测系统接收到的数据和/或处理数据以供后续分析和显示。
图25中所例示的计算机系统2500可以被理解为可以从媒体2511和/或网络端口2505读取指令的逻辑设备,其可以可选地连接到具有固定媒体2512的服务器2509。如图25所示的系统可以包括CPU 2501、磁盘驱动器2503、诸如键盘2515和/或鼠标2516的可选输入装置以及可选的监视器2507。数据通信可以通过指示的通信介质实现到本地或远程位置处的服务器。通信介质可以包括发送和/或接收数据的任何装置。例如,通信介质可以是网络连接、无线连接或因特网连接。这种连接可以提供通过万维网的通信。可以想象,可以通过这样的网络或连接来发送与本公开相关的数据,以便由用户方(party)2522接收和/或审查,如图25所示。
图29是例示出可以结合本发明的示例性示例使用的计算机系统100的第一示例性架构的框图。如图29所示,示例计算机系统可以包括用于处理指令的处理器102。处理器的非限制性示例包括:Intel XeonTM处理器、AMD OpteronTM处理器、三星32位RISC ARM 1176JZ(F)-S vl.OTM处理器、ARM Cortex-A8三星S5PC100TM处理器、ARM Cortex-A8苹果A4TM处理器、Marvell PXA 930TM处理器或功能等效的处理器。多个执行线程可以用于并行处理。在一些示例中,还可以使用多个处理器或具有多个核的处理器,无论是在单个计算机系统中、在集群中的,还是在通过包括多个计算机、蜂窝电话和/或个人数据助理装置的网络的分布式系统(distributed across systems)中。
如图29所例示,高速缓存104可以连接到处理器102或并入处理器102中,以为被处理器102最近或频繁使用的指令或数据提供高速存储器。处理器102通过处理器总线108连接到北桥106。北桥106通过存储器总线112连接到随机存取存储器(RAM)110,并且管理由处理器102对RAM 110的访问。北桥106还通过芯片组总线116连接到南桥114。南桥114进而连接到外围总线118。外围总线可以是例如PCI、PCI-X、串行总线(PCI Express)或其它外围总线。北桥和南桥通常被称为处理器芯片组,并且管理处理器、RAM和外围总线118上的外围组件之间的数据传输。在一些另选架构中,北桥的功能可以并入处理器中,而不是使用单独的北桥芯片。
在一些示例中,系统100可以包括附接到外围总线118的加速器卡122。加速器可以包括现场可编程门阵列(FPGA)或用于加速某些处理的其它硬件。例如,加速器可以用于自适应数据重构或者用于评估在扩展集处理中使用的代数表达式。
软件和数据存储在外部存储器124中,并且可以被加载到RAM 2910和/或高速缓存104中以供处理器使用。系统100包括用于管理系统资源的操作系统;操作系统的非限制性示例包括:Linux、WindowsTM、MACOSTM、BlackBerry OSTM、iOSTM和其它功能等效的操作系统,以及在操作系统之上运行的、用于根据当前公开的技术的示例性示例来管理数据存储和优化的应用软件。
在该示例中,系统100还包括连接到外围总线用于提供到外部存储器(诸如网络附加存储器(NAS)和可用于分布式并行处理的其它计算机系统)的网络接口的网络接口卡(NIC)120和121。
图30是示出具有多个计算机系统3002a和3002b、多个蜂窝电话和个人数据助理3002c、以及网络附加存储器(NAS)3004a和3004b的网络3000的图。在示例性示例中,系统3002a、3002b和3002c可以管理数据存储并且优化对存储在网络附加存储器(NAS)3004a和3004b中的数据的数据访问。数学模型可以用于数据并且可以使用跨计算机系统3002a和3002b以及蜂窝电话和个人数据助理系统3002c的分布式并行处理来进行评估。计算机系统3002a和3002b以及蜂窝电话和个人数据助理系统3002c还可以为存储在网络附加存储器(NAS)3004a和3004b中的数据的自适应数据重构提供并行处理。图30仅例示出了一个示例,并且各种各样的其它计算机架构和系统可以结合当前公开的技术的各种示例来使用。例如,刀片式服务器可以用于提供并行处理。处理器刀片可以通过背板连接以提供并行处理。存储器还可以通过单独的网络接口连接到背板或作为网络附加存储器(NAS)。
在一些示例性示例中,处理器可以通过网络接口、背板或用于由其它处理器进行并行处理的其它连接器来维护单独的存储器空间并传输数据。在其它示例中,处理器中的一些或全部可以使用共享虚拟地址存储空间。
图31是根据示例性fOCT设备使用共享虚拟地址存储空间的多处理器计算机系统302的框图。该系统包括可以访问共享存储器子系统304的多个处理器302a-302f。该系统在存储器子系统304中并入多个可编程硬件存储器算法处理器(MAP)306a-306f。每个MAP 306a-306f可以包括存储器308a-308f和一个或更多个现场可编程门阵列(FPGA)310a-310f。MAP提供可配置的功能单元,并且可以向FPGA310a-310f提供特定的算法或算法的部分,以便与相应的处理器紧密协作地进行处理。例如,MAP可以用于评估关于数据模型的代数表达式,以及在示例性示例中执行自适应数据重构。在该示例中,为了这些目的,每个MAP都可由所有处理器全局访问。在一种配置中,各个MAP可以使用直接存储器访问(DMA)来访问相关联的存储器308a-308f,从而使其能够独立于相应的微处理器302a-302f(并且与其异步地)执行任务。在该配置中,MAP可以将结果直接馈送到另一MAP以用于流水线和算法的并行执行。
上述计算机架构和系统仅是示例,并且各种其它计算机、蜂窝电话和个人数据助理架构和系统可结合示例性示例使用,所述示例性示例包括使用通用处理器、协处理器、FPGA和其它可编程逻辑器件、片上系统(SOC)、专用集成电路(ASIC)以及其它处理和逻辑元件的任意组合的系统。在一些示例中,计算机系统的全部或部分可以以软件或硬件来实现。任何种类的数据存储介质都可以结合示例性示例使用,包括随机存取存储器、硬盘驱动器、闪存、磁带驱动器、磁盘阵列、网络附加存储器(NAS)以及其它本地或分布式数据存储装置和系统。
在示例性示例中,计算机系统可以使用在上述或其它计算机架构和系统中的任一个上执行的软件模块来实现。在其它示例中,系统的功能可以部分地或完全地以固件、诸如图31中所示的现场可编程门阵列(FPGA)的、可编程逻辑器件、片上系统(SOC)、专用集成电路(ASIC)或其它处理和逻辑元件来实现。例如,可以通过使用硬件加速器卡(诸如图29中所示的加速器卡122)利用硬件加速来实现设置处理器和优化器。
VI、术语
本文所使用的术语仅是用来描述特定的示例,并非旨在限制本公开的装置。如本文所使用的,除非上下文明确指出,否则单数形式“一(a)”、“一个(an)”和“该”旨在也包括其复数形式。此外,就在详细描述和/或权利要求中所使用的术语“包括”、“包括”、“具有(have)”、“具有”、“具有(with)”或其变体来说,这样的术语是意在以类似于术语“包括(comprise)”的方式包含于内。
以上参照用于例示的示例性应用描述了本公开的装置的若干方面。应当理解,阐述了许多具体细节、关系和方法以提供对设备的完全理解。然而,相关领域的普通技术人员将很容易认识到,装置可以在没有一个或更多个具体细节的情况下或者利用其它方法来实现。本公开不限于所例示出的动作或事件的顺序,因为一些动作可以以不同的顺序发生和/或与其它动作或事件同时发生。此外,并非需要所有例示出的动作或事件来实现根据本公开的方法。
范围在本文中可以表示为从“约”一个特定值,和/或到“约”另一个特定值。当表达这样的范围时,另一个示例包括从一个特定值和/或到另一个特定值。类似地,当值通过使用先行词“约”表示为近似值时,应当理解,该特定值形成另一个示例。还应当理解,范围中的每一个的端点无论是关联于另一个端点还是独立于另一个端点都是有意义的。如本文所用的术语“约”是指在特定用途的上下文内与所述数值相加或减去15%的范围。例如,约10将包括从8.5到11.5的范围。
示例
示例1
该示例描述了测量和分析OCT信号以估计全血的光学吸收特性的方法。使用描述来自全血的散射和吸收以及血管散射的综合分析模型,执行通过vis-OCT(包含可见光的fOCT)的体内视网膜血氧定量法。由于血细胞的多重光学散射而产生的包装因子也包括在该模型中。
vis-OCT血氧定量法的原理如图12所例示。从底部脉管壁反射的入射光双重通过脉管腔。反射光的光谱通过一系列短时傅里叶变换(STFT)提取,其被表示为:
I2=I02R0r exp[-2ndμHbO2(sO2)-2ndμHb(1-sO2)]
其中,I0是视网膜上的入射强度。忽略由眼晶状体和玻璃体腔引起的光学衰减,并因此源光谱取为I0;R0是参考臂反射率;n是血液的平均折射率(~1.35);d[mm]是脉管直径;r[无量纲]是脉管壁处的反射率,其散射光谱可以被建模为在一阶玻恩近似r(λ)=Aλ-a下的幂次定律,其中A是常数。光学衰减系数μ[mm-1]结合了全血的吸收系数(μa)和散射系数(μs),它们都是波长和氧合依赖性的。下标Hb和HbO2分别表示来自脱氧和氧合血液的贡献。通过取自然对数和插入上面的表达式,方程1变为
然后可以执行最小二乘法(LS)拟合来拟合光谱并获得sO2、a和ln(AR0)。11的光谱等于μ=μa+Wμs,其中W是对散射光谱加权的血细胞包装因子。
在该示例中,设置由利用超连续谱源(SuperK、NKT光子学)实现的图1的自由空间光谱域OCT系统组成。光谱范围以585nm为中心,具有85-nm FWHM带宽。理论轴向分辨率在空气中为1.5μm,测量为1.7μm。在自制的(home-made)光谱仪中使用2k像素线扫描CCD(Aviiva、SM2、e2v)。A线速率为24kHz。为了获取由256×256个A线组成的3D图像,获取时间为2.7s。对于体内实验,使着色的大鼠成像(Long Evans大鼠,500g,Harlan实验室)。
vis-OCT数据用以下步骤执行。首先通过源光谱对原始光谱进行归一化,并减去DC分量。在获取3D图像之后,通过平均强度投影获得眼底图像,并且数字地识别每条血管的中心线。最后,通过具有高斯窗尺寸kw=0.32μm-1(在585nm处17nm)的STFT,沿着中心线从底部脉管壁提取OCT光谱,将轴向分辨率(在空气中)放松至~8.9μm。对来自每个脉管的光谱进行平均以进行鲁棒估计,并且对光谱从540nm到610nm应用LS以取得sO2。
观察血液光学散射和血细胞包装因子如何影响μ的光谱。根据Kramers-Kronig关系,血红蛋白的吸收影响血液光学散射,并因此导致依赖氧合的光学散射光谱。如前所述,由氧合和脱氧血液计算μa和μs的光谱,其中血浆折射率设定为1.35。此外,由于密集血细胞的多重散射效应,全血中的散射系数通过包装因子W(01W11)加权。将表达式更正为μ=μa+Wμs,其中W取决于全血中红细胞的体积分数(血细胞比容)H。因此,μ的光谱是W的函数。随着包装因子的增加,μ的光谱红移并且整个光谱形状也发生改变。W的值从0到1变化,并进行LS拟合,同时绘制来自主动脉和静脉的sO2的平均值和标准偏差。还计算了每个脉管的相对于LS拟合的平均光谱残差。动脉和静脉的所有平均残差被平均(图10)。当W=0.2时,来自动脉和静脉二者的计算出的氧合的变化(误差条)达到它们的最小值以及拟合残差。从动脉和静脉(图11中的3号和6号)获得拟合并取样。当W=0.2时,圆柱粒子模型中的血细胞比容计算为35%,球形粒子模型中的血细胞比容计算为30%。图11示出了vis-OCT血氧定量法的体内结果。在反向对比中以灰度显示OCT眼底图像(图11)。明亮的血管结构对应于血液中的强光学衰减。作为比较,我们从深度范围160-250μm(对应于到RPE层的IS/OS连接点)将3D OCT体积分段并预计(project)平均强度。作为结果,来自微脉管系统的对比度增强(图16)。此外,在图16中,主脉管中的平均sO2值被量化,并且sO2的伪色图被覆盖。使用具有4096个A线的围绕视盘的圆形扫描图案(图16中的圆圈),使得可以对所有主要脉管进行采样。我们将圆形扫描扩展为B扫描图像,其中脉管指数对应于图18中的数字。利用红色和蓝色标记的动脉和静脉给出各个脉管中的sO2的值(图17)。平均来说,来自动脉和静脉的sO2分别为95±3%和72±7%。来自静脉的标准偏差高于动脉,这主要是由μ的平坦光谱造成的。交替的动脉和静脉图案可以通过脉管的尺寸来确认(即动脉由于其收缩性而具有比静脉更小的直径)。
本文所提出的算法和模型基于以下事实:底部血管壁可以以高信噪比(SNR)来成像。在当前的示例中,利用具有直径在30μm至130μm之间的脉管中的计算,实现了对于sO 2的足够的SNR。
示例2
该示例证明可见光光学相干断层成像(vis-OCT)可以通过并行测量血流量和来自视网膜循环的sO2来量化体内rMRO2。3D成像能力使得vis-OCT尤其能够从血管中恢复光谱并消除来自其它视网膜层的混杂信号。通过将sO2测量与OCT流量测量相结合获得rMRO2。在体外和体内验证血流和sO2测量。作为原理的验证,我们调查了对进行性缺氧挑战的代谢反应以及缺氧期间视网膜与脉络膜循环之间的平衡的变化。实验结果通过氧扩散模型进行交叉验证,所述模型来源于使用微电极对大鼠外视网膜中的氧张力分布的直接测量。
使大鼠视网膜的3D结构成像,并使用vis-OCT量化rMRO2(图22)。聚焦的宽带激光扫描视网膜以提供横向(x,y)辨别。通过所例示光与参考光之间的干涉重建深度(z)(A线)处的反射率。每个3D测量(x,y,z中的2.8mm×2.8mm×1mm)以98fps的帧速率仅需要几秒(通常为2.5s),允许用高时间分辨率监测rMRO2。为了量化rMRO2(每单位时间消耗的氧气的气体体积,mL/min),从视网膜循环测量两个参数:总视网膜血流量F[JlL/min]和相对sO2[百分比]。根据以下方程计算rMRO2:
其中CHb是血红蛋白浓度[g/JlL],并且1.34是血红蛋白的氧结合能力[mL/g]。下标a和v表示动脉和静脉sO2。如本文所述,血流是横截面脉管面积(s)和速率(v)的乘积,其中s是根据断层扫描图像计算的,v是基于来自移动血细胞的相位变化测量的。sO2的对比度来自相对于氧合血红蛋白和脱氧血红蛋白不同的吸收光谱。通过拟合从血管提取的血液光谱,计算总血红蛋白中氧合血红蛋白的百分比(按照定义为sO2)。
由于在可见光范围内血液的强衰减,当光通过时,在脉管下方投射阴影。在深视网膜中使用正前(en face)切片作为屏幕以捕获该“阴影效应”并产生微脉管系统的2D“印迹”。大的视网膜脉管以及毛细管网络的细节被清楚地可视化。该方法不需要如先前报告的高密度扫描方案,但是其却提供了鲁棒的无标签的微血管造影术。
为了测试sO2和血流量测量的精确度,进行体外流量校准,其中通过注射泵将浑浊水溶液(1%脂肪内脂)泵送通过毛细管,然后针对泵流量设置校准vis-OCT流量测量。对于sO2,具有受控的sO2的牛全血流过毛细管,并且将vis-OCT sO2量化与源自血液分析仪读数的结果进行比较。针对速率和sO2测量,精确度分别在0.25f.l/min和4%内。
为了完成体内流量测量,在视盘(ONH)周围采用双圆扫描图案。因为视网膜血管从ONH径向延伸,所以每个圆圈都穿过所有动脉和静脉,并且使得能够捕获全部视网膜血流量(图21)。在两个圆形扫描之间的脉管的位移为绝对流量提供脉管的方向性。以70kHz的A线速率进行八个双圆扫描。高速扫描使得能够捕获血流的脉动分布(profile)(图21)。参考同步EKG记录以提供心动周期的时间。来自动脉的脉动流动图案与EKG分布良好地吻合,在流与QRS复合波的峰值之间具有轻微的延迟(~0.1s)。这种延迟是由房室结放电序列、心室收缩以及从心脏到头部的压力传播所花费的时间造成的。进行脉动图谱的傅里叶变换,并且来自所有动脉流的不同峰值一致,表明心率为4.36s-1。基于针对每个脉管的八个双圆扫描的流量读数被平均并且总计为总的动脉和静脉流量。来自动脉和静脉血管的总血流量在测量精确度内(从5只大鼠平均为±0.38f.L/min)。
为了验证向内和向外血流量的一致性,以6-8JLL/min(n=5只大鼠)计算总平均血流量的值,其与使用相同麻醉方案报告的数据良好地一致。
两个实验方案被用于检查我们的体内sO2测量的精确度。在第一方案中,吸入空气中的氧含量在几个步骤中从21%逐渐变为10%。每次调整后,允许动物适应改变的空气并再稳定~2分钟。通过附接到大鼠后腿的脉搏血氧计监测系统性外周动脉氧合(spO2)。在每次吸入条件下,通过vis-OCT测量动脉sO2,并将其与脉搏血氧计spO2读数的平均值进行比较(图23)。线性相关(R2=0.839)建立了我们的sO2测量对血氧变化的响应性。在第二个方案中,吸入氧从21%变为100%,然后从21%变为10%(图23)。动脉sO2从21%到100%大致不变,但在10%氧气时显着降低(在21%氧气时为0.95±0.02,在100%氧气时为0.95±0.01,在恢复21%时为0.96±0.01,并且在10%氧气时为0.59±0.03);另一方面,静脉sO2随变化的氧含量而变化(在21%氧气时为0.75±0.03,在100%氧气时为0.86±0.01,在恢复21%时为0.74±0.02,并且在10%氧气时为0.48±0.01)。
任何纵向研究的关键因素是随时间重复的测量的稳定性。为了测试重复性,进行时间进程实验,其中在两周的时间跨度内对同一对象进行五次测量。五次测量的各种参数的标准偏差均在平均值的11%内(针对动脉sO2为7.4%,针对静脉sO2为6.4%,针对血流量为9%,并且针对rMRO2为11%)。
已表征了血流量和sO2测量的精确度,研究了系统性氧张力及其如何在缺氧期间影响rMRO2。虽然先前的研究已经显示在低氧供应下的血液动力学(增加的视网膜血流量)和血管变化(增加的血管直径),但是从未报告过关于内部视网膜氧消耗如何对有限的氧供应做出反应的全面观察。此外,视网膜循环在光适应条件下向外部视网膜提供非常少的氧,但是在缺氧期间如何变化未知。
观察缺氧条件下的视网膜脉管变化(图22)。在缺氧期间主动脉和静脉扩张。针对动脉,平均脉管直径增加~35%(常氧期间为59.7±1.5f.m,缺氧期间为80.8±2.0f.m),并且针对静脉,平均脉管直径增加~16%(常氧期间为77.4±2.0f.m,缺氧期间为90.2±2.3f.m)。在常氧中,动脉由于收缩性脉管紧张度而弯曲;在缺氧情况下,直的动脉表示脉管平滑肌松弛。此外,也可以在较小的小动脉中观察到扩张(图22),这允许更多的血流量进入外部网状层(OPL)中的深视网膜毛细血管网。
为了逐步跟踪自动调节反应,进行“步降(step-down)”缺氧挑战方案,其中吸入氧含量在六个步骤中(21%19%、16%、14%、11%和9%)从21%(常氧)降低到9%(缺氧)(图23)。在各个步骤进行测量,并且量化sO2、血流量、脉管直径和rMRO2的发展趋势(n=6只大鼠)。整个实验方案耗费不到30分钟。
如预期的,动脉和静脉sO2两者随着降低的氧而减少(图19)。静脉SO2几乎线性下降,而当氧含量低于14%时,动脉sO2下降得更快。因为氧分压(PO2)可以是对自动调节的直接刺激并且具有更多的生物学意义,所以基于具有n=2.8和P50=32.9的希耳方程(Hill's equation)定义的血红蛋白解离曲线将sO2读数转换为PO2。对于动脉和静脉,平均PO2分别为106.5±6.6和45.5±1.8mmHg,并且9%的吸入O2的情况下几乎线性地下降到36.8±1.5和26.3±0.9mmHg。动静脉sO2差异表现出当动脉PO2高于65mmHg时稍微增加并且之后迅速减少的两段式图案。当检查时,脉管直径与动脉PO2的发展趋势也具有类似的两段式图案,其中在严重缺氧期间扩张变得更明显。脉管扩张的结果是脉管阻力的减小,这允许更多的血流量(图23)。增加的血流量补偿了saO2的缺乏,并且通过动脉血管的总氧输送(由1.34×Fartery X saO2定义)得以维持(斜率=-0.0028)。氧摄取指数(由动静脉sO2差异相对于动脉sO2的比率定义)增加,表明视网膜在缺氧条件下更有效地摄取氧。最后,来自视网膜循环的视网膜的氧消耗也随着动脉PO2的减少而增加(图23)。图中23的斜率明显不为零(分别为P=0.033、0.001和<0.001),其中散布主要由各动物的数据的垂直偏移贡献,每个动物的斜率呈现相同的趋势(在图23i的插图中示出)。
vis-OCT用于精确测量rMRO2并可视化微脉管系统。该方法使得能够以高时间分辨率通过其氧消耗来监测视网膜功能。以高精度测量rMRO2对系统性PO2变化的反应和所观察到的在缺氧条件下来自视网膜循环的增加的氧消耗。
缺氧期间增加的氧摄取可能是当来自脉络膜循环的氧供应下降时从视网膜循环到外部视网膜的增加的氧供应的结果。视网膜与脉络膜循环之间的平衡在缺氧期间可能不具有主动补偿;而是,它可以由两种循环响应于氧缺乏而表现的不同方式产生。脉络膜循环具有小的动静脉sO2差异和很少的自动调节反应,而视网膜循环具有大的动静脉sO2差异并且被良好地调节。当系统性PO2降低时,来自脉络膜血管层(chorioicapillaris)的氧供应下降,减少感光体周围的PO2,并增加梯度以将氧从OPL中的视网膜毛细血管推向感光体(图24)。为了确定这种平衡机制是否可以量化地解释从视网膜循环增加的氧摄取,我们进行了模拟。
外部视网膜是无血管的,其氧供应仅依赖于扩散。在解剖学上,外部视网膜可以进一步分为三层(图24)。从脉络膜侧,它们是感光体外段(OS,层1)、感光体内段(IS,层2)和外核层(ONL,层3)。通过在各种哺乳动物物种(包括大鼠)中的微电极测量来表征穿过外部视网膜的视网膜氧分布(图19)。PO2在脉络膜处最大,并且朝向其中消耗氧的感光体的内段以陡峭的梯度下降。在外核层中,PO2还表现出朝向感光体的内段的梯度。该氧分布可以通过基于菲克第二定律的一维三层扩散模型来建模,
其中Q是通过组织重量[ml·min-1·100g-1]标准化的氧消耗,D是氧的扩散率[1.97e-5cm2/s],k是氧的溶解度[2.4ml O2/(ml视网膜·mmHg)],P是P O2[mmHg],以及x是距脉络膜的距离。通过将扩散模型拟合到测量的P O2曲线,已经表征了在光适应下外视网膜Qav中的平均耗氧量。此外,从视网膜循环提供的Qav的分数也可以在给定外部视网膜中的三层的厚度、外部视网膜的边界处的PO2值和Qav的情况下计算。使用从大鼠视网膜测量的参数值,并且假设脉络膜PO2降低,在外视网膜上模拟缺氧分布。这使得我们能够估计通过视网膜循环提供给外部视网膜的额外氧气,并将其与我们的实验数据进行比较。视网膜氧摄取随降低的动脉PO2变化在模拟和实验中分别几乎相同(斜率=-0.0020和-0.0023)。
示例3
用fOCT和vis-OCT量化rMRO2的能力可以提供对各种视网膜疾病,尤其是DR和青光眼的发病机理的有价值的洞察。关键要素是理解视网膜细胞变性与血液动力学失调之间的因果关系。例如在DR中,已知内皮和周细胞破裂发生在早期DR,但是发生的血液动力学变化不清楚。一些研究显示增加的视网膜血流量并暗示较高的血流量和高葡萄糖水平导致过度灌注,这进一步损害内皮细胞和周细胞;然而,存在矛盾的数据显示减少的血流量是糖尿病视网膜中最早的变化之一。假设是疾病早期阶段的周细胞损失减少了氧消耗,这可能矛盾地导致视网膜的增加的氧合。这可能产生相对高氧,导致血管收缩和减少的血流量。类似地,在青光眼中,存在视网膜神经节细胞及其轴突的变性。尽管在青光眼中观察到改变的血流量和脉管系统,但是它们与神经节细胞死亡的因果关系仍然是未知的。配置用于视网膜扫描的fOCT装置被设置用于诊断、监测治疗患者的各种眼科疾病。通过测量rMRO2,对代谢功能和血流量进行测量并且代谢功能和血流量与许多疾病相关,其中视网膜由于疾病或对疾病的易感性而经历氧消耗的变化。血流动力学失调与视网膜细胞变性之间的联系。随着对视网膜代谢功能的更好的理解,可以设计早期疾病检测和治疗策略的改进的方法。
示例4
在该示例中,配置有vis-OCT测量的探针被配置用于成像宫颈粘液以及与诸如HIV的感染性疾病的潜在的相互作用。尽管目前的方法使用外源物质来预防AIDS感染(例如,阴道屏障装置和抗生素),但是越来越多的研究集中在内在的AIDS防御系统上。其中,宫颈粘液作为重要的屏障。由多种糖蛋白和抗体组成的正常粘液在捕获和中和侵入的感染性微生物方面非常有效。
指示宫颈内屏障的完整性的一个关键参数是粘液厚度,这仍然是迄今为止难以监测的,部分是因为其凝胶状外观阻止通过目视检查的直接测量。在这项研究中,可见光光学相干断层成像(vis-OCT)是用横向分辨率和微米级深度分辨率来动态测量体内粘液厚度。粘液含有源自细胞碎片和不可溶物质的固有对比度,其特征性背散射图案使其区分于下层组织,使得能够实现其厚度的定量测量。Vis-OCT能够在体外可视化并进行宫颈粘液的厚度测量。此外,vis-OCT探针实现了粘液分泌和水解的实时动态监测。vis-OCT系统被成功地小型化用于可以容易地插入猕猴FRT的内窥镜探针。
构建原型内窥镜OCT探针,其可以进行线性和圆形扫描。为了实现用于原位测量的较高的穿透深度,也使用近红外(NIR)光源。内窥镜探针是基于光纤的微型尺寸的透镜-棱镜复合体。OCT探针的示意图如图26所示。使用梯度折射率(GRIN)透镜来获得光聚焦。将直角棱镜附接在GRIN透镜上以实现期望的侧视成像。透镜-棱镜复合体安装在旋转轴上,该旋转轴由步进电动机驱动以控制圆形扫描。使用机动线性平移台来将探针从近端位置移动到远端位置,从而使得能够执行3维圆柱形扫描图案。图26中的照片示出了成品原型内窥镜OCT探针的尺寸。探针的外径为大约4.5mm,其可以很容易地插入猕猴FRT中。
图27示出了使用台式OCT系统的横截面B-扫描帧画面。包括上皮和固有层(LP)的宫颈内组织结构在OCT图像中被可视化。粘液通过来自粘液表面的强烈反射和粘液内分散的细胞碎片被识别。
图27中绘制了在用PBS培养时的相对粘液厚度变化。在成像序列期间,在该过程的第一个30分钟内观察到粘液厚度几乎线性增加达到三倍的厚度。针对这些时间点,厚度的变化在统计学上是明显的(P<0.01)。粘液厚度此后达到平稳阶段。
对完整猕猴阴道管离体进行360°圆柱扫描。图28示出了整个3维体积数据集的旋转B扫描图像之一。为了更好地观察,图像被重新缩放以放大组织层,显示阴道粘膜的粗糙表面。我们还进行了高分辨率体积扫描,其覆盖45°的扫描角度(对应于1.2mm圆周)和0.8mm的纵向位移。图28示出了体积数据的B扫描之一。除了由保护性玻璃外壳所施加的压力引起的一些平坦表面之外,诸如阴道皱褶解剖结构被可视化。此外,上皮凹部中的亮的颗粒状图案表明存在阴道粘液。探针用于显示粘液流和组织完整性的动态特性,其可用于下游诊断和疾病监测目的,例如用于HIV感染。
示例5
在一个示例中,结肠镜检查探针或内窥镜针对fOCT进行调整以评估肠壁息肉的癌症。目前,各种其它成像技术与内窥镜成像结合使用;然而,该方法提供较差的灵敏度和特异性。然而,本领域已知所有癌症由于血管生成(angiogenesis)而是高度血管性的。血管生成是从既存的血管生长出新血管的过程。血管生成是肿瘤从休眠状态到恶性状态的基本步骤,其中新血管贯穿到癌性生长中并提供营养物和氧。由于血管携带血红蛋白,因此启用fOCT的探针能够提供作为血液流速和血红蛋白氧饱和度的函数的氧消耗的高度精确的测量。如本文方法所提供的,计算一种或多种息肉的代谢速率。另外,fOCT探针能够以高分辨率对息肉下面或周围的脉管系统的各个方面成像,以帮助在早期阶段确定息肉是否可能是癌前期或是癌症。本领域中通常已知癌症与正常组织相比具有增强的代谢特性,因此,与正常组织相比,癌细胞具有来自血红蛋白的更高的氧含量和更高浓度的脱氧血红蛋白。另选地,当用fOCT对潜在结肠癌息肉进行成像时,将fOCT图像和代谢速率计算与和正常组织的fOCT看起来像什么进行比较;如果增加的血管形成出现在fOCT图像中,则诊断是可能的。异常血管形成也可以表示患病组织。例如,异常血管形态可以表示血管生成和推定的结肠癌。异常血管形态将是健康结肠组织的正常脉管系统解剖结构外的任何血管形态。
示例6
癌症诊断的另一个示例包括乳腺癌。fOCT探针被配置用于针中以及用于移除乳腺癌肿瘤的外科手术工具。使用针fOCT探针,针将被放置在肿瘤的可疑区域周围的位置,以检查组织的形态和肿瘤的脉管系统。3D fOCT图像与乳房的一个或更多个区域的代谢速率信息相结合有助于外科医生确定用于切除乳腺癌肿瘤的最佳手术切缘。由于血管生成而增加的氧合血红蛋白分子可以通过由fOCT方法确定和计算的更高的代谢速率向外科医生指示。因此,当与正常乳腺组织相比较时,可以相应地猜测和诊断乳房中具有来自血红蛋白的较高氧含量和较高浓度的脱氧血红蛋白的癌细胞。另选地,当用fOCT成像乳房时,将超声图像与正常组织的fOCT图像进行比较,如果出现增加的或异常的血管形成,则诊断是可能的。
示例7
fOCT的另一示例包括用于针对具有可以通过fOCT检测的增加的血管形成的患病组织的诊断技术的配置方法和装置。当血供不足时,已知在冠状动脉疾病、外周动脉疾病和中风中出现血管生成。例如,围绕大动脉或灌注大动脉壁的血管,例如血管滋养管。这些血管围绕心脏周围的动脉。如果这些血管中有斑块,则血供应随着斑块尺寸增加而增长,并且来自这些额外血管的更多细胞移动到斑块中,使得其不稳定并且更可能破裂,导致心脏病发作和中风。已经显示血管滋养管的内皮在高胆固醇血症条件下受到干扰。这引起血管滋养管的收缩,随后缺乏氧供应。随后结果是VEGF表达将随着快速血管滋养管形成而增加。这种增加的血管形成可以通过本文描述的系统检测,以诊断易感性心肌梗死或缺血性病症。
示例8
在该示例中,fOCT被配置用于要被插入到导管中的探针,其被引导到动脉瘤的部位。fOCT探针能够连续测量代谢速率,并提供动脉瘤中和周围的血管的3D结构图像,通知外科医生在最佳安全的地方操作的位置。fOCT探针用于将一个或更多个外科器械引导到需要治疗的动脉瘤部位。
示例9
在该示例中,fOCT被配置用于用于分析大脑中的血液脉管系统的术中工具,以帮助外科医生识别异常神经活动的病灶(foci)。在治疗癫痫中,可能需要对一个或更多个癫痫病灶进行神经调节以控制癫痫症状。为了识别病灶,外科医生使用fOCT探针来识别脑中具有异常脉管系统和增加的代谢的区域,这可能与与癫痫有关联的异常神经活动相关。使用fOCT数据,外科医生识别癫痫病灶并应用治疗。
示例10
在该示例中,fOCT用于监测患有AMD的患者的治疗和预后。患者存在早期AMD的症状,包括玻璃疣的存在和视觉中的零星模糊和黑斑。医生管理FDA批准的药物和抗VEGF药物。在给药之前和之后用fOCT监测患者的视网膜。3周后,在用的情况下,观察到很少或没有效果。医生转换治疗并向患者施用另一种抗VEGF药物在施用药物之前和之后监测患者的视网膜。
- 还没有人留言评论。精彩留言会获得点赞!