改进的神经测量的制作方法
本申请要求2014年5月5日提交的澳大利亚临时专利申请号2014901639的权益,该专利通过引用结合在此。
技术领域
本申请涉及神经活动的测量,并且具体地涉及通过使用植入在神经组织附近的一个或多个电极来测量复合动作电位。
发明背景
存在一系列环境,在这些环境中期望获得由施加于神经通路的电刺激在所述神经通路上所诱发的复合动作电位(CAP)。然而,这可能会是较难的任务,因为所观察到的CAP信号一般将具有微伏范围内的最大振幅,而所施加以诱发所述CAP的刺激一般是几伏特。电极假象通常由该刺激产生,并且在整个CAP出现的时间显示若干几毫伏的衰减输出,这为分离感兴趣的CAP呈现了一个显著障碍。由于神经反应可以与刺激和/或刺激假象同时发生,所以CAP测量为放大器的设计提出一个困难的挑战。实际上,电路的许多不理想方面导致假象,并且因为这些主要具有可能具有或者正极性或者负极性的衰减指数特性,对假象来源的识别和消除会比较艰难。
已经提出了许多种方式来用于记录CAP,包括金(King)(美国专利号5,913,882)、尼加德(Nygard)(美国专利号5,785,651)和戴利(Daly)(美国专利申请号2007/0225767)的那些方式。
当诱发反应晚于假象出现的时间出现时、或当信噪比足够高时,测量它们更不困难。假象通常被限制在刺激之后的1-2ms的时间并且因此其条件是在这个时间窗之后测量神经反应,可以获得数据。这是在手术监测中的情况,其中在刺激电极和记录电极之间存在大的距离,这样使得从刺激位点到记录电极的传播时间超过2ms。然而,为了表征来自例如背柱的反应,需要高刺激电流以及电极之间非常接近,并且因此测量过程必须直接克服同时发生的假象。在深部脑刺激中可能会出现类似的考量,其中,可能期望刺激神经结构并在神经反应传播至别处之前立即测量这个结构的反应。
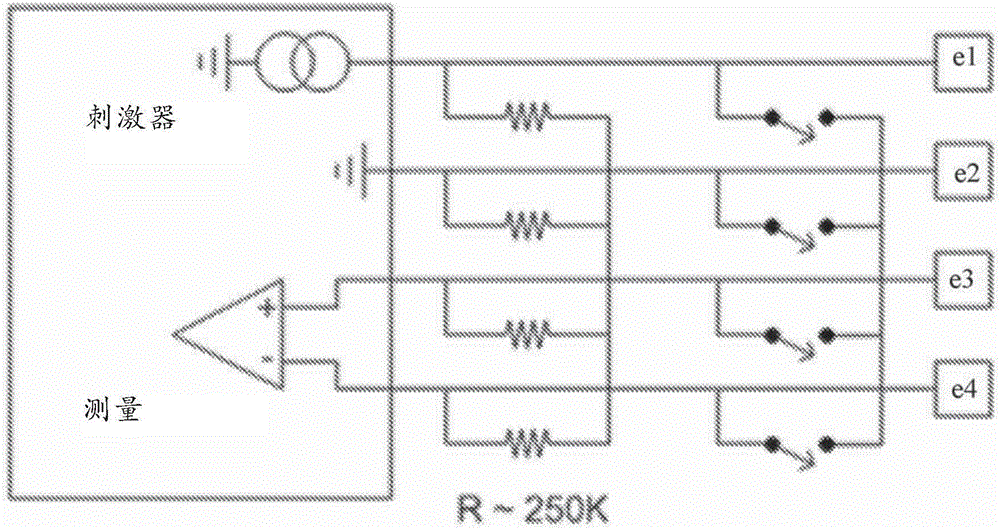
植入式电刺激设备还必须提供电荷恢复,从而保证刺激所递送的瞬态电流不引起向组织中的净DC电荷注入。一种方式是提供串联在每个电极上的电容器,从而防止向组织的DC传送,并且此类电容器通常是监管机构的要求,以便有源的可植入式设备获得市场准入。如图1中所示的另一种安排省略了电极电容器,并反而提供了开关来使刺激电极与感测电极e1-e4彼此短路从而实现刺激之间的电荷恢复,并且还提供了星形电阻器网络(每个电阻器具有在可能几百kΩ范围内的值),从而将所有的电极永久地连接在一起以便在设备上电之前使电荷平衡,如图1中所示。然而,在电极与测量放大器之间提供电极电容器或星形电阻器网络可能会引起相当大的假象效果,这可能会妨碍测量小CAP信号的尝试。
本说明书中已包括的文件、行为、材料、设备、物品等的任何讨论仅用于为本发明提供上下文的目的。不能由于它在本申请的各项权利要求的优先日期之前就存在,而承认任何或所有这些事项形成现有技术基础的一个部分,或在与本发明相关的领域中是一般常识。
贯穿本说明书,“包括(comprise)”一词或变化形式(例如“包括了(comprises)”或“包括着(comprising)”)应被理解为意指包括所陈述的要素、整体或步骤,或者多个要素、整体或步骤的群组,但不排除任何其他要素、整体或步骤,或者多个要素、整体或步骤的群组。
在本说明书中,元件可以是选项列表中的“至少一个”的陈述应被理解为所述元件可以是所列出的选项中的任意一项,或者可以是所列出的选项中的一项或多项的任何组合。
技术实现要素:
根据第一方面,本发明提供了一种用于测量对刺激的神经反应的方法,所述方法包括:
从刺激电极向神经组织施加电刺激;
强加延迟,在所述延迟过程中,所述刺激电极是开路的;以及
在所述延迟过程中,利用测量放大器来测量存在于感测电极处的神经反应信号,同时保证所述感测电极之间的阻抗足够大,使得响应于所述刺激而出现在感测电极组织界面上的电压被限制为允许对在所述感测电极处所见的神经反应电压进行评估的电平。
根据第二方面,本发明提供了一种用于测量对刺激的神经反应的可植入式设备,所述设备包括:
多个电极,所述多个电极包括一个或多个标称刺激电极以及一个或多个标称感测电极;
刺激源,所述刺激源用于提供有待从所述一个或多个刺激电极递送至神经组织以便诱发神经反应的刺激;
测量放大器,所述测量放大器用于放大在所述一个或多个感测电极处所感测到的神经反应信号,所述感测电极之间的阻抗足够大,使得响应于所述刺激而出现在感测电极组织界面上的电压被限制为允许对在所述感测电极处所见的神经反应电压进行评估的电平;以及
控制单元,所述控制单元被配置成用于控制向所述神经组织施加刺激以及对所诱发的神经反应的测量,所述控制单元被配置成用于从所述刺激电极向神经组织施加电刺激,所述控制单元被进一步配置成用于强加延迟,在所述延迟的过程中,所述刺激电极是开路的,并且所述控制单元进一步被配置成用于在所述延迟的过程中利用所述测量放大器来测量存在于所述感测电极处的神经反应信号。
应注意的是,不同实施例可以涉及具有不同强度或持续时间的刺激、具有不同几何结构和尺寸的电极、和/或刺激电极与(这些)感测电极之间的不同空间间隔。本发明认识到,了解诱发反应测量系统中的每个这种参数使得能够确定期望电压,所述期望电压将由于所递送的刺激的电学特性而出现在所述(多个)感测电极上。具体地,将所述(多个)感测电极与组织之间的界面建模成包括恒相位元件阻抗、代表电极-电解质界面电容和组织电容、以及针对所考虑的植入物的物理参数确定恒相位元件的阻抗使得能够对这个感测电极之间的阻抗加以合适的下限。
这些感测电极之间的阻抗优选地被选择为足够大,使得响应于刺激而出现在感测电极组织界面上的电压被限制为以下电平:所述电平至多比在感测电极处所见的神经反应电压大15倍,更有选地至多比在感测电极处所见的神经反应电压大5倍,更优选地至多比在感测电极处所见的神经反应电压大2倍,甚至更优选地至多与在感测电极处所见的神经反应电压一样,并且最优选地至多是在感测电极处所见的神经反应电压的一半。
一些实施例可以通过使用两个感测电极来利用神经反应的差分测量。在此类实施例中,响应于刺激而出现在感测电极组织界面上的电压应被理解为响应于刺激而出现在这两个感测电极之间的差分电压。这两个感测电极例如可以安装在单个植入的电极阵列上。替代性实施例可以利用单个感测电极和远端参考电极采取单端测量,并且在此类实施例中,响应于刺激而出现在感测电极组织界面上的电压应被理解为响应于刺激而出现在感测电极与参考电极之间的差分电压。
本发明的一些实施例进一步包括串联设置在所述感测电极与所述测量放大器之间的感测电极电容器,所述感测电极电容器被选择为具有保证响应于所述刺激而出现在所述电容器两端的电压被限制为允许对在所述感测电极处所见的所述神经反应电压进行评估的电极的电容。此类实施例从而可以使得能够改进防止DC电荷注入组织,同时尽管如此保留了神经反应测量能力。在此类实施例中,刺激电极可以具有相应的电容器,以便防止DC电荷注入,并且还允许根据需要将每个电极电学重新配置成或者刺激电极或者感测电极。
在一些实施例中,所述测量放大器的输入阻抗(Z入)被定义为:
其中
ZC是所述或每个感测电极的恒相位元件阻抗,
Vs1–Vs2是响应于所述刺激而出现在所述感测电极组织界面上的所述差分电压,并且
VE是在所述感测电极处所见的所述神经反应电压。
在此类实施例中,倘若满足了上述要求,Z入可以包括电阻和/或电容。为了给出VE在(VS1–VS2)上的足够裕量,在一些实施例中,V入可以由以下方程限定:
Z入>A x ZC(Vs1–Vs2)/VE
A是被提供用于给出VE在(VS1–VS2)上的足够裕量的标量,并且可以例如在范围2-5内。可替代地,在通过指数减法利用假象补偿的实施例中,A可以在范围0.5内或更大,同时仍然允许对神经反应的评估,并且此类实施例从而在本发明的范围内。而且,根据本申请人的澳大利亚临时专利申请号2013904519(其内容通过引用结合在此)的教导,一些实施例可以将测量结果与滤波器模板相关联,从而从测量结果提取神经反应,并且在此类实施例中,A可以在0.067的范围内或更大同时仍允许对神经反应的评估,并且此类实施例因而在本发明的范围内。
在一些实施例中,可以通过国际专利公开号WO2012155183所教导的方式执行神经反应测量,该专利的内容通过引用结合在此。
所述方法可以进一步包括:随着时间推移重复地获得神经测量结果;以及监视变化。响应于所检测到的变化,一些实施例可以提供对被传送至患者的治疗的反馈控制,比如电刺激治疗和/或药物。可以例如通过植入式药物泵或者通过产生供医生改变处方的报告来自动地控制药物。
在一些实施例中,在施加刺激之前和/或在测量神经反应之后,可以通过或者短路或者借助电容将刺激电极彼此连接来恢复刺激电极上的电荷。
在一些实施例中,在整个刺激和测量过程中,保持测量放大器连接至感测电极。在此类实施例中,测量放大器优选地是具有足够的共用模式范围以通过刺激避免饱和的宽带宽放大器。可替代地,放大器可以在自动规定状态下使用,在该状态下,在刺激之后它可以足够快速地归零以追踪神经反应。
附图说明
现在将参照以下附图对本发明的实例进行描述,在附图中:
图1展示了用于神经反应测量的现有技术方法;
图2展示了根据本发明的一个实施例的神经反应测量系统;
图3展示了利用电极电容器的发明实施例;
图4是图3的实施例的另一种图示,示出了刺激电极短路安排;
图5是可植入式设备和周围组织的驱动电路的简化模型;
图6是每个电极-组织界面处的恒相位元件的示意性等效电路;
图7是通过模拟图5的模型所产生的图表,示出了在放大器输入阻抗的各值(电容性和电阻性的两者)存在的情况下刺激之后出现的假象;
图8示出了当放大器输入电阻和电容变化时由刺激所引起的假象的试验数据点和模拟曲线;
图9分别示出了来自电阻和电容的RMS假象贡献;
图10示出了电阻和电容的假象变化;以及
图11示出了电阻和电容的RMS假象变化。
优选实施方式的说明
图2展示了根据本发明的一个实施例的神经反应测量系统。各自具有恒相位元件(CPE)阻抗ZC的两个感测电极用于检测植入物受体的神经组织中出现的神经反应信号Ve。(图4中所示)植入物的刺激电极所施加的刺激引起神经反应,但是还造成感测电极上出现刺激电压Vs1和Vs2。输入阻抗Z入存在于差分测量放大器的每个输入端处。
通过注明噪声输入与刺激电压相当并且目标是使刺激在感测电极的CPE上感生出小于所诱发的反应VE的电压(Vs1-Vs2),确定本发明的本实施例中所需的输入阻抗。结果是,期望的输入阻抗有下方程给出:
在一个实施例中,存在具有面积为14mm2、Zc=20Ω、(Vs1-Vs2)~1V、Ve=50uV的电极的脊髓刺激器(SCS),从而使得上述方程指定Z入的最小值为400kΩ。为了给出Ve在假象上的足够裕量,更期望的Z入值更大,可能在1-2MΩ范围内。在替代性实施例中,比如具有约0.1mm2电极面积的人工耳蜗植入物,作为SCS电极的面积的一小部分,需要的最小放大器输入阻抗是高出很多倍;8MΩ或者(为了足够的裕量)更优选地20MΩ,展示了图1中所选择的电阻值的难度。
图3示出了利用具有非常高Z入值的ASIC放大器的本发明实施例。电极电容器被提供用于阻止向组织进行DC插入,这些电极电容器具有值C入=5pF。由于图3的ASIC放大器在关闭期过程中自动地归零,不需要在放大器输入端添加电阻。
图4是图2的实施例的另一种图解。在所有电极上设置了电极电容器来阻止DC。这些电极电容器可以储存其自身的电荷,所述电荷进而可以在接通时产生不受控制的电流。相应地,控制模块关闭开关从而在每次刺激之前使刺激电极平衡。这些开关仅在短脉冲中关闭,从而使得平衡电流不引起植入物受体可感知的电位。可以提供在测量放大器的输入端上具有附加电阻和/或电容的类似的实施例,只要输入电阻遵守上述方程。
在图2中包括电极-组织界面的恒相位元件模型的重要性例如源于如图5中所示的驱动电路和盐水的简化模型。所述电路由以下各项组成:扩展电阻,所述扩展电阻是模拟通过整体盐水的电流的电阻器网格;恒相位元件(CPE),在所述恒相位元件中盐水与电极金属相遇;激励源,所述激励源具有包括一些杂散电容的输出阻抗;每个电极上的负载以及接地连接。盐水浴具有体电压点sBath。盐水浴用于模拟组织。在图5中,可以在e1与e2之间进行单端测量,并且可以在e2与e3之间进行差分测量。
图6中示出了CPE的等效电路。它由并联连接的一组串联RC网络组成。为了充分地模拟盐水浴,CPE可能具有20个至30个RC对,但示出了图6的简化版本以便于理解。这些RC对具有以指数方式变化的时间常量,在这种情况下以因数sqrt(10),然而,可注意到的事实是每个RC对的时间常量不同于CPE中的所有其他RC对。在刺激之后,由于电荷在电容器之间重新分布,CPE的输出电压将随着时间推移而改变,即使没有净电流流入或流出。单个并联RC网络享有这种特性,虽然CPE不具有在DC可以找到的R值。
与表现电路的相应特性的RC网络不同,CPE的响应由与刺激的时长具有类似时间常量的RC网络主导。例如,SCS可以具有在100–500μs范围内的刺激脉冲宽度。这个结果对于定义电容器的表观电导来说非常重要,如下文所讨论的。
在刺激之后,在图5的电路中存在三个机构或假象源可以被标识。对于这些机构中的每一个,负载和电流源阻抗被认为是无穷大,除非另外说明:
·电极1上的CPE上的电压发生改变。这在单端测量e2-e1中或在模拟电极e1上可见。这在差分测量中没有见到,因为这个电压是e2与e3之间的共用模式。
·如果电流源输出阻抗是有穷大,电极1CPE电压的变化导致电流流过扩展电阻。这在电极e2与e3上表现为差分的。这仅由于扩展电阻的网格本质而发生;如果用星形电阻器或单串电阻器进行模拟的话,将观察不到这种现象。
·如果任一个感应放大器的输入阻抗是有穷大,则在刺激过程中,电流将流入此负载。然后,这将稳定下来。
图5的模型预测e4上电压的能力是经过实验测试的。所有的刺激都使用4mA 400us双相脉冲。这些被用来引起假象,所述假象足够大以解决上述噪声并且在电极上具有可以在没有异常的情况下被数字化的电压。这个刺激电平每次刺激递送1.6uC,这在SCS中舒适电平刺激所需的电荷范围的上端。在99次迭代上对测量结果取平均。由于假象可以采取任一种极性的许多不同轮廓,在将DC值重置至基线之后,单次假象测量被定义为信号的V.t乘积的积分。
除了实验验证之外,还进行了图5的刺激。图7示出了刺激输出,表明刺激之后的所选择范围上的假象,其中,y轴表示RMS电压×时间,并且x轴表示导纳,其中,电容的导纳被计算为Y=C.t,其中,t是刺激脉宽。放大器上的输入阻抗被选择为或者330pF、1000pF、3300pF、330kΩ、以及100kΩ,从而引起对应的假象波形702、704、706、708、710。可注意到的是,电容和电阻引起相反极性的假象。虽然这些是简单模型,实际上,对于不同的时间常量可以存在若干假象源,从而使得可见的实际假象会比所示的简单单调递减曲线更复杂。
图8示出了实验数据点和仿真曲线两者,其中,负载电阻和电容不同。电容器的电容(等于其值除以双相脉冲的每一相的长度)是与电阻器具有同样的假象斜率的度量,并且因而优选使用图8至图11中刺激的整个长度。图8中所示的仿真线和具有正斜率的实验获得的数据点分组表现了增加电阻的效果,同时仿真线和具有负斜率的实验获得的数据点分组表现了向放大器输入阻抗添加电容的效果。电容和电阻线的斜率对所有的电极而言都非常类似,并与仿真的斜率紧密匹配,从而表示图5的模型很大程度上是正确的。这些电极具有不同的y截距。当电阻负载减小时电极1(‘r1.txt’数据点)具有700uV的峰值假象,这是非常大的假象并且必然将使约10uV的神经反应信号模糊。当不存在负载时,假象可以为正或负。这些y截距偏移不受电子设备的控制,并且必须通过比如滤波技术处理。
虽然图8的图表证实了仿真模型,它还表明,存在当没有负载时造成假象以及造成y截距偏移的失效元件。y截距偏移对每个电极不同,并且可能是创造了小原电池的每个电极表面上金属污染和双相脉冲的相位的非对称行为的结果。
图9分别示出了来自电阻和电容的仿真假象的RMS贡献。
图10示出了当电阻和电容都逐渐地变化时的假象变化。
图11使用上文所述的RMS方法示出了电阻和电容的假象变化。
在图10和图11中,曲线骤降然后上升,与图8一致。如期望的,由于DC偏移,RMS方法使得模型的基本准确度不显著。
从仿真模型中,使用上文所描述的假象的基线定义和400us脉宽,假象对电阻的敏感度是4.1×10-2V.s每姆欧(mho),并且假象对电容的敏感度是-2.85×10-2Vs每姆欧。因而,对于负载R,并且其中假象在1ms间隔上,则电压为
V(r,t)=4.1×10-2/(R×t)
因此,例如,对100KΩ的放大器输入电阻和1ms假象间隔:
V(100k,1ms)=400uV
进一步,对于电容性负载,并且其中假象在1ms间隔上,则电压为
V(C,t)=-7.14×101×C/t
因此,例如对于1000pF负载,假象在1ms上,假象=71.4uV。
使用这种假象计算方法,以下表格示出了典型的SCS中可能存在的各杂散阻抗的假象贡献。
如从上表中可见,神经测量系统中存在的此类阻抗的适当调整和控制可以允许减少大量的假象源,并使测量大约10uV的神经信号的任务易于完成。
本领域技术人员应理解,在不偏离广泛描述的本发明的精神或范围的情况下,可以对如具体实施例所示的发明做出众多的变化和/或修改。因此,本发明的这些实施例在所有方面都被视为是说明性的而不是限制性的。
- 还没有人留言评论。精彩留言会获得点赞!