用于预防或治疗以异常的成纤维细胞增殖和细胞外基质沉积为特征的疾病、病况或进程的组合物和方法与流程
相关申请的交叉引用
本申请要求2014年8月29日提交的在先的美国非临时专利申请号14/473,339的权益,其内容通过引用以其全部并入本文。
政府资助的声明
所述发明利用由小企业创新研究(smallbusinessinnovationresearch)(sbir)授予moeraematrix,llc的政府支持完成。政府具有本发明中的某些权利。
发明领域
本发明涉及细胞和分子生物学、多肽、和治疗使用方法的领域。
背景技术:
1.伤口愈合和纤维化的机制
术语“伤口愈合”是指身体修复任何其组织的创伤(尤其是由物理手段造成并且具有连续性中断的那些)的过程。
伤口愈合反应通常被描述为具有三个不同的阶段:损伤、炎症和修复。一般而言,身体利用炎性反应响应损伤,其对维持生物体的健康和完整性是至关重要的。然而,如果其出现错误,就会导致组织破坏。
阶段i:损伤
由包括但不限于自身免疫或过敏反应、环境微粒、感染或机械伤害的因素造成的损伤通常导致正常组织架构的破裂,从而启动愈合反应。受损的上皮和内皮细胞必须被替换以分别地维持屏障功能与完整性和阻止失血。对内皮细胞的急性损伤导致炎性介质的释放和抗纤维蛋白溶解凝结级联的启动,其利用血小板和富含纤维蛋白的凝块暂时地填塞受损脉管。例如,与慢性阻塞性肺病(copd)和对照患者相比,来自特发性肺纤维化(ipf)患者的肺匀浆、上皮细胞或支气管肺泡灌洗液包含更高水平的血小板-分化因子、x-盒-结合蛋白-1,这表明凝块形成反应被连续地活化。此外,凝血酶(将纤维蛋白原转化为纤维蛋白所需的丝氨酸蛋白酶)也容易在多种肺纤维化病况的肺和肺泡内空间内检测到,这进一步确认凝血途径的活化。凝血酶还可以直接地活化成纤维细胞,其增加增殖并促进成纤维细胞分化为产胶原成肌纤维细胞。对气道上皮(具体地,肺泡肺细胞)的损伤可以激发类似的抗纤维蛋白溶解级联,并且导致间质性水肿、急性炎症的区域和上皮从基底膜分离。
血小板募集、脱粒和凝块形成迅速地进展到具有增加的渗透性的血管收缩阶段,其允许外渗(白细胞从毛细血管至环绕它们的组织的移动)和直接募集白血球至损伤位点。形成在实质组织的上皮和内皮下方的细胞外基质的基底膜妨碍直接接近受损组织。为了破裂此物理屏障,锌依赖性肽链内切酶(也称为基质金属蛋白酶(mmp))裂解一种或多种细胞外基质组分,允许细胞的外渗进入和离开受损位点。具体地,mmp-2(明胶酶a,n型胶原酶)和mmp-9(明胶酶b,iv型胶原酶)裂解基底膜的两种重要的组分:n型胶原和明胶。最近的研究已经发现mmp-2和mmp-9是上调的,这突显了组织破坏和再生过程在纤维化病况中是常见的。mmp的活性受多种机制的控制,包括转录调节、酶原调节,以及mmp的具体组织抑制剂。mmp和多种抑制机制之间的平衡可以调节炎症和决定在愈合反应期间沉积的胶原的净量。
使用变应性气道炎症的模型和利用mmp-2−/−、mmp-9−/−和mmp-2−/−mmp-9−/−双敲除小鼠重构的先前的研究显示mmp-2和mmp-9是将炎性细胞从发炎组织成功地运出和清除并进入气室所必需的。在不存在这些mmp的情况下,细胞被截留在肺的实质内,并且不能够移动进入气室,其导致致命的窒息。
阶段ii:炎症
一旦已经实现对组织损伤位点的接近,趋化因子梯度募集炎性细胞。在急性损伤的位点处观察到嗜中性粒细胞、嗜酸性细胞、淋巴细胞和巨噬细胞,以及细胞碎片和被吞噬细胞清除的坏死的区域。
提供炎性细胞因子和趋化因子的嗜酸性细胞、嗜中性粒细胞、淋巴细胞和巨噬细胞的早期募集可以有助于局部的tgf-β和il-13积聚。在最初损伤和炎性细胞的波动之后,炎性细胞的晚期募集可以辅助吞噬,清除细胞碎片,和控制过量的细胞增殖,这可以共同促成正常的愈合。晚期炎症可以起抗纤维化的作用并且可以是成功地消除(resolution)伤口愈合反应所必需的。例如,除了抑制局部的趋化因子产生和tgf-β的il-10-分泌性调节t细胞之外,还富含辅助成纤维细胞清除的吞噬性巨噬细胞的晚期炎性谱(profile)可以阻止过量的成纤维细胞活化。
损伤或病原体的性质通常决定随后发生的炎性反应的特性。例如,外源性刺激如病原相关分子模式(pamp)被病原识别受体(如toll样受体和nod样受体(在炎性和凋亡反应的调节中具有各种功能的胞质蛋白))识别,并且影响先天细胞对入侵病原的应答。内源性危险信号也可以影响局部的先天细胞并编排炎性级联。
炎性反应的性质显著地影响固有组织细胞和随后发生的炎性细胞。炎性细胞自身还通过分泌趋化因子、细胞因子和生长因子传播进一步的炎症。许多细胞因子参与整个伤口愈合和纤维化反应,其中具体的基因的组在多种条件中活化。例如,哮喘患者中的慢性变应性气道疾病通常与升高的2型辅助t细胞(th2)相关细胞因子谱(包括但不限于,白介素-4(il-4)、白介素-5(il-5)、白介素-6(il-6)、白介素-13(il-13)、和白介素-9(il-9))相关联,而慢性阻塞性肺病和纤维化肺病(如特发性肺纤维化)患者更频繁地呈现促炎细胞因子谱(包括但不限于,白介素-1α(il-1α)、白介素-1β(il-1β)、白介素-6(il-6)、肿瘤坏死因子α(tnf-α)、转化生长因子β(tgf-β)、和血小板源生长因子(pdgf))。已经显示这些细胞因子中的每个展示显著的促纤维化活性,通过成纤维细胞、巨噬细胞和成肌纤维细胞的募集、活化和增殖而起作用。
阶段iii:组织修复和收缩
伤口愈合的闭合阶段由以下构成:由富含纤维蛋白(聚合以形成“网状物”的纤维状蛋白质,所述网状物形成伤口位点上方的凝块)的支架形成引导的经编排的细胞重组、伤口收缩、闭合和再上皮化(re-epithelialization)。阐明涉及此阶段的伤口修复的过程的绝大部分研究来自真皮伤口研究和体外系统。
成肌纤维细胞源胶原和平滑肌肌动蛋白(α-sma),与形成纤维蛋白支架的巨噬细胞、血小板、和成纤维细胞源纤连蛋白一起形成临时性细胞外基质。共同地,这些结构通常被称为肉芽组织。从特发性肺纤维化患者分离的原代成纤维细胞或肺泡巨噬细胞比对照成纤维细胞产生显著更多的纤连蛋白和α-sma,其指示提高的成纤维细胞活化的状态。已经报道了经历类固醇治疗的ipf患者具有与未经治疗的ipf患者相似的升高水平的巨噬细胞源纤连蛋白。因而,类似于类固醇抗性il-13-介导的成肌纤维细胞分化,巨噬细胞源纤连蛋白释放似乎也耐受类固醇治疗,这提供了为什么类固醇治疗可能无效的另一种原因。根据动物模型,纤连蛋白似乎是肺纤维化的发展所必需的,因为与它们的野生型对应物(counterpart)相比,具有纤连蛋白的额外(extra)iii型结构域(eda)的具体缺失的小鼠在博来霉素施用之后发展出显著更少的纤维化。
除纤连蛋白以外,临时性细胞外基质还由糖蛋白(比如pdgf)、糖葡胺聚糖(比如透明质酸)、蛋白多糖和弹性蛋白构成。生长因子和tgf-β-活化的成纤维细胞沿着细胞外基质网络迁移并修复伤口。在皮肤伤口内,tgf-β还诱导收缩反应,调节胶原纤维的取向。如上面讨论的,成纤维细胞至成肌纤维细胞分化还产生应力纤维和新表达的α-sma,其二者均给予成肌纤维细胞内的高收缩活性。成肌纤维细胞在被称为“纤维连接复合体(fibronexus)”或“超成熟黏着斑”的特定位点处与细胞外基质的附着将伤口拉在一起,其在收缩阶段期间减小病变的大小。细胞外基质铺设的程度和活化的成肌纤维细胞的数量决定胶原沉积量。为此,基质金属蛋白酶(mmp)对金属蛋白酶的组织抑制剂(timp)以及胶原对胶原酶的平衡贯穿反应变化,从促合成(pro-synthesis)和增加的胶原沉积移向受控的平衡,而没有胶原的净增加。对于成功的伤口愈合,这种平衡通常在成纤维细胞经历凋亡,炎症开始消退,并且肉芽组织退缩时出现,留下富含胶原的病变。炎性细胞,并且尤其是α-sma-阳性成肌纤维细胞的移除对终止胶原沉积是必不可少的。有趣地,在特发性肺纤维化患者中,尽管观察到升高水平的促凋亡和fas-信号传导分子,但成纤维细胞的移除会被延迟,并且细胞耐受凋亡信号。此对凋亡的相对抗性可以潜在地是此纤维化疾病的病因。然而,多种研究还已经在特发性肺纤维化中观察到增加比率的胶原分泌成纤维细胞和上皮细胞凋亡,这表明还有另一种平衡需要监测成纤维细胞凋亡和成纤维细胞增殖。根据皮肤研究,伤口位点的再上皮化重建屏障功能并允许包被的细胞重组。使用在胶原基质上方生长的人或大鼠上皮细胞或体内气管伤口的多种体外和体内模型已经用于鉴定细胞迁移、增殖、和细胞扩散的显著阶段。迅速的和动态的机动性和增殖,以及从裸露区域的边缘开始的上皮恢复发生在初始伤口的数小时内。此外,上皮细胞的滑片(slidingsheet)可以在损伤区域上方迁移,帮助伤口覆盖。已经显示多种因子调节再上皮化,包括血清源转化生长因子α(tgf-α)、和基质金属蛋白酶-7(mmp-7)(其自身由timp-1调节)。
共同地,炎症的程度、血管发生、和细胞外基质沉积量均有助于纤维化病变的最终发展。因而,干扰成纤维细胞活化、增殖或凋亡的治疗干预需要对伤口修复的全部阶段的彻底理解和领会。虽然这三个阶段通常顺序地呈现,但是在慢性或反复损伤期间,这些过程并行地作用,向调控机制提出显著的要求。(wilson和wynn,mucosalimmunol.,2009,3(2):103-121)。
2.作为病理学的纤维化
纤维化代表器官或组织中过量的纤维结缔组织的形成或发育,其由于导致疤痕的正常或异常/反应性伤口愈合反应而形成。纤维化的特征在于,例如,非限制性地,细胞外基质蛋白的异常沉积、成纤维细胞增殖的异常促进、成纤维细胞群分化为成肌纤维细胞群的异常诱导、成肌纤维细胞附着至细胞外基质的异常促进,或其组合。
促炎介质
越来越多的证据已经表明已知为细胞因子的多肽介质,包括多种淋巴因子、白介素和趋化因子,是纤维化中的胶原沉积的重要刺激物。认为由固有组织细胞和募集的炎性细胞释放的细胞因子刺激成纤维细胞增殖和细胞外基质蛋白(包括胶原)的增加的合成。例如,特发性肺纤维化的发病机理中的早期特征是肺泡上皮和/或毛细血管细胞损伤。这促进募集循环免疫细胞进入肺,比如单核细胞、嗜中性粒细胞、淋巴细胞和嗜酸性细胞。然后,这些效应细胞与固有肺细胞(如巨噬细胞、肺泡上皮和内皮细胞)一起释放细胞因子,其刺激靶细胞(通常为成纤维细胞)复制并合成增加量的胶原。还可以抑制细胞外基质蛋白的分解,从而有助于纤维化过程。(coker和laurent,eurrespirj,1998,;11:1218-1221)。
众多细胞因子已经涉及纤维化的发病机理,非限制性地包括,转化生长因子-β(tgf-β)、肿瘤坏死因子-α(tnf-α)、血小板源生长因子(pdgf)、胰岛素样生长因子-1(igf-1)、内皮素-1(et-1)和白介素:白介素-1(il-1)、白介素-6(il-6)、白介素-8(il-8)和白介素-17(il-17)。趋化因子白血球化学引诱物,包括调节活化的正常t-细胞表达和分泌的因子(factorregulateduponactivationinnormalt-cells,expressedandsecreted,rantes),也被认为发挥重要的作用。已经发现在周围血中升高水平的促炎细胞因子,比如白介素8(il-8),以及相关的下游细胞粘附分子(cam)比如细胞间粘附分子-1(icam-1)和血管细胞粘附分子-1(vcam-1),基质金属蛋白酶比如基质金属蛋白酶-7(mmp-7),和信号传导分子比如s100钙结合蛋白a12(s100a12,又称为钙粒蛋白c),与死亡率、无肺移植存活、和患有特发性肺纤维化的患者中的疾病进展相关联(richards等,amjrespircritcaremed,2012,185:67-76)。
tgf-β蛋白家族对细胞外基质沉积具有强有力的刺激作用,并且实际上已经用于通过基因转移构建纤维化的诱导动物模型。体外研究显示作为潜在前体分泌的tgf-β1促进成纤维细胞前胶原基因表达和蛋白质合成。数据表明其它哺乳动物同种型(tgf-β2和tgf-β3)也刺激人肺成纤维细胞胶原合成并减少体外分解。在肺纤维化的动物模型中,增强的tgf-β1基因表达在时间上和空间上与增加的胶原基因表达和蛋白质沉积相关。tgf-β1抗体减少博来霉素诱导的鼠肺纤维化中的胶原沉积,并且人纤维化肺组织显示增强的tgf-β1基因和蛋白质表达。
tnf-α可以刺激体外成纤维细胞复制和胶原合成,并且在小鼠中,肺tnf-α基因表达在施用博来霉素后上升。可溶性tnf-α受体减少鼠模型中的肺纤维化,并且转基因小鼠中肺tnf-α的过表达表征为肺纤维化。与对照相比,在患有ipf或石棉沉着病(由石棉纤维的吸入和滞留引起的影响肺的实质组织的慢性炎性和纤维化医学病况)的患者中,支气管肺泡灌洗液源巨噬细胞释放增加量的tnf-α。
内皮素(et-1)也满足促纤维化细胞因子的标准。此分子促进成纤维细胞增殖和趋化性并刺激前胶原产生。其存在于患有肺纤维化的患者的肺中,并且最近的报道表明当施用至实验动物时,et-1受体拮抗物波生坦改善肺纤维化。
不受遏制的成肌纤维细胞增殖/活化和纤维化病灶形成
成纤维细胞至成肌纤维细胞的分化已经长期被认为是许多病况中的重要事件,包括伤口修复和纤维化。例如,已经报道了成肌纤维细胞在活跃纤维化的区域中出现,并且是肺纤维化中细胞外基质(ecm)蛋白产生和沉积的原因。(liu,t.等,amjrespircellmolbiol,2007,37:507-517)。
特发性肺纤维化的成因的一个假设表明仍未确定的刺激产生急性肺损伤的反复发作。这些损伤位点处的伤口愈合最终导致纤维化,以及肺功能损失。作为特发性肺纤维化的特征病变,成纤维细胞病灶以活跃复制的间充质细胞和丰富沉积的新鲜细胞外基质为特征。这样的病灶是典型的肺泡上皮细胞损伤,伴有腔内血浆渗出和远端气室的萎陷。在这些位点也表达与伤口愈合正常相关联的介质,如转化生长因子-β1(tgf-β1)和结缔组织生长因子。此局部急性肺损伤和伤口修复的驱动力是未知的。
3.纤维化发挥作用的疾病或病况
纤维化已经涉及大量异质性疾病或病况,包括但不限于,间质性肺病,比如特发性肺纤维化、急性肺损伤(ali)、辐射诱发的纤维化、和移植物排斥。
3.1.特发性肺纤维化(ipf)
特发性肺纤维化(ipf,又称为隐原性纤维性肺泡炎cfa,或特发性纤维性间质性肺炎)定义为主要在老年人中发生的不确定病因的慢性、进行性纤维性间质性肺炎的具体形式,其局限于肺,并且与常见的间质性肺炎(uip)的放射学和组织学模式相关联(raghug.等,amjrespircritcaremed.,183(6):788-824,2011;thannickal,v.等,procamthoracsoc.,3(4):350-356,2006)。其可以表征为肺间质中纤维化组织的异常和过量沉积。在高分辨率计算机断层摄影术(hrct)图像上,uip表征为存在通常与牵拉性支气管扩张症(tractionbronchiectasis)相关联的网状混浊。随着ipf进展,蜂窝样变得更显著(neiningera.等,jbiolchem.,277(5):3065-8,2002)。肺功能测试通常揭示一氧化碳的限制性损害和减小的扩散能力(thomas,t.等,jneurochem.,105(5):2039-52,2008)。研究已经报道了在患有特发性肺纤维化(ipf)的患者中的tnf-α和il-6释放显著增加(zhang,y,等j.immunol.150(9):4188-4196,1993),其已经归因于il-1β的表达水平(kolb,m.,等j.clin.invest,107(12):1529-1536,2001)。ipf症状(呼吸急促和咳嗽)的发作通常是隐伏的但逐步地进展,在诊断后五年内70%的患者发生死亡。此糟糕的预后类似于由乳腺癌引起的年死亡数量(raghug.等,amjrespircritcaremed.,183(6):788-824,2011)。
在美国,ipf困扰几乎130,000名患者,以及全世界每年大约50,000名新患者和每年几乎40,000例死亡(raghug.等,amjrespircritcaremed.,183(6):788-824,2011)。虽然这些数据是显著的,但是最近的研究报道可能由于增加的流行率或增强的诊断能力,ipf可能比先前认为的更流行5-10倍(thannickal,v.等,procamthoracsoc.,3(4):350-356,2006)。肺移植被认为是用于ipf的确定性疗法,但是肺移植之后的五年存活小于50%。因此,甚至肺移植也不能被认为是用于ipf的“治愈疗法(cure)”。除对患者的身体和情绪影响以外,ipf的治疗和护理极度昂贵,对于每100,000名患者每年的国家医疗保健花费在$28亿美元的范围内。
此外,先前的研究已经表明叠加的环境损伤在特发性肺纤维化的发病机理中可以是重要的。在大多数报道的病例系列中,多至75%患有特发性肺纤维化的索引患者(indexpatient)是现或曾吸烟者。在大规模流行病学研究中,吸烟已经与特发性肺纤维化强烈地相关联。此外,特发性肺纤维化的许多炎性特征相对于潜在的肺病更强烈地关联至吸烟状态。因而,吸烟可以是特发性肺纤维化的独立风险因素。潜伏性病毒感染,尤其是疱疹病毒家族的那些,也已经被报道与特发性肺纤维化相关联。
由于包括肺移植在内都没有用于ipf的已知的有效治疗,对开发新型疗法仍存在迫切的需要。当前有多种治疗方法正在研究中,包括可以减慢或抑制身体产生疤痕或纤维化组织的能力的抗纤维化疗法和增加肺中用于气体交换的组织面积的肺血管扩张剂。除肺移植以外,潜在的ipf治疗已经包括皮质类固醇、硫唑嘌呤、环磷酰胺、抗凝剂、和n-乙酰半胱氨酸(raghug.等,amjrespircritcaremed.,183(6):788-824,2011)。此外,常规地采用支持疗法比如氧气疗法和肺康复。然而,这些中没有一种已经明确地影响ipf患者的长期存活,其进一步突显了对于ipf治疗选择的未满足的医疗需要。作为实例,尽管临床方案结果是混合的,intermune的口服小分子esbriet®(吡非尼酮)得到了欧洲和日本批准用于患有ipf的患者。esbriet®因而成为专门指示用于ipf的治疗的第一种药物;由于可疑的试验结果和药物副作用,药物的实用性在美国审查时被怀疑,并且基于当时提交的数据没有得到fda批准。因此,正在进行大规模的3期临床试验以测定其功效,从而支持在美国的新药申请。
组织病理学上,ipf可以描述为成纤维细胞病灶中活化的成肌纤维细胞(或间充质细胞)的积聚(thannickal,v.等,procamthoracsoc.,3(4):350-356,2006)。成肌纤维细胞的受损的凋亡可以导致以组织纤维化告终的持续且失调的修复过程。可以说,炎症也在ipf中发挥关键的作用,可能通过成纤维细胞的周期性急性刺激。这些发现指向用于治疗干预的潜在目标。
3.1.1.特发性肺纤维化(ipf)的发病机理
虽然不完全地理解致病机制,当前接受的范例提出在对肺泡上皮的损伤之后,接着发生引发与正常的组织修复相关联的应答的促炎性和纤维增殖介质的爆发。出于不清楚的原因,这些修复过程从不消除且随后发生进行性纤维化。(selmanm,等,anninternmed,134(2):136-151,2001;noble,p.和homerr.,clinchestmed,25(4):749-58,2004;strieter,r.,chest,128(5suppl1):526s-532s,2005)。
3.1.2.肺纤维化的博来霉素小鼠模型
虽然存在大量动物模型并且可以是有用的(例如,tgf-β腺病毒转导模型或辐射诱导的纤维化模型),但是博来霉素模型是现今使用的证据充分和最佳表征的鼠模型,用以证明特定药物或蛋白激酶抑制剂在炎症后/预纤维化/纤维预防阶段中的功效(vittal,r.等,jpharmacolexpther.,321(1):35-44,2007;vittal,r.等,amjpathol.,166(2):367-75,2005;heckerl.等,natmed.,15(9):1077-81,2009)。
抗生素博来霉素最初从轮丝链霉菌(streptomycesverticillatus)分离(umezawa,h.等,cancer20:891-895,1967)。随后发现,这种抗生素对鳞状细胞癌和皮肤肿瘤有效(umezawa,h.,fedproc,33:2296-2302,1974);然而,其作为抗肿瘤剂的有效性受限于导致纤维化的剂量依赖性肺毒性(muggia,f.等,cancertreatrev,10:221-243,1983)。经由气管内途径递送博来霉素(通常1.25-4u/kg,其取决于来源)具有优势,即药物的单次注射在啮齿动物中产生肺损伤和由此导致的纤维化(phan,s.等,amrevrespirdis121:501-506,1980;snider,g.等,amrevrespirdis.117:289-297,1978;thrall,r.等,amjpathol,95:117-130,1979)。气管内递送药物至啮齿动物导致最初对肺泡上皮细胞的直接伤害。此事件之后是在第一周内的嗜中性粒细胞和淋巴细胞全肺泡炎的发展(janick-buckner,d.等,toxicolapplpharmacol.,100(3):465-73,1989)。随后,肺泡炎性细胞被清除,成纤维细胞增殖是显著的,并且细胞外基质被合成(schrierd.等,amrevrespirdis.,127(1):63-6,1983)。此模型中纤维化的发展可以在第14天在生物化学上和组织学上看到,而且最大应答通常在第21-28天左右显著(izbickig.等,intjexppathol.,83(3):111-9,2002;phan,s.等,chest.,83(5suppl):44s-45s,1983)。然而,超过第28天,对博来霉素的应答是更可变的。原始报道表明气管内递送的博来霉素可以诱导进展或持续60-90天的纤维化(thrallr.等,amjpathol.,95(1):117-30,1979;goldsteinr.,等,amrevrespirdis.,120(1):67-73,1979;starcherb.等,amrevrespirdis.,117(2):299-305,1978);然而,其它报道证明了在此时期后开始消除的自限性反应(thrallr.等,amjpathol.,95(1):117-30,1979;phan,s.等,chest,83(5suppl):44s-45s,1983;lawsonw.等,amjpathol.2005;167(5):1267-1277)。虽然此模型的消除性质不模拟人疾病,但是模型的此方面提供了研究在这些随后的时间点的纤维化消除的机会。
3.2.急性肺损伤(ali)
急性肺损伤(ali)和其更严重的形式(即急性呼吸窘迫综合征(ards)),是由急性肺水肿和炎症引起的急性呼吸衰竭的综合征。ali/ards是急性呼吸衰竭的病因,在全部年龄的患者中,急性呼吸衰竭由各种临床障碍,包括脓毒症(肺源性和非肺源性)、肺炎(细菌性、病毒性和真菌性)、胃和口咽内容物的吸入、严重创伤、以及多种其它临床障碍,包括重度急性胰腺炎、药物过量、和血液产品,发展而来(ware,l.和matthay,m.,nengljmed,342:1334-1349,2000)。大多数患者需要利用正压力辅助通气。主要的生理学异常是重度动脉低氧血症以及继发于肺死腔分数急剧增加的每分通气量的显著增加。患有ali/ards的患者发展出富含蛋白质的肺水肿,其是由继发于屏障渗透性增加的流体向肺的间质和气室隔室中的外渗造成的。另外的病理学变化指示涉及肺水肿的机制是复杂的,并且水肿只是ali/ards中的病理生理学事件之一。一个生理学结果是导致增加的呼吸功的肺顺应性的显著降低(nucktont.等,nengljmed,346:1281-1286,2002),这是需要辅助通气以支持大多数患者的原因之一。
已经表明机械通气(mv,其为用于ali的支柱治疗)通过对呼吸系统的多种组成施加机械应力,引起通气机相关肺损伤(vali),而潜在地促成且恶化渗透性(fan,e.等,jama,294:2889-2896,2005;macintyren.,chest,128:561s-567,2005)。最近的试验证明了与高潮气量(hvt)相比,以低潮气量(lvt)通气的患者中显著改善的存活(theacuterespiratorydistresssyndromen.ventilationwithlowertidalvolumesascomparedwithtraditionaltidalvolumesforacutelunginjuryandtheacuterespiratorydistresssyndrome.nengljmed;342:1301-1308,2000)。除了在较低的潮气量下通气(假定其施加更低的机械应力)之外,几乎没有关于病理生理学的机械学理解,并且没有用于vali的定向疗法。
已经表明高潮气量(hvt)机械通气(mv)导致p38map激酶的磷酸化、mk2的活化和hspb1的磷酸化——引起肌动蛋白从hspb1离解并且聚合以形成应力纤维的过程,其最终导致细胞外周间隙和增加的血管渗透性。此外,显示抑制p38map激酶或其下游效应子mk2阻止hspb1的磷酸化,并通过废除肌动蛋白应力纤维形成和细胞骨架重排,保护免于血管渗透性,这表明靶向抑制mk2可以是用于治疗急性肺损伤的潜在的治疗策略(damarla,m.等,plosone,4(2):e4600,2009)。
而且,研究已经表明肺纤维化还可以由ali造成。ali可以完全消除或继续至纤维性肺泡炎,伴随持续的血液中的低氧(低氧血症)和减小的肺每次呼吸膨胀的能力(减小的肺顺应性)。其表明虽然损伤诱发的肺纤维化的病因不同于特发性肺纤维化,但是两种疾病共享共同的病理学机制,即,使成纤维细胞浸润到肺的气室中(tager等.,nat.med.14:45-54,2008;ley,k.和zarbock,a.,nat.med.14:20-21;2008)。
3.3.辐射诱发的纤维化
纤维化是通过放疗的癌症治疗和事故性辐照二者的常见后遗症。已经描述在许多组织中的放射治疗之后的纤维化病变,包括皮肤(bentzen,s.等,radiother.oncol.15:261-214,1989;brocheriou,c.,等,br.j.radiol.suppl.19:101-108,1986)、肺(lopezcardozo,b.等,int.j.radiat.oncol.biol.phys.,11:907-914,1985)、心(fajardo,l.和stewart,j.,lab.invest.,29:244-257,1973)、和肝(ingold,j.等,am.j.roentgenol.,93:200-208,1965)。
在肺(晚期应答组织)中,可以发生两种辐射毒性综合征:辐射性肺炎和肺纤维化。肺炎在完成放疗后2-3个月显现。病理学上,肺炎表征为间质性水肿,存在间质性和肺泡炎性细胞,并且ii型肺细胞的数目增加(gross,n.等,radiat.res.,iii:143-50,1981;guerry-force,m.等,radiat.res.114:138-53,1988)。在肺炎中,对组织的主要伤害最可能由实质细胞的耗竭造成(hendry,j.,radiat.oncol.vol.4,2:123-132,1994;rosiello,r.等,am.rev.respir.dis.,148:1671-1676,1993;travis,e.和terry,n.,front.radiat.ther.oncol.,23:41-59,1989)。
纤维化反应表现为:增加的间质性胶原沉积、血管壁的增厚和血管闭塞(vergava,j.等,int.j.radiat.oncol.biol.phys.2:723-732,1987)。纤维化病变的组织学检查已经揭示了纤维化组织包含浸润性炎性细胞、成纤维细胞、和更大量的多种细胞外基质组分。在纤维化组织中,已经描述了间质性胶原、纤连蛋白和蛋白多糖的增强的合成和沉积(maasiha,p.等,int.j.radiat.oncol.biol.phys.20:973-980,1991),并且这已经解释为成纤维细胞细胞系统的辐射诱导调节的结果(remy,j.等,radiat.res.125:14-19,1991)。
辐射诱发的纤维化(尤其是肺的纤维化)表明是由于参与纤维化反应的多种细胞系统之间的细胞和分子事件的相互影响。辐照能够单独地诱导成纤维细胞/纤维细胞细胞系统的过早的终末分化过程,其导致有丝分裂期后的纤维细胞的增强的积聚,这表征为间质性胶原的合成的数倍增加。与此同时,附带的实质细胞类型(如肺泡巨噬细胞和肺泡ii型肺细胞)的辐照诱导具体的细胞因子(如tgf-β1)的立即合成,其然后变更实质细胞与成纤维细胞细胞系统的相互作用。作为负责纤维化反应的主要的细胞因子之一,tgf-β1经由祖成纤维细胞细胞类型的扩增,以及祖成纤维细胞过早地终末分化为有丝分裂期后的纤维细胞,来诱导成纤维细胞增殖。由于祖成纤维细胞和有丝分裂期后的纤维细胞的均衡细胞类型比率受到干扰,这导致有丝分裂期后的纤维细胞的积聚。提出辐照之后的病理生理学组织应答由变更的细胞因子-和生长因子-介导的多细胞细胞系统的相互作用造成,其导致间质性成纤维细胞/纤维细胞细胞系统的均衡细胞类型比率受到干扰。(rodemann,h.和bamberg,m.,radiotherapyandoncology,35,83-90,1995)。
3.4.移植物排斥
移植是将细胞、组织或器官从一个位点转移至另一个位点的行为。可以利用来自供体的器官(例如,肾、肝、心、肺或胰腺)的移植矫正器官系统的机能障碍。然而,免疫系统仍是移植作为常规医学治疗的最难以克服的屏障,并且这样的器官的排斥通常对应于移植器官中的纤维化表型。免疫系统已经发展出精密和有效的机制以对抗外源物(foreignagent)。这些机制还参与移植器官的排斥,其被宿主的免疫系统识别为外源的。
对移植物的免疫反应的程度部分地取决于移植器官和宿主之间的遗传差异的程度。异种移植物,其是不同物种的成员之间的移植物,具有最大差异并且引起最大的免疫反应,经历迅速的排斥。自体移植物,其是从身体的一部分至另一部分的移植物(例如,皮肤移植物),不是外源组织,并且因此不引起排斥。同系移植物,其是遗传上同一的个体(例如,同卵双胞胎)之间的移植物,也不经历排斥。
同种异体移植物是遗传上不同的相同物种的成员之间的移植物。这是移植的最常见形式。同种异体移植物经历排斥的程度部分地取决于供体和宿主之间的相似性或组织相容性的程度。
应答的程度和类型还随着移植物的类型改变。一些位点(如眼和脑)免疫豁免的(即,它们具有最少或不具有免疫系统细胞,并且可以耐受甚至不匹配的移植物)。皮肤移植物初始不被血管化,并且因此直到血液供给发展都不显现排斥。肺、心、肾和肝是高度血管器官并且通常在宿主中导致有力的细胞介导的应答,需要免疫抑制疗法。
缩窄性细支气管炎(cb,也称为肺移植患者闭塞性细支气管炎)是主要在膜性和呼吸性细支气管的壁和相邻组织中发生的炎症和纤维化,以及由此导致的它们的腔变窄。cb见于各种环境(setting)中,最经常作为肺与心-肺移植(影响34%至39%的患者,通常在移植后的前2年)和骨髓移植的并发症,但是也见于在类风湿性关节炎中,在吸入毒剂比如二氧化氮后,在摄取某些药物比如青霉胺和摄取东亚蔬菜守宫木(sauropusandrogynous)后,并且作为儿童中腺病毒、a型流感、麻疹和肺炎支原体感染的罕见并发症。在肺移植中,cb是导致其后死亡的单个最重要的因素。在一个研究中,总死亡率是25%。然而,同时,87%的无症状并且由经支气管活组织检查单独诊断的患者具有消除或稳定的疾病。fev1从基线的降低可以用于临床支持移植患者中的cb;术语闭塞性细支气管炎综合征用于表示此临床机能障碍,并且已经为其建立分级系统,其现在在文献中广泛地使用。肺移植中cb的发展的显著风险因素包括同种异体抗原依赖性和非依赖性机制。在前者组中,为晚期急性排斥和a基因座的hla错配;在后者中,为由移植手术和巨细胞病毒感染造成的对气道的局部缺血/再灌注损伤(schlesingerc.等,curropinpulm.med.,4(5):288-93,1998)。
排斥的机制
对移植器官的免疫反应由细胞(淋巴细胞介导的)和体液(抗体介导的)机制二者组成。虽然也涉及其它细胞类型,但是t细胞是移植物排斥的中枢。排斥反应由致敏阶段和效应阶段组成。
致敏阶段
在此阶段中,cd4和cd8t细胞经由它们的t-细胞受体识别在外源移植物的细胞上表达的同种异体抗原。抗原的识别需要两个信号;第一个通过t细胞受体与mhc分子呈递的抗原的相互作用提供,第二个由t细胞/apc表面上的共刺激受体/配体相互作用提供。在众多的共刺激途径中,t细胞表面上的cd28与其apc表面配体b7-1或b7-2(一般分别已知为cd80或cd86)的相互作用已经得到最多的研究(clarkson,m.和sayegh,m.,transplantation;80(5):555-563,2005)。此外,细胞毒性t淋巴细胞相关抗原-4(ctla4)也结合至这些配体并且提供抑制信号。其它共刺激分子包括cd40和其配体cd40l(cd154)。典型地,mhc分子的螺旋形成肽结合沟并且被源自正常细胞蛋白质的肽占据。胸腺或中枢耐受机制(克隆缺失)和外周耐受机制(例如,无反应性)确保这些自体肽mhc复合物不被t细胞识别,从而预防自身免疫反应。
效应阶段
同种异体抗原依赖性和非依赖性因素促成效应机制。最初,非免疫性“损伤反应”(局部缺血)诱导非特异性炎性反应。正因如此,由于粘附分子、ii类mhc、趋化因子和细胞因子的表达上调,至t细胞的抗原呈递增加。其还促进可以活化间接的同种异体识别途径的完整的可溶性mhc分子的脱落(shedding)。在活化后,cd4阳性t细胞启动巨噬细胞介导的迟发型超敏反应(dth)应答并且向b细胞提供帮助用于抗体产生。
多种t细胞和t细胞源细胞因子比如il-2和ifn-γ在移植后不久上调。稍后,表达ß-趋化因子如rantes(调节活化的,正常t-细胞表达和分泌的)、ip-10和mcp-1,并且这促进同种异体移植的强烈的巨噬细胞浸润。il-6、tnf-α、诱导型一氧化氮合酶(inos)和生长因子也在此过程中发挥作用。生长因子(包括tgf-β和内皮素)引起平滑肌增殖、内膜增厚、间质纤维化、和在肾的情况下的肾小球硬化症。
由t细胞源细胞因子活化的内皮细胞和巨噬细胞表达ii类mhc、粘附分子和共刺激分子。这些可以呈递抗原并且从而募集更多的t细胞,其扩大排斥过程。cd8阳性t细胞或者通过递送“致死一击(lethalhit)”,或者可选地,通过诱导凋亡,来介导细胞介导的细胞毒性反应。
此外,新兴研究已经表明纤维化过程参与器官移植的慢性移植物排斥。例如,显示慢性肺同种异体移植物排斥由同种异体移植物内皮细胞源hif-1α的相对缺乏介导,其导致移植器官的纤维化重构(wilkes,d.,jclininvest.,121(6):2155-2157,2011;jiang,x.等,jclininvest.,121(6):2336-2349,2011)。
3.5.慢性阻塞性肺病(copd)
慢性阻塞性肺病(copd)是由慢性和相对不可逆的呼气气流机能障碍所代表的肺病的共同描述,其由于慢性阻塞性支气管炎、气肿和/或慢性哮喘的一些组合所导致的。copd由一系列环境和遗传风险因素造成,包括促成疾病的吸烟。
copd的流行在全世界不断增加,并且copd已经成为美国的第四大死亡原因。在美国,尽管最近数十年中吸烟降低,但是与copd流行率和相关的死亡率增加,并且预计仍将继续增加数年。此外,copd花费昂贵,并且在患有中度或更高严重性的copd的患者中大致上一年发生一次的急性发作构成最昂贵的组成。
在copd中,气流阻塞可以在肺的两个非常不同的病例生理学过程中的任一个的基础上发生:1)实质的炎症,其导致肺实质的蛋白质水解和肺弹性的失去(气肿);和2)小气道的炎症、结疤和变窄(“小气道疾病”)。在个体患者中,这些过程中的一个(其可以受控于不同的遗传因素)可以占优势,但是二者通常共存。最后,这两个过程都产生相似模式的功能损害:减少的呼气流、充气过度和气体交换的异常。
在copd的早期阶段,在copd患者的肺中发现下列症状:1)通过破坏气溶胶使气道上皮破裂,2)炎性粘液性渗出物的积聚,3)通过炎性免疫细胞浸润气道壁,4)气道重构/气道壁增厚和侵占腔空间,和5)对气流的增加的阻力。在此早期阶段期间,平滑肌收缩和高反应性也增加阻力,但是增加的阻力通过支气管扩张剂解除。
在晚期阶段,copd患者特征性地在环绕气道壁的上皮下和外膜(aventitial)隔室中发展纤维结缔组织的沉积。这样的细支气管周纤维化通过限制随肺膨胀发生的气道管径的扩大而促成固定的气道闭塞。
3.5.1.慢性支气管炎
慢性支气管炎定义为在不存在被认为引起痰产生的其它疾病的情况下,在连续两年的至少三个月内存在慢性咳嗽和痰产生。在慢性支气管炎中,在流行病学上,支气管上皮变得慢性发炎,伴随粘液腺体肥大和杯状细胞数量增加。纤毛也被毁坏,并且粘液纤毛活动梯(escalator)的效率被极大地损害。粘液粘性和粘液产生增加,导致难以咳出痰。粘液的淤积导致对感染的易感性增加。
在显微镜上,存在炎性细胞对气道壁的浸润。炎症之后是结疤和重构,其增厚壁并且还导致气道变窄。随着慢性支气管炎进展,存在鳞状化生(衬在气道内部的组织中的异常变化)和纤维化(进一步增厚气道壁和其使结疤)。这些变化的结果是气流的限制。随时间的反复感染和炎症导致对气道壁的不可逆性结构伤害并且导致结疤,以及较小的外周气道的变窄和畸变。
3.5.2.气肿
气肿按照其病理学特征限定,表征为在末端细支气管远端的末端气室的异常扩张,以及它们的壁的毁坏和肺弹性的失去。如果气肿的区域的直径大于1cm,则由于膨胀过度可以发展出大疱(大于1cm宽的疱)。异常气室的分布允许两种主要模式的气肿的分类:全腺泡性(全小叶性)气肿,其导致膨胀,并且毁坏整个腺泡,特别是肺的下半部。腺泡中央性(小叶中央性)气肿包含围绕呼吸细支气管的伤害,其影响肺的上叶和下叶的上部。此外,已知气肿的某些形式与纤维化相关联。
气肿的破坏过程主要与吸烟相关联。香烟烟雾是刺激物并且导致气道和肺泡的低度炎症。已知香烟包含超过4,000种毒性化学品,其影响肺内的抗蛋白酶和蛋白酶之间的平衡,引起永久的伤害。炎性细胞(巨噬细胞和嗜中性粒细胞)产生被称为弹性酶的蛋白水解酶,其破坏作为肺组织重要组分的弹性蛋白。
肺的肺泡或气囊包含弹性组织,其支持和维持肺内气道的效能。肺泡壁的毁坏允许通过放松帮助保持气道开放的牵绳(guyrope)而使小气道变窄。在正常吸气期间,膈向下移动同时胸腔(ribcage)向外移动,并且空气通过产生的负压吸入肺内。在呼气时,随着胸腔和膈放松,肺实质的弹性回位向上和向外推动空气。在肺实质破坏的情况下,其导致松软的肺并失去肺泡牵绳,发生小气道塌陷和空气积存,导致肺充气过度。充气过度使膈变平,其导致不太有效的收缩和减小的肺泡效率,其转而导致进一步的空气积存。描述的机制随着时间导致重度气流阻塞,其导致呼气不足以允许肺在下一次吸气之前完全地放气。
3.5.3慢性哮喘
哮喘定义为气道的慢性炎性病况,其导致普遍的和多变的气道阻塞,其是自发可逆或利用治疗可逆的。在患有慢性哮喘的一些患者中,该疾病进展,导致不可逆性气道阻塞,特别是在哮喘是未治疗的(因为其还没有被诊断或者处置不当)或特别严重的情况下。患有哮喘的儿童具有发展不可逆性哮喘的十分之一的几率,而成年发作的哮喘患者的风险是四分之一。研究也已经发现在儿童和成人中,如果他们的哮喘没有被适当地治疗,具体地使用皮质类固醇疗法,则该哮喘可能导致肺功能的不可逆的恶化。
哮喘中的气道炎症可以通过增加的平滑肌、表面上皮的破裂、增加的胶原沉积和基底膜的增厚,随着时间而导致气道的重构。
增加的平滑肌
增加的气道平滑肌(asm)质量是气道重构的最突出的特征(n.carroll,j.elliot,a.morton,和a.james,“thestructureoflargeandsmallairwaysinnonfatalandfatalasthma,”americanreviewofrespiratorydisease,vol.147,no.2,pp.405-410,1993),其中与总壁厚度的增加相比,asm质量不成比例地增加(e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。气道重构在致死性和非致死性哮喘二者中都有记载(a.j.james,“relationshipbetweenairwaywallthicknessandairwayhyperesponsiveness,”inairwaywallremodelinginasthma,a.g.stewart,ed.,pp.1-27,crcpress,bocaraton,fla,usa,1997),并且与疾病严重程度和持续时间二者关联,在致死性病例中比在非致死性病例中更多(n.carroll,j.elliot,a.morton,和a.james,“thestructureoflargeandsmallairwaysinnonfatalandfatalasthma,”americanreviewofrespiratorydisease,vol.147,no.2,pp.405-410,1993;a.l.james,p.d.pare,和j.c.hogg,“themechanicsofairwaynarrowinginasthma,”americanreviewofrespiratorydisease,vol.139,no.1,pp.242-246,1989;k.kuwano,c.h.bosken,p.d.pare,t.r.bai,b.r.wiggs,和j.c.hogg,“smallairwaysdimensionsinasthmaandinchronicobstructivepulmonarydisease,”americanreviewofrespiratorydisease,vol.148,no.5,pp.1220-1225,1993),并且在患有致死性哮喘的老年患者中比在年轻患者中多。asm质量的增加可以是增加的肌细胞大小(肥大)、增加的肌细胞数目(增生)、和间充质细胞至asm束的分化和迁移的协同结果(s.beqaj,s.jakkaraju,r.r.mattingly,d.pan,和l.schuger,“highrhoaactivitymaintainstheundifferentiatedmesenchymalcellphenotype,whereasrhoadown-regulationbylaminin-2inducessmoothmusclemyogenesis,”journalofcellbiology,vol.156,no.5,pp.893-903,2002;s.j.hirst,j.g.martin,j.v.bonacci等,“proliferativeaspectsofairwaysmoothmuscle,”journalofallergyandclinicalimmunology,vol.114,no.2,pp.s2-s17,2004;m.schmidt,g.sun,m.a.stacey,l.mori,和s.mattoli,“identificationofcirculatingfibrocytesasprecursorsofbronchialmyofibroblastsinasthma,”journalofimmunology,vol.171,no.1,pp.380-389,2003;c.bergeron,w.al-ramli,和q.hamid,“remodelinginasthma,”proceedingsoftheamericanthoracicsociety,vol.6,no.3,pp.301-305,2009)。
作为刺激细胞分裂并且引发有丝分裂的化合物,促分裂原(a.shifren,c.witt,c.christie和m.castro,“mechanismsofremodelinginasthmaticairways,”journalofallergy,vol.2012,articleid316049,pp.1-12)在哮喘气道特有的asm质量增加的发展中起不可或缺的作用。促分裂原结合受体酪氨酸激酶(rtk)、g蛋白偶联受体(gpcr)、和细胞因子受体,所有这些都能够在细胞培养模型中产生asm质量的增加(e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。促分裂原的列表涉及广泛,并且包括tgf-β、il-1β、il-6、血栓烷、白三烯、组胺、类胰蛋白酶、血清素、血管内皮生长因子(vegf)、和众多其它的(s.j.hirst,j.g.martin,j.v.bonacci等,“proliferativeaspectsofairwaysmoothmuscle,”journalofallergyandclinicalimmunology,vol.114,no.2,pp.s2-s17,2004;a.m.freyer,s.r.johnson,和i.p.hall,“effectsofgrowthfactorsandextracellularmatrixonsurvivalofhumanairwaysmoothmusclecells,”americanjournalofrespiratorycellandmolecularbiology,vol.25,no.5,pp.569-576,2001;p.h.howarth,a.j.knox,y.amrani,o.tliba,r.a.panettieri,和m.johnson,“syntheticresponsesinairwaysmoothmuscle,”journalofallergyandclinicalimmunology,vol.114,no.2,supplement1,pp.s32-s50,2004)。受体系统主要通过磷酸肌醇3'-激酶(pi3k)和细胞外信号调节激酶(erk)信号传导途径调节有丝分裂发生(k.page,j.li,y.wang,s.kartha,r.g.pestell,和m.b.hershenson,“regulationofcyclind(1)expressionanddnasynthesisbyphosphatidylinositol3-kinaseinairwaysmoothmusclecells,”americanjournalofrespiratorycellandmolecularbiology,vol.23,no.4,pp.436-443,2000;m.j.orsini,v.p.krymskaya,a.j.eszterhas,j.l.benovic,r.a.panettieri,和r.b.penn,“mapksuperfamilyactivationinhumanairwaysmoothmuscle:mitogenesisrequiresprolongedp42/p44activation,”americanjournalofphysiology,vol.277,no.3,pp.l479-l488,1999)。pi3k和erk途径活化转录因子,其使促进细胞周期进程的d型细胞周期蛋白磷酸化(e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。已经在来自哮喘患者的气道活组织检查和支气管肺泡灌洗(bal)液中鉴定出,或在哮喘气道细胞培养物中检测到几乎所有这些促分裂原(r.m.pascual和s.p.peters,“airwayremodelingcontributestotheprogressivelossoflungfunctioninasthma:anoverview,”journalofallergyandclinicalimmunology,vol.116,no.3,pp.477-486,2005)。
通常记载asm细胞很靠近气道上皮(a.shifren,c.witt,c.christie和m.castro,“mechanismsofremodelinginasthmaticairways,”journalofallergy,vol.2012,articleid316049,pp.1-12)。与对照中的135 μm相比,此上皮-肌肉距离在哮喘患者中测量为67 μm(l.benayoun,a.druilhe,m.c.dombret,m.aubier,和m.pretolani,“airwaystructuralalterationsselectivelyassociatedwithsevereasthma,”americanjournalofrespiratoryandcriticalcaremedicine,vol.167,no.10,pp.1360-1368,2003)。已经假设间充质气道细胞分化为asm并且随后新的asm细胞迁移入肌束(j.m.madison,“migrationofairwaysmoothmusclecells,”americanjournalofrespiratorycellandmolecularbiology,vol.29,no.1,pp.8-11,2003)。不知道这些现象是否在体内发生,但是报道指示培养的人asm细胞响应于促有丝分裂刺激而迁移(m.hoshino,m.takahashi,和n.aoike,“expressionofvascularendothelialgrowthfactor,basicfibroblastgrowthfactor,andangiogeninimmunoreactivityinasthmaticairwaysanditsrelationshiptoangiogenesis,”journalofallergyandclinicalimmunology,vol.107,no.2,pp.295-301,2001)。参与细胞增殖的许多促分裂原,包括tgf-β、il-1β和vegf,也诱导asm细胞迁移(r.m.pascual和s.p.peters,“airwayremodelingcontributestotheprogressivelossoflungfunctioninasthma:anoverview,”journalofallergyandclinicalimmunology,vol.116,no.3,pp.477-486,2005;e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。
表面上皮的破裂
上皮细胞脱落、纤毛细胞丢失、和杯状细胞增生均已经在哮喘气道中被描述(n.carroll,j.elliot,a.morton,和a.james,“thestructureoflargeandsmallairwaysinnonfatalandfatalasthma,”americanreviewofrespiratorydisease,vol.147,no.2,pp.405-410,1993;t.aikawa,s.shimura,h.sasaki,m.ebina,和t.takishima,“markedgobletcellhyperplasiawithmucusaccumulationintheairwaysofpatientswhodiedofsevereacuteasthmaattack,”chest,vol.101,no.4,pp.916-921,1992;b.naylor,“thesheddingofthemucosaofthebronchialtreeinasthma,”thorax,vol.17,pp.69-72,1962)。增加的上皮细胞增殖造成上皮的增厚和增加的网状板(还称为上皮下纤维化)的证据已经在患有中度至重度哮喘的患者中观察到,而在轻度持续性哮喘、慢性支气管炎的患者和正常对照中不存在(l.cohen,e.xueping,j.tarsi等,“epithelialcellproliferationcontributestoairwayremodelinginsevereasthma,”americanjournalofrespiratoryandcriticalcaremedicine,vol.176,no.2,pp.138-145,2007)。这些研究提出在重度哮喘中可见的气道的增厚可部分地是由于气道上皮增殖造成的。
杯状细胞增生已经在轻度、中度和重度形式的哮喘中一致地证明(h.a.jenkins,c.cool,s.j.szefler等,“histopathologyofseverechildhoodasthma:acaseseries,”chest,vol.124,no.1,pp.32-41,2003;c.l.ordoñez,r.khashayar,h.h.wong等,“mildandmoderateasthmaisassociatedwithairwaygobletcellhyperplasiaandabnormalitiesinmucingeneexpression,”americanjournalofrespiratoryandcriticalcaremedicine,vol.163,no.2,pp.517-523,2001)。类似地,粘膜下粘液腺体占据的气道壁的面积的增加在哮喘气道中是常见的发现,并且在致死性和非致死性哮喘形式二者中发生(n.carroll,j.elliot,a.morton,和a.james,“thestructureoflargeandsmallairwaysinnonfatalandfatalasthma,”americanreviewofrespiratorydisease,vol.147,no.2,pp.405-410,1993)。杯状细胞产生粘蛋白糖蛋白(muc),其中十三(13)种已经在人气道中被鉴定(e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。人中主要的粘蛋白是muc5ac,其在正常对象的气道中表达并且在哮喘对象中被上调(j.v.fahy,“remodelingoftheairwayepitheliuminasthma,”americanjournalofrespiratoryandcriticalcaremedicine,vol.164,no.10,pp.s46-51,2001)。已经证明,杯状细胞增生跟随th2细胞向卵清蛋白-激发的(challenged)小鼠中的过继性转移,并且最可能是th2-驱动的白介素表达的结果(l.cohn,j.s.tepper,和k.bottomly,“cuttingedge:il-4-independentinductionofairwayhyperresponsivenessbyth2,butnotth1,cells,”journalofimmunology,vol.161,no.8,pp.3813-3816,1998)。通过stat-6信号传导途径的il-13信号(r.j.homer和j.a.elias,“airwayremodelinginasthma:therapeuticimplicationsofmechanisms,”physiology,vol.20,no.1,pp.28-35,2005)和il-13过表达在小鼠中的作用几乎完全是stat-6依赖性的(d.a.kuperman,x.huang,l.l.koth等,“directeffectsofinterleukin-13onepithelialcellscauseairwayhyperreactivityandmucusoverproductioninasthma,”naturemedicine,vol.8,no.8,pp.885-889,2002)。
上皮损伤后通常跟随着负责组织修复的蛋白质的上调。上皮生长因子受体(egfr)和muc5ac的表达均在哮喘患者的上皮中显著地上调(m.amishima,m.munakata,y.nasuhara等,“expressionofepidermalgrowthfactorandepidermalgrowthfactorreceptorimmunoreactivityintheasthmatichumanairway,”americanjournalofrespiratoryandcriticalcaremedicine,vol.157,no.6,pp.1907-1912,1998;s.m.puddicombe,r.polosa,a.richter等,“involvementoftheepidermalgrowthfactorreceptorinepithelialrepairinasthma,”fasebjournal,vol.14,no.10,pp.1362-1374,2000),并且已经显示在杯状细胞中共定位(k.takeyama,j.v.fahy,和j.a.nadel,“relationshipofepidermalgrowthfactorreceptorstogobletcellproductioninhumanbronchi,”americanjournalofrespiratoryandcriticalcaremedicine,vol.163,no.2,pp.511-516,2001)。对egfr的免疫反应性和muc5ac染色的总面积在哮喘患者和对照对象二者中都显示了阳性关联。另外已经显示,egfr的活化在体外上调人上皮细胞中的粘蛋白产生和杯状细胞生成二者(m.amishima,m.munakata,y.nasuhara等,“expressionofepidermalgrowthfactorandepidermalgrowthfactorreceptorimmunoreactivityintheasthmatichumanairway,”americanjournalofrespiratoryandcriticalcaremedicine,vol.157,no.6,pp.1907-1912,1998)。
增加的胶原沉积和基底膜的增厚
气道重构的原始报道描述了基底膜增厚的现象(h.l.huber和k.k.koessler,“thepathologyofbronchialasthma,”archivesofinternalmedicine,vol.30,no.6,pp.689-760,1922)。随后,电子显微镜已经显示增厚仅在真正的基底膜下方的已知为网状板的区域中发生(w.r.roche,j.h.williams,r.beasley,和s.t.holgate,“subepithelialfibrosisinthebronchiofasthmatics,”lancet,vol.1,no.8637,pp.520-524,1989)。在对照对象中,网状板是4-5 μm厚的胶原层。已经记载,在哮喘患者中,网状板的厚度在7和23 μm之间(r.j.homerandj.a.elias,“consequencesoflong-terminflammation:airwayremodeling,”clinicsinchestmedicine,vol.21,no.2,pp.331-343,2000)。增厚是细胞外基质沉积的结果,主要为胶原i、iii和v(r.j.homer和j.a.elias,“airwayremodelinginasthma:therapeuticimplicationsofmechanisms,”physiology,vol.20,no.1,pp.28-35,2005)。此外,已经描述了非胶原基质(包括弹性蛋白、纤连蛋白、生腱蛋白、腔蛋白聚糖、和蛋白聚糖)的异常(w.r.roche,j.h.williams,r.beasley,和s.t.holgate,“subepithelialfibrosisinthebronchiofasthmatics,”lancet,vol.1,no.8637,pp.520-524,1989;j.huang,r.olivenstein,r.taha,q.hamid,和m.ludwig,“enhancedproteoglycandepositionintheairwaywallofatopicasthmatics,”americanjournalofrespiratoryandcriticalcaremedicine,vol.160,no.2,pp.725-729,1999;a.laitinen,a.altraja,m.kämpe,m.linden,i.virtanen,和l.a.laitinen,“tenascinisincreasedinairwaybasementmembraneofasthmaticsanddecreasedbyaninhaledsteroid,”americanjournalofrespiratoryandcriticalcaremedicine,vol.156,no.3,pp.951-958,1997)。
成肌纤维细胞被认为是上皮下纤维化的关键效应子。成肌纤维细胞是具有成纤维细胞和肌细胞二者的表型特性的特化细胞(e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。它们表达α-平滑肌肌动蛋白,产生炎性介质,并且是组织修复和重构必需的细胞外基质蛋白的主要生产者。
转化生长因子-(tgf-)β介导il-13过表达小鼠的效应(chungeunlee,r.j.homer,z.zhu等,“interleukin-13inducestissuefibrosisbyselectivelystimulatingandactivatingtransforminggrowthfactorβ1,”journalofexperimentalmedicine,vol.194,no.6,pp.809-821,2001)。tgf-β是由包括上皮细胞、巨噬细胞、成纤维细胞、淋巴细胞和嗜酸性细胞的多种肺细胞产生的细胞因子(e.tagaya和j.tamaoki,“mechanismsofairwayremodelinginasthma,”allergologyinternational,vol.56,no.4,pp.331-340,2007)。tgf-β诱导成纤维细胞表达α-平滑肌肌动蛋白并且采用(assume)成肌纤维细胞表型(v.batra,a.i.musani,a.t.hastie等,“bronchoalveolarlavagefluidconcentrationsoftransforminggrowthfactor(tgf)-β1,tgf-β2,interleukin(il)-4andil-13aftersegmentalallergenchallengeandtheireffectsonα-smoothmuscleactinandcollageniiisynthesisbyprimaryhumanlungfibroblasts,”clinicalandexperimentalallergy,vol.34,no.3,pp.437-444,2004)。作为正常伤口修复的一部分,tgf-β诱导多种细胞外基质蛋白的表达和分泌,同时还抑制它们的降解。在许多疾病中,过量的tgf-β导致过度的病理学组织纤维化,其导致损害的器官功能(m.h.branton和j.b.kopp,“tgf-βandfibrosis,”microbesandinfection,vol.1,no.15,pp.1349-1365,1999)。与对照相比,tgf-β表达在哮喘气道和bal液中增加。此外,tgf-β水平与上皮下纤维化的程度、气道成纤维细胞数目、和疾病严重程度关联(e.m.minshall,d.y.m.leung,r.j.martin等,“eosinophil-associatedtgf-β1mrnaexpressionandairwaysfibrosisinbronchialasthma,”americanjournalofrespiratorycellandmolecularbiology,vol.17,no.3,pp.326-333,1997;i.ohno,y.nitta,k.yamauchi等,“transforminggrowthfactorβ1(tgfβ1)geneexpressionbyeosinophilsinasthmaticairwayinflammation,”americanjournalofrespiratorycellandmolecularbiology,vol.15,no.3,pp.404-409,1996;l.p.boulet,m.belanger,和g.carrier,“airwayresponsivenessandbronchial-wallthicknessinasthmawithorwithoutfixedairflowobstruction,”americanjournalofrespiratoryandcriticalcaremedicine,vol.152,no.3,pp.865-871,1995)。因而,过量的tgf-β产生可以对上皮下纤维化的发展是关键的。
基质金属蛋白酶是能够降解细胞外基质分子的锌依赖性肽链内切酶。基质金属蛋白酶和它们的抑制剂之间的动态平衡是基质重构的关键决定因素(r.visse和h.nagase,“matrixmetalloproteinasesandtissueinhibitorsofmetalloproteinases:structure,function,andbiochemistry,”circulationresearch,vol.92,no.8,pp.827-839,2003)。哮喘气道中增加的上皮下纤维化的存在表明在二者之间存在的促纤维化平衡。在哮喘中,最重要的金属蛋白酶分子是mmp-9和其抑制剂——金属蛋白酶-(timp-)1的组织抑制剂(r.j.homer和j.a.elias,“airwayremodelinginasthma:therapeuticimplicationsofmechanisms,”physiology,vol.20,no.1,pp.28-35,2005)。mmp-9和timp-1水平在哮喘患者的气道活组织检查和bal液中都升高(a.m.vignola,l.riccobono,a.mirabella等,“sputummetalloproteinase-9/tissueinhibitorofmetalloproteinase-1ratiocorrelateswithairflowobstructioninasthmaandchronicbronchitis,”americanjournalofrespiratoryandcriticalcaremedicine,vol.158,no.6,pp.1945-1950,1998;m.hoshino,y.nakamura,j.sim,j.shimojo,和s.isogai,“bronchialsubepithelialfibrosisandexpressionofmatrixmetalloproteinase-9inasthmaticairwayinflammation,”journalofallergyandclinicalimmunology,vol.102,no.5,pp.783-788,1998;g.mautino,c.henriquet,c.gougat等,“increasedexpressionoftissueinhibitorofmetalloproteinase-1andlossofcorrelationwithmatrixmetalloproteinase-9bymacrophagesinasthma)。然而,与对照对象相比,哮喘患者具有显著更低的mmp-9与timp-1比率,其支持促纤维化平衡(抑制超过降解)。此外,较低的mmp-9与timp-1比率与气道阻塞的程度关联(e.a.kelly和n.n.jarjour,“roleofmatrixmetalloproteinasesinasthma,”currentopinioninpulmonarymedicine,vol.9,no.1,pp.28-33,2003)。
tgf-β作为潜伏性复合体由细胞分泌并且通过潜伏性tgf-β结合蛋白靶向细胞外基质用于随后的活化(m.hyytiäinen,c.penttinen,和j.keski-oja,“latenttgf-βbindingproteins:extracellularmatrixassociationandrolesintgf-βactivation,”criticalreviewsinclinicallaboratorysciences,vol.41,no.3,pp.233-264,2004)。mmp调节与基质结合的(matrix-bound)细胞因子释放(e.a.kellyandn.n.jarjour,“roleofmatrixmetalloproteinasesinasthma,”currentopinioninpulmonarymedicine,vol.9,no.1,pp.28-33,2003),并且tgf-β的活化是mmp-9依赖性的(chungeunlee,r.j.homer,z.zhuetal.,“interleukin-13inducestissuefibrosisbyselectivelystimulatingandactivatingtransforminggrowthfactorβ1,”journalofexperimentalmedicine,vol.194,no.6,pp.809-821,2001)。因此,升高水平的mmp-9在哮喘中的作用可以与tgf-β活化和其下游纤维化后遗症相关(r.j.homerandj.a.elias,“airwayremodelinginasthma:therapeuticimplicationsofmechanisms,”physiology,vol.20,no.1,pp.28-35,2005)。
3.6其它类型的纤维化
其它类型的纤维化非限制性地包括胰腺和肺的囊性纤维化、注射纤维化(injectionfibrosis)、心内膜心肌纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、和肾原性系统性纤维化。
囊性纤维化(cf、mucovidosis、粘液粘稠病(mucovisidosis))是遗传性常染色体隐形障碍。它是美国最常见的致死性遗传障碍之一,影响大约30,000名个体,并且在白种人群体中最流行,每3,300名新生儿中出现一例。涉及囊性纤维化的基因——在1989年被鉴定——编码称为囊性纤维化跨膜传导调节因子(cftr)的蛋白质。cftr正常地由遍及身体的外分泌上皮细胞表达,并且调节氯根离子、碳酸氢盐离子和谷胱甘肽进出细胞的运动。在囊性纤维化患者中,cftr基因的突变导致cftr蛋白功能的改变或完全失去,其导致外分泌分泌物的克分子渗透压浓度、ph和氧化还原性质的缺失。在肺中,cf自身通过存在堵塞气道的厚粘液分泌物显现。在其它外分泌器官比如汗腺中,cf自身可以不通过阻塞性表型显现,而是通过分泌物中异常的盐组成显现(因此临床汗液克分子渗透压浓度测试检测cf患者)。囊性纤维化患者疾病和死亡的主要原因是进行性肺病。阻塞气道通道的cf粘液的厚度被认为由分泌物的克分子渗透压浓度的异常,以及由存在大量源自炎性细胞的亚类——称为嗜中性粒细胞——的dna、肌动蛋白、蛋白酶和促氧化酶(prooxidativeenzyme)造成。实际上,cf肺病表征为对病毒和细菌病原体二者的早期极度活跃的嗜中性粒细胞介导的炎性反应。cf肺的高炎性(hyperinflammatory)综合征具有多种基础,在其之中促炎趋化因子——主要是il-8——和抗炎性细胞因子——主要是il-10——之间的不平衡已经被报道起主要的作用。参见chmiel等,clinrevallergyimmunol.3(1):5-27(2002)。研究已经报道了囊性纤维化患者的支气管肺泡灌洗液中的tnf-a、il-6和il-1β的水平比在健康对照支气管肺泡灌洗液中高(bondfield,t.l.等am.j.resp.crit.caremed.152(1):2111-2118,1995)。
注射纤维化(if)是肌肉内注射的并发症,其通常发生在婴儿和儿童的四头肌、三头肌和臀肌中,其中对象不能完全地弯曲受影响的肌肉。其通常是无痛的,但是是进展的。研究已经报道了糖蛋白骨桥蛋白(opn)在组织重构中起作用(liaw,l.等,j.clin.invest.101(7):1469-1478,1998),并且此促炎介质诱导人单核细胞中il-1β上调和伴随增强的tnf-α和il-6的产生(naldini,a.等,j.immunol.177:4267-4270,2006;weber,g.f.和cantor,h.cytokinegrowthfactorreviews.7(3):241-248,1996)。
心内膜心肌病(嗜酸性细胞增多综合征(hs))是表征为血液中持续升高的嗜酸性细胞计数(1500个嗜酸性细胞/mm3)的疾病过程。hs同时影响很多器官。研究已经报道了il-1β、il-6和tnf-α在病毒诱导的心肌炎患者中以高水平表达(satoh,m.,等,virchowsarchiv.427(5):503-509,1996)。症状可以包括心肌病、皮肤病变、血栓栓塞疾病、肺病、神经病、肝脾肿大(肝脏和脾脏同时增大)和减小的心室大小。治疗可以包括利用皮质类固醇减小嗜酸性细胞水平。
纵隔纤维化(mf)表征为集中在淋巴结上的浸润性钙化纤维化,其封阻大脉管和气道。mf是组织胞浆菌病的晚期并发症。纤维化的鼠模型中的研究已经报道了il-10和tnf-α显著地升高(ebrahimi,b,等am.j.pathol.158:2117-2125,2001)。
骨髓纤维化(髓样化生、慢性特发性骨髓纤维化、原发性骨髓纤维化)是其中骨髓经历纤维化的骨髓的障碍。骨髓纤维化导致进行性骨髓衰竭。平均存活是五年,并且死因包括感染、出血、器官衰竭、门静脉高血压和白血病转化。已经报道了tnf-α和il-6水平在病毒诱导的骨髓纤维化的动物模型中升高(bousse-kerdiles,m.,等ann.hematol.78:434-444,1999)。
腹膜后纤维化(奥蒙德病)是特征为腹膜后腔中的纤维组织增殖的疾病。腹膜后腔是包含肾、主动脉、肾道(renaltract)、和其它结构的体室(bodycompartment)。已经报道了il-1、il-6和tnf-α在腹膜后纤维化的发病机理中具有关键作用(demko,t.等,j.am.soc.nephrol.8:684-688,1997)。腹膜后纤维化的症状可以包括但不限于:下背疼痛、肾衰竭、高血压和深静脉血栓形成。
肾原性系统性纤维化(nsf、肾原性纤维化皮肤病)涉及皮肤、关节、眼睛和内部器官的纤维化。nsf可能与暴露于钆相关联。患者发展出大面积的硬化皮肤并且具有纤维化的结节和斑块。还可以出现伴随限制运动范围的屈曲挛缩。nsf显示了真皮成纤维细胞和树突细胞的增殖、增厚的胶原束、增加的弹性纤维、和粘蛋白的沉积物。一些报道已经表明促炎状态提供了引起肾原性系统性纤维化的诱病因素(saxena,s.等,int.urol.nephrol.40:715-724,2008),并且tnf-α的水平在肾原性系统性纤维化的动物模型中升高(steger-hartmann,t.,等exper.tox.pathol.61(6):537-552,2009)。
4.风险因素
4.1.主要风险因素
4.1.1.吸烟
虽然已经鉴定了纤维化气道疾病的大量风险因素(其中的一些可能在它们的成因中起作用),烟草烟雾保持copd的主要的和最重要的原因。吸的烟的数目越大,发展出纤维化气道疾病的风险越大。发展出纤维化气道疾病的压倒性多数的人是吸烟者,并且他们的肺功能比不吸烟者降低得更快。
最有效的干预是停止吸烟,优选地在早期阶段。戒烟的吸烟者将不会恢复失去的肺功能,但是减退速率可以回复至非吸烟者的减退速率。在早期阶段停止吸烟改善预后,而不管戒烟需要多少尝试。个体对发展纤维化气道疾病的易感性关于吸烟变化。大约15%的吸烟者将发展出临床上显著的copd,而大约50%将永远不发展出任何症状。肺功能的降低是逐步的,并且因为患者可以适应呼吸急促的症状,或可能未注意该症状,该疾病经常被延误诊断。研究已经显示取决于每天吸的烟的数目,24-47%的吸烟者发展出气流阻塞。暴露于被动吸烟增加对该疾病的易感性。
4.1.2.α-1抗胰蛋白酶缺陷
此罕见的遗传病况导致肺中关键的抗蛋白酶保护系统之一的完全缺乏。其是影响1:4000的人口的隐形障碍。患有α-1抗胰蛋白酶缺陷的患者处于在早期年龄(20和40岁的年龄之间)发展出气肿的危险中,并且通常具有重度家族病史。患有该缺陷和气肿的患者从每个父母遗传一个异常基因;也就是说,父母是该基因的携带者。这样的父母将具有血液中正常水平一半的抗胰蛋白酶,其可以足够保护免于发展出气肿。同样地,α-1抗胰蛋白酶缺陷患者的全部儿童将携带一个异常基因,但是将不受影响。α-1抗胰蛋白酶缺陷的两种常见形式由编码α-1抗胰蛋白酶的基因中的点突变造成。
4.2.相关的风险因素
4.2.1.环境污染
存在有力的证据表明纤维化气道疾病可以被空气污染恶化,但是当与吸烟相比时,污染在纤维化气道疾病的病因中的作用很小。通过煤和石油化石燃料的燃烧产生的,具有大量微粒物质、碳和二氧化硫的空气污染是纤维化气道疾病的发展中重要的原因或辅因子。这些主要地源自汽车废气排放,并且具体而言,光化学污染物比如臭氧受到谴责。在发展中国家,具体地对女性而言,通风不良的家庭中来自燃烧用于烹饪和供暖的生物质燃料的室内空气污染可以是纤维化气道疾病比如copd的重要的风险因素。
4.2.2.职业因素
其中工作者暴露于煤、二氧化硅和阳离子的一些职业(如矿工、纺织工人和水泥工)与纤维化气道疾病的增加的风险相关联。自20世纪50年代起,暴露于重金属镉和焊接烟气已经被认为是气肿的原因。
许多粉尘职业比暴露于气体或烟气更危险,并且与慢性支气管炎和多种形式的气道阻塞性疾病的发展相关联。船坞焊工和捻缝工也已知具有发展出纤维化气道疾病的增加的风险,以及在暴露于水泥粉尘的建筑业中工作的那些。
4.2.3.儿童期呼吸感染
出生后第一年内的胸部感染(如肺炎和细支气管炎)可以在以后的生活中易于发展出copd。这可能是由于出生时直到早期成年期肺生长结束呼吸系统的不完全发育。如果发育中的肺被伤害,将不能达到最大的潜在肺功能,其在早年产生copd的症状。
4.3.其它风险因素
在成因中起作用和/或充当纤维化气道疾病的早期症状(如肺纤维组织形成)的其它风险因素包括:超敏感性肺炎(最通常由吸入被细菌、真菌或动物制品污染的粉尘造成)、一些典型的结缔组织疾病(比如类风湿性关节炎、系统性红斑狼疮(sle)和硬皮病)、涉及结缔组织(比如肉样瘤病和韦格纳肉芽肿病)的其它疾病、感染、某些药物(例如胺碘酮、博来霉素、白消安、甲氨蝶呤、和呋喃妥因)、和对胸部的放射疗法。
5.用于治疗纤维化疾病或病况的当前的和新兴的治疗途径
当前正在用于治疗纤维化疾病的治疗剂被公开在datta等,britishjournalofpharmacology,163:141-172,2011中;其通过引用并入本文。这样的治疗剂的非限制性实例包括但不限于,纯化的牛v型胶原(例如,iw-001;immuneworks;unitedtherapeutics)、il-13受体拮抗物(例如,qax576;novartis)、蛋白质酪氨酸激酶抑制剂(例如,伊马替尼(imatinib)(gleevec®);craigdaniels/novartis)、内皮受体拮抗物(例如,act-064992(马西替坦(macitentan));actelion)、双内皮素受体拮抗物(例如,波生坦(tracleer®);actelion)、前列环素类似物(吸入性伊洛前列素(例如,ventavis®);actelion)、抗ctgf单克隆抗体(例如,fg-3019)、内皮素受体拮抗物(a-选择性)(例如,安立生坦(ambrisentan)(letairis®),gilead)、ab0024(arresto)、赖氨酰氧化酶样2(loxl2)单克隆抗体(例如,gs-6624(以前的ab0024);gilead)、c-junn-末端激酶(jnk)抑制剂(例如,cc-930;celgene)、吡非尼酮(例如,esbriet®(intermune),pirespa®(shionogi))、ifn-γ1b(例如,actimmune®;intermune)、针对全部三种tgf-β同种型的全中和igg4人抗体(例如,gc1008;genzyme)、tgf-β活化抑制剂(例如,stromedix(stx-100))、重组人正五聚蛋白-2蛋白(rhptx-2)(例如,prm151;promedior)、双特异性il4/il13抗体(例如,sar156597;sanofi)、人源化单克隆抗体靶向整合蛋白αvβ6(bibf1120;boehringeringelheim)、n-乙酰半胱氨酸(zambonspa)、西地那非(viagra®)、tnf拮抗物(例如,依那西普(etanercept)(enbrel®);pfizer)、糖皮质激素(例如,强的松、布地奈德、糠酸莫米松、丙酸氟替卡松、和糠酸氟替卡松)、支气管扩张剂(例如,白三烯改性剂(例如,孟鲁司特(singuair®))、抗胆碱能(anticholingertic)支气管扩张剂(例如,异丙托溴铵和噻托溴铵)、短效β2激动剂(例如,甲磺酸乙基异丙肾上腺素(bronkometer®)、肾上腺素、舒喘灵/舒喘宁、和特布他林)、长效β2激动剂(例如,沙美特罗、福莫特罗、indecaterol(onbrez®))、和混合型支气管扩张剂,其包括但不限于,symbicort®(包含布地奈德和福莫特罗二者)、皮质类固醇(例如,强的松、布地奈德、糠酸莫米松)、甲基化黄嘌呤和其衍生物(例如,咖啡因、氨茶碱、ibmx、副黄嘌呤、己酮可可碱、可可碱、和茶碱)、嗜中性粒细胞弹性酶抑制剂(例如,ono-5046、mr-889、l-694,458、ce-1037、gw-311616和tei-8362,和过渡态抑制剂,比如ono-6818、ae-3763、fk-706、ici-200,880、zd-0892和zd-8321)、磷酸二酯酶抑制剂(例如,罗氟司特(roflumilast)(daxas®;daliresp®)、和西洛司特(cilomilast)(ariflo®,sb-207499))。
5.1.激酶和磷酸化
激酶是催化从磷酸供体(通常是5'-三磷酸腺苷(atp))至受体底物的磷酰基转移反应的一组普遍的酶。虽然全部激酶均催化大体上相同的磷酰基转移反应,但是它们在它们的底物特异性、结构、和它们参与其中的途径中展示出卓越的多样性。全部可获得的激酶序列(大约60,000个序列)的最近的分类指示激酶可以被分组为25个同源(意思是源自共同的祖先)蛋白家族。基于结构折叠的相似性,这些激酶家族被装配为12个折叠组。进一步,25个家族中的22个(大约98.8%的全部序列)属于结构折叠已知的10个折叠组。其它3个家族中,多磷酸激酶形成不同的折叠组,并且2个剩余的家族均是整合膜激酶并且包括最后一个折叠组。这些折叠组不仅包括最广泛地传播的蛋白质折叠中的一些,比如罗斯曼样折叠(通过两个α螺旋以拓扑顺序β-α-β-α-β连接的三个或更多个平行β链)、铁氧还蛋白样折叠(沿着其主链具有特征βαββαβ二级结构的常见的α+β蛋白质折叠)、tim-桶折叠(barrelfold)(意思是由沿着肽主链交替的八个α螺旋和八个平行β链构成的保守型蛋白质折叠)、和反向平行β桶折叠(β桶是扭转和卷曲以形成其中第一条链氢键结合至最后一条链的闭合结构的大β片层),还包括蛋白质结构的全部主要类别(全部α、全部β、α+β、α/β)。在折叠组中,每个家族的核苷酸结合阈的核心具有相同的架构,并且蛋白质核心的拓扑学或者是同一的或者与循环交替变换相关。没有表明折叠组内的家族之间的同源性。
i组(23,124个序列)激酶包含蛋白s/t-y激酶、非典型蛋白激酶、脂质激酶、和atp抓握酶(graspenzyme)并且进一步包括包括蛋白s/t-y激酶和非典型蛋白激酶家族(22,074个序列)。这些激酶包括:胆碱激酶(ec2.7.1.32);蛋白激酶(ec2.7.137);磷酸化酶激酶(ec2.7.1.38);高丝氨酸激酶(ec2.7.1.39);i-磷脂酰肌醇4-激酶(ec2.7.1.67);链霉素6-激酶(ec2.7.1.72);乙醇胺激酶(ec2.7.1.82);链霉素3'-激酶(ec2.7.1.87);卡那霉素激酶(ec2.7.1.95);5-甲硫核糖激酶(ec2.7.1.100);紫霉素激酶(ec2.7.1.103);[羟甲基戊二酰-coa还原酶(nadph2)]激酶(ec2.7.1.109);蛋白质-酪氨酸激酶(ec2.7.1.112);[异柠檬酸脱氢酶(nadp+)]激酶(ec2.7.1.116);[肌球蛋白轻链]激酶(ec2.7.1.117);潮霉素-b激酶(ec2.7.1.119);钙/钙调蛋白依赖性蛋白激酶(ec2.7.1.123);视紫红质激酶(ec2.7.1.125);[β-肾上腺素能受体]激酶(ec2.7.1.126);[肌球蛋白重链]激酶(ec2.7.1.129);[tau蛋白]激酶(ec2.7.1.135);大环内脂2'-激酶(ec2.7.1.136);i-磷脂酰肌醇3-激酶(ec2.7.1.137);[rna-聚合酶]-亚基激酶(ec2.7.1.141);磷脂酰肌醇-4,5-二磷酸3-激酶(ec2.7.1.153);和磷脂酰肌醇-4-磷酸3-激酶(ec2.7.1.154)。i组进一步包括脂质激酶家族(321个序列)。这些激酶包括:i-磷脂酰肌醇-4-磷酸5-激酶(ec2.7.1.68);id-肌-肌醇-三磷酸3-激酶(ec2.7.1.127);肌醇-四磷酸5-激酶(ec2.7.1.140);i-磷脂酰肌醇-5-磷酸4-激酶(ec2.7.1.149);i-磷脂酰肌醇-3-磷酸5-激酶(ec2.7.1.150);肌醇-多磷酸多激酶(ec2.7.1.151);和肌醇-六磷酸激酶(ec2.7.4.21)。i组进一步包括atp-抓握激酶(729个序列),其包括肌醇-四磷酸i-激酶(ec2.7.1.134);丙酮酸、磷酸二激酶(ec2.7.9.1);和丙酮酸、水二激酶(ec2.7.9.2)。
ii组(17,071个序列)激酶包含罗斯曼样激酶。ii组包括p-环激酶家族(7,732个序列)。这些包括葡糖酸激酶(ec2.7.1.12);磷酸核酮糖激酶(ec2.7.1.19);胸苷激酶(ec2.7.1.21);核糖基烟酰胺激酶(ec2.7.1.22);脱磷酸-coa激酶(ec2.7.1.24);腺苷酰硫酸激酶(ec2.7.1.25);泛酸激酶(ec2.7.1.33);蛋白激酶(细菌)(ec2.7.1.37);尿苷激酶(ec2.7.1.48);莽草酸激酶(ec2.7.1.71);脱氧胞苷激酶(ec2.7.1.74);脱氧腺苷激酶(ec2.7.1.76);多核苷酸5'-羟基-激酶(ec2.7.1.78);6-磷酸果糖-2-激酶(ec2.7.1.105);脱氧鸟苷激酶(ec2.7.1.113);四酰基二糖4'-激酶(ec2.7.1.130);脱氧核苷激酶(ec2.7.1.145);腺苷钴啉醇酰胺激酶(ec2.7.1.156);多磷酸激酶(ec2.7.4.1);磷酸甲羟戊酸激酶(ec2.7.4.2);腺苷酸激酶(ec2.7.4.3);核苷-磷酸激酶(ec2.7.4.4);鸟苷酸激酶(ec2.7.4.8);胸苷酸激酶(ec2.7.4.9);核苷-三磷酸-腺苷酸激酶(ec2.7.4.10);(脱氧)核苷-磷酸激酶(ec2.7.4.13);胞苷酸激酶(ec2.7.4.14);和尿苷酸激酶(ec2.7.4.22)。ii组进一步包括烯醇丙酮酸磷酸羧激酶家族(815个序列)。这些酶包括蛋白激酶(hpr激酶/磷酸酶)(ec2.7.1.37);烯醇丙酮酸磷酸羧激酶(gtp)(ec4.1.1.32);和烯醇丙酮酸磷酸羧激酶(atp)(ec4.1.1.49)。ii组进一步包括磷酸甘油酸激酶(1,351个序列)家族。这些酶包括磷酸甘油酸激酶(ec2.7.2.3)和磷酸甘油酸激酶(gtp)(ec2.7.2.10)。ii组进一步包括天冬氨酸激酶家族(2,171个序列)。这些酶包括氨基甲酸激酶(ec2.7.2.2);天冬氨酸激酶(ec2.7.2.4);乙酰谷氨酸激酶(ec2.7.2.81);谷氨酸5-激酶(ec2.7.2.1)和鸟苷酸激酶(ec2.7.4.)。ii组进一步包括磷酸果糖激酶样激酶家族(1,998个序列)。这些酶包括6-磷酸果糖激酶(ec2.7.1.11);nad(+)激酶(ec2.7.1.23);i-磷酸果糖激酶(ec2.7.1.56);二磷酸-果糖-6-磷酸i-磷酸转移酶(ec2.7.1.90);鞘氨醇激酶(ec2.7.1.91);二酰基甘油激酶(ec2.7.1.107);和神经酰胺激酶(ec2.7.1.138)。ii组进一步包括核糖激酶样家族(2,722个序列)。这些酶包括:葡糖激酶(ec2.7.1.2);己酮糖激酶(ec2.7.1.3);果糖激酶(ec2.7.1.4);6-磷酸果糖激酶(ec2.7.1.11);核糖激酶(ec2.7.1.15);腺苷激酶(ec2.7.1.20);吡哆醛激酶(ec2.7.1.35);2-脱氢-3-脱氧葡糖酸激酶(ec2.7.1.45);羟甲基嘧啶激酶(ec2.7.1.49);羟乙基噻唑激酶(ec2.7.1.50);i-磷酸果糖激酶(ec2.7.1.56);肌苷激酶(ec2.7.1.73);5-脱氢-2-脱氧葡糖酸激酶(ec2.7.1.92);塔格糖-6-磷酸激酶(ec2.7.1.144);adp依赖性磷酸果糖激酶(ec2.7.1.146);adp-依赖性果糖激酶(ec2.7.1.147);和磷酸甲基嘧啶激酶(ec2.7.4.7)。ii组进一步包括硫胺素焦磷酸激酶家族(175个序列),其包括硫胺素焦磷酸激酶(ec2.7.6.2)。ii组进一步包括甘油酸激酶家族(107个序列),其包括甘油酸激酶(ec2.7.1.31)。
iii组激酶(10,973个序列)包括铁氧还蛋白样折叠激酶。iii组进一步包括核苷-二磷酸激酶家族(923个序列)。这些酶包括核苷-二磷酸激酶(ec2.7.4.6)。iii组进一步包括hppk激酶家族(609个序列)。这些酶包括2-氨基-4-羟基-6-羟甲基二氢喋啶焦磷酸激酶(ec2.7.6.3)。iii组进一步包括胍基激酶家族(324个序列)。这些酶包括胍乙酸激酶(ec2.7.3.1);肌酸激酶(ec2.7.3.2);精氨酸激酶(ec2.7.3.3);和吲哚磷脂激酶(ec2.7.3.5)。iii组进一步包括组氨酸激酶家族(9,117个序列)。这些酶包括蛋白激酶(组氨酸激酶)(ec2.7.1.37);[丙酮酸脱氢酶(硫辛酰胺)]激酶(ec2.7.1.99);和[3-甲基-2-氧丁酸脱氢酶(硫辛酰胺)]激酶(ec2.7.1.115)。
iv组激酶(2,768个序列)包含核糖核酸酶h样激酶。这些酶包括己糖激酶(ec2.7.1.1);葡糖激酶(ec2.7.1.2);果糖激酶(ec2.7.1.4);鼠李树胶糖激酶(ec2.7.1.5);甘露糖激酶(ec2.7.1.7);葡糖酸激酶(ec2.7.1.12);l-核酮糖激酶(ec2.7.1.16);木酮糖激酶(ec2.7.1.17);赤藓糖醇激酶(ec2.7.1.27);甘油激酶(ec2.7.1.30);泛酸激酶(ec2.7.1.33);d-核酮糖激酶(ec2.7.1.47);l-岩藻酮糖激酶(ec2.7.1.51);l-木酮糖激酶(ec2.7.1.53);阿洛糖激酶(ec2.7.1.55);2-脱氢-3-脱氧半乳糖酸激酶(ec2.7.1.58);n-乙酰葡糖胺激酶(ec2.7.1.59);n-乙酰甘露糖胺激酶(ec2.7.1.60);多磷酸-葡萄糖磷酸转移酶(ec2.7.1.63);β-糖苷激酶(ec2.7.1.85);乙酸激酶(ec2.7.2.1);丁酸激酶(ec2.7.2.7);支链脂肪酸激酶(ec2.7.2.14);和丙酸激酶(ec2.7.2.15)。
v组激酶(1,119个序列)包含timβ桶激酶。这些酶包括丙酮酸激酶(ec2.7.1.40)。
vi组激酶(885个序列)包含ghmp激酶。这些酶包括半乳糖激酶(ec2.7.1.6);甲羟戊酸激酶(ec2.7.1.36);高丝氨酸激酶(ec2.7.1.39);l-阿拉伯糖激酶(ec2.7.1.46);岩藻糖激酶(ec2.7.1.52);莽草酸激酶(ec2.7.1.71);4-(胞苷5'-二磷酸)-2-c-甲基-d-赤藓糖醇激酶(ec2.7.1.148);和磷酸甲羟戊酸激酶(ec2.7.4.2)。
vii组激酶(1,843个序列)包含air合成酶样激酶。这些酶包括硫胺素-磷酸激酶(ec2.7.4.16)和硒化物、水二激酶(ec2.7.9.3)。
viii组激酶(565个序列)包含核黄素激酶(565个序列)。这些酶包括核黄素激酶(ec2.7.1.26)。
ix组激酶(197个序列)包含二羟基丙酮激酶。这些酶包括甘油酮激酶(ec2.7.1.29)。
x组激酶(148个序列)包含推定的甘油酸激酶。这些酶包括甘油酸激酶(ec2.7.1.31)。
xi组激酶(446个序列)包含多磷酸激酶。这些酶包括多磷酸激酶(ec2.7.4.1)。
xii组激酶(263个序列)包含整合膜激酶。xii组包括多萜醇激酶家族。这些酶包括多萜醇激酶(ec2.7.1.108)。xii组进一步包括十一萜醇激酶家族。这些酶包括十一萜醇激酶(ec2.7.1.66)。
激酶在众多细胞代谢及信号传导途径中起必不可少的作用,并且它们属于在结构水平、生物化学水平和细胞水平方面研究最彻底的酶。尽管事实上所有激酶使用相同的磷酸供体(大部分情况下为atp),并且表面上催化同样的磷酰基转移反应,但它们在其结构折叠和底物识别机制上展示出显著的多样性。这很可能主要是由于它们的底物的结构和性质极为多样化的特性。
5.1.1促分裂原活化蛋白激酶-活化的蛋白激酶(mk2和mk3)
不同组的mapk-活化蛋白激酶(map-kapk)已经限定了促分裂原活化蛋白激酶(mapk)的下游。这些酶将信号转导至不为mapk的直接底物的靶蛋白,并且因此,用来利用mapk级联将磷酸化依赖的信号传导转至多种细胞功能。这些组中的一个由三种mapkapk:mk2、mk3(又称为3pk)和mk5(还命名为prak)形成。促分裂原活化蛋白激酶-活化的蛋白激酶2(也称作“mapkapk2”、“mapkap-k2”、“mk2”)是丝氨酸/苏氨酸(ser/thr)蛋白激酶家族的激酶。mk2与mk3高度同源(大约75%氨基酸同一性)。mk2和mk3的激酶结构域与钙/钙调蛋白依赖性蛋白激酶(camk)、磷酸化酶b激酶和核糖体s6激酶(rsk)同种型的c-末端激酶结构域(ctkd)最相似(大约35%-40%同一性)。mk2基因编码两种可变剪接的370个氨基酸(mk2a)和400个氨基酸(mk2b)的转录物。mk3基因编码382个氨基酸的一种转录物。mk2蛋白和mk3蛋白高度同源,但mk2a具备较短的c-末端区。mk2b的c-末端包含较短的mk2a同种型中不存在的功能二分的核定位序列(nls)(lys-lys-xaa10-lys-arg-arg-lys-lys;seqidno:23),其指示可变剪接决定mk2同种型的细胞定位。mk3具备相似的核定位序列。在mk2b和mk3二者中发现的核定位序列均包含d结构域(leu-leu-lys-arg-arg-lys-lys;seqidno:24),研究已经显示其介导mk2b和mk3与p38α和p38β的特异性相互作用。mk2b和mk3还具备位于nls和d结构域的n-末端的功能核输出信号(nes)。mk2b中的nes足以在刺激之后引发核输出,该过程可以被来普霉素(leptomycin)b抑制。mk2和mk3中的催化结构域的n-末端序列富含脯氨酸,并且包含一个(mk3)或两个(mk2)推定的src同源3(sh3)结构域-结合位点,研究已经显示对于mk2其介导体外与c-abl的sh3结构域的结合。最近的研究表明此结构域参与mk2介导的细胞迁移。
mk2b和mk3主要位于休眠细胞的细胞核中,而mk2a存在于细胞质中。mk2b和mk3二者均在应激刺激之后经由染色体区域维持蛋白(crm1)依赖性机制迅速地输出至细胞质。mk2b的核输出似乎由激酶活化介导,因为激酶的活化环内thr334的磷酸模拟突变(phosphomimeticmutation)提高了mk2b的细胞质定位。不受理论的束缚,认为mk2b和mk3可以包含组成型活性的nls和磷酸化调节的nes。
mk2和mk3似乎广泛表达,并且主要在心、骨骼肌和肾组织中表达。
5.1.2.活化
p38α和p38β的多种活化剂有效地刺激mk2和mk3活性。p38在四个脯氨酸定向位点thr25、thr222、ser272和thr334上介导mk2的体外和体内磷酸化。在这些位点中,只有thr25在mk3中是非保守的。不受理论的束缚,虽然不知道磷酸化的thr25的功能,但是其在两个sh3结构域-结合位点之间的位置表面其可以调节蛋白质-蛋白质相互作用。mk2中的thr222(mk3中的thr201)位于激酶结构域的活化环中,并且已经显示对mk2和mk3激酶活性必不可少。mk2中的thr334(mk3中的thr313)位于催化结构域的c-末端,并且对激酶活性必不可少。已经解析了mk2的晶体结构并且——不受理论的束缚——表明thr334磷酸化可以充当mk2核输入和输出的转换。thr334的磷酸化还可以减弱或干扰mk2的c末端与催化结构域的结合,这暴露了nes并且促进核输出。
研究已经显示,虽然p38能够在细胞核中活化mk2和mk3,但是实验证据表明mk2和mk3的活化和核输出偶联磷酸化依赖性构象转换,其还支配p38稳定性和定位,并且p38自身的细胞定位受mk2并且可能受mk3控制。另外的研究已经显示,在mk2的磷酸化和活化之后,细胞核的p38以与mk2的复合物输出至细胞质。p38和mk2之间的相互作用对于p38稳定性可能是重要的,因为研究指示mk2缺陷型细胞中的p38水平低,并且无催化活性的mk2蛋白的表达恢复p38水平。
5.1.3.底物和功能
进一步的研究已经显示小的热休克蛋白hspb1(又称为热休克蛋白27或hsp27)、淋巴细胞特异性蛋白lsp-i和波形蛋白被mk2磷酸化。hspb1是特别感兴趣的,因为其形成大的寡聚物,其可以充当分子伴侣并且保护细胞免受热休克和氧化应激。在磷酸化之后,hspb1失去其形成大的寡聚物的能力,并且不能够阻断肌动蛋白聚合,这表明mk2介导的hspb1的磷酸化起内环境稳定功能,其目标在于调节否则将在应激期间非稳定的肌动蛋白动力学。
mk3也显示在体外和体内磷酸化hspb1,但是还没有阐明其在应激条件期间的作用。mk2与mk3共享许多底物。两种酶具有相当的底物偏好,并且以相似的动力学常数磷酸化肽底物。发现被mk2高效磷酸化所需的最小序列是hyd-xaa-arg-xaa-xaa-pser/thr(seqidno:25),其中hyd是体积大的疏水残基。
实验证据支持p38在调节细胞因子生物合成和细胞迁移中的作用。定向缺失小鼠中的mk2基因表明,虽然p38介导许多相似激酶的活化,但是mk2似乎是负责这些p38依赖性生物过程的关键激酶。失去mk2导致(i)脂多糖(lps)诱导的细胞因子比如肿瘤坏死因子α(tnfα)、白介素-6(il-6)和γ干扰素(ifn-γ)合成中的缺陷,和(ii)改变小鼠胚胎胎成纤维细胞、平滑肌细胞和嗜中性粒细胞的迁移。
与mk2在炎性反应中的作用一致,mk2缺陷型小鼠显示对单核细胞增多性李斯特菌感染的增加的易感性,和局部缺血之后减少的炎症介导的神经元死亡。因为在mk2缺陷型细胞中p38蛋白水平也显著减小,辨别这些表型是否单独地由于失去mk2是必要的。为达到此目的,在mk2缺陷型细胞中表达mk2突变体,并且结果指示mk2催化活性对恢复p38水平不是必要的,但是为调节细胞因子生物合成所需。
mk2的敲除和敲落研究为以下提供了有力支持:活化的mk2通过与il-6mrna的富含au的3’非翻译区相互作用的蛋白质的磷酸化来增强il-6mrna的稳定性。具体而言,已经显示mk2主要地负责hnrnpa0——稳定il-6rna的mrna-结合蛋白——的磷酸化。此外,调查多种的炎性疾病的多种另外的研究已经发现促炎细胞因子——比如il-6、il-1β、tnf-α和il-8——的水平在来自患有稳定的慢性阻塞性肺病(copd)的患者的诱导痰或吸烟者的肺泡巨噬细胞中增加(keatingsv.等,amjrespcritcaremed,1996,153:530-534;lim,s.等,jrespircritcaremed,2000,162:1355-1360)。促炎细胞因子比如白介素-8(il-8)和白介素-6(il-6)、以及相关的下游细胞粘附分子(cam)比如细胞间粘附分子-1(icam-1)和血管细胞粘附分子-1(vcam-1)、基质金属蛋白酶比如基质金属蛋白酶-7(mmp-7)、和信号传导分子比如s100钙结合蛋白a12(s100a12,又称为钙粒蛋白c)在周围血中升高的水平已经发现与患有特发性肺纤维化的患者中的死亡率、无肺移植存活和疾病进展相关联(richards等.,amjrespircritcaremed,2012,185:67-76;richards,t.等,amjrespircritcaremed,181:a1120,2010;moodley,y.等,amjrespircellmolbiol.,29(4):490-498,2003)。合起来,这些研究暗示通过mk2活化诱导的升高水平的炎性细胞因子可以参与气道或肺组织疾病的发病机理;并且表明了其用于治疗气道或肺组织疾病——比如特发性肺纤维化和慢性阻塞性肺病(copd)——的抗细胞因子疗法的可能性(chung,k.,eurrespirj,2001,18:suppl.34:50-59)。
5.1.4.mrna翻译的调节
使用mk2基因敲除小鼠或mk2缺陷型细胞的先前的研究已经显示,mk2通过增加其mrna的翻译速率来增加炎性细胞因子——包括tnf-α、il-1和il-6——的产生。在mk2缺陷型小鼠中不能检测到tnf-α转录、加工和释放的显著减少。已知p38途径在调节mrna稳定性中起重要作用,并且mk2代表p38通过其介导此功能的很可能的靶标。利用mk2缺陷型小鼠的研究指示,mk2的催化活性对其在细胞因子产生和迁移中的作用是必需的,这表明——不受理论的束缚——mk2磷酸化涉及mrna稳定性的靶标。与此一致,mk2已经显示结合和/或磷酸化核内不均一核糖核蛋白(hnrnp)a0、锌指蛋白36(tristetraprolin)、聚(a)-结合蛋白pabp1和hur——广泛表达的rna结合蛋白的elav(黑腹果蝇(drosophilamelanogaster)中的胚胎致性异常视觉)家族的成员。已知这些底物与在3’非翻译区富含au元件的mrna结合或共纯化,这表明mk2可以调节富含au的mrna比如tnf-α的稳定性。当前不知道mk3是否起相似的作用,但是mk2缺陷成纤维细胞的lps处理完全地废除了hnrnpao磷酸化,这表明mk3不能够补偿mk2的损失。
mk3与mk2一起参与真核生物延伸因子2(eef2)激酶的磷酸化。eef2激酶磷酸化和钝化eef2。eef2活性对mrna在翻译期间的延伸很关键,并且eef2在thr56上的磷酸化导致mrna翻译的终止。eef2激酶在ser377上的mk2和mk3磷酸化表明这些酶可以调节eef2激酶活性,并且从而调节mrna翻译延伸。
5.1.5.通过mk2和mk3的转录调节
与许多mk相似,细胞核的mk2有助于camp应答元件结合(creb)蛋白、血清应答因子(srf)和转录因子er81的磷酸化。野生型和mk2缺陷型细胞的比较揭示了mk2是应激诱导的主要srf激酶,这表明mk2在应激介导的立即早期应答中的作用。mk2和mk3二者均在体内与碱性螺旋-环-螺旋转录因子e47相互作用,并且在体外磷酸化e47。发现mk2介导的e47的磷酸化抑制e47的转录活性,并且从而抑制e47依赖性基因表达,这表明mk2和mk3可以调节组织特异性基因表达和细胞分化。
5.1.6.mk2和mk3的其它靶标
还已经鉴别了多种其它mk2和mk3底物,其反映了mk2和mk3在多钟生物过程中的多样功能。支架蛋白14-3-3ζ是生理性mk2底物。研究指示14-3-3ζ与大量细胞信号转导途径的组分相互作用,包括蛋白激酶、磷酸酶和转录因子。另外的研究已经显示,mk2介导的14-3-3ζ在ser58上的磷酸化危害其结合活性,这表明mk2可以影响通常由14-3-3ζ调节的多种信号转导分子的调节。
另外的研究已经显示,mk2也与7元arp2和arp3复合物的p16亚基(p16-arc)相互作用并使其在ser77上磷酸化。p16-arc在调节肌动蛋白细胞骨架中起作用,这表明mk2可能参与此过程。
mk2和mk3还可以磷酸化5-脂加氧酶。5-脂加氧酶催化炎性介质白细胞三烯的形成中的初始步骤。酪氨酸羟化酶、糖原合酶和akt也显示被mk2磷酸化。最后,mk2在ser1210上磷酸化肿瘤抑制蛋白马铃薯球蛋白,其形成14-3-3ζ的停靠位点。马铃薯球蛋白和错构瘤蛋白通常形成功能复合物,其通过拮抗mtor依赖性信号传导负调节细胞生长,这表明p38-介导的mk2的活化可以通过增加14-3-3ζ与马铃薯球蛋白的结合来调节细胞生长。
5.2.激酶抑制
真核生物蛋白激酶构成借助其催化结构域而相关的最大的同源蛋白超家族之一。最相关的蛋白激酶特异于丝氨酸/苏氨酸或酪氨酸磷酸化。蛋白激酶在细胞对细胞外刺激物的应答中起不可或缺的作用。因而,认为蛋白激酶的刺激是信号转导系统中最常见的活化机制之一。已知许多底物通过多种蛋白激酶经历磷酸化,并且已经公布了关于多种蛋白激酶的催化结构域的一级序列的相当量的信息。这些序列共享参与atp结合、催化和结构完整性的维持的大数目残基。大部分蛋白激酶具备很保守的30-32kda催化结构域。
研究已经试图鉴定和利用蛋白激酶的调节元件。这些调节元件包括抑制剂、抗体和封闭肽。
5.2.1.抑制剂
酶抑制剂是与酶结合从而降低酶活性的分子。结合抑制剂可以阻止底物进入酶的活性位点和/或妨碍酶催化其反应。抑制剂结合是可逆或不可逆的。不可逆的抑制剂通常与酶作用并且在使其化学地改变(例如,通过修饰酶活性必需的关键氨基酸残基),使得其不再能够催化其反应。与此相反,可逆的抑制剂非共价地结合,并且取决于这些抑制剂结合酶、酶-底物复合物还是二者,产生不同的抑制类型。
酶抑制剂通常通过其特异性和效价来评估。如在此环境中使用的,术语“特异性”指的是抑制剂与其它蛋白质的选择性附着或其没有结合至其它蛋白质。如本文使用的,术语“效价”指的是抑制剂的解离常数,其指示抑制酶所需的抑制剂的浓度。
已经研究了用作蛋白激酶活性调节中的工具的蛋白激酶的抑制剂。已经研究了将抑制剂用于,例如,细胞周期蛋白依赖性(cdk)激酶、map激酶、丝氨酸/苏氨酸激酶、src家族蛋白酪氨酸激酶、酪氨酸激酶、钙调蛋白(cam)激酶、酪蛋白激酶、限制点激酶(chk1)、糖原合酶激酶3(gsk-3)、c-junn-末端激酶(jnk)、促分裂原活化蛋白激酶1(mek)、肌球蛋白轻链激酶(mlck)、蛋白激酶a、akt(蛋白激酶b)、蛋白激酶c、蛋白激酶g、蛋白质酪氨酸激酶、raf激酶和rho激酶。
5.2.2.封闭肽
肽为由两个或更多个氨基酸的链组成的化合物,由此链中的一个氨基酸的羧基经由肽键连接至另一个氨基酸的氨基连接。肽已经尤其用于研究蛋白质结构和功能。合成肽尤其可以用作探针以查看在哪里发生蛋白质-肽相互作用。抑制性肽尤其可以用于临床研究以检查肽对蛋白激酶、癌蛋白和其它障碍的抑制作用。
已经研究了多种封闭肽的用途。例如,细胞外信号调节激酶(erk),为mapk蛋白激酶,其对细胞增殖和分化是必不可少的。mapk的活化需要级联机制,由此mapk被上游mapkk(mek)磷酸化,其然后转而被第三激酶mapkkk(mekk)磷酸化。erk抑制肽通过与erk结合起mek诱铒的作用。
其它封闭肽包括autocamtide-2相关抑制肽(aip)。此合成肽具有高度特异性,是ca2+/钙调蛋白依赖性蛋白激酶ii(camkii)的有效抑制剂。aip是autocamtide-2的不可磷酸化的类似物——camkii的高选择性肽底物。aip以100nm的ic50(ic50是获得50%抑制所需的抑制剂的浓度)抑制camkii。aip抑制关于syntide-2(camkii肽底物)和atp是非竞争性的,但是关于autocamtide-2是竞争性的。抑制不受是否存在ca2+/钙调蛋白影响。camkii活性完全被aip(1μm)抑制,而pka、pkc和camkiv不受影响。
其它封闭肽包括细胞分裂蛋白激酶5(cdk5)抑制肽(cip)。cdk5当与p25缔合时,磷酸化阿尔茨海默病特异性磷酸化表位处的微管蛋白tau。p25是截短的活化剂,其在暴露于淀粉状蛋白β肽之后,由生理性cdk5活化剂p35产生。在神经元感染cip之后,cip选择性地抑制p25/cdk5活性,并抑制皮层神经元中异常的tau磷酸化。由cip展现的特异性的原因不被完全地理解。
已经研究了下列另外的封闭肽:细胞外调节激酶2(erk2)、erk3、p38/hog1、蛋白激酶c、酪蛋白激酶ii、ca2+/钙调蛋白激酶iv、酪蛋白激酶ii、cdk4、cdk5、dna依赖性蛋白激酶(dna-pk)、丝氨酸/苏氨酸-蛋白激酶pak3、磷酸肌醇(pi)-3激酶、pi-5激酶、pstaire(cdk高度保守序列)、核糖体s6激酶、gsk-4、生发中心激酶(gck)、sapk(应活化化蛋白激酶)、sek1(应激信号传导激酶)、和粘着斑激酶(fak)。
5.3.细胞穿透肽(cpp)
细胞穿透(penetrataing)肽(cpp)是能够穿透哺乳动物细胞的质膜并且跨越膜传输许多类型和分子量的复合物的一类肽。这些复合物包括效应分子,比如蛋白质、dna、缀合肽(conjugatedpeptide)、寡核苷酸,和小颗粒比如脂质体。当cpp化学地连接或融合至其它蛋白质时,得到的融合蛋白仍能够进入细胞。虽然转导的准确机制是未知的,但是这些蛋白质的内化不认为是受体介导或转运体介导的。cpp的长度通常是10-16个氨基酸,并且可以更具其组成分组,比如,例如,富含精氨酸和/或赖氨酸的肽。
能够将效应分子传输入细胞的cpp的用途在药物的设计中越来越有吸引力,因为其促进细胞摄取货物分子。这些通常取决于其序列分类为两亲性(意思是具有极性及非极性端二者)或阳离子(意思是或涉及包含净正电荷原子)的细胞穿透肽,其为大分子提供非侵入性递送技术。cpp通常被称为“特洛伊肽(trojanpeptide)”、“膜易位序列”、“蛋白转导结构域(ptd)”或“细胞穿透性蛋白(cpp)”。cpp也可以用于帮助新型hspb1激酶抑制剂穿透细胞膜(参见:2008年1月10提交的标题为“polypepticinhibitorsofhspb1kinaseandusesthereof”的美国专利申请序号11/972,459;和2008年8月7日提交的标题为“kinaseinhibitorsandusesthereof”的美国专利申请序号12/188,109,每个申请的内容通过引用以其全部并入本文)。
5.3.1.含有病毒cpp的蛋白质
描述为具有转导性质的第一蛋白质是病毒来源的。这些蛋白质仍为用于cpp作用的最普遍认可的模型。在细胞穿透肽之中,已经最广泛地研究了富含精氨酸的细胞穿透肽,包括但不限于tat肽(el-sayed,a.等,aapsj.11,13-22,2009;wender,p.等,adv.drugdeliv.rev.60,452-472,2008)。
tat(hiv-1反式活化蛋白基因产物)是86个氨基酸的多肽,其充当整合的hiv-1基因组的强大的转录因子。tat在潜伏感染的细胞中对病毒基因组作用刺激病毒复制。tat蛋白的易位性质使得其能够活化休眠的感染细胞,并且其可以通过调节包括细胞因子的许多细胞基因来参与引发未感染细胞的随后感染。tat的最小cpp是9个氨基酸的蛋白质序列rkkrrqrrr(tat49-57;seqidno:20)。利用较长的tat片段的研究成功地证明了大至120kda的融合蛋白的转导。已经证明多种tat-cpp的添加以及合成的tat衍生物介导膜易位。含有tatcpp的融合蛋白已经在涉及癌症、传输死亡-蛋白质进入细胞、和神经变性障碍的疾病模型的实验中用作治疗部分。
vp22是hsv-1被膜蛋白(tegumentprotein)——hsv病毒粒子的结构部分。vp22能够不依赖于受体易位,并且在细胞核中积聚。vp22的此性质将该蛋白质归类为含有cpp的肽。包含全长vp22的融合蛋白已经有效跨越质膜易位。
5.3.2.具有细胞间易位性质的同源异型蛋白
同源异型蛋白是参与形态学过程的高度保守的反式活化转录因子。它们通过60个氨基酸的特异序列结合至dna。dna-结合同源域是同源异型蛋白的最高度保守的序列。已经描述了多种同源异型蛋白展现cpp样活性;它们能够以不具有细胞类型特异性的不依赖于能量且不依赖于胞吞作用的方式有效地跨越细胞膜易位。
触角蛋白(antp)是能够跨越细胞膜易位的反式活化因子;能够易位的最小序列是16个氨基酸的肽,其对应于蛋白质的同源域(hd)的第三个螺旋。此螺旋的内化在4℃发生,这表明此过程不依赖于胞吞作用。作为具有antphd的融合蛋白产生的多至100个氨基酸的肽穿透细胞膜。
能够易位的其它同源域包括果蝇ftz(ftz)和果蝇en(en)同源域。许多同源域共享高度保守的第三螺旋。
5.3.3.人cpp
人cpp在引入人患者之后可以绕过可能的免疫原性问题。具有cpp序列的肽包括:hoxa-5、hox-a4、hox-b5、hox-b6、hox-b7、hox-d3、gax、mox-2和ftzcpp。这些蛋白质均共享在antpcpp中发现的序列。其它cpp包括胰岛-1、白介素-1、肿瘤坏死因子、和来自卡波西-成纤维细胞生长因子(或fgf-4)信号肽的疏水序列,其能够不依赖于能量、受体和胞吞作用易位。未确定的cpp包括成纤维细胞生长因子(fgf)家族的成员。
6.mk2抑制剂和纤维化疾病或病况的治疗
活化蛋白激酶2(mapkapk2或mk2,其为p38mapk下游的丝氨酸/苏氨酸激酶底物)的促分裂原活化蛋白激酶涉及通过结疤和纤维化而复杂化的许多炎性疾病(lopes,l.等,biochembiophysrescommun.,382(3):535-9,2009)。这些包括但不限于癌症、内膜增生、器官纤维化、腹腔粘连、炎性肠道疾病、和类风湿性关节炎。除特发性肺纤维化(ipf)之外,涉及炎症和纤维化并且影响肺的其它障碍包括急性肺损伤(ali)、器官移植排斥(肺移植也是ipf的后期治疗)、继发于脓毒症的器官衰竭、急性肺衰竭、自身免疫性疾病比如硬皮病、和慢性阻塞性肺病(copd)。
纤维化的发展已知需要导致成肌纤维细胞表型的细胞的成纤维细胞的炎症、增殖和募集(horowitzj.等,seminrespircritcaremed.,27(6):600-612,2006)。已经显示mk2在转录和转录后水平上控制基因表达(neiningera.等,jbiolchem.2002;277(5):3065-8,thomast.等,jneurochem.,105(5):2039-52,2008;johansenc.等,jimmunol.,176(3):1431-8,2006;rousseaus.等,emboj.21(23):6505-14,2002)以及细胞骨架架构(lopes,l.等,biochembiophysrescommun.,382(3):535-9,2009)。此外,已经显示活化的mk2增加炎性细胞因子mrna的翻译和稳定性,并且引起肌动蛋白重组;并且mk2的抑制与减少的炎症(ward,b.等,jsurgres.,169(1):e27-36,2011)和成肌纤维细胞分化(lopes,l.等,biochembiophysrescommun.,382(3):535-9,2009)相关联。
总之,这些数据表明mk2的抑制可以向患有纤维化障碍或病况(例如,特发性肺纤维化(ipf)、急性肺损伤(ali)和移植物排斥)的患者提供治疗益处。在此方面,所述发明提供了使用mk2的细胞穿透性肽基抑制剂干预炎症和纤维化的过程的方法。
技术实现要素:
根据一个方面,所述发明提供了用于治疗哮喘的方法,其包括:向有需要的对象施用药学组合物,其包括治疗量的氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)的多肽,或由第一多肽和第二多肽之间的融合物制成的其功能等价物,和其药学上可接受的载体,所述第一多肽是细胞穿透肽(cpp),其选自氨基酸序列wlrrikawlrrika(seqidno:12)、wlrrika(seqidno:13)、ygrkkrrqrrr(seqidno:14)、wlrrikawlrri(seqidno:15)、faklaarlyr(seqidno:16)、kafaklaarlyr(seqidno:17)和hrrikawlkki(seqidno:18)的多肽,所述第二多肽是治疗结构域(td),其选自氨基酸序列kalarqlava(seqidno:8)、kalarqlgva(seqidno:9)和kalarqlgvaa(seqidno:10)的多肽,哮喘是其进展表征为肺组织中的在气道中产生收缩的异常的成纤维细胞增殖和细胞外基质沉积、气道重构、和气道阻塞中的一种或多种的疾病、病况或病理学过程,其中所述治疗量的多肽对减少小气道尺寸的收缩和气道阻塞、治疗气道重构、或其组合是有效的。根据方法的一个实施方式,所述治疗量的多肽对增强异丙肾上腺素诱导的人气道平滑肌的舒张是有效的。根据另一个实施方式,所述哮喘进一步表征为肺组织中的炎症。根据另一个实施方式,炎症是急性或慢性炎症。根据另一个实施方式,所述炎症是由选自肿瘤坏死因子-α(tnf-α)、白介素-6(il-6)、和白介素-1β(il-1β)的至少一种细胞因子介导的。根据另一个实施方式,所述肺组织中的异常的成纤维细胞增殖和细胞外基质沉积表征为与在正常健康对照对象的组织中的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的活性相比,所述组织中的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常活性。根据另一个实施方式,所述施用发生在气管内、胃肠外、静脉内、或腹膜内。根据另一个实施方式,所述施用发生在气管内。根据另一个实施方式,所述药物组合物进一步包括至少一种另外的治疗剂。根据另一个实施方式,所述另外的治疗剂选自:纯化的牛v型胶原、il-13受体拮抗物、蛋白质酪氨酸激酶抑制剂、内皮受体拮抗物、双内皮素受体拮抗物、前列环素类似物、抗ctgf单克隆抗体、内皮素受体拮抗物(a-选择性)、ab0024、赖氨酰氧化酶样2(loxl2)单克隆抗体、c-junn-末端激酶(jnk)抑制剂、吡非尼酮、ifn-γ1b、针对全部三种tgf-β同种型的全中和igg4人抗体、tgf-β活化抑制剂、重组人正五聚蛋白-2蛋白(rhptx-2)、双特异性il4/il13抗体、靶向整合蛋白αvβ6的人源化单克隆抗体、n-乙酰半胱氨酸、西地那非、肿瘤坏死因子(tnf)拮抗物(依那西普),及其组合。根据另一个实施方式,所述另外的治疗剂是糖皮质激素,其选自强的松、布地奈德、糠酸莫米松、丙酸氟替卡松和糠酸氟替卡松,及其组合。根据另一个实施方式,所述另外的治疗剂是支气管扩张剂,其选自白三烯改性剂、抗胆碱能支气管扩张剂、短效β2激动剂、和长效β2激动剂,及其组合。根据另一个实施方式,所述另外的治疗剂是镇痛剂。根据另一个实施方式,所述另外的治疗剂是抗感染剂。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列faklaarlyrkalarqlgvaa(seqidno:3)。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列kafaklaarlyrkalarqlgvaa(seqidno:4)。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlava(seqidno:5)。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlgva(seqidno:6)。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列hrrikawlkkikalarqlgvaa(seqidno:7)。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物的治疗结构域(td)是其序列与氨基酸序列kalarqlgvaa(seqidno:2)具有基本同一性的多肽,其中所述功能等价物由可操作地连接至为治疗结构域(td)的第二多肽的为细胞穿透肽(cpp)的第一多肽的融合物制成。根据另一个实施方式,所述第二多肽是氨基酸序列kalarqlava(seqidno:8)的多肽。根据另一个实施方式,所述第二多肽是氨基酸序列kalarqlgva(seqidno:9)的多肽。根据另一个实施方式,所述第二多肽是氨基酸序列kalarqlgvaa(seqidno:10)的多肽。根据另一个实施方式,所述多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是融合蛋白,其包括可操作地连接至第二多肽的第一多肽,其中所述第一多肽是功能上等价于yaraaarqara(seqidno:11)的细胞穿透肽,其选自氨基酸序列wlrrikawlrrika(seqidno:12)、wlrrika(seqidno:13)、ygrkkrrqrrr(seqidno:14)、wlrrikawlrri(seqidno:15)、faklaarlyr(seqidno:16)、kafaklaarlyr(seqidno:17)和hrrikawlkki(seqidno:18)的多肽,并且第二多肽具有氨基酸序列kalarqlgvaa(seqidno:2)。根据另一个实施方式,所述第一多肽是氨基酸序列wlrrikawlrrika(seqidno:12)的多肽。根据另一个实施方式,所述第一多肽是氨基酸序列wlrrika(seqidno:13)的多肽。根据另一个实施方式,所述第一多肽是氨基酸序列ygrkkrrqrrr(seqidno:14)的多肽。根据另一个实施方式,所述第一多肽是氨基酸序列wlrrikawlrri(seqidno:15)的多肽。根据另一个实施方式,所述第一多肽是氨基酸序列faklaarlyr(seqidno:16)的多肽。根据另一个实施方式,所述第一多肽是氨基酸序列kafaklaarlyr(seqidno:17)的多肽。根据另一个实施方式,所述第一多肽是氨基酸序列hrrikawlkki(seqidno:18)的多肽。根据另一个实施方式,所述载体选自控释载体、延释载体、缓释载体、和长期释放载体。根据另一个实施方式,所述药物组合物是干粉的形式。根据另一个实施方式,所述干粉包含具有1至5微米的质量中值空气动力学直径(mmad)的微粒。根据另一个实施方式,经由吸入装置进行施用。根据另一个实施方式,所述吸入装置是喷雾器。根据另一个实施方式,所述吸入装置是定量(metered-dose)吸入器(mdi)。根据另一个实施方式,所述吸入装置是干粉吸入器(dpi)。根据另一个实施方式,所述吸入装置是干粉喷雾器。根据另一个实施方式,所述哮喘进一步表征为与正常健康对照对象相比选自以下的至少一种病理:肺间质中细胞外基质蛋白的异常沉积、成肌纤维细胞分化的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。根据另一个实施方式,所述哮喘与过敏反应、吸入环境微粒、吸烟、细菌感染、病毒感染、对于对象的肺的机械伤害、自身免疫障碍、遗传障碍,或其组合相关。
附图说明
图1显示了纯喷雾干燥胰岛素的递送性能。
图2显示了喷雾干燥胰岛素的颗粒大小分布,其通过安德森多级撞击(andersoncascadeimpaction,aci)测定。
图3显示了微剂量干粉吸入器(dpi)对两种市售的“被动(passive)”干粉吸入器(dpi)的效率和流量比较。
图4显示了喷雾干燥纯肽的流量独立性。
图5显示了喷雾干燥肽(非胰岛素)的代表性显微照片。
图6显示了喷雾干燥肽(非胰岛素)的颗粒大小分布。
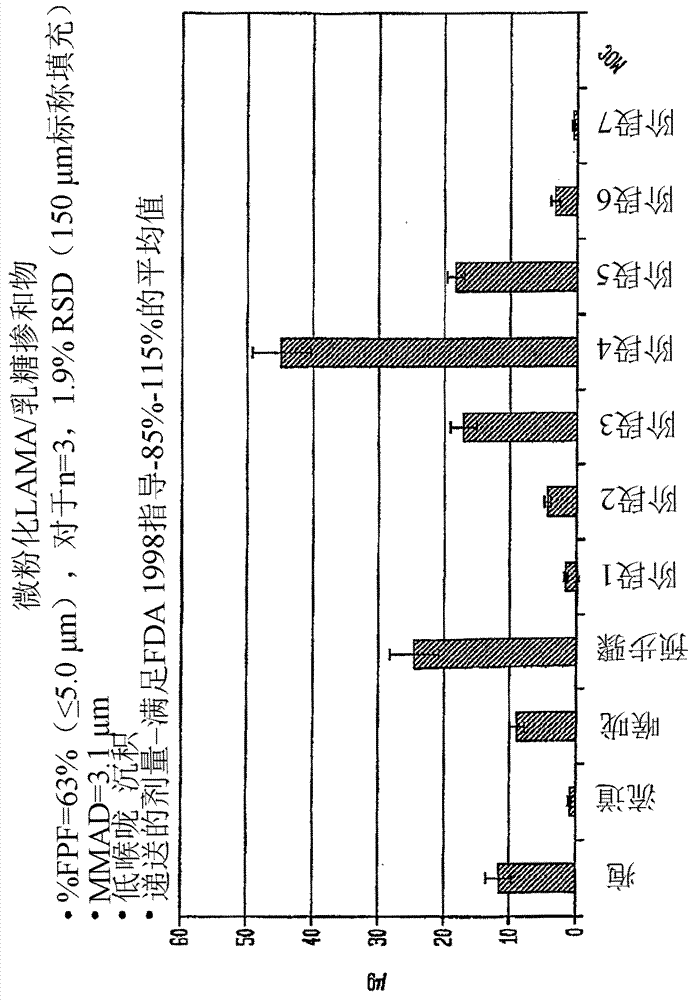
图7显示了微粉化/乳糖掺和物组合的颗粒大小分布,其通过下一代撞击器(nextgenerationimpactor,ngi)测定。
图8显示了微粉化小分子(长效蕈毒碱剂(lama)/乳糖掺和物)的递送性能。
图9显示了石蜡包埋的人特发性肺纤维化ipf肺的免疫组织化学分析,其显示了活化的mk2(即,磷酸化-thr334-mapkapk2)在成纤维细胞病灶处的核定位。正常肺(左图板);ipf肺组织活检切片(右图板)。插图显示了衬在具有对活化mk2的阳性细胞染色(暗灰色)的病灶处的上皮的破裂。图9中显示的缩写如下:nl(具有肺泡囊的正常肺架构);aw(气道);ff(来自患有ipf的肺组织外植体的成纤维细胞病灶)。
图10显示了用于测试化合物抑制肺纤维化的博来霉素小鼠模型(特发性肺纤维化(ipf)预防模型)中的纤维化发展的能力的示意图。在博来霉素递送后的第7天,当炎症消退且纤维化机制活化时,开始每天经由喷雾或向腹膜内施用磷酸盐缓冲盐水(pbs)或mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1)),直到在博来霉素递送后的第21天,观察到显著的纤维化时。
图11显示了吸入疗法和全身施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)防止小鼠中的博来霉素诱导的肺纤维化。上图板:第21天的代表性小鼠肺组织的苏木精和伊红(h&e)染色。下图板:马逊蓝色三色染色的相同视野揭示了具有博来霉素损伤的大量胶原沉积(箭头)。缩写:aw:气道;nl:正常肺架构;ff:纤维化病灶;v:静脉。
图12显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)预防由博来霉素损伤引起的显著的胶原沉积。值代表平均值±sem。n=5只动物/组。‘*’p<0.05;‘**’p<0.01;‘***’p<0.001。胶原指数=胶原的常量因子7.5×羟脯氨酸浓度。
图13显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)以剂量依赖方式预防由博来霉素损伤引起的纤维化。马逊蓝色三色染色博来霉素小鼠的肺切片。(a)mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1);(b)mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)。
图14显示了全身施用的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)消除由博来霉素损伤引起的系统性t细胞活化。值代表平均值±sem。‘p’值<0.01。n=4只动物/组。图14中显示的缩写如下:(i)利用pbs治疗的野生型小鼠(pbs);(ii)利用pbs治疗的博来霉素小鼠(bleo);(iii)利用喷雾的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠(bleo+mmi-0100(neb));和(iv)利用腹膜内的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠(bleo+mmi-0100(ip))。
图15显示了测试mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)消除特发性肺纤维化的博来霉素模型(ipf治疗模型)中的纤维化进展的能力的示意图。在博来霉素递送后的第14天开始,以50μg/kg每天的剂量经由喷雾或向腹膜内pbs或mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1)),直到博来霉素递送后的第28天。
图16显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的全身(ip)或喷雾(neb)施用改善小鼠中博来霉素诱导的肺纤维化。上图板:苏木精和伊红(h&e)染色。下图板:相同视野的马逊蓝色三色染色。图16中显示的缩写如下:pbs(利用pbs治疗的野生型小鼠);bleo(利用pbs治疗的博来霉素小鼠);mmi-0100(neb)(利用喷雾的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠);mmi-0100(ip)(利用腹膜内的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠);nl(具有肺泡囊的正常肺架构);aw(气道);ff(来自患有ipf的肺组织外植体的成纤维细胞病灶)。
图17显示了mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))中止由博来霉素损伤引起的显著的胶原沉积。图17中显示的缩写如下:pbs(利用pbs治疗的野生型小鼠);bleo(利用pbs治疗的博来霉素小鼠);bleo+mmi-0100(neb)(利用喷雾的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠);bleo+mmi-0100(ip)(利用腹膜内的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠)。值代表平均值±sem。n=5只动物/组。胶原指数=胶原的常量因子7.5×羟脯氨酸浓度。
图18显示了肺切片(博来霉素损伤后第28天)的抗磷酸化-thr334-mapkapk2(mk2的活化形式)染色的代表性显微照片,所述肺切片来自(i)利用pbs治疗的博来霉素小鼠(pbs);(ii)利用pbs治疗的博来霉素小鼠(bleo);(iii)利用喷雾的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠(bleo+mmi-0100(neb));和(iv)利用腹膜内的mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))治疗的博来霉素小鼠(bleo+mmi-0100(ip))。c57-bl/6小鼠在第0天受到博来霉素损伤。在第14天,小鼠通过腹膜内(ip)注射或喷雾器(neb)每天施用50µg/kg的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1),直到博来霉素损伤后的第28天。原始放大倍数:20×。
图19显示了参与tgf-β介导的炎性和纤维化途径的关键信号传导分子。
图20显示了在最后施用后24小时,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)下调特发性肺纤维化的博来霉素小鼠模型(治疗模型)中的循环炎性细胞因子的水平。
图21显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)抑制特发性肺纤维化治疗模型中的成肌纤维细胞α-平滑肌肌动蛋白(α-sma)活化。c57-bl/6小鼠在第0天受到博来霉素损伤。在第14天到第28天,小鼠通过腹膜内(ip)注射或喷雾器(neb)施用50µg/kg/日的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)。福尔马林固定的肺组织切片针对α-sma免疫染色。利用生物素化的二级igg抗体进行对照染色。使用链亲和素缀合的辣根过氧化物酶,并以3,3'-二氨基联苯胺作为底物,并且利用苏木精复染细胞核。原始放大倍数:20×。
图22显示了正常人胚胎肺成纤维细胞(imr-90)中通过mk2肽抑制剂的tgf-β诱导的成肌纤维细胞活化的调节。利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)以规定剂量预处理imr-90细胞1h,并且然后在存在或不存在tgf-β1(2ng/ml)的情况下培养48h。细胞裂解产物针对α-sma(成肌纤维细胞活化的标志物)和gapdh(上样对照)的抗体进行免疫印迹。
图23显示了人胚胎肺成纤维细胞(imr-90)中tgf-β介导的纤连蛋白质表达的调节。以规定剂量利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)预处理imr-90细胞1h,并且然后在存在或不存在tgf-β1(2ng/ml)的情况下培养72h。纤连蛋白被测量为条件培养基中的分泌片段。来自条件培养基的等量(14μg)的总蛋白被上样在每个泳道中。
图24显示了参与通过α5β1-整合蛋白介导的pdgfr-β的活化,由纤连蛋白调节间充质干细胞迁移的关键信号传导分子(veevers-lowej等.,jcellsci,124:1288-1300,2011)。
图25显示了ipf患者中活化形式的mk2激酶的水平的增加。(a)正常和ipf组织中磷酸化-thr334水平的定量分析;(c)肺功能和mk2活化之间的关联。
图26显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)增强异丙肾上腺素(iso)诱导的猪气道平滑肌的舒张。
图27显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)增强异丙肾上腺素(iso)诱导的人气道平滑肌的舒张。(a)气道平滑肌张力(g)对时间(min);(b)气道平滑肌收缩应答;(c)响应于异丙肾上腺素(iso)的气道平滑肌的舒张百分比。
图28显示了mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)在哮喘中的示意模型。
具体实施方式
所述发明提供了用于治疗有需要的对象中的肺纤维化的组合物和方法,方法包括施用治疗量的组合物,其包括具有氨基酸序列yaraaarqarakalarqlgvaa(mmi-0100;seqidno:1)的多肽或其功能等价物。
术语表
如本文使用的,术语“气道”指的是空气通过其进入或离开身体的通道。肺气道包括空气通过其在呼吸期间穿过的呼吸道的那些部分。
如本文使用的,术语“气道阻塞”指的是气流的任何异常减小。气流阻力可以发生在从上气道至末端支气管的气道中的任何地方。
如本文使用的,术语“气道疾病”指的是影响携带氧气和其它气体进入和离开肺的管(气道)的疾病。气道疾病包括但不限于慢性阻塞性肺病(copd),其包括哮喘、气肿和慢性支气管炎。
如本文使用的,术语“肺组织疾病”指的是影响肺组织(例如,肺间质)的结构的疾病。肺组织的结疤或炎症使得肺不能完全地膨胀(“限制性肺病”)。它还使得肺吸收氧气(氧合)和释放二氧化碳的能力减弱。肺组织疾病的实例包括但不限于特发性肺纤维化(ipf)、急性肺损伤(ali)、肺中的辐射诱发的纤维化、和与肺移植相关联的纤维化病况。肉样瘤病是其中在淋巴结、肺、肝、眼、皮肤或其它组织中发生肿胀(炎症)的疾病。
术语“肺间质”或“肺的间质”在本文可交换地使用,指的是位于肺中的气室上皮和胸膜间皮之间的区域。基质蛋白、胶原和弹性蛋白的纤维是肺间质的主要组分。这些纤维的主要功能是形成维持通气期间的结构完整性的机械支架。
如本文使用的,术语“可及表面积”或“asa”指的是暴露于溶剂的生物分子的表面积。如本文使用的,术语“溶剂可及表面”或“sas”指的是可及溶剂的给定残基的表面积的百分比。其被计算为ratiobetween三维结构中的残基的asa和其延伸的肽确认的最大asa之间的比率。
术语“氨基酸残基”或“氨基酸”或“残基”在本文可交换地使用,指的是并入蛋白质、多肽或肽的氨基酸,其包括但不限于天然存在的氨基酸和已知的天然氨基酸的类似物,其可以以与天然存在的氨基酸相似的方式作用。氨基酸可以是l-或d-氨基酸。氨基酸可以被合成氨基酸取代,如此改变是为了增加肽的半衰期,增加肽的效价,或增加肽的生物利用度。
在本文主要地使用氨基酸的单字母名称。如本领域技术人员熟知的,这样的单字母名称如下:
a是丙氨酸;c是半胱氨酸;d是天冬氨酸;e是谷氨酸;f是苯丙氨酸;g是甘氨酸;h是组氨酸;i是异亮氨酸;k是赖氨酸;l是亮氨酸;m是甲硫氨酸;n是天冬酰胺;p是脯氨酸;q是谷氨酰胺;r是精氨酸;s是丝氨酸;t是苏氨酸;v是缬氨酸;w是色氨酸;并且y是酪氨酸。
下列代表彼此保守取代的氨基酸组:1)丙氨酸(a)、丝氨酸(s)、苏氨酸(t);2)天冬氨酸(d)、谷氨酸(e);3)天冬酰胺(n)、谷氨酰胺(q);4)精氨酸(r)、赖氨酸(k);5)异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、缬氨酸(v);和6)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)。
如本文使用的,除非上下文另外清楚地规定,单数形式“一个”、“一种”和“该”包括复数指代物。例如,提及“多肽”意思是一个或多个多肽。
如本文使用的,术语“添加”指的是将一个或多个碱基、或一个或多个氨基酸插入序列。
如本文使用的,术语“施用”指的是配药、供给、施加、给予、分配或供量。术语“施用(administering)”或“施用(administration)”可交换地使用,并且包括体内施用,以及直接施用至离体组织。通常,组合物可以以根据需要包含常规无毒的药学上可接受的载体、佐剂和媒介的剂量单位制剂,口服、含服、胃肠外、外用——通过吸入或吹入(即,通过嘴或通过鼻)、或直肠来全身施用;或可以通过比如而不限于注射、植入、移植、外部施加、或胃肠外的手段局部施用。可以进行另外的施用,例如,静脉内、经心包、口服、经由植入物、经粘膜、经皮、外用、肌肉内、皮下、腹膜内、鞘内、淋巴内、病灶内、或硬膜外。例如,可以进行一次、多次、和/或在一个或多个延长期内施用。
如本文使用的,术语“过敏反应”指的是免疫系统的超敏反应。过敏反应由称为变应原的正常无害的环境物质引起;这些反应是后天的、可预见的、和迅速的。过敏反应表征为称为肥大细胞和嗜碱性粒细胞的某些白细胞被称为ige的抗体类型过度的活化,其导致极端的炎性反应。常见的过敏反应包括湿疹、荨麻疹、枯草热、哮喘发作、食物过敏、和对螯针昆虫比如胡蜂和蜜蜂的毒液的反应。
如本文使用的,术语“α-平滑肌肌动蛋白”或“α-sma”指的是首先上血管中分离平滑肌细胞的肌动蛋白蛋白、α-肌动蛋白-2(acta2;又称为肌动蛋白或主动脉平滑肌肌动蛋白)。肌动蛋白是在所有真核细胞中表达的高度保守的蛋白质。肌动蛋白丝形成细胞骨架的一部分,并且在调节细胞形状和运动中起至关重要的作用。已经在哺乳动物细胞中鉴定了六个不同的肌动蛋白同种型。每个由单独的基因编码并且以发育调节和阻止特异的方式表达。α和β细胞质肌动蛋白在各种各样的细胞中表达,由此α骨骼肌动蛋白、α心脏肌动蛋白、α血管肌动蛋白、和γ肠肌动蛋白的表达更限制于特化的肌肉细胞类型。α-平滑肌肌动蛋白的基因是其表达相对地限制于血管平滑肌细胞的少数基因之一,但是其现在最常用作成肌纤维细胞形成的标志物。α平滑肌肌动蛋白的表达由激素和细胞增殖调节,并且被病理学病况改变,包括致癌性转化和动脉粥样硬化。
如本文使用的,术语“肺泡(alveolus)”或“肺泡(alveoli)”指的是具有空腔形式的解剖结构。在肺中发现,肺泡是与血液气体交换的呼吸位点的球形露出。肺泡包含一些胶原和弹性纤维。当吸气时,弹性纤维允许肺泡随着其充满空气而伸展。它们然后在呼气期间回弹,以便排除富含二氧化碳的空气。
如本文使用的,术语“博来霉素”指的是由细菌轮丝链霉菌产生的糖肽抗生素。其通过诱导dna链断裂和抑制胸苷并入dna链起作用。博来霉素的最严重的并发症是肺纤维化和受损的肺功能。
如本文使用的,术语“支气管肺泡灌洗”或“bal”指的是其中支气管镜穿过嘴和鼻进入肺并且流体被喷入肺的一小部分并且然后被重新收集用于检查的医疗过程。bal通常进行以诊断肺病。bal一般地用于诊断具有免疫系统问题的人中的感染、使用呼吸机的人中的肺炎、一些类型的肺癌的、和肺的结疤(间质性肺病)。bal是采样上皮内衬液(epithelialliningfluid)(elf)的组分和测定肺气道的蛋白质组成的最常见的方式,并且通常作为采样肺中的细胞或病原体水平的手段用于免疫学研究。
如本文使用的,术语“载体”和“药学载体”指的是用于将一种或多种活性剂递送至对象的药学上可接受的惰性药剂或媒介,并且通常被称为“赋形剂”。(药学)载体必需具有足够高的纯度和足够低的毒性以使得其适于施用至正在治疗的对象。(药学)载体进一步应当维持活性剂(例如,所述发明的多肽)的稳定性和生物利用度。当与给定组合物的活性剂或其它组分结合时,(药学)载体可以是流体或固体,并且以所考虑的计划的施用方式选择以提供期望的体积、稠度等。(药学)载体可以非限制性地是结合剂(例如,预胶化玉米淀粉、聚乙烯吡咯烷酮或羟丙基甲基纤维素等)、填料(例如,乳糖和其它糖类、微晶纤维素、果胶、明胶、硫酸钙、乙基纤维素、聚丙烯酸酯、磷酸氢钙等)、润滑剂(例如,硬脂酸镁、滑石、二氧化硅、胶体二氧化硅、硬脂酸、硬脂酸金属盐、氢化植物油、玉米淀粉、聚乙二醇、苯甲酸钠、乙酸钠等)、崩解剂(例如,淀粉、羧基乙酸淀粉钠等)、或湿润剂(例如,十二烷基硫酸钠等)。用于所述发明的组合物的其它合适的(药学)载体包括但不限于水、盐溶液、醇类、聚乙二醇、明胶、直链淀粉、硬脂酸镁、滑石、硅酸、粘性石蜡、羟甲基纤维素、聚乙烯吡咯烷酮等。用于胃肠外施用所述发明的多肽的组合物可以包括(药学)载体比如无菌水溶液、常见溶剂中的非水溶液比如醇类、或多肽在液体油基中的溶液。
如本文使用的,术语“胶原”指的是在哺乳动物的新鲜结缔组织中发现的一组天然存在的蛋白质。其是结缔组织的主要组分,并且是哺乳动物中最丰富的蛋白质,占据全身蛋白质含量的大约25%至35%。细长纤丝形式的胶原最主要地发现于纤维组织,比如腱、韧带和皮肤,并且还富含于角膜、软骨、骨髓、血管、内脏和椎间盘。目前为止,已经鉴定了29种类型的胶原,并且身体中超过90%的胶原是i型(皮肤、腱、血管、韧带、器官、骨髓)、ii型(软骨)、iii型(网状体(reticulate)(网状纤维的主要组分))、和iv型(其形成细胞基底膜的基底)胶原。
如本文使用的,术语“病况”指的是各种健康状态,并且意为包括由任何潜在机制、障碍、或损伤引起的障碍或疾病。
术语“细胞因子”是指由细胞分泌的小的可溶性蛋白物质,其对其它细胞具有多种作用,其通常用于指许多信号传导分子,非限制性地包括淋巴因子、白介素和趋化因子。细胞因子介导许多重要的生理学功能,包括生长、发育、伤口愈合和免疫反应。它们通过与位于细胞膜的其细胞特异性受体结合发挥作用,这使得在细胞中开始独特的信号转导级联,其最终将导致靶标细胞中的生化和表型变化。通常,细胞因子在局部起作用,但是一些已经发现具有系统性免疫调节作用,以及类似于激素的多效性自分泌、旁分泌和内分泌作用。它们包括:i型细胞因子,其包含许多白介素,以及多种造血生长因子;ii型细胞因子,包括干扰素和白介素-10;肿瘤坏死因子(“tnf”)相关分子,包括tnf-α和淋巴毒素;免疫球蛋白超家族成员,包括白介素1(“il-1”);和趋化因子,其为在各种各样免疫和炎性功能中起关键作用的分子家族。相同的细胞因子可以取决于细胞状态对细胞具有不同的作用。细胞因子通常调节其它细胞因子的表达并引发级联。
如本文使用的,术语“疾病”或“障碍”指的是健康的损害或异常功能的病况,而不管原因(是否是可遗传的、环境的、饮食的、传染的、由于伤口、或另外的)。例如,障碍可以包括但不限于:炎性或纤维化疾病、纤维化、急性肺损伤、辐射诱发的纤维化、移植排斥、慢性阻塞性肺病(copd)、内毒素休克、局限性炎性疾病、动脉粥样硬化性心血管疾病、阿尔茨海默病、肿瘤疾病、神经缺血、结缔组织与系统性自身免疫疾病、类风湿性关节炎、克罗恩病、炎性肠道疾病、系统性红斑狼疮(sle)、斯耶格伦综合症、硬皮病、血管炎、内膜增生、狭窄、再狭窄、动脉粥样硬化、平滑肌细胞肿瘤与转移、平滑肌痉挛、心绞痛、普林兹迈托心绞痛、缺血、中风、心动过缓、高血压、心脏肥大、肾衰竭、中风、肺动脉高压、哮喘、妊娠毒血症、未足月产、先兆子痫、子痫、雷诺病或现象、溶血性尿毒症、肛裂、失弛缓症、阳痿、偏头疼、与平滑肌痉挛相关联的缺血性肌肉损伤、血管病变、缓慢性心律失常(bradyarrythmia)、充血性心力衰竭、顿抑心肌(stunnedmyocardium)、肺动脉高血压、舒张期机能障碍、神经胶质增生(星形胶质细胞的增殖,并且可以包括中枢神经系统的受损区域中的细胞外基质(ecm)沉积)、慢性阻塞性肺病(即,表征为气流阻塞或限制的呼吸道病;包括但不限于慢性支气管炎、气肿和慢性哮喘)、骨质减少、内皮机能障碍、炎症、变性关节炎、强直性脊柱炎、格-巴二氏病、传染病、脓毒病、内毒素休克、银屑病、放射性小肠炎、肝硬化、间质纤维化、肺纤维化(包括特发性肺纤维化)、结肠炎、阑尾炎、胃炎、喉炎、脑膜炎、胰腺炎、耳炎、再灌注损伤、外伤性脑损伤、脊髓损伤、周维神经病变、多发性硬化、过敏症、心代谢疾病、肥胖、ii型糖尿病、i型糖尿病、和nash/肝硬化。
如本文使用的,术语“结构域”指的是具有典型的三级结构和功能的蛋白质的区域,并且指的是一起组成通过折叠其线性肽链形成的其三级结构的蛋白质的任意三维亚基。
如本文使用的,术语“治疗结构域”(也称为“td”)指的是肽、肽区段或变体、或其衍生物,其与肽kalarqlgvaa(seqidno:2)、或其区段具有实质同一性。治疗结构域通过其自身通常不能够穿透哺乳动物细胞的质膜。一旦在细胞内,治疗结构域可以抑制具体组的激酶的激酶活性。
如本文使用的,术语“细胞穿透肽”(也称为“cpp”、“蛋白质转导结构域”、“ptd”、“特洛伊肽”、“膜易位序列”和“细胞穿透性蛋白”)指的是能够穿透哺乳动物细胞细胞的质膜的肽类。其还指的是肽、肽区段、或变体或其衍生物,其与肽yaraaarqara(seqidno:11)、或其功能区段具有实质同一性,并且指的是肽、肽区段、或变体或其衍生物,其在功能上等同于seqidno:11。cpp的长度通常为10-16个氨基酸,并且能够跨越哺乳动物细胞传输许多类型和分子量的化合物。这样的化合物包括但不限于效应分子,比如蛋白质、dna、缀合肽、寡核苷酸)、和小颗粒比如脂质体。化学连接或融合至其它蛋白质(“融合蛋白”)的cpp仍能够穿透质膜并进入细胞。
如本文使用的术语“细胞外基质”指的是经由特异性细胞表面受体与细胞相互作用的细胞的外部环境中的支架。细胞外基质由纤维状蛋白质和糖葡胺聚糖(gag)的连锁网(interlockingmesh)组成。在细胞外基质中发现的纤维状蛋白质的实例非限制性地包括胶原、弹性蛋白、纤连蛋白、和层粘连蛋白。在细胞外基质中发现的gag的实例非限制性地包括蛋白多糖(例如,硫酸肝素)、硫酸软骨素、硫酸钾蛋白、和非蛋白多糖的多糖(例如,透明质酸)。术语“蛋白多糖”指的是包含一种或多种糖葡胺聚糖附着至其的核心蛋白的一组糖蛋白。细胞外基质发挥许多功能,包括但不限于向细胞提供支撑和锚定、从一个组织分离另一个组织、和调节细胞内通讯。
术语“功能等价物”或“在功能上等价的”在本文可交换地使用,指的是具有相似或相同作用或用途的物质、分子、多核苷酸、蛋白质、肽或多肽。在功能上等价于例如多肽yaraaarqarakalarqlgvaa(seqidno:1)的多肽可以具有基本上类似于或同一于seqidno:1的表达多肽的生物学活性,例如,抑制活性、动力学参数、盐度抑制、辅因子依赖活性、和/或功能单位大小。
在功能上等价于yaraaarqarakalarqlgvaa(seqidno:1)的多肽的实例包括但不限于氨基酸序列faklaarlyrkalarqlgvaa(seqidno:3)的多肽、氨基酸序列kafaklaarlyrkalarqlgvaa(seqidno:4)的多肽、氨基酸序列yaraaarqarakalarqlava(seqidno:5)的多肽、氨基酸序列yaraaarqarakalarqlgva(seqidno:6)的多肽、和氨基酸序列hrrikawlkkikalarqlgvaa(seqidno:7)的多肽。
本发明中描述的氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)肽包括融合蛋白,其中为了增强治疗效果,细胞穿透肽(cpp;yaraaarqara;seqidno:11)可操作地连接至治疗结构域(kalarqlgvaa;seqidno:2)。
在功能上等价于多肽yaraaarqarakalarqlgvaa(seqidno:1)的治疗结构域(td;kalarqlgvaa;seqidno:2)的多肽的实例包括但不限于氨基酸序列kalarqlava(seqidno:8)的多肽、氨基酸序列kalarqlgva(seqidno:9)的多肽、和氨基酸序列kalarqlgvaa(seqidno:10)的多肽。
在功能上等价于多肽yaraaarqarakalarqlgvaa(seqidno:1)的细胞穿透肽(cpp;yaraaarqara;seqidno:11)的多肽的实例包括但不限于氨基酸序列wlrrikawlrrika(seqidno:12)的多肽、氨基酸序列wlrrika(seqidno:13)的多肽、氨基酸序列ygrkkrrqrrr(seqidno:14)的多肽、氨基酸序列wlrrikawlrri(seqidno:15)的多肽、氨基酸序列faklaarlyr(seqidno:16)的多肽、氨基酸序列kafaklaarlyr(seqidno:17)的多肽、和氨基酸序列hrrikawlkki(seqidno:18)的多肽。
如本文使用的,术语“内源的”指的是在生长或源自于内部、或内部衍生的。
如本文使用的,术语“内皮”指的是衬在血管的内表面的细胞内的薄层,其形成腔中循环血液和其余脉管壁之间的界面。内皮细胞将衬在整个循环系统内,从心至最小的毛细血管。这些细胞减少血液流动的湍流,使得流体被泵送得更远。
如本文使用的,术语“嗜酸性细胞”或“嗜酸性粒细胞”指的是负责防治脊柱动物中的多细胞寄生虫和某些感染的白细胞。它们是在迁移入血液前在造血期间在骨髓中发育的粒细胞。连同肥大细胞一起,它们还控制与过敏症和哮喘相关联的机制。在活化之后,嗜酸性细胞发挥多样的功能,包括(1)产生阳离子颗粒蛋白和其通过脱粒的释放,(2)产生活性氧类别,比如,超氧化物、过氧化物、和次溴酸盐(次溴酸,其由嗜酸性细胞过氧化物酶优先地产生),(3)产生脂质介质,比如,来自白三烯和前列腺素家族的类花生酸,(4)产生生长因子,比如转化生长因子(tgf-β)、血管内皮生长因子(vegf)、和血小板源生长因子(pdgf),和(5)产生细胞因子比如il-1、il-2、il-4、il-5、il-6、il-8、il-13和tnf-α。
如本文使用的,术语“上皮”指的是由衬在遍及身体的结构的腔和表面内的细胞组成的组织。上皮的基底面面向下面的结缔组织,并且两层被基底膜分离。
如本文使用的,术语“外渗”指的是血细胞组分从毛细血管至环绕它们的组织的移动(血细胞渗出)。在恶性肿瘤转移的情况下,它指的是离开毛细血管和进入器官的癌细胞。
如本文使用的,术语“渗出”指的是来自循环系统的流体通过其穿过血管的壁进入病变或炎症区域的过程。血液渗出物包含一些或全部血浆蛋白、白细胞、血小板和红细胞。
如本文使用的,术语“纤维蛋白”指的是参与凝血的纤维状蛋白质。其是聚合以形成“网”的纤维性蛋白,所述“网”在伤口位点上方形成止血栓子或凝块(连同血小板)。纤维蛋白参与信号转导、血液凝固、血小板活化、和蛋白质聚合。
如本文使用的,术语“成纤维细胞”指的是制造和分泌细胞外基质蛋白(包括但不限于,胶原)的结缔组织细胞。作为见于结缔组织中的最常见的细胞类型,成纤维细胞在愈合伤口中起重要的作用。与结缔组织的其它细胞一样,成纤维细胞源自原始间质(源自全部三个胚层并且位于胚胎的疏松结缔组织类型)。在某些情况下,上皮细胞可以产生成纤维细胞——称为上皮间充质转换的过程。成纤维细胞和纤维细胞是相同细胞的两种状态,前者是活化状态,后者是低活性状态,与维持和组织代谢相关,其中两种术语偶尔可交换地使用。
如本文使用的,术语“成肌纤维细胞”指的是伤口区域中的成纤维细胞,其具有平滑肌的一些特性(如收缩性质)和纤维,并且被认为暂时地产生iii型胶原。虽然存在许多可能方式的成肌纤维细胞发育,但是成肌纤维细胞是在其分化中在成纤维细胞和平滑肌细胞之间的细胞。在许多器官如肝、肺和肾中,它们主要地涉及纤维化。在伤口组织中,其与伤口加固(通过细胞外胶原纤维沉积)和然后伤口收缩(通过细胞内收缩和通过整合蛋白介导的拉动至胶原束的胶原纤维的伴行排列(concomitantalignment))相关。
如本文使用的,术语“纤连蛋白”指的是高分子量(~440kda)细胞外基质糖蛋白,其与跨膜细胞表面基质受体蛋白(“整合蛋白”)并且与细胞外基质组分比如胶原、纤维蛋白和硫酸肝素蛋白多糖(例如多配体聚糖)结合。纤连蛋白作为二聚物存在,其由通过一对二硫键连接的两个几乎相同的单体构成。存在纤连蛋白的多种同种型。血浆纤连蛋白是可溶的并且在血液和其它体液中循环,其中其被认为增强凝血、伤口愈合和吞噬作用。其它同种型在细胞的表面上聚集,并且作为高度不溶性纤连蛋白丝沉积于细胞外基质。成纤维细胞的表面上或附近形成的纤连蛋白丝通常与相邻的细胞内肌动蛋白应力纤维对齐,其促进分泌的纤连蛋白分子聚集为丝并且影响丝取向。纤连蛋白在细胞粘附、细胞生长、细胞迁移和细胞分化中起主要作用,并且其对过程比如伤口愈合和胚胎发育是重要的。
如本文使用的,术语“纤维化”指的是器官或组织中因部分损伤或炎症或因干扰其血液供应而产生的过量的纤维结缔组织的形成或发展。其可以为导致疤痕的正常愈合反应、异常的反应过程的结果,或不具有已知的或理解的成因。
如本文使用的,术语“吸入”指的是利用呼吸吸取含药蒸气的动作。
如本文使用的,术语“吹入”指的是在压力下递送空气、气体或粉末至身体的腔或室的动作。例如,鼻吹入涉及通过鼻在压力下递送空气、气体或粉末至身体的腔或室的动作。
如本文使用的,术语“吸入递送装置”指的是从液体或干粉气溶胶制剂产生小液滴或气溶胶,并且用于通过嘴施用以便实现例如在溶液、粉末等中的药物的肺施用的机器/设备或组件。吸入递送装置的实例包括但不限于喷雾器、定量吸入器和干粉吸入器(dpi)。
如本文使用的,术语“喷雾器”指的是用于以雾的形式施加吸入肺的液体药物的装置。
如本文使用的,术语“定量吸入器”、“mdi”或“喷气机(puffer)”指的是加压的手持装置,其使用推进剂以递送特定量的药物(“定量”)至患者的肺。如本文使用的,术语“推进剂”指的是通常由通过会聚的扩散喷嘴的气体压力用于排出物质的材料。压力可以来自压缩气体、或通过化学反应产生的气体。排放材料可以是气体、液体、等离子体或化学反应前的固体、液体或胶体。用于加压定量吸入器的推进剂是液化气体,传统上是氯氟烃(cfc)且越来越多是氢氟烷烃(hfa)。合适的推进剂包括,例如,氯氟烃(cfc),比如三氯氟甲烷(也称为推进剂11)、二氯二氟甲烷(也称为推进剂12)、和1,2-二氯-1,1,2,2-四氟乙烷(也称为推进剂114);氢氯氟烃;氢氟烷(hfc),比如1,1,1,2-四氟乙烷(也称为推进剂134a、hfc-134a或hfa-134a)和1,1,1,2,3,3,3-七氟丙烷(也称为推进剂227、hfc-227或hfa-227);二氧化碳;二甲醚;丁烷;丙烷;或其混合物。在其它实施方式中,推进剂包括氯氟烃、氢氯氟烃、氢氟烷、或其混合物。在其它实施方式中,氢氟烷被用作推进剂。在其它实施方式中,hfc-227和/或hfc-134a被用作推进剂。
如本文使用的,术语“干粉吸入器”或“dpi”指的是类似于定量吸入器的装置,但是其中药物是粉末的形式。患者呼出完整呼吸,将嘴唇放在衔口(mouthpiece)周围,并且然后快速地吸入粉末。干粉吸入器不需要mdi必需的时机和协作。
如本文使用的,术语“颗粒”指的是极小的构分(例如纳米颗粒、微粒或在一些情况下更大的颗粒),在其中或其上包含本文所述的组合物。
如本文使用的,术语“肺纤维化”、“特发性肺纤维化”和“隐原性纤维性肺泡炎”指的是间质性肺病的主要构成,其表征为重构正常肺组织结构和危害其功能的异常成纤维细胞增殖和细胞外基质蛋白的沉积。特发性肺纤维化的标志病变是成纤维细胞病灶。这些位点具有以下特点:间充质细胞的活跃复制和新鲜细胞外基质的丰富沉积。
如本文使用的,术语“纤维化部位”或“纤维化病灶”可交换地指的是由过量的纤维组织形成或发展的组织中的特定位置。
如本文使用的,术语“融合蛋白”指的是出于制造具有源自原始蛋白质或多肽中的每个的功能性质的单个多肽或蛋白质的目的,通过结合多个蛋白结构域或多肽构建的蛋白质或多肽。融合蛋白的制造可以通过以下完成:经由重组dna技术可操作地结合或连接编码每个蛋白结构域或多肽的两个不同的核苷酸序列,从而制造编码期望的融合蛋白的新的多核苷酸序列。可选地,可以通过化学地接合期望的蛋白结构域制造融合蛋白。
如本文使用的,术语“特发性”意思是自发地产生或来自模糊或未知的原因。
如本文使用的,术语“炎症”指的是血管化组织通过其响应损伤的生理过程。参见,例如,fundamentalimmunology,4thed.,williame.paul,ed.lippincott-ravenpublishers,philadelphia(1999)at1051-1053,其通过引用并入本文。在炎性过程期间,参与解毒和修复的细胞被炎性介质动员至危害位点。炎症通常表征为白血球特别是嗜中性粒细胞(多形核细胞)在炎症位点的强烈浸润。这些细胞通过在血管壁处或在未损伤组织中释放有毒物质来促进组织伤害。传统地,炎症已经被分为急性和慢性反应。
如本文使用的。术语“急性炎症”指的是对急性损伤的迅速的、短暂(几分钟至几天)的、相对一致的反应,其表征为流液、血浆蛋白和嗜中性白血球的聚积。引起急性炎症的有害因素(injuriousagent)的实例包括但不限于病原体(例如细菌、病毒、寄生虫)、来自外源性(例如石棉)或内源性(例如,尿酸盐结晶、免疫复合物)来源的异物、和物理(例如,烧伤)或化学(例如,腐蚀剂)因素。
如本文使用的,术语“慢性炎症”指的是较长持续时间的炎症,并且其具有不明确且不确定的终止期。当急性炎症通过不完全清除初始炎性因素(例如,吸烟)或由于在相同位置出现的多个急性事件而持续时,慢性炎症接管。包括淋巴细胞与巨噬细胞的流入和成纤维细胞生长的慢性炎症可以在延长或反复的炎性活动的位点导致组织结疤。
如本文使用的,术语“炎性介质”指的是炎性和免疫过程的分子介质。这些可溶性可扩散的分子在组织伤害和感染的位点的局部和更远的位点二者处起作用。一些炎性介质通过炎性过程活化,而其它的响应于急性炎症或通过其它可溶性炎性介质从细胞来源合成和/或释放。炎性反应的炎性介质的实例包括但不限于血浆蛋白酶、补体、激肽、凝血蛋白和溶纤维蛋白、脂质介质、前列腺素、白细胞三烯、血小板活化因子(paf)、肽、激素(包括类固醇激素比如糖皮质激素)、和胺(包括但不限于组胺、血清素和神经肽)、和促炎性细胞因子,包括但不限于白介素-1β(il-1β)、白介素-4(il-4)、白介素-6(il-6)、白介素-8(il-8)、肿瘤坏死因子-α(tnf-α)、干扰素-γ(if-γ)、白介素12(il-12)和白介素-17(il-17)。
在促炎介质之中,已知il-1、il-6和tnf-α在在急性期反应中活化肝细胞以合成活化补体的急性期蛋白。补体是与病原体相互作用以标记它们被吞噬细胞破坏的血浆蛋白的系统。补体蛋白可以被病原体直接地或被病原体结合抗体间接地活化,其导致在病原体的表面上发生并且生成具有多种效应功能的活性组分的级联反应。il-1、il-6和tnf-α还活化骨髓内皮以动员嗜中性粒细胞,并且作为内源性致热原起作用,提高体温,其帮助从身体消除感染。细胞因子的主要作用是作用于下丘脑以改变体温调节,和作用于肌肉和脂肪细胞以刺激肌肉和脂肪细胞的分解代谢以升高体温。在升高的温度下,细菌和病毒复制降低,同时适应性免疫系统更高效地运行。
如本文使用的,术语“肿瘤坏死因子”指的是响应于抗原或感染由白细胞制造的细胞因子,其诱导肿瘤细胞坏死(死亡)并且具备宽范围的促炎作用。肿瘤坏死因子还是对脂质代谢、凝血、胰岛素抗性、和衬在血管内的内皮细胞的功能作用的多功能细胞因子。
如本文使用的,术语“白介素(il)”指的是来自第一次观察到由白血球分泌并且作用于白血球的一类同源相关蛋白的细胞因子。已经发现白介素由各种体细胞产生。白介素调节细胞生长、分化和运动,并且刺激免疫反应,比如炎症。白介素的实例包括白介素-1(il-1)、白介素-1β(il-1β)、白介素-6(il-6)、白介素-8(il-8)、白介素-12(il-12)和白介素-17(il-17)。
在本文使用的术语“抑制(inhibiting)”、“抑制(inhibit)”或“抑制(inhibition)”指的是减小过程的量或速率,完全停止过程,或降低、限制或阻断其作用或功能。抑制可以包括将物质的量、速率、作用功能、或过程减小或降低至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%。
如本文使用的,术语“抑制剂”指的是与第一个分子结合从而降低第一个分子的活性的第二个分子。酶抑制剂是与酶结合从而降低酶活性的分子。抑制剂的结合可以阻止底物进入酶的活性位点和/或阻碍酶催化其反应。抑制剂结合是可逆的或不可逆的。不可逆的抑制剂通常与酶反应并且使其化学地改变,例如,通过修饰酶活性所必需的关键氨基酸残基。相比之下,可逆的抑制剂非共价地结合并且取决于这些抑制剂是否结合酶、酶-底物复合物、或二者产生不同类型的抑制。酶抑制剂通常通过其特异性和效价进行评估。
如本文使用的,术语“损伤”指的是由物理的或化学的外部因素或外力引起的身体的结构或功能的损害或伤害。
本文使用的术语“分离的”指的是物质,比如,但不限于核酸、肽、多肽或蛋白质,其:(1)基本上或大体上不含正常地在其天然存在环境中发现的与其伴随或互相作用的组分。本文使用的术语“基本上不含”或“大体上不含”指的是相当地或显著地不含,或多于大约95%不含,或多于大约99%不含这样的组分。分离的物质任选包括在其天然环境中未发现的物质;或(2)如果物质在其天然环境中,则该物质已经通过有意的人为介入被合成地(非天然地)改变为组合物和/或被置于细胞中的某个位置(例如,基因组或亚细胞器),其对在环境中发现的物质是非天然的。可以对处于其天然状态的物质进行改变,或从其天然状态移除,以产生合成物质。例如,借助在其来源的细胞内进行人为介入,如果天然存在的核酸被改变,或如果其从已经被改变的dna转录,则其成为分离的核酸。参见,例如,compoundsandmethodsforsitedirectedmutagenesisineukaryoticcells,kmiec,美国专利号5,565,350;invivohomologoussequencetargetingineukaryoticcells;zarling等,pct/us93/03868,每个通过引用以其全部并入本文。同样地,天然存在的核酸(例如,启动子),如果通过非天然存在的手段引入对该核酸非天然的基因组的基因座,则其称为分离的。如本文限定的,“分离的”核酸也称为“异源”核酸。
如本文使用的,术语“激酶”指的是将磷酸基团从高能供体分子转移至特异性靶分子或底物的酶类型。高能供体组可以包括但不限于atp。
如本文使用的。术语“白血球”或“白细胞(wbc)”指的是免疫细胞类型。大多数白血球在骨髓中制造并且发现于血液和淋巴组织。白血球帮助身体与感染和其它疾病斗争。粒细胞、单核细胞和淋巴细胞是白血球。
如本文使用的,术语“淋巴细胞”指的是小的白细胞(白血球)在保护身体抵御疾病中起大作用。存在两种主要类型的淋巴细胞:b细胞和t细胞。b细胞制造攻击细菌和毒素的抗体,而当体细胞已经被病毒接管或已经变为癌性时,t细胞自身攻击体细胞。淋巴细胞分泌调节许多其它类型的细胞的功能活性并且通常存在于慢性炎症的位点的产物(淋巴因子)。
如本文使用的,术语“巨噬细胞”指的是环绕和杀死微生物,移除死细胞,并且刺激其它免疫系统细胞的作用的白细胞类型。在消化病原体后,巨噬细胞呈递病原体的抗原(分子,最通常是在病原体的表面上发现的蛋白质,由免疫系统用于识别)至对应的辅助t细胞。通过将其整合入细胞膜并且展示附着至mhcii类分子的其完成呈递,其向其它白细胞指示巨噬细胞不是病原体,而不管在其表面上具有抗原。最后,抗原呈递导致附着至病原体的抗原的抗体的产生,使得巨噬细胞更易于附着至它们的细胞膜和更易于吞噬作用。
如本文使用的,术语“间充质细胞”或“间质”指的是源自全部三个胚层的细胞,其发育为结缔组织、骨骼、阮福、淋巴系统和循环系统。
如本文使用的,术语“mk2激酶”或“mk2”指的是促分裂原活化蛋白激酶-活化的蛋白激酶2(也称为“mapkapk2”、“mapkap-k2”、“mk2”),其是丝氨酸/苏氨酸(ser/thr)蛋白激酶家族的成员。
如本文使用的,术语“质量中值空气动力学直径”或“mmad”指的是空气散播颗粒质量关于空气动力学直径的分布的中值。mmad通常伴随几何标准差(g或σg),其表征颗粒大小分布的可变性。
如本文使用的,术语“调节”意思是调整、改变、适应或调节至某一度量或比例。
如本文使用的,术语“单核细胞”指的是在骨髓中制造并且经过血液至身体中的组织——其在其中变为巨噬细胞的免疫细胞类型。单核细胞是白细胞类型和吞噬细胞类型。
如本文使用的,术语“嗜中性粒细胞”或“多形核嗜中性粒细胞(pmn)”指的是哺乳动物中最丰富的白细胞类型,其形成先天免疫系统的基本部分。它们连同嗜碱性细胞和嗜酸性细胞一起形成多形核细胞家族(pmn)的一部分。嗜中性粒细胞正常地发现于血流。在炎症的开始(急性)期期间,特别地由于细菌感染和一些癌症,嗜中性粒细胞是炎性细胞朝向炎症位点迁移的第一应答者之一。它们在称为趋化性的过程中,跟随化学信号比如白介素-8(il-8)和c5a迁移通过血管,然后通过间质性组织,所述过程是运动性细胞或部分沿着化学浓度梯度朝向其视为吸引性的环境条件和/或远离其发现排斥(repellent)的环境的定向运动。
如本文使用的,术语“正常健康对照对象”指的是不具有气道或肺组织疾病的症状或其它临床证据的对象。
本文使用的术语“核酸”指的是单链或双链形式的脱氧核糖核苷酸或核糖核苷酸聚合物,并且除非另外限制,包含具有天然核苷酸的基本性质的已知类似物(例如,肽核酸),其中它们以与天然存在的核苷酸相似的方式与单链核酸杂交。
本文使用的术语“核苷酸”指的是由杂环碱基、糖和一个或多个磷酸基团构成的化合物。在最常见的核苷酸中,碱基是嘌呤或嘧啶的衍生物,并且糖是戊糖脱氧核糖或核糖。核苷酸是核酸的单体,其中三个或更多个结合在一起以形成核酸。核苷酸是rna、dna和多种辅因子(包括但不限于coa、fad、dmn、nad和nadp)的结构单位。嘌呤包括腺嘌呤(a)和鸟嘌呤(g);嘧啶包括胞嘧啶(c)、胸腺嘧啶(t)和尿嘧啶(u)。
本文使用下列术语描述两种或更多种核酸或多核苷酸之间的序列关系:(a)“参考序列”、(b)“比较窗口”、(c)“序列同一性”、(d)“序列同一性的百分比”、和(e)“基本同一性”。
(a)术语“参考序列”指的是用作序列比较的基础的序列。参考序列可以是指定序列的子集或全部;例如,作为全长cdna或基因序列的区段,或完整的cdna或基因序列。
(b)术语“比较窗口”指的是多核苷酸序列的连续的指定区段,其中所述多核苷酸序列可以与参考序列比较,并且其中比较窗口中的多核苷酸序列部分与参考序列(其不包括添加或缺失)相比,可以包括添加或缺失(即空位)用于两个序列的最佳比对。通常,比较窗口的长度是至少20个连续核苷酸,并且任选地可以是至少30个连续核苷酸、至少40个连续核苷酸、至少50个连续核苷酸、至少100个连续核苷酸长或更长。本领域技术人员理解,为了避免由于在多核苷酸序列中包含空位而与参考序列高度相似,通常引入空位罚分,并且从匹配数减去空位罚分。
用于比较的序列比对方法在本领域是熟知的。可以通过以下实施用于比较的序列最佳比对:smith和waterman,adv.appl.math.2:482(1981)的局部同源性算法;needleman和wunsch,j.mol.biol.48:443(1970)的同源性比对算法;pearson和lipman,proc.natl.acad.sci.85:2444(1988)的相似性检索方法;这些算法的计算机执行包括但不限于:pc/基因程序中的clustal,intelligenetics,mountainview,calif.;wisconsin遗传学软件包中的gap、bestfit、blast、fasta和tfasta,geneticscomputergroup(gcg),575sciencedr.,madison,wis.,usa;由higgins和sharp,gene73:237-244(1988)很好描述的clustal程序;higgins和sharp,cabios5:151-153(1989);corpet,等,nucleicacidsresearch16:10881-90(1988);huang等,computerapplicationsinthebiosciences8:155-65(1992);和pearson等,methodsinmolecularbiology,24:307-331(1994)。可以用于数据库相似性检索的blast程序家族包括:用于针对核苷酸数据库序列的核苷酸查询序列的blastn;用于针对蛋白质数据库序列的核苷酸查询序列的blastx;用于针对蛋白质数据库序列的蛋白质查询序列的blastp;用于针对核苷酸数据库序列的蛋白质查询序列的tblastn;和用于针对核苷酸数据库序列的核苷酸查询序列的tblastx。参见currentprotocolsinmolecularbiology,chapter19,ausubel,等,eds.,greenepublishingandwiley-interscience,newyork(1995)。
除非另外说明,本文提供的序列同一性/相似性值指的是使用blast2.0程序套件使用默认参数获得的值。altschul等,nucleicacidsres.25:3389-3402(1997)。用于进行blast分析的软件是可以公开获得的,例如,通过国家生物技术信息中心。此算法包括首先通过识别查询序列中长度w的短字(shortword)识别高分数序列对(hsp),所述短字当与数据库序列中相同长度的字比对时,与一些正值的阀值分数t匹配或符合。t被称为邻近字分数阀值(altschul等,如上)。这些初始邻近字命中作为用于起始检索以发现包含它们的更长的hsp的种子。然后,只要累积的比对分数可以增加,字命中沿着每个序列以两个方向延伸。对于核苷酸序列,使用参数m(匹配残基对的奖励分数;总是>0)和n(不匹配残基的罚分;总是<0)计算累积的分数。对于氨基酸序列,评分矩阵被用于计算累积的分数。当出现以下情况时,停止每个方向中字命中的延伸:累积的比对分数从其最大获得值减少数量x;由于一个或多个负评分残基比对的积累,累积的分数变为0或低于0;或到达任一序列的末端。blast算法参数w、t和x决定比对的灵敏度和速度。blastn程序(对于核苷酸序列)使用以下作为默认值:11的字长(w),10的期望值(e),100的切分点(cutoff),m=5,n=-4,和两条链进行比较。对于氨基酸序列,blastp程序使用以下作为默认值:3的字长(w),10的期望值(e),和blosum62评分矩阵(参见henikoff&henikoff(1989)proc.natl.acad.sci.usa89:10915)。
除计算序列同一性百分比之外,blast算法还进行两个序列之间相似性的统计学分析(参见,例如,karlin&altschul,proc.natl.acad.sci.usa90:5873-5787(1993))。由blast算法提供的一种相似性测量是最小和概率(p(n)),其提供两个核苷酸或氨基酸序列之间将偶然出现匹配的可能性的指示。blast检索假设蛋白质可以作为随机序列建模。然而,许多真实的蛋白质包括非随机序列的区域,其可以是同聚物区域(homopolymerictract)、短期重复、或富集于一种或多种氨基酸的区域。可以在不相关的蛋白质之间比对这样的低复杂度区域,即使蛋白质的其它区域完全不相似。可以采用大量的低复杂度过滤程序以减少这样的低复杂度比对。例如,可以单独地或组合地采用seg(wooten和federhen,comput.chem.,17:149-163(1993))和xnu(claverie和states,comput.chem.,17:191-201(1993))低复杂度过滤器。
(c)本文在两个核酸或多肽序列的背景下使用的术语“序列同一性”或“同一性”指的是在指定的比较窗口内当比对最大一致性时两个序列中相同的残基。当在关于蛋白质使用序列同一性的百分比时,认识到不同一的残基位置通常是因保守氨基酸取代而不同,即,其中氨基酸残基被具有相似化学性质(例如电荷或疏水性)的其它氨基酸残基取代,并且因此不改变分子的功能性质。在序列因保守取代而不同时,可以向上调节序列同一性百分比以校正取代的保守性质。据说因这样的保守取代而不同的序列具有“序列相似性”或“相似性”。用于进行此调节的手段对本领域技术人员是熟知的。通常,这包括将保守取代评分为部分不匹配而不是完全不匹配,从而增加序列同一性百分比。因而,例如,在给予相同氨基酸1分并且给予非保守取代0分时,保守取代被给予0和1之间的分数。例如,根据例如在程序pc/gene(intelligenetics,mountainview,calif.,usa)中执行的meyers和miller,computerapplic.biol.sci.,4:11-17(1988))的算法计算保守取代的评分。
(d)本文使用的术语“序列同一性的百分比”意思是通过在比较窗口内比较两个最佳比对的序列而测定的值,其中比较窗口中的多核苷酸序列部分与参考序列(其不包括添加或缺失)相比可以包括添加或缺失(即,空位)用于两个序列的最佳比对。百分比如下计算:通过测定两个序列中出现相同核酸碱基或氨基酸残基的位置的数目产生匹配位置的数目,用匹配位置的数目除以比较窗口中的位置的总数,并且将该结果乘以100以产生序列同一性的百分比。
(e)多核苷酸序列的术语“基本同一性”意思是使用描述的比对程序中的一种,使用标准参数,多核苷酸与参考序列相比包括具有至少70%序列同一性、至少80%序列同一性、至少90%序列同一性和至少95%序列同一性的序列。技术人员将认识到,可以通过考虑密码子简并性、氨基酸相似性、读框定位等,适当调整这些值以确定由两个核苷酸序列编码的蛋白质的相应同一性。出于这些目的,氨基酸序列的基本同一性通常意思是至少60%、或至少70%、至少80%、至少90%、或至少95%的序列同一性。核苷酸序列基本上同一的另一个指示是两个分子在严格条件下是否彼此杂交。然而,如果其编码的多肽基本上同一,则在严格条件下彼此不杂交的核酸仍然基本上同一。例如,这可以当使用遗传密码所允许的最大密码子简并性形成核酸的拷贝时发生。两个核酸序列基本上同一的一个指示是第一核酸编码的多肽与由第二核酸编码的多肽有免疫学交叉反应。
如本文使用的,短语“可操作地连接的”指的是其中两个或多个蛋白结构域或多肽经由重组dna技术或化学反应接合或组合的连接,以使得得到的融合蛋白的每个蛋白结构域或多肽保留其原始功能。例如,seqidno:1通过可操作地连接细胞穿透肽(seqidno:11)与治疗结构域(seqidno:2)构建,从而产生具备seqidno:11的细胞穿透功能和seqidno:2的激酶抑制剂功能二者的融合肽。
如本文使用的,术语“实质”指的是如与结缔组织或血管对比构成器官的基本部分的动物组织。术语“实质的”意思是涉及器官的实质。
如本文使用的,术语“胃肠外”指的是通过注射引入身体(即,通过注射施用),包括,例如,皮下(即,在皮肤下注射)、肌肉内(即,注射入肌肉)、静脉内(即,注射入静脉)、鞘内(即,注射入脊髓周围空间或大脑的蛛网膜下)、胸骨内注射或输注技术,并且包括腹膜内注射或输注入体腔(例如腹膜)。使用针——例如,外科手术针——或其它身体进入装置(corporalaccessdevice)递送胃肠外施用的组合物。如本文使用的,术语“外科手术针”指的是适于递送流体(即,能够流动)组合物进入选择的解剖结构的任何进入装置。可以使用合适的分散剂或湿润剂和悬浮剂,根据已知技术配制可注射的制剂,比如无菌注射的水性或油性悬浮液。
如本文使用的,术语“微粒”指的是悬浮在气体或液体中的固体或液体物质的细小颗粒。
如本文使用的术语“药学上可接受的载体”指的是常规地可用于施用药物的任何基本上无毒的载体,其中本发明的分离的多肽将保持稳定和生物利用。药学上可接受的载体必须具有足够高的纯度和足够低的毒性以使得其适合施用至正在治疗的哺乳动物。其进一步应当维持活性剂的稳定性和生物利用度。药学上可接受的载体可以是液体或固体,并且利用考虑的计划施用方式选择,以当与活性剂和给定组合物的其它组分结合时提供期望的体积、稠度等。
术语“药学上可接受的盐”意思是以下那些盐,其在可靠医学判断的范围内,适合用于与人和低级动物的组织接触而没有过度的毒性、刺激、变应性反应等,且与合理的效益/风险比相称。
术语“多肽”、“肽”和“蛋白质”在本文可交换地使用,指的是氨基酸残基的聚合物。术语适用于其中一个或多个氨基酸残基为相应天然存在的氨基酸的人工化学类似物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物。天然存在的氨基酸的这样的类似物的基本性质是,当将并入蛋白质时,该蛋白质与完全由天然存在的氨基酸组成的相同的蛋白质引出的抗体有特异反应性。
还在本文以最广义地使用的术语“多肽”和“蛋白质”指的是亚基氨基酸、氨基酸类似物或模拟肽的序列。除注释的地方之外,亚基通过肽键连接。本文描述的多肽可以是化学合成的或重组表达的。所述发明的多肽也可以是化学合成的。使用固相、液相或肽缩合技术、或其任意组合的熟知技术制备的合成多肽可以包括天然和非天然氨基酸。用于肽合成的氨基酸可以是利用merrifield(1963,j.am.chem.soc.85:2149-2154)的原始固相过程的标准去保护、中和、偶联和清洗方案的标准boc(n-α-氨基保护的n-α-叔丁氧羰基)氨基酸树脂,或carpino和han(1972,j.org.chem.37:3403-3409)首先描述的碱不稳定的n-α-氨基保护的9-芴甲氧羰基(fmoc)氨基酸。fmoc和bocn-α-氨基保护的氨基酸二者可以从sigma,cambridgeresearchbiochemical或本领域技术人员熟悉的其它化学公司获得。此外,可以利用本领域技术人员熟悉的其它n-α-保护基团合成多肽。可以通过本领域技术人员熟悉和例如在stewart和young,1984,solidphasesynthesis,secondedition,piercechemicalco.,rockford,ill.;fields和noble,1990,int.j.pept.proteinres.35:161-214中提供的技术,或使用自动合成仪完成固相肽合成。本发明的多肽可以包括d-氨基酸(其在体内耐受l-氨基酸特异性蛋白酶)、d-和l-氨基酸的组合、和多种“设计的”氨基酸(例如,β-甲基氨基酸、c-α-甲基氨基酸和n-α-甲基氨基酸等)以传达特殊的性质。合成氨基酸包括针对赖氨酸的鸟氨酸,和针对亮氨酸或异亮氨酸的正亮氨酸。此外,多肽可以具有模拟肽键,比如酯键,以制备具有新性质的肽。例如,可以生成并入减少的肽键的肽,即,r1-ch2-nh-r2,其中r1和r2是氨基酸残基或序列。减少的肽键可以介绍为二肽亚基。这样的多肽可以耐受蛋白酶活性,并且将具备延长的体内半衰期。因此,这些术语可以适用于其中一个或多个氨基酸残基为相应天然存在的氨基酸的人工化学类似物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物。天然存在的氨基酸的这样的类似物的基本性质是,当将并入蛋白质时,该蛋白质与完全由天然存在的氨基酸组成的相同的蛋白质引出的抗体有特异反应性。
术语“多肽”、“肽”和“蛋白质”还包括修饰,其包括但不限于糖基化、脂质附着、硫酸盐化、谷氨酸残基的γ-羧基化、羟基化和adp-核糖基化。将了解,如熟知且如上面记载的,多肽可以是不完全线性的。例如,多肽可以由于泛素化而是分支的,并且它们可以通常由于翻译后事项而为具有或不具有分支的环状,所述翻译后事项包括天然加工事项和不天然存在的人为操作带来的事项。也可以通过非翻译天然过程和通过完全合成方法来合成环状、分支及分支环状多肽。在一些实施方式中,肽是任意长度或大小的。
如本文使用的,术语“酶原(proenzyme)”或“酶原(zymogen)”指的是无活性酶前体。酶原需要生化改变(比如显露活性位点的水解反应,或改变构型以显露活性位点)以使其变为活性酶。生化改变通常发生于溶酶体,其中为了使其活化前体酶的特异部分被裂解。在活化后释放的氨基酸链被称为活化肽。
如本文使用的,术语“增殖”指的是通过将单个细胞连续地分裂为同一的子细胞来扩增细胞群。
如本文使用的,术语“肺间质”指的是肺的气囊周围的组织和空间。
如本文使用的,术语“肺泡”指的是具有空腔形式的解剖结构。肺泡位于肺的呼吸区,在肺泡管和肺泡前房的末端处,形成呼吸道的端点。肺泡是与血液气体交换的呼吸位点的球形露出,并且仅在哺乳动物肺中发现。肺泡膜是气体交换表面。血液携带来自身体其余部分的二氧化碳用于释放入肺泡,并且肺泡中的氧气被肺泡血管中的血液携带以传输至身体中的全部细胞。肺泡包含一些胶原和弹性纤维。当吸气时,弹性纤维允许肺泡随着其充满空气而伸展。它们然后在呼气期间回弹,以便排除富含二氧化碳的空气。在肺泡壁中存在三种主要肺泡细胞,(1)鳞状肺泡细胞,其形成肺泡壁的结构的,(2)大肺泡细胞,其分泌肺表面活性物以降低水的表面张力和使得膜分离,从而增加气体交换的能力,(3)巨噬细胞,其消灭外源病原体,比如细菌。
术语“相似的”与术语类似的、等价的、或相像的可交换地使用,意思是具有共同的性状或特性。
如本文使用的,术语“溶液”指的是两种或更多种物质的均匀混合物。它通常但未必是液体。在溶液中,溶质分子(或溶解的物质)在溶剂中均一分布。
术语“可溶性”和“溶解性”指的是易于溶解于指定流体(溶剂)的性质。术语“不溶性”指的是在指定溶剂中具有最小或限制溶解性的物质的性质。在溶液中,溶质分子(或溶解的物质)在溶剂中均一分布。
如本文使用的,术语“应力纤维”指的是由肌动蛋白丝、交联蛋白(将连个或更多个丝结合在一起的蛋白质)和肌球蛋白ii马达构成的细胞中的高度有序结构。肌动蛋白是球状蛋白质(~43kda),其聚合和形成具有彼此卷绕的原丝的有序丝状结构,以形成单个“肌动蛋白丝”,又称为“微丝”。肌球蛋白马达在应力纤维中移动,其滑动肌动蛋白丝越过彼此,使得纤维可以收缩。为了收缩以生成力,纤维必须被锚定至某物。应力纤维可以锚定至细胞膜,并且通常是其中此锚定发生也连接至细胞外的结构(基质或一些其它基底)的位点。这些连接位点被称为粘着斑。许多蛋白质需要适当的粘着斑产生和维持。针对这些固定的外部基底的收缩是允许由肌球蛋白马达生成的力和丝生长和重排移动和重塑细胞的收缩。
如本文使用的,术语“悬浮物/液”指的是其中细微分散的种类与另一个种类结合的分散物(混合物),而且前者被如此细微地分散和混合,使得其不迅速地沉淀。在日常生活中,最常见的悬浮物是液体中的固体。
可交换地使用的术语“对象”或“个体”或“患者”指的是哺乳动物来源的动物物种的成员,包括但不限于小鼠、大鼠、猫、山羊、绵羊、马、仓鼠、雪貂、鸭嘴兽、猪、狗、豚鼠、兔和灵长类,比如,例如,猴、猿或人。
如本文使用的,短语“需要这样的治疗的对象”指的是遭受疾病、障碍、病况或病理过程的患者。在一些实施方式中,术语“需要这样的治疗的对象”还用于指(i)将施用至少本发明的至少一种多肽;(ii)正在接受本发明的至少一种多肽;或(iii)已经接受本发明的至少一种多肽的患者,除非上下文和短语的用法另外指示。
在本文使用的术语“取代”指的是其中dna序列中的一个或多个碱基被交换为另一个或多个碱基的情况。取代可为同义取代或非同义取代。取代可以是同义取代或非同义取代。如本文使用的,“同义取代”指的是在编码蛋白质的基因的外显子中一个碱基取代另一个碱基以使得产生的氨基酸序列未被修饰。如本文使用的“非同义取代”指的是在编码蛋白质的基因的外显子中一个碱基取代另一个碱基以使得产生的氨基酸序列被修饰。
可交换地使用的活性剂的术语“治疗量”、“有效量”或“药学有效量”指的是足以提供预期的治疗益处的量。例如,抑制所述发明的组合物的激酶的“治疗量”包括但不限于以下量,其足以:(1)移除至少一个纤维化部位或降低其大小或(2)减小细胞外基质——包括胶原和纤连蛋白——沉积在肺纤维化患者的肺中的间质中的速率。术语还包含足以抑制或减轻肺纤维化患者的至少一种症状的量,其中症状包括但不限于氧饱和、呼吸困难(难以呼吸)、干咳(意思是空气从肺中突然地、嘈杂地呼出,其可能由刺激或炎症引起并且不从呼吸道移除痰)、杵状指(clubbing)(手指成为球根状外观的缺陷)、和捻发音(在吸入期间肺中的噼啪声,偶尔被称为啰音或爆裂声)。
根据所述发明可以采用的活性剂的有效量通常在大约0.001mg/kg体重至大约10g/kg体重的范围内。然而,剂量水平基于各种因素,包括损伤的类型、年龄、重量、性别、患者的医疗病况、病况的严重程度、给药的途径和频率、和采用的具体活性剂。因而给药方案可以广泛地变化,但是可以使用标准方法由医师常规地确定。
术语“治疗(treat)”或“治疗(treating)”包括废除、基本上抑制、减慢或逆转疾病、病况或障碍的进展,基本上减轻病况的临床或美容症状,基本上预防疾病、病况或障碍的临床或美容症状的出现,并且保护免受有害或恼人的症状。治疗进一步指的是实现下列中一个或多个:(a)减小障碍的严重程度;(b)限制正在治疗的障碍(一种或多种)特有的症状的发展;(c)限制正在治疗的障碍(一种或多种)特有的症状的恶化;(d)限制先前已经患有障碍(一种或多种)的患者中的障碍(一种或多种)的复发;和(e)限制先前有障碍(一种或多种)症状的患者的症状的复发。
本文使用的术语“变体”、“突变体”和“衍生物”指的是与参考核苷酸或多肽序列具有基本同一性的核苷酸或多肽序列。序列中的差异可以是在序列或结构上自然地或通过设计改变的结果。天然改变可以在特定核酸序列的正常复制或自然复制过程期间产生。设计的改变可以出于具体的目的而具体地设计并且将其引入序列。这样的具体的改变可以在体外使用各种诱变技术完成。这样具体生成的序列变体可以被称为原始序列的“突变体”或“衍生物”。
技术人员同样可以生产具有单个或多个氨基酸取代、缺失、添加或置换,但是功能上等价于seqidno:1的多肽yaraaarqarakalarqlgvaa(seqidno:1)的多肽变体。这些变体尤其可以包括:(a)其中一个或多个氨基酸残基被保守或非保守氨基酸取代的变体;(b)其中添加一个或多个氨基酸的变体;(c)其中至少一个氨基酸包括取代基的变体;(d)其中在保守或非保守位置处,来自一个物种的氨基酸残基被取代为另一个物种中的对应残基的变体;和(d)其中靶蛋白与另一个肽或多肽比如融合配偶体(fusionpartner)、蛋白标签或其它化学部分融合的变体,其可以赋予靶蛋白有用的性质,例如,抗体的表位。用于获得这样的变体的技术包括但不限于遗传(抑制、缺失、突变等)、化学和酶技术,其是技术人员所知。如本文使用的,术语“突变”指的是生物体的基因或染色体内的dna序列的变化,其导致产生在亲代型中未发现的新品质或性状,或通过改变编码基因的dna的核苷酸序列或通过改变染色体的物理排列而在染色体中发生这类变化的过程。突变的三种机制包括取代(一个碱基对交换另一个碱基对)、添加(将一个或多个碱基插入序列)、和缺失(失去一个或多个碱基对)。
如本文使用的,术语“媒介”指的是促进与其混合的药物或其它材料的物质。
如本文使用的,术语“伤口愈合”或“伤口修复”通常指的是身体在伤口后修复组织的自然过程。当个体受伤时,发生一系列复杂的生化事项以修复伤害,所述生化事项包括止血、炎症、增殖和重构。
i.组合物:用于预防或治疗表征为异常的成纤维细胞增殖和胶原沉积的疾病的治疗肽
根据一方面,所述发明提供了用于治疗表征为对象的组织中异常的成纤维细胞增殖和细胞外基质沉积的疾病、病况或过程的药物组合物,
其中所述药物组合物包括治疗量的氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)的多肽或其功能等价物、和其药学上可接受的载体,并且
其中所述治疗量对减少对象的组织中的成纤维细胞增殖和细胞外基质沉积是有效的。
根据一个实施方式,所述疾病或病况是急性肺损伤(ali)或急性呼吸窘迫综合征(ards)。
根据另一个实施方式,所述疾病或病况是辐射诱发的纤维化。
根据另一个实施方式,所述疾病或病况是移植物排斥。
根据另一个实施方式,所述组织是肺组织。
根据另一个实施方式,所述疾病或病况是间质性肺病。
根据另一个实施方式,其中所述疾病或病况是肺纤维化。
根据另一个实施方式,其中所述肺纤维化是特发性肺纤维化。
根据另一个实施方式,所述肺纤维化由施用博来霉素造成。
根据另一个实施方式,所述肺纤维化由过敏反应、吸入环境微粒、吸烟、细菌感染、病毒感染、对对象的肺的机械伤害、肺移植排斥、自身免疫障碍、遗传障碍、或其组合造成。
根据另一个实施方式,所述疾病或病况进一步表征为组织中的炎症。
根据另一个实施方式,所述炎症是急性或慢性炎症。
根据另一个实施方式,所述炎症由选自肿瘤坏死因子-α(tnf-α)、白介素-6(il-6)和白介素-1β(il-1β)的至少一种细胞因子介导。
根据另一个实施方式,所述肺纤维化表征为选自以下的至少一种病理:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、肺中成肌纤维细胞分化的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积表征为与正常健康对照对象的组织中促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的活性相比,所述组织中促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常活性。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积由以下证明:与正常健康对照对象的组织中活化的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的量或分布相比,组织中活化的(磷酸化的)促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常的量和分布。
根据另一个实施方式,所述药物组合物抑制选自本文在表1中列出的组的激酶的激酶活性。
根据另一个实施方式,此抑制可以,例如,对减少对象的组织中的成纤维细胞增殖、细胞外基质沉积、或其组合是有效的。
根据另一个实施方式,此抑制可以,例如,对减少选自以下的至少一种病理是有效的:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、肺中成肌纤维细胞分化的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据一些实施方式,mmi抑制剂在体内的抑制概况取决于剂量、给药途径、和响应于抑制剂的细胞类型。
根据另一个实施方式,所述药物组合物抑制激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物抑制激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少95%的激酶活性。
根据一些实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2激酶)的激酶活性。根据一些其它实施方式,药物组合物抑制mk2激酶的至少50%的激酶活性。根据一些其它实施方式,药物组合物抑制mk2激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3激酶)的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少70%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物抑制mk3激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少50%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少70%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少75%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少80%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少85%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少90%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少95%的激酶活性。
根据另一个实施方式,药物组合物抑制bdnf/nt-3生长因子受体(trkb)的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少50%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少70%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少75%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性、和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性、和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性、和bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制选自mk2、mk3、camki、trkb的至少一种激酶的激酶活性,而基本上不抑制从本文在表1中列出的其余组的一种或多种其它选择的激酶的活性。
根据一些实施方式,mmi抑制剂在体内的抑制概况取决于剂量、给药途径、和响应于抑制剂的细胞类型。
根据这样的实施方式,所述药物组合物抑制其它选择的激酶(一种或多种)的小于50%的激酶活性。根据这样的实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于65%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于50%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于40%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于20%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于15%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于10%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于5%的激酶活性。根据另一个实施方式,药物组合物增加其它选择的激酶的激酶活性。
根据前一段的实施方式,基本上不抑制的一种或多种其它选择的激酶选自ca2+/钙调蛋白依赖性蛋白激酶ii(camkii,包括其亚基camkiiδ)、原癌基因丝氨酸/苏氨酸-蛋白激酶(pim-1)、细胞肉瘤(c-src)、脾脏酪氨酸激酶(syk)、c-src酪氨酸激酶(csk)、和胰岛素样生长因子1受体(igf-1r)。
根据一些实施方式,所述药物组合物进一步包括至少一种另外的治疗剂。
根据一些这样的实施方式,所述另外的治疗剂选自纯化的牛v型胶原(例如,iw-001;immuneworks;unitedtherapeutics)、il-13受体拮抗物(例如,qax576;novartis)、蛋白质酪氨酸激酶抑制剂(例如,伊马替尼(gleevec®);craigdaniels/novartis)、内皮受体拮抗物(例如,act-064992(马西替坦);actelion)、双内皮素受体拮抗物(例如,波生坦(tracleer®);actelion)、前列环素类似物(吸入性伊洛前列素(例如,ventavis®);actelion)、抗ctgf单克隆抗体(例如,fg-3019)、内皮素受体拮抗物(a-选择性)(例如,安立生坦(letairis®),gilead)、ab0024(arresto)、赖氨酰氧化酶样2(loxl2)单克隆抗体(例如,gs-6624(以前的ab0024);gilead)、c-junn-末端激酶(jnk)抑制剂(例如,cc-930;celgene)、吡非尼酮(例如,esbriet®(intermune),pirespa®(shionogi))、ifn-γ1b(例如,actimmune®;intermune),针对全部三种tgf-β同种型的全中和igg4人抗体(例如,gc1008;genzyme)、tgf-β活化抑制剂(例如,stromedix(stx-100))、重组人正五聚蛋白-2蛋白(rhptx-2)(例如,prm151;promedior)、双特异性il4/il13抗体(例如,sar156597;sanofi)、人源化单克隆抗体靶向整合蛋白αvβ6(bibf1120;boehringeringelheim)、n-乙酰半胱氨酸(zambonspa)、西地那非(viagra®)、tnf拮抗物(例如,依那西普(enbrel®);pfizer)、糖皮质激素(例如,强的松、布地奈德、糠酸莫米松、丙酸氟替卡松和糠酸氟替卡松)、支气管扩张剂(例如,白三烯改性剂(例如,孟鲁司特(singuair®))、抗胆碱能支气管扩张剂(例如,异丙托溴铵和噻托溴铵)、短效β2激动剂(例如,甲磺酸乙基异丙肾上腺素(bronkometer®)、肾上腺素、舒喘灵/舒喘宁、和特布他林)、长效β2激动剂(例如,沙美特罗、福莫特罗、indecaterol(onbrez®),及其组合。
根据一些其它实施方式,所述另外的治疗剂包括支气管扩张剂,其包括但不限于白三烯改性剂、抗胆碱能支气管扩张剂、β2激动剂、或其组合。
根据另一个实施方式,所述另外的治疗剂包括皮质类固醇,其包括但不限于强的松、布地奈德、莫米松、倍氯米松(beclemethasone)、或其组合。
根据一些其它实施方式,所述另外的治疗剂是抗炎性剂。
根据一些这样的实施方式,所述抗炎性剂是非甾体抗炎性剂。如本文使用的,术语“非甾体抗炎性剂”指的是在其作用上类似阿司匹林的一大群药剂,包括但不限于布洛芬(advil®)、萘普生钠(aleve®)和扑热息痛(tylenol®)。有用于所述发明的上下文的非甾体抗炎性剂的另外的实例非限制性地包括昔康类,比如吡罗昔康、伊索昔康、替诺昔康、舒多昔康和cp-14,304;双水杨酸、贝诺酯(benorylate)、三柳胆镁(trilisate)、safapryn、solprin、二氟尼柳和芬度柳;乙酸衍生物,比如双氯芬酸、芬氯酸、消炎痛、舒林酸、托美丁、伊索克酸、呋罗芬酸、硫平酸、齐多美辛、阿西美辛、芬替酸、佐美酸、环氯弗酸(clindanac)、奥昔平酸、联苯乙酸和酮咯酸;灭酸类(fenamates),比如甲芬那酸、甲氯芬那酸、氟芬那酸、尼氟灭酸和托芬那酸;丙酸衍生物,比如苯睧洛芬、氟比洛芬、酮洛芬、非诺洛芬、芬布芬、吲哚洛芬、吡洛芬、卡洛芬、噁丙嗪、普拉洛芬、咪洛芬、硫噁洛芬、舒洛芬、阿明洛芬和噻洛芬酸;吡唑,比如保泰松、羟布宗、非普拉宗、阿扎丙宗和曲保松。还可以采用这些非甾体抗炎性剂的混合物,以及这些药剂的皮肤病学上可接受的盐和酯。例如,依托芬那酯(一种氟芬那酸衍生物)对外部应用是特别有用的。
根据另一个实施方式,所述非甾体抗炎性剂包括转化生长因子-β3(tgf-β3)、抗肿瘤坏死因子-α(tnf-α)药剂、或其组合。
根据另一个实施方式,所述抗炎性剂是甾体抗炎性剂。如本文使用的,术语“甾体抗炎性剂”指的是包含17个碳4个环系统的众多化合物中的任一个,并且包括固醇、多种激素(如促蛋白合成类固醇)和糖苷。甾体抗炎性药物的代表性实例非限制性地包括皮质类固醇比如氢化可的松、羟基曲安西龙、α-甲基地塞米松、地塞米松-磷酸盐、二丙酸倍氯米松、戊酸氯倍他索、地奈德、去羟米松、醋酸去氧皮质酮、地塞米松、二氯松、戊酸二氟米松、氟轻可舒松(fluadrenolone)、氟氯奈德、特戊酸氟米松、氟轻可舒松缩酮(fluosinoloneacetonide)、氟轻松醋酸酯、氟可丁丁酯(flucortinebutylester)、氟可龙、醋酸氟泼尼定(fluprednylidene)、氟氢缩松、哈西奈德、醋酸氢化可的松、丁酸氢化可的松、甲基泼尼松龙、曲安奈德、可的松、可托多松、醋酸氟轻松(flucetonide)、氟氢可的松、双醋二氟拉松(difluorosonediacetate)、氟轻可舒松缩酮、氟氢可的松、双醋二氟拉松(diflorosonediacetate)、氟轻可舒松缩酮、甲羟松、安西法尔(amcinafel)、安西非特、倍他米松和其酯的余量、氯化强的松、醋酸氯化强的松醋、氯可托龙(clocortelone)、地西松(clescinolone)、二氯松、二氟拨尼酯(diflurprednate)、氟二氯松、氟尼缩松、氟米龙、氟培龙、氟泼尼松龙、戊酸氢化可的松、氢化可的松环戊丙酸酯、氢可他酯、甲泼尼松、帕拉米松、泼尼松龙、强的松、二丙酸倍氯米松、曲安西龙,及其混合物。
根据另一个实施方式,所述甾体抗炎性剂包括选自强的松,布地奈德、莫米松、倍氯米松,及其组合的至少一种皮质类固醇。
根据另一个实施方式,所述另外的治疗剂包括黄嘌呤或黄嘌呤衍生物,比如甲基黄嘌呤。
根据另一个实施方式,所述另外的治疗剂包括嗜中性粒细胞弹性酶抑制剂。
根据另一个实施方式,所述另外的治疗剂是至少一种嗜中性粒细胞弹性酶抑制剂,其包括但不限于ici200355、ono-5046、mr-889、l-694,458、ce-1037、gw-311616、tei-8362、ono-6818、ae-3763、fk-706、ici-200,880、zd-0892、zd-8321,及其组合。
根据另一个实施方式,另外的治疗剂包括至少一种磷酸二酯酶抑制剂,其包括但不限于磷酸二酯酶4抑制剂。磷酸二酯酶4抑制剂的实例包括但不限于罗氟司特、西洛司特或其组合。
根据另一个实施方式,所述另外的治疗剂是镇痛剂。根据一些实施方式,镇痛剂通过提高痛阈而不干扰意识或改变其它感觉模式来缓解疼痛。根据一些这样的实施方式,镇痛剂是非阿片镇痛药。“非阿片镇痛药”是减少疼痛但不是阿片镇痛药的天然或合成物质。非阿片镇痛药的实例包括但不限于依托度酸、消炎痛、舒林酸、托美丁、萘丁美酮、吡罗昔康、扑热息痛、非诺洛芬、氟比洛芬、布洛芬、酮洛芬、萘普生、萘普生钠、噁丙嗪、阿司匹林、三水杨酸胆碱镁、二氟尼柳、甲氯芬那酸、甲芬那酸、和保泰松。根据一些其它实施方式,镇痛药是阿片镇痛药。“阿片镇痛药”、“阿片”或“麻醉性镇痛药”是与中枢神经系统中的阿片受体结合,产生对抗行为的天然或合成物质。阿片镇痛药的实例包括但不限于可待因、芬太尼、氢吗啡酮、左啡诺、哌替啶、美沙酮、吗啡、羟考酮、羟吗啡酮、丙氧芬、丁丙诺啡、布托啡诺、地佐辛、纳布啡、和喷他佐辛。
根据另一个实施方式,所述另外的治疗剂是抗感染剂。根据另一个实施方式,抗感染剂是抗生素药剂。如本文使用的,术语“抗生素药剂”意思是在传染病的治疗中主要使用的具有抑制细菌和其它微生物的生长或消灭细菌和其它微生物的能力的任意组化学物质。抗生素药剂的实例包括但不限于青霉素g;甲氧西林;萘夫西林;苯唑西林;氯唑西林;二氯唑西林;氨苄青霉素;阿莫西林;替卡西林;羧苄青霉素;美洛西林;阿洛西林;哌拉西林;亚胺培南;氨曲南;头孢噻酚;头孢克洛;头孢西丁;头孢呋辛;头孢尼西;头孢美唑;头孢替坦;头孢丙烯;氯碳头孢;头孢他美;头孢哌酮;头孢噻肟;头孢唑肟;头孢曲松;头孢他啶;头孢吡肟;头孢克肟;头孢泊肟;头孢磺啶;氟罗沙星;萘啶酸;诺氟沙星;环丙沙星;氧氟沙星;依诺沙星;洛美沙星;西诺沙星;多西环素;米诺环素;四环素;阿米卡星;庆大霉素;卡那霉素;奈替米星;妥布霉素;链霉素;阿奇霉素;克拉霉素;红霉素;依托红霉素;琥乙红霉素;葡庚糖酸红霉素;乳糖酸红霉素;硬脂酸红霉素;万古霉素;太古霉素;氯霉素;克林霉素;甲氧苄啶;新诺明;呋喃妥因;利福平;莫匹罗星;灭滴灵;头孢氨苄;罗红霉素;co-amoxiclavuanate;哌拉西林和他唑巴坦的组合;和其多种盐、酸、碱和其它衍生物。抗菌抗生素药剂包括但不限于青霉素、头孢菌素、碳头孢烯、头霉素、碳青霉烯、单环β-内酰胺、氨基糖苷、糖肽、喹诺酮、四环素、大环内脂、和氟喹诺酮。
根据另一个实施方式,所述药物组合物抑制在对象的肺中发生的炎症。根据另一个实施方式,炎症是急性炎症。根据另一个实施方式,炎症是慢性炎症。根据另一个实施方式,炎症由肿瘤坏死因子-α(tnf-α)介导。根据另一个实施方式,炎症由白介素-6(il-6)介导。根据另一个实施方式,炎症由白介素-1β(il-1β)介导。
根据另一个实施方式,与对照相比,所述药物组合物调节肺中肿瘤坏死因子-α(tnf-α)的量。根据另一个实施方式,与对照相比,药物组合物调节肺中白介素-6(il-6)的量。根据另一个实施方式,与对照相比,药物组合物调节肺中白介素-1β(il-1β)的量。
根据另一个实施方式,所述药物组合物抑制热休克27kda蛋白1(hspb1)的活性。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成纤维细胞增殖的异常诱导。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成肌纤维细胞分化的异常诱导。根据另一个实施方式,被药物组合物抑制的hspb1的活性是细胞外基质蛋白沉积入肺间质。根据另一个实施方式,细胞外基质蛋白是胶原。根据另一个实施方式,被药物组合物抑制的hspb1的活性是纤维变性位置形成的促进。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成肌纤维细胞收缩活性的增加。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成肌纤维细胞附着至细胞外基质的促进。
根据一些实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有基本序列同一性。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少70%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少80%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少90%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少95%序列同一性。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列faklaarlyrkalarqlgvaa(seqidno:3)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列kafaklaarlyrkalarqlgvaa(seqidno:4)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlava(seqidno:5)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlgva(seqidno:6)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列hrrikawlkkikalarqlgvaa(seqidno:7)。
根据一些其它实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是包括可操作地连接至第二多肽的第一多肽的融合蛋白,其中第一多肽具有氨基酸序列yaraaarqara(seqidno:11),并且第二多肽包括治疗结构域,其序列与氨基酸序列kalarqlgvaa(seqidno:2)具有基本同一性。
根据一些这样的实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少70%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少80%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少90%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少95%序列同一性。
根据一些实施方式,第二多肽是氨基酸序列kalarqlava(seqidno:8)的多肽。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlgva(seqidno:9)的多肽。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlgvaa(seqidno:10)的多肽。
根据一些其它实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是包括可操作地连接至第二多肽的第一多肽的融合蛋白,其中第一多肽包括在功能上等价于yaraaarqara(seqidno:11)的细胞穿透肽,并且第二多肽具有氨基酸序列kalarqlgvaa(seqidno:2)。
根据另一个实施方式,第一多肽是氨基酸序列wlrrikawlrrika(seqidno:12)的多肽。根据另一个实施方式,第一多肽是氨基酸序列wlrrika(seqidno:13)的多肽。根据另一个实施方式,第一多肽是氨基酸序列ygrkkrrqrrr(seqidno:14)的多肽。根据另一个实施方式,第一多肽是氨基酸序列wlrrikawlrri(seqidno:15)的多肽。根据另一个实施方式,第一多肽是氨基酸序列faklaarlyr(seqidno:16)的多肽。根据另一个实施方式,第一多肽是氨基酸序列kafaklaarlyr(seqidno:17)的多肽。根据另一个实施方式,第一多肽是氨基酸序列hrrikawlkki(seqidno:18)的多肽。
根据另一方面,所述发明还提供了分离的核酸,其编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少70%氨基酸序列同一性的蛋白质序列。根据一些实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少80%氨基酸序列同一性的蛋白质序列。根据一些其它实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少90%氨基酸序列同一性的蛋白质序列。根据一些其它实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少95%氨基酸序列同一性的蛋白质序列。
根据一些其它实施方式,所述药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.00001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.0001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.001mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.01mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.1mg/kg(或100µg/kg)体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约1mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约10mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约2mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约3mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约4mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约5mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约60mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约70mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约80mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约90mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约90mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约80mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约70mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约60mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约50mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约40mg/kg体重的量。根据另一个实施方式,治疗性抑制肽的治疗量的具有从大约0.000001mg/kg体重至大约30mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约20mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.01mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.001mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.0001mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.00001mg/kg体重的量。
根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至25μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至2μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在2μg/kg/天至3μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在3μg/kg/天至4μg/kg/天的范围内。根据一些其它实施方式,药物的治疗性抑制肽的治疗剂量在4μg/kg/天至5μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在5μg/kg/天至6μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在6μg/kg/天至7μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在7μg/kg/天至8μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在8μg/kg/天至9μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在9μg/kg/天至10μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至5μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在5μg/kg/天至10μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在10μg/kg/天至15μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在15μg/kg/天至20μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在25μg/kg/天至30μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在30μg/kg/天至35μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在35μg/kg/天至40μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在40μg/kg/天至45μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在45μg/kg/天至50μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在50μg/kg/天至55μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在55μg/kg/天至60μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在60μg/kg/天至65μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在65μg/kg/天至70μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在70μg/kg/天至75μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在80μg/kg/天至85μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在85μg/kg/天至90μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在90μg/kg/天至95μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在95μg/kg/天至100μg/kg/天的范围内。
根据另一个实施方式,药物组合物的治疗性抑制肽的治疗剂量是1μg/kg/天。
根据另一个实施方式,药物组合物的治疗性抑制肽的治疗剂量是2μg/kg/天。
根据另一个实施方式,药物组合物的治疗性抑制肽的治疗剂量是5μg/kg/天。
根据另一个实施方式,药物组合物的治疗性抑制肽的治疗剂量是10μg/kg/天。
根据一些实施方式,本发明的多肽包括d-氨基酸(其在体内耐受l-氨基酸特异性蛋白酶)、d-和l-氨基酸的组合、和多种“设计的”氨基酸(例如,β-甲基氨基酸、c-α-甲基氨基酸和n-α-甲基氨基酸等)以传达特殊的性质。合成氨基酸取代的实例包括鸟氨酸取代赖氨酸,和正亮氨酸取代亮氨酸或异亮氨酸。
根据一些实施方式,多肽可以被连接至其它化合物以促进增加的体内半衰期,比如聚乙二醇或葡聚糖。这样的连接可以是共价的或非共价的,如本领域技术人员所理解的。根据一些其它实施方式,多肽可以被包裹在微团比如由聚(乙二醇)-聚(聚丙二醇)或聚(乙二醇)-聚乳酸嵌段共聚物制造的微团中。根据一些其它实施方式,多肽可以被包裹在由可降解的聚酯(包括但不限于,聚乳酸、聚乙交酯和聚己酸内酯)组成的可降解的纳米颗粒或微粒中。
根据另一个实施方式,多肽可以以固体形式(包括颗粒剂、粉末或栓剂)或液体形式(例如,溶液、悬浮液或乳液)制备。
根据另一个实施方式,所述发明的组合物可以是可分散的干粉的形式,以便通过吸入或吹入递送(分别通过嘴或通过鼻)。干粉组合物可以通过本领域已知的工艺制备,比如冻干和气流粉碎,如在国际专利公布号wo91/16038中公开的和如在美国专利号6,921,527中公开的,其公开内容通过引用并入。所述发明的组合物以足以给对象提供单位剂量治疗的量放置在合适的剂量受器内。剂量受器是以下受器:在合适的吸入装置内适配以允许通过散布入气流来气溶胶化干粉组合物,从而形成气溶胶并且然后在腔室中捕获如此产生的气溶胶,所述腔室具有附加的衔口,以便需要治疗的对象的随后的吸入。这样的剂量受器包括本领域已知的封装组合物的任意容器比如明胶或塑料胶囊,其具有允许气流(例如,空气)导向进入容器以分散干粉组合物的可移除的部分。这样的容器由在美国专利号4,227,522;美国专利号4,192,309;和美国专利号4,105,027中显示的那些例证。合适的容器还包括与glaxo的ventolin®rotohaler牌粉末吸入器或fison的spinhaler®牌粉末吸入器共同使用的那些。提供优良防潮层的另一种合适的单位剂量容器由铝箔层压塑料形成。基于药物的粉末按重量计或按体积计填充入可成形的箔中的凹陷,并且利用覆箔-层压塑料密封。与粉末吸入装置一起使用的这样的容器描述在美国专利号4,778,054中,并且与glaxo的diskhaler®(美国专利号4,627,432;4,811,731;和5,035,237)一起使用。全部这些参考文献通过引用以其全部并入本文。
根据另一个实施方式,所述发明的组合物的载体包括释放剂,比如缓释或延释载体。在这样的实施方式中,载体可以是能够缓释或延释多肽以提供更高效的施用的任意物质,例如,导致多肽的更不频繁和/或降低的剂量,提高操作的便利,并且延长或延迟对正在治疗、预防或促进的疾病、障碍、病况、综合征等的作用。这样的载体的非限制性实例包括天然和合成聚合物等的脂质体、微海绵、微球、或微胶囊。脂质体可以由各种磷脂形成,包括但不限于,胆固醇、硬脂胺或磷脂酰胆碱。
用于合成和制备小肽的方法是本领域熟知的,并且公开在例如美国专利号5,352,461;5,503,852;6,071,497;6,331,318;6,428,771和美国公布号20060040953中。美国专利号6,444,226和6,652,885描述了为了使活性剂与颗粒结合,在向其中添加活性剂的溶液的水性悬浮液中制备和提供二酮哌嗪的微粒。这些专利进一步描述了通过冻干移除液体介质以产生包括活性剂的微粒的方法。改变这样的悬浮液的溶剂条件以促进活性剂与颗粒的结合公开在美国申请号60/717,524;11/532,063;和11/532,065;美国专利号6,440,463;和美国申请号11/210,709和11/208,087中。这些专利和专利申请中的每个通过引用并入本文。
在一些实施方式中,本发明的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物可以通过在例如美国申请号11/678,046(通过引用并入本文)中公开的喷雾干燥的方法干燥。
在又另一个实施方式中,本发明的多肽可以应用于各种溶液。合适的制剂是无菌的,溶解足够量的多肽,并且对提出的应用无害。例如,所述发明的组合物可以配制为水性悬浮液,其中活性成分(一种或多种)在与适于制造水性悬浮液的赋形剂的掺合物中。
这样的赋形剂非限制性地包括悬浮剂(例如,羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、海藻酸钠、聚乙烯吡咯烷酮、黄蓍胶和阿拉伯树胶),分散或湿润剂,其包括天然存在的磷脂(例如,卵磷脂)、或环氧烷烃与脂肪酸的缩合产物(例如,聚氧乙烯硬脂酸酯)、或环氧烷烃与长链脂肪醇的缩合产物(例如,十七碳乙烯氧基鲸蜡醇(heptadecaethyl-eneoxycetanol))、或环氧烷烃与源自脂肪酸和己糖醇的偏酯的缩合产物(例如,聚氧乙烯山梨醇单油酸酯)、或环氧烷烃与源自脂肪酸和己糖醇酐的偏酯的缩合产物(例如,聚乙烯失水山梨醇单油酸酯)。
所述发明的组合物还可以通过在植物油(例如,花生油、橄榄油、芝麻油或椰子油)或在矿物油(例如,液体石蜡)中悬浮活性成分配制为油性悬浮液。油性悬浮液可以包含增稠剂(例如,蜂蜡、硬石蜡或鲸蜡醇)。
所述发明的组合物还可以通过添加水以适于制备水性悬浮液的可分散的粉末或颗粒剂的形式配制。这样的粉末和颗粒剂中的活性成分提供在与分散或湿润剂、悬浮剂、和一种或多种防腐剂的掺合物中。合适的分散或湿润剂和悬浮剂由上面已经提及的那些例证。还可以存在另外的赋形剂。
根据一些实施方式,干粉由喷雾干燥过程产生。
根据一些其它实施方式,干粉由微粉化产生。
根据另一个实施方式,干粉包含具有1至5微米的质量中值空气动力学直径(mmad)的微粒。
根据另一个实施方式,干粉包含具有大约2微米的质量中值空气动力学直径(mmad)的微粒。
根据另一个实施方式,药物组合物包装在吸入装置中,包括,例如,不限于喷雾器、定量吸入器(mdi)、和干粉吸入器(dpi)。
根据一些其它实施方式,药物组合物是使用喷雾器进行气溶胶递送的液体。根据一些这样的实施方式,药物组合物的流量是至少0.3ml/min,并且药物组合物被递送为2mm颗粒,分布入最深的肺泡。
所述发明的组合物还可以是乳液的形式。乳液是通过结合两种不混溶的液体载体制备的两相系统,其中的一个贯穿另一个均匀地散开(disburse)并且由小球构成,所述小球的直径等于或大于最大的胶体颗粒的直径。小球大小是关键的,并且必须使得系统实现最大稳定性。通常,两个相的分离将不会发生,除非并入第三种物质——乳化剂。因而,基本的乳液包含至少三种组分——两种不混溶的液体载体和乳化剂,以及活性成分。大多数乳液浆水相并入非水相(或反之亦然)。然而,制备基本上非水性的乳液是可能的,例如,非水性不混溶系统甘油和橄榄油的阴离子和阳离子表面活性剂。因而,本发明的组合物可以是水包油乳液的形式。油相可以是植物油,例如,橄榄油或花生油,或矿物油,例如液体石蜡,或其混合物。合适的乳化剂可以是天然存在的树胶,例如,阿拉伯树胶或黄蓍胶,天然存在的磷脂,例如大豆、卵磷脂,和源自脂肪酸和己糖醇酐的酯或偏酯,例如失水山梨醇单油酸酯,和偏酯与环氧乙烷的缩合产物,例如,聚氧乙烯失水山梨醇单油酸酯。
根据一些实施方式,所述发明的多肽是化学合成的。使用固相、液相或肽缩合技术、或其任意组合的熟知技术制备的这样的合成多肽可以包括天然或非天然氨基酸。用于肽合成的氨基酸可以是利用merrifield(1963,j.am.chem.soc.85:2149-2154)的原始固相过程的标准去保护、中和、偶联和清洗方案的标准boc(n-α-氨基保护的n-α-叔丁氧羰基)氨基酸树脂,或carpino和han(1972,j.org.chem.37:3403-3409)首先描述的碱不稳定的n-α-氨基保护的9-芴甲氧羰基(fmoc)氨基酸。fmoc和bocn-α-氨基保护的氨基酸二者可以从sigma,cambridgeresearchbiochemical或本领域技术人员熟悉的其它化学公司获得。此外,可以利用本领域技术人员熟悉的其它n-α-保护基团合成多肽。可以通过本领域技术人员熟悉和例如在stewart和young,1984,solidphasesynthesis,secondedition,piercechemicalco.,rockford,ill.;fields和noble,1990,int.j.pept.proteinres.35:161-214中提供的技术,或使用自动合成仪完成固相肽合成,每个通过引用以其全部并入本文。
ii.用于预防或治疗表征为异常的成纤维细胞增殖和胶原沉积的疾病的方法
根据另一方面,所述发明提供了用于治疗表征为对象的组织中异常的成纤维细胞增殖和细胞外基质沉积的疾病、病况或过程的方法,方法包括:
施用药物组合物至对象,所述药物组合物包括治疗量的氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)的多肽或其功能等价物、和其药学上可接受的载体,
其中治疗量对减少对象的组织中的成纤维细胞增殖和细胞外基质沉积是有效的。
根据方法的一个实施方式,所述疾病或病况是急性肺损伤(ali)或急性呼吸窘迫综合征(ards)。
根据另一个实施方式,所述疾病或病况是辐射诱发的纤维化。
根据另一个实施方式,所述疾病或病况是移植物排斥。
根据另一个实施方式,所述组织是肺组织。
根据另一个实施方式,所述疾病或病况是间质性肺病。
根据另一个实施方式,所述疾病或病况是肺纤维化。
根据另一个实施方式,所述肺纤维化是特发性肺纤维化。
根据另一个实施方式,所述肺纤维化由施用博来霉素造成。
根据另一个实施方式,所述肺纤维化由过敏反应、吸入环境微粒、吸烟、细菌感染、病毒感染、对对象的肺的机械伤害、肺移植排斥、自身免疫障碍、遗传障碍、或其组合造成。
根据另一个实施方式,所述疾病或病况是进一步表征为组织中的炎症。
根据另一个实施方式,所述炎症是急性或慢性炎症。
根据另一个实施方式,所述炎症由选自肿瘤坏死因子-α(tnf-α)、白介素-6(il-6)和白介素-1β(il-1β)的至少一种细胞因子介导。
根据另一个实施方式,所述肺纤维化表征为选自以下的至少一种病理:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、肺中成肌纤维细胞分化的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积表征为与正常健康对照对象的组织中促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的活性相比,所述组织中促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常活性。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积由以下证明:与正常健康对照对象的组织中活化的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的量或分布相比,组织中活化的(磷酸化的)促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常的量和分布。
根据另一个实施方式,所述肺纤维化表征为选自以下的至少一种病理:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、肺中成肌纤维细胞群分化为成肌纤维细胞群的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据另一个实施方式,所述疾病或病况是慢性阻塞性肺病(copd)。根据另一个实施方式,慢性阻塞性肺病(copd)由吸烟造成。根据另一个实施方式,慢性阻塞性肺病(copd)由环境微粒造成。根据另一个实施方式,慢性阻塞性肺病(copd)由α-1抗胰蛋白酶缺陷造成。根据另一个实施方式,慢性阻塞性肺病(copd)由儿童期呼吸感染造成。
根据另一个实施方式,所述肺纤维化表征为与正常健康对照对象相比,对象的肺中热休克27kda蛋白1(hspb1)的异常活性。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比,对象的肺间质中细胞外基质蛋白的异常沉积。根据另一个实施方式,细胞外基质蛋白是胶原。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中成纤维细胞增殖的异常促进。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中成肌纤维细胞分化的异常诱导。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中纤维化部位形成的促进。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中成肌纤维细胞收缩活性的增加。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中成肌纤维细胞附着至细胞外基质的异常促进。
根据另一个实施方式,所述药物组合物抑制在对象的肺中发生的炎症。根据另一个实施方式,炎症是急性炎症。根据另一个实施方式,炎症是慢性炎症。根据另一个实施方式,炎症由肿瘤坏死因子-α(tnf-α)介导。根据另一个实施方式,炎症由白介素-1β(il-1β)介导。根据另一个实施方式,炎症由白介素-6(il-6)介导。
根据另一个实施方式,与对照相比,所述药物组合物调节对象的肺中肿瘤坏死因子-α(tnf-α)的量。根据另一个实施方式,与对照相比,药物组合物调节对象的肺中白介素-1β(il-1β)的量。根据另一个实施方式,与对照相比,药物组合物调节对象的肺中白介素-6(il-6)的量。
根据另一个实施方式,与对象的肺中的正常健康对照对象相比,所述药物组合物抑制hspb1的异常活性。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺间质中细胞外基质蛋白的异常沉积。根据另一个实施方式,细胞外基质蛋白是胶原。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中成纤维细胞增殖的异常促进。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比肺中成纤维细胞分化为成肌纤维细胞的异常诱导。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比纤维化部位形成的异常促进。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比成肌纤维细胞的收缩活性的异常增加。根据另一个实施方式,与正常健康对照对象相比,成肌纤维细胞收缩活性表征为升高水平的α平滑肌肌动蛋白(α-sma)。根据另一个实施方式,与正常健康对照对象相比,成肌纤维细胞收缩活性表征为应力纤维形成的增加。根据另一个实施方式,hspb1的异常活性是与正常健康对照对象相比成肌纤维细胞附着至细胞外基质的异常促进。
根据一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2激酶)的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3激酶)的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少70%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少50%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少70%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少75%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少80%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少85%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少90%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少95%的激酶活性。
根据另一个实施方式,药物组合物抑制bdnf/nt-3生长因子受体(trkb)的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少50%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少70%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少75%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性、和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性、和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性、和bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制选自mk2、mk3、camki、trkb的至少一种激酶的激酶活性,而基本上不抑制来自本文在表1中列出的其余组的一种或多种其它选择的激酶的活性。
根据另一个实施方式,所述药物组合物抑制选自本文在表1中列出的组的激酶的激酶活性。
根据另一个实施方式,此抑制可以,例如,对减少对象的组织中的成纤维细胞增殖、细胞外基质沉积、或其组合是有效的。
根据另一个实施方式,此抑制可以,例如,对减少选自以下的至少一种病理是有效的:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、成肌纤维细胞分化的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据一些实施方式,mmi抑制剂在体内的抑制概况取决于剂量、给药途径、和响应于抑制剂的细胞类型。
根据这样的实施方式,所述药物组合物抑制其它选择的激酶(一种或多种)的小于50%的激酶活性。根据这样的实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于65%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于50%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于40%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于20%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于15%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于10%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于5%的激酶活性。根据另一个实施方式,药物组合物增加其它选择的激酶的激酶活性。
根据前一段的实施方式,基本上不抑制的一种或多种其它选择的激酶选自ca2+/钙调蛋白依赖性蛋白激酶ii(camkii,包括其亚基camkiiδ)、原癌基因丝氨酸/苏氨酸-蛋白激酶(pim-1)、细胞肉瘤(c-src)、脾脏酪氨酸激酶(syk)、c-src酪氨酸激酶(csk)、和胰岛素样生长因子1受体(igf-1r)。
根据一些实施方式,所述药物组合物进一步包括另外的治疗剂。
根据一些这样的实施方式,所述另外的治疗剂选自纯化的牛v型胶原(例如,iw-001;immuneworks;unitedtherapeutics)、il-13受体拮抗物(例如,qax576;novartis)、蛋白质酪氨酸激酶抑制剂(例如,伊马替尼(gleevec®);craigdaniels/novartis)、内皮受体拮抗物(例如,act-064992(马西替坦);actelion)、双内皮素受体拮抗物(例如,波生坦(tracleer®);actelion)、前列环素类似物(吸入性伊洛前列素(例如,ventavis®);actelion)、抗ctgf单克隆抗体(例如,fg-3019)、内皮素受体拮抗物(a-选择性)(例如,安立生坦(letairis®),gilead)、ab0024(arresto)、赖氨酰氧化酶样2(loxl2)单克隆抗体(例如,gs-6624(以前的ab0024);gilead)、c-junn-末端激酶(jnk)抑制剂(例如,cc-930;celgene)、吡非尼酮(例如,esbriet®(intermune)、pirespa®(shionogi))、ifn-γ1b(例如,actimmune®;intermune)、针对全部三种tgf-β同种型的全中和igg4人抗体(例如,gc1008;genzyme)、tgf-β活化抑制剂(例如,stromedix(stx-100))、重组人正五聚蛋白-2蛋白(rhptx-2)(例如,prm151;promedior)、双特异性il4/il13抗体(例如,sar156597;sanofi)、人源化单克隆抗体靶向整合蛋白αvβ6(bibf1120;boehringeringelheim)、n-乙酰半胱氨酸(zambonspa)、西地那非(viagra®;)、tnf拮抗物(例如,依那西普(enbrel®);pfizer)、糖皮质激素(例如,强的松、布地奈德、糠酸莫米松、丙酸氟替卡松和糠酸氟替卡松)、支气管扩张剂(例如,白三烯改性剂(例如,孟鲁司特(singuair®))、抗胆碱能支气管扩张剂(例如,异丙托溴铵和噻托溴铵)、短效β2激动剂(例如,甲磺酸乙基异丙肾上腺素(bronkometer®)、肾上腺素、舒喘灵/舒喘宁和特布他林)、长效β2激动剂(例如,沙美特罗、福莫特罗、indecaterol(onbrez®),及其组合。
根据一些其它实施方式,所述另外的治疗剂包括支气管扩张剂,其包括但不限于白三烯改性剂、抗胆碱能支气管扩张剂、β2激动剂、或其组合。
根据另一个实施方式,所述另外的治疗剂包括皮质类固醇,其包括但不限于强的松、布地奈德、莫米松、倍氯米松、或其组合。
根据一些其它实施方式,所述另外的治疗剂包括支气管扩张剂,其包括但不限于白三烯改性剂、抗胆碱能支气管扩张剂、β2激动剂、或其组合。
根据另一个实施方式,所述另外的治疗剂包括皮质类固醇,其包括但不限于强的松、布地奈德、莫米松、倍氯米松、或其组合。
根据另一个实施方式,所述另外的治疗剂是抗炎性剂。
根据另一个实施方式,所述抗炎性剂是非甾体抗炎性剂。还可以采用非甾体抗炎性剂的混合物,以及这些药剂的皮肤病学上可接受的盐和酯。例如,依托芬那酯(一种氟芬那酸衍生物)对外部应用是特别有用的。
根据另一个实施方式,其中所述非甾体抗炎性剂包括转化生长因子-β3(tgf-β3)、抗肿瘤坏死因子-α(tnf-α)药剂、或其组合。
根据另一个实施方式,所述抗炎性剂是甾体抗炎性剂。根据另一个实施方式,甾体抗炎性剂包括选自强的松、布地奈德、莫米松、倍氯米松,及其组合的至少一种皮质类固醇。
根据另一个实施方式,所述另外的治疗剂包括甲基黄嘌呤。
根据另一个实施方式,所述另外的治疗剂包括嗜中性粒细胞弹性酶抑制剂。
根据另一个实施方式,所述另外的治疗剂是至少一种嗜中性粒细胞弹性酶抑制剂,其包括但不限于ici200355、ono-5046、mr-889、l-694,458、ce-1037、gw-311616、tei-8362、ono-6818、ae-3763、fk-706、ici-200,880、zd-0892、zd-8321,及其组合。
根据另一个实施方式,所述另外的治疗剂包括至少一种磷酸二酯酶抑制剂,其包括但不限于磷酸二酯酶4抑制剂。磷酸二酯酶4抑制剂的实例包括但不限于罗氟司特、西洛司特或其组合。
根据另一个实施方式,所述另外的治疗剂是镇痛剂。根据一些这样的实施方式,镇痛剂是非阿片镇痛药。根据一些其它实施方式,镇痛药是阿片镇痛药。
根据另一个实施方式,所述另外的治疗剂是抗感染剂。根据另一个实施方式,抗感染剂是抗生素药剂。
根据一些实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有基本序列同一性。
根据一些这样的实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少70%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少80%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少90%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少95%序列同一性。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列faklaarlyrkalarqlgvaa(seqidno:3)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列kafaklaarlyrkalarqlgvaa(seqidno:4)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlava(seqidno:5)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlgva(seqidno:6)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列hrrikawlkkikalarqlgvaa(seqidno:7)。
根据一些其它实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是包括可操作地连接至第二多肽的第一多肽的融合蛋白,其中第一多肽是氨基酸序列yaraaarqara(seqidno:11),并且第二多肽包括治疗结构域,其序列与氨基酸序列kalarqlgvaa(seqidno:2)具有基本同一性。
根据另一个实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少70%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少80%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少90%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少95%序列同一性。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlava(seqidno:8)的多肽。
根据另一个实施方式,第二多肽氨基酸序列kalarqlgva(seqidno:9)的多肽。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlgvaa(seqidno:10)的多肽。
根据一些实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是包括可操作地连接至第二多肽的第一多肽的融合蛋白,其中第一多肽包括在功能上等价于yaraaarqara(seqidno:11)的细胞穿透肽,并且第二多肽具有氨基酸序列kalarqlgvaa(seqidno:2),并且药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性。
根据另一个实施方式,第一多肽是氨基酸序列wlrrikawlrrika(seqidno:12)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列wlrrika(seqidno:13)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列ygrkkrrqrrr(seqidno:14)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列wlrrikawlrri(seqidno:15)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列faklaarlyr(seqidno:16)的多肽。根据一些这样的实施方式,第一多肽是氨基酸序列kafaklaarlyr(seqidno:17)的多肽。根据一些这样的实施方式,第一多肽是氨基酸序列hrrikawlkki(seqidno:18)的多肽。
根据另一方面,所述发明还提供了分离的核酸,其编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少70%氨基酸序列同一性的蛋白质序列。
根据一些这样的实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少80%氨基酸序列同一性的蛋白质序列。根据一些其它实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少90%氨基酸序列同一性的蛋白质序列。根据一些其它实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少95%氨基酸序列同一性的蛋白质序列。
根据另一个实施方式,施用的步骤可以口服、含服、胃肠外、外用,通过吸入,通过吹入、或直肠来全身发生,或可以通过比如而不限于注射、植入、移植、外部施加、或胃肠外的手段局部发生。可以进行另外的施用,例如,静脉内、经粘膜、经皮、肌肉内、皮下、气管内(包括通过肺吸入)、腹膜内、鞘内、淋巴内、病灶内、或硬膜外。可以作为单独的单位剂量或以包括多种药物和/或物质的多单位剂量的治疗方案的形式进行施用,例如,一次、多次、和/或在一个或多个延长期内。
根据一些其它实施方式,施用的步骤作为单一剂量发生一次。根据一些其它实施方式,施用的步骤作为时间周期内的多个剂量进行。根据一些这样的实施方式,时间周期是一天、一周、一个月、一个月、一年、或其倍数。根据一些实施方式,施用的步骤每天进行持续至少一周的时期。根据一些实施方式,施用的步骤每周进行持续至少一个月的时期。根据一些实施方式,施用的步骤每月进行持续至少两个月的时期。根据另一个实施方式,施用的步骤在至少一年的时期内重复进行。根据另一个实施方式,施用的步骤每月进行至少一次。根据另一个实施方式,施用的步骤每周进行至少一次。根据另一个实施方式,施用的步骤每天进行至少一次。
根据一些其它实施方式,治疗量的药物组合物经由吸入装置施用。可以用于施用药物组合物的吸入装置的实例包括但不限于喷雾器、定量吸入器(mdi)、干粉吸入器(dpi)、和干粉喷雾器。
根据另一个实施方式,干粉包含具有1至5微米的质量中值空气动力学直径(mmad)的微粒。根据另一个实施方式,干粉包含具有大约2微米的质量中值空气动力学直径(mmad)的微粒。
根据一些其它实施方式,所述药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.00001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.0001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.001mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.01mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.1mg/kg(或100µg/kg)体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约1mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约10mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约2mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约3mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约4mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约5mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约60mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约70mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约80mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约90mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约90mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约80mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约70mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约60mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约50mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约40mg/kg体重的量。根据另一个实施方式,治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约30mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约20mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.01mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.001mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.0001mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.00001mg/kg体重的量。
根据一些其它实施方式,所述药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至25μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至2μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在2μg/kg/天至3μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在3μg/kg/天至4μg/kg/天的范围内。根据一些其它实施方式,药物的治疗性抑制肽的治疗剂量在4μg/kg/天至5μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在5μg/kg/天至6μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在6μg/kg/天至7μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在7μg/kg/天至8μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在8μg/kg/天至9μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在9μg/kg/天至10μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至5μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在5μg/kg/天至10μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在10μg/kg/天至15μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在15μg/kg/天至20μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在25μg/kg/天至30μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在30μg/kg/天至35μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在35μg/kg/天至40μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在40μg/kg/天至45μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在45μg/kg/天至50μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在50μg/kg/天至55μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在55μg/kg/天至60μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在60μg/kg/天至65μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在65μg/kg/天至70μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在70μg/kg/天至75μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在80μg/kg/天至85μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在85μg/kg/天至90μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在90μg/kg/天至95μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在95μg/kg/天至100μg/kg/天的范围内。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是1μg/kg/天。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是2μg/kg/天。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是5μg/kg/天。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是10μg/kg/天。
iii.用于预防或治疗表征为异常的成纤维细胞增殖和胶原沉积的疾病的系统
根据另一方面,所述发明提供了用于治疗表征为对象的组织中异常的成纤维细胞增殖和细胞外基质沉积的疾病、病况或过程的系统,
其中药物组合物包括治疗量的氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)的多肽或其功能等价物、和其药学上可接受的载体,并且
其中治疗量对减少对象的组织中的成纤维细胞增殖和细胞外基质沉积是有效的。
根据方法的一个实施方式,所述疾病或病况是急性肺损伤(ali)或急性呼吸窘迫综合征(ards)。
根据另一个实施方式,所述疾病或病况是辐射诱发的纤维化。
根据另一个实施方式,所述疾病或病况是移植物排斥。
根据另一个实施方式,所述组织是肺组织。
根据另一个实施方式,所述疾病或病况是间质性肺病。
根据另一个实施方式,所述疾病或病况是肺纤维化。
根据另一个实施方式,所述肺纤维化是特发性肺纤维化。
根据另一个实施方式,所述肺纤维化由施用博来霉素造成。
根据另一个实施方式,所述肺纤维化由过敏反应、吸入环境微粒、细菌感染、病毒感染、对对象的肺的机械伤害、肺移植排斥、自身免疫障碍、遗传障碍、或其组合造成。
根据另一个实施方式,所述疾病或病况是进一步表征为组织中的炎症。
根据另一个实施方式,所述炎症是急性或慢性炎症。
根据另一个实施方式,所述炎症由选自肿瘤坏死因子-α(tnf-α)、白介素-6(il-6)、和白介素-1β(il-1β)的至少一种细胞因子介导。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积表征为与在正常健康对照对象的组织中的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)活性相比,所述组织中促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常活性。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积由以下证明:与正常健康对照对象的组织中活化的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的量或分布相比,组织中活化的(磷酸化的)促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常的量和分布。
根据另一个实施方式,所述肺纤维化表征为选自以下的至少一种病理:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、肺中成肌纤维细胞群分化为成肌纤维细胞群的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据另一个实施方式,所述药学上可接受的载体包括但不限于控释载体、延释载体、缓释载体、和长期释放载体。
根据另一个实施方式,所述吸入装置是喷雾器。
根据另一个实施方式,所述吸入装置是定量吸入器(mdi)。
根据另一个实施方式,所述吸入装置是干粉吸入器(dpi)。
根据另一个实施方式,所述吸入装置是干粉喷雾器。
根据另一个实施方式,所述药物组合物是干粉的形式。
根据另一个实施方式,所述干粉包含具有1至5微米的质量中值空气动力学直径(mmad)的微粒。
根据另一个实施方式,所述干粉包含具有大约2微米的质量中值空气动力学直径(mmad)的微粒。
根据一些实施方式,所述药物组合物进一步包括另外的治疗剂。
根据一些这样的实施方式,所述另外的治疗剂选自纯化的牛v型胶原(例如,iw-001;immuneworks;unitedtherapeutics)、il-13受体拮抗物(例如,qax576;novartis)、蛋白质酪氨酸激酶抑制剂(例如,伊马替尼(gleevec®);craigdaniels/novartis)、内皮受体拮抗物(例如,act-064992(马西替坦);actelion)、双内皮素受体拮抗物(例如,波生坦(tracleer®);actelion)、前列环素类似物(吸入性伊洛前列素(例如,ventavis®);actelion)、抗ctgf单克隆抗体(例如,fg-3019)、内皮素受体拮抗物(a-选择性)(例如,安立生坦(letairis®),gilead)、ab0024(arresto)、赖氨酰氧化酶样2(loxl2)单克隆抗体(例如,gs-6624(以前的ab0024);gilead)、c-junn-末端激酶(jnk)抑制剂(例如,cc-930;celgene)、吡非尼酮(例如,esbriet®(intermune)、pirespa®(shionogi))、ifn-γ1b(例如,actimmune®;intermune)、针对全部三种tgf-β同种型的全中和igg4人抗体(例如,gc1008;genzyme)、tgf-β活化抑制剂(例如,stromedix(stx-100))、重组人正五聚蛋白-2蛋白(rhptx-2)(例如,prm151;promedior)、双特异性il4/il13抗体(例如,sar156597;sanofi)、人源化单克隆抗体靶向整合蛋白αvβ6(bibf1120;boehringeringelheim)、n-乙酰半胱氨酸(zambonspa)、西地那非(viagra®;)、tnf拮抗物(例如,依那西普(enbrel®);pfizer)、糖皮质激素(例如,强的松、布地奈德、糠酸莫米松、丙酸氟替卡松、和糠酸氟替卡松),支气管扩张剂(例如,白三烯改性剂(例如,孟鲁司特(singuair®))、抗胆碱能支气管扩张剂(例如,异丙托溴铵和噻托溴铵)、短效β2激动剂(例如,甲磺酸乙基异丙肾上腺素(bronkometer®)、肾上腺素、舒喘灵/舒喘宁、和特布他林)、长效β2激动剂(例如,沙美特罗、福莫特罗、indecaterol(onbrez®),及其组合。
根据一些其它实施方式,所述另外的治疗剂包括支气管扩张剂,其包括但不限于白三烯改性剂、抗胆碱能支气管扩张剂、β2激动剂、或其组合。
根据另一个实施方式,所述另外的治疗剂包括皮质类固醇,其包括但不限于强的松、布地奈德、莫米松、倍氯米松、或其组合。
根据一些这样的实施方式,所述另外的治疗剂包括支气管扩张剂,其包括但不限于白三烯改性剂、抗胆碱能支气管扩张剂、β2激动剂、或其组合。
根据另一个实施方式,所述另外的治疗剂包括皮质类固醇,其包括但不限于强的松、布地奈德、莫米松、倍氯米松、或其组合。
根据另一个实施方式,所述另外的治疗剂是抗炎性剂。
根据另一个实施方式,所述抗炎性剂是非甾体抗炎性剂。还可以采用非甾体抗炎性剂的混合物,以及这些药剂的皮肤病学上可接受的盐和酯。例如,依托芬那酯(一种氟芬那酸衍生物)对外部应用是特别有用的。
根据另一个实施方式,其中所述非甾体抗炎性剂包括转化生长因子-β3(tgf-β3)、抗肿瘤坏死因子-α(tnf-α)药剂、或其组合。
根据另一个实施方式,所述抗炎性剂是甾体抗炎性剂。根据另一个实施方式,甾体抗炎性剂包括选自强的松、布地奈德、莫米松、倍氯米松,及其组合的至少一种皮质类固醇。
根据另一个实施方式,所述另外的治疗剂包括甲基黄嘌呤。
根据另一个实施方式,所述另外的治疗剂包括嗜中性粒细胞弹性酶抑制剂。
根据另一个实施方式,所述另外的治疗剂是至少一种嗜中性粒细胞弹性酶抑制剂,其包括但不限于ici200355、ono-5046、mr-889、l-694,458、ce-1037、gw-311616、tei-8362、ono-6818、ae-3763、fk-706、ici-200,880、zd-0892、zd-8321,及其组合。
根据另一个实施方式,所述另外的治疗剂包括至少一种磷酸二酯酶抑制剂,其包括但不限于磷酸二酯酶4抑制剂。磷酸二酯酶4抑制剂的实例包括但不限于罗氟司特、西洛司特或其组合。
根据另一个实施方式,所述另外的治疗剂是镇痛剂。根据一些这样的实施方式,镇痛剂是非阿片镇痛药。根据一些其它实施方式,镇痛药是阿片镇痛药。
根据另一个实施方式,所述另外的治疗剂是的抗感染剂。根据另一个实施方式,抗感染剂是抗生素药剂。
根据另一个实施方式,所述药物组合物抑制在对象的肺中发生的炎症。根据另一个实施方式,炎症是急性炎症。根据另一个实施方式,炎症是慢性炎症。根据另一个实施方式,炎症由升高水平的肿瘤坏死因子-α(tnf-α)介导。根据另一个实施方式,炎症由升高水平的白介素-6(il-6)介导。根据另一个实施方式,炎症由升高水平的白介素-1β(il-1β)的介导。
根据另一个实施方式,与对照相比,所述药物组合物调节肺中肿瘤坏死因子-α(tnf-α)的量。根据另一个实施方式,与对照相比,药物组合物调节肺中白介素-6(il-6)的量。根据另一个实施方式,与对照相比,药物组合物调节肺中白介素-1β(il-1β)的量。
根据另一个实施方式,所述药物组合物抑制hspb1的活性。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成纤维细胞增殖的异常诱导。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成纤维细胞群分化为成肌纤维细胞群的异常诱导。根据另一个实施方式,被药物组合物抑制的hspb1的活性是细胞外基质蛋白沉积入肺间质。根据另一个实施方式,细胞外基质蛋白是胶原。根据另一个实施方式,被药物组合物抑制的hspb1的活性是纤维化部位形成的促进。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成肌纤维细胞收缩活性的增加。根据另一个实施方式,被药物组合物抑制的hspb1的活性是成肌纤维细胞附着至细胞外基质的促进。
根据另一个实施方式,所述组织中异常的成纤维细胞增殖和细胞外基质沉积由以下证明:与正常健康对照对象的组织中活化的促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的量或分布相比,组织中活化的(磷酸化的)促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的异常的量和分布。
根据另一个实施方式,所述药物组合物抑制选自本文在表1中列出的组的激酶的激酶活性。
根据另一个实施方式,所述药物组合物抑制激酶的至少50%的激酶活性。根据另一个实施方式药物组合物抑制激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少95%的激酶活性。
根据一些实施方式,mmi抑制剂在体内的抑制概况取决于剂量、给药途径、和响应于抑制剂的细胞类型。
根据另一个实施方式,所述药物组合物抑制激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物抑制激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制该激酶的至少90%的激酶活性。根据另一个实施方式药物组合物抑制该激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2激酶)的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物抑制mk2激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3激酶)的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少50%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少65%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少70%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少75%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少80%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少85%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少90%的激酶活性。根据另一个实施方式,药物组合物进一步抑制mk3激酶的至少95%的激酶活性。
根据另一个实施方式,所述药物组合物抑制钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少50%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少70%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少75%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少80%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少85%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少90%的激酶活性。根据另一个实施方式,药物组合物进一步抑制ca2+/钙调蛋白依赖性蛋白激酶i(camki)的至少95%的激酶活性。
根据另一个实施方式,药物组合物抑制bdnf/nt-3生长因子受体(trkb)的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少50%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少70%的激酶活性。根据另一个实施方式,药物进一步抑制bdnf/nt-3生长因子受体(trkb)的至少75%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性、和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的激酶活性、和bdnf/nt-3生长因子受体(trkb)的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性和bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)的至少65%的激酶活性、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)的至少65%的激酶活性、钙/钙调蛋白依赖性蛋白激酶i(camki)的至少65%的激酶活性、和bdnf/nt-3生长因子受体(trkb)的至少65%的激酶活性。
根据另一个实施方式,所述药物组合物抑制选自mk2、mk3、camki、trkb的至少一种激酶的激酶活性,而基本上不抑制来自本文在表1中列出的其余组的一种或多种其它选择的激酶的活性。
根据另一个实施方式,所述药物组合物抑制选自本文在表1中列出的组的激酶的激酶活性。
根据另一个实施方式,此抑制可以,例如,对减少对象的组织中的成纤维细胞增殖、细胞外基质沉积、或其组合是有效的。
根据另一个实施方式,此抑制可以,例如,对减少选自以下的至少一种病理是有效的:与正常健康对照对象相比,肺间质中细胞外基质蛋白的异常沉积、肺中成纤维细胞增殖的异常促进、成肌纤维细胞分化的异常诱导、和成肌纤维细胞附着至细胞外基质的异常促进。
根据一些实施方式,mmi抑制剂在体内的抑制概况取决于剂量、给药途径、和响应于抑制剂的细胞类型。
根据这样的实施方式,所述药物组合物抑制其它选择的激酶(一种或多种)的小于50%的激酶活性。根据这样的实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于65%的激酶活性。根据这样的实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于50%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于40%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于20%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于15%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于10%的激酶活性。根据另一个实施方式,药物组合物抑制其它选择的激酶(一种或多种)的小于5%的激酶活性。根据另一个实施方式,药物组合物增加其它选择的激酶的激酶活性。
根据前一段的实施方式,基本上不抑制的一种或多种其它选择的激酶选自ca2+/钙调蛋白依赖性蛋白激酶ii(camkii,包括其亚基camkiiδ)、原癌基因丝氨酸/苏氨酸-蛋白激酶(pim-1)、细胞肉瘤(c-src)、脾脏酪氨酸激酶(syk)、c-src酪氨酸激酶(csk)、和胰岛素样生长因子1受体(igf-1r)。
根据一些实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有基本序列同一性。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少70%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少80%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少90%序列同一性。根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少95%序列同一性。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列faklaarlyrkalarqlgvaa(seqidno:3)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列kafaklaarlyrkalarqlgvaa(seqidno:4)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlava(seqidno:5)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列yaraaarqarakalarqlgva(seqidno:6)。
根据另一个实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物具有氨基酸序列hrrikawlkkikalarqlgvaa(seqidno:7)。
根据一些其它实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是包括可操纵地连接至第二多肽的第一多肽的融合蛋白,其中第一多肽具有氨基酸序列yaraaarqara(seqidno:11),并且第二多肽包括治疗结构域,其序列与氨基酸序列kalarqlgvaa(seqidno:2)具有基本同一性。
根据另一个实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少70%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少80%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少90%序列同一性。根据一些其它实施方式,第二多肽与氨基酸序列kalarqlgvaa(seqidno:2)具有至少95%序列同一性。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlava(seqidno:8)的多肽。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlgva(seqidno:9)的多肽。
根据另一个实施方式,第二多肽是氨基酸序列kalarqlgvaa(seqidno:10)的多肽。
根据一些其它实施方式,多肽yaraaarqarakalarqlgvaa(seqidno:1)的功能等价物是包括可操纵地连接至第二多肽的第一多肽的融合蛋白,其中第一多肽包括在功能上等价于yaraaarqara(seqidno:11)的细胞穿透肽,并且第二多肽具有氨基酸序列kalarqlgvaa(seqidno:2)。
根据进一步的实施方式,第一多肽是氨基酸序列wlrrikawlrrika(seqidno:12)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列wlrrika(seqidno:13)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列ygrkkrrqrrr(seqidno:14)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列wlrrikawlrri(seqidno:15)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列faklaarlyr(seqidno:16)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列kafaklaarlyr(seqidno:17)的多肽。
根据另一个实施方式,第一多肽是氨基酸序列hrrikawlkki(seqidno:18)的多肽。
根据另一方面,所述发明还提供了分离的核酸,其编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少70%氨基酸序列同一性的蛋白质序列。根据一些这样的实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少80%氨基酸序列同一性的蛋白质序列。根据一些这样的实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少90%氨基酸序列同一性的蛋白质序列。根据一些这样的实施方式,分离的核酸编码与氨基酸序列yaraaarqarakalarqlgvaa(seqidno:1)具有至少95%氨基酸序列同一性的蛋白质序列。
根据一些其它实施方式,所述药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.00001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.0001mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.001mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.01mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.1mg/kg(100µg/kg)体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约1mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约10mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约2mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约3mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约4mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约5mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约60mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约70mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约80mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约90mg/kg体重至大约100mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约90mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约80mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约70mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约60mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约50mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约40mg/kg体重的量。根据另一个实施方式,治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约30mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约20mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约10mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.1mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.01mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.001mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.0001mg/kg体重的量。根据另一个实施方式,药物组合物的治疗性抑制肽的治疗量具有从大约0.000001mg/kg体重至大约0.00001mg/kg体重的量。
根据一些其它实施方式,所述药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至25μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至2μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在2μg/kg/天至3μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在3μg/kg/天至4μg/kg/天的范围内。根据一些其它实施方式,药物的治疗性抑制肽的治疗剂量在4μg/kg/天至5μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在5μg/kg/天至6μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在6μg/kg/天至7μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在7μg/kg/天至8μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在8μg/kg/天至9μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在9μg/kg/天至10μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在1μg/kg/天至5μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在5μg/kg/天至10μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在10μg/kg/天至15μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在15μg/kg/天至20μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在25μg/kg/天至30μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在30μg/kg/天至35μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在35μg/kg/天至40μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在40μg/kg/天至45μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在45μg/kg/天至50μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在50μg/kg/天至55μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在55μg/kg/天至60μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在60μg/kg/天至65μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在65μg/kg/天至70μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在70μg/kg/天至75μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在80μg/kg/天至85μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在85μg/kg/天至90μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在90μg/kg/天至95μg/kg/天的范围内。根据一些其它实施方式,药物组合物的治疗性抑制肽的治疗剂量在95μg/kg/天至100μg/kg/天的范围内。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是1μg/kg/天。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是2μg/kg/天。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是5μg/kg/天。
根据另一个实施方式,所述药物组合物的治疗性抑制肽的治疗剂量是10μg/kg/天。
在本申请内,除非另外说明,利用的技术可以发现于任意多种熟知的参考文献,比如:molecularcloning:alaboratorymanual(sambrook,等,1989,coldspringharborlaboratorypress),geneexpressiontechnology(methodsinenzymology,vol.185,editedbyd.goeddel,1991.academicpress,sandiego,ca),“guidetoproteinpurification”inmethodsinenzymology(m.p.deutshcer,ed.,(1990)academicpress,inc.);pcrprotocols:aguidetomethodsandapplications(innis,等1990.academicpress,sandiego,ca),cultureofanimalcells:amanualofbasictechnique,2nded.(r.i.freshney.1987.liss,inc.newyork,ny),和genetranferandexpressionprotocols,pp.109-128,ed.e.j.murray,thehumanapressinc.,clifton,n.j.),其全部通过引用并入本文。
除非另外定义,本文使用的全部技术和科学术语具有与本发明所属领域普通技术人员一般所理解的相同的含义。虽然与本文描述的方法和材料相似或等同的任何方法及材料也可以用于本发明实践或测试,但是现在描述了优选的方法和材料。本文提及的全部出版物通过引用并入本文,以公开和描述与引用的出版物关联的方法和/或材料。
除非上下文另外明确地规定,在提供数值范围时,可以理解,在该范围的上限和下限之间的每个介于其间的值(至下限单位的十分之一)、和该规定范围中的任何其它规定值或介于其间的值包含在本发明内。可以独立地包括在较小范围中的这些较小范围的上限和下限也包含在本发明内,在规定范围中服从任何具体排除限制。在规定范围包括限制中的一种或两种时,排除那些包括的限制二者中的任一种的范围也包括在本发明中。
还必须注意,除非上下文另外明确地规定,如在本文和所附权利要求中所用的,单数形式“一个”、“一种”和“该”包括复数指代物。本文使用的全部技术和科学术语具有相同的含义。
本文讨论的出版物通过引用以其全部并入本文,并且仅因其公开内容先于本申请的提交日期而提供。本文的任何事物不解释为承认所述发明由于在先的发明而不享有先于这样的出版物的权利。另外,提供的出版物的日期可能不同于实际出版日期,其可能需要独立地确认。
本领域技术人员应当理解,可以做出多种改变并且可以进行等价物替换,而不背离本发明的真实精神和范围。此外,对于所述发明的客观精神和范围,可以进行很多修改以适应具体的情况、材料、物质组成、过程、过程步骤或多个步骤。所有这样的修改都意欲落入所附权利要求书的范围内。
实施例
提出下列实施例,以便为本领域普通技术人员提供如何制造和使用所述发明的完整公开和描述,并且不意欲限制本发明人认为的其发明的范围,也不意欲表示下面的实验是全部实验或仅被实施的实验。已经做出努力以确保关于使用的数字(例如量、温度等)的准确性,但是一些实验误差和偏差在所难免。除非另外指出,份是重量份,分子量是重均分子量,温度是摄氏度,并且压力是大气压或接近大气压。
i.材料和方法
mmi-0100药物研发
对于mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的优质制造规范(gmp)生产,将大约1kg的fmoc-ala-王氏树脂转入装备有机械搅拌器的50l玻璃固相合成反应容器。在dmf吸干(draining)前,允许树脂在二甲基甲酰胺(dmf)中膨胀不少于(nlt)2小时。然后,利用dmf的连续漂洗来清洗树脂珠。通过使用dmf中20%哌啶的处理,除去n-端保护基团(即fmoc)(去封闭步骤),并且利用dmf清洗树脂。在存在1-羟基苯并三唑(hobt)和二异丙基碳二亚胺(dic)的情况下,偶联序列中的下一个氨基酸。通常,使用至合成规模的2.5-3.5摩尔当量的fmoc-氨基酸(fmoc-aa),进行偶联。fmoc-aa溶解于dmf并且通过添加hobt和dic被活化。通过茚三酮检验监测每个偶联的完成。如果偶联未完成,则通过使用对称酸酐法进行利用相同氨基酸的第二次偶联。通常,使用至合成规模的3.0-6.0摩尔当量的fmoc-aa,进行偶联。将fmoc-aa溶解于二氯甲烷(dcm)和最小体积的dmf,并通过以fmoc-aa/dic=1.0/0.5的摩尔比添加的dic而活化。当完整的肽序列完成时,利用dmf和meoh的连续清洗来彻底地漂洗肽树脂。然后,将树脂在真空下干燥不少于3小时。典型回收的总的干燥肽树脂是大约2800克,其代表~65%的肽树脂产率。
然后,将大约370-500克的肽树脂转移入装备有磁力搅拌棒的合适大小的玻璃瓶。包含肽树脂的烧瓶在冰/水浴或在冰箱中冷却不多于30分钟。三氟乙酸(tfa)混合物(95ml:2.5ml:2.5ml的比率的tfa、tis和水的混合物)在冰/水浴中预冷不多于30分钟。向此容器中添加大约8-12ml的tfa裂解混合物/克的树脂。一旦肽树脂和tfa混合物组合,就移除冰/水浴并且反应混合物在室温下搅拌2-3小时。然后,通过粗玻璃滤器过滤反应混合物,并且利用每次清洗每克树脂0.1-1.0ml的tfa清洗树脂两次。收集合并滤液并且丢弃树脂。然后,以1ml的滤液/10ml醚的比率,将滤液添加至在冰箱中预冷少于30分钟的醚,以沉淀所裂解的肽。将肽-醚混合物平衡(equilibrate)至室温,进行不多于30分钟。在中等(medium)玻璃滤器上收集沉淀的肽。利用冷醚彻底地清洗沉淀物三次,使用足够的醚至少覆盖滤器上的全部沉淀物。然后,通过相同的中等玻璃滤器洗脱醚。将粗肽转移入塑料瓶并且放置于与机械真空泵连接的干燥器以干燥不多于12小时。在干燥后,将粗肽在5±3℃下储存。裂解过程重复多次直到全部肽树脂都被裂解。典型批量回收的总的干燥的粗肽是大约1250克,其代表大约110%的裂解产率。
通过将肽以20mg/ml的最终粗肽浓度溶解于hplc缓冲液,对裂解获得的粗肽进行制备以用于高效液相色谱(hplc)纯化。将肽溶液通过1µm玻璃滤膜过滤,并且装载至由制备型hplc系统操作的c18反相柱上。清洗和平衡柱。使用线性梯度从柱洗脱粗肽。在每次粗纯化之后,使用kromasilc18,5µm,100å4.6×250mm柱,通过分析型hplc系统分析级分。基于每个级分的hplc纯度和杂质概况,合并由初次纯化生成的级分。肽池(peptidepool)在2-8℃下储存直到进一步处理。此过程重复直到所有粗肽通过hplc柱纯化并且满足主池纯度标准。通过hplc进行至醋酸盐的盐交换。最终肽溶液通过0.22µm滤器过滤并且被装载至托盘冻干器上。在开始冻干周期前,肽在40℃下预冻不多于720分钟。冻干耗费大约5天。由纯化和冻干步骤产生大约50-55%的最终产率。
放射性测量的ic50测定
由二分之一对数稀释液(one-halflogdilution)的10点曲线(10-pointcurve)估算ic50值。在二甲基亚砜(dmso)中提供肽。具体地,将人重组mk2(h)(5-10mu)与50mm3-甘油磷酸钠(ph=7.5)、0.1mmegta、30μm的底物肽(kklnrtlsva;seqidno:21)、10mm醋酸镁、和90umγ-33p-atp(25μl的最终体积)一起在室温下温育40分钟。然后,利用3%磷酸终止反应。将10μl的此混合物点至p30过滤垫(filtermat)上,并且利用75mm磷酸清洗三次持续五分钟,并利用甲醇清洗一次。最后,膜被干燥并且使用闪烁计数器。选择atp的表观km在15μm之内的atp浓度,因为hayess和benndorf(biochempharmacol,1997,53(9):1239-47)显示了它们的原始抑制肽(即,肽kkkalnrqlgvaa;seqidno:22)的机制不与atp结合竞争。
除测定mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的ic50值以外,使用millipore的ic50profilerexpress服务(millipore,billerica,ma)测试针对266种人激酶的抑制活性。
对于特异性分析,使用溶解于二甲基亚砜(dmso)的100μm的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)、mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)、mmi-0300(faklaarlyrkalarqlgvaa;seqidno:3)、mmi-0400(kafaklaarlyrkalarqlgvaa;seqidno:4)、和mmi-0500(hrrikawlkkikalarqlgvaa;seqidno:7)的每一种。选择100μm浓度,因为此浓度在体内研究中抑制粘附形成(如在2009年10月20日提交的美国申请号12/582,516中公开的,其内容通过引用以其全部并入本文)。每种激酶活性测量以一式两份进行。
组织化学和免疫组织化学
通过气管内施用0.025u的博来霉素/pbs至c57bl/6小鼠来生成肺纤维化的小鼠模型。从博来霉素损伤后第7天(对于炎性后/预纤维化阶段的分析;预防模型)或博来霉素损伤后第14天(对于纤维化后阶段的分析;治疗模型)开始至博来霉素递送后第21或28天,每天气管内施用或经由喷雾施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)(以每天50μg/kg、75μg/kg和100μg/kg的剂量)。在博来霉素递送后第21天(对于预防模型)或博来霉素递送后第28天(对于治疗模型),利用戊巴比妥钠注射(120mg/kg)处死小鼠组,并且打开胸腔。结扎右主支气管(mainstembronchus)并且移除右肺。进行气管插管并且在21cmh2o压力下,使用4%甲醛灌注左肺。然后,将组织块包埋在石蜡中,并且制备4-mm切片用于染色。利用苏木精和伊红(h&e)对来自每只动物的切片进行染色以使细胞可视化,或利用马逊三色染色突出胶原沉积。在培育后,在染色皿中,利用0.2%醋酸清洗切片,通过浸入95%乙醇脱水,并且利用二甲苯(3-4次)透明化。利用有机封固剂将染色切片固定在贴标签的载玻片上。
ii.结果
实施例1:mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的ic50和特异性。
使用millipore的ic50profilerexpress服务,测定mk2抑制肽(mmi-0100;yaraaarqarakalarqlgvaa(seqidno:1))的ic50(半最大抑制浓度)值。此定量测定测量抑制50%的给定的生物过程或该过程的组分(即,酶、细胞或细胞受体)需要多少抑制剂[ic50]。具体地,在这些测定中,如果激酶未被抑制肽抑制,则带正电荷的底物被来自atp的放射性标记的磷酸基团磷酸化。带正电荷的底物然后被吸引到带负电荷的滤膜,利用闪烁记数器定量,并且与100%活性对照比较。
选择atp的表观km在15μm内的atp浓度,因为靠近该km的atp浓度可以允许激酶具有相同的相对量的磷酸化活性。mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的ic50测定为22μm。
除测定化合物的ic50以外,通过检查可用于在millipore激酶概况服务中测试的全部266种人激酶的活性来评估mk2抑制肽的特异性(表1)。对于分析,测定被mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1);mmi-0200(yaraaarqarakalnrqlgva;seqidno:19);mmi-0300(faklaarlyrkalarqlgvaa;seqidno:3);mmi-0400(kafaklaarlyrkalarqlgvaa;seqidno:4);和mmi-0500(hrrikawlkkikalarqlgvaa;seqidno:7)抑制大于65%的激酶。
如表1中所示,在100μm下,mk2抑制肽mmi-0100(seqidno:1)、mmi-0200(seqidno:19)、mmi-0300(seqidno:3);mmi-0400(seqidno:4);和mmi-0500(seqidno:5)抑制具体组的激酶并且显示非常有限的脱靶激酶抑制。更具体地,mk2抑制肽mmi-0100(seqidno:1)、mmi-0200(seqidno:19)、mmi-0300(seqidno:3);mmi-0400(seqidno:4);和mmi-0500(seqidno:5)在体外抑制促分裂原活化蛋白激酶-活化的蛋白激酶2(mk2)、促分裂原活化蛋白激酶-活化的蛋白激酶3(mk3)、钙/钙调蛋白依赖性蛋白激酶i(camki,丝氨酸/苏氨酸特异性蛋白激酶)、和bdnf/nt-3生长因子受体(trkb,酪氨酸激酶)的大于65%的激酶活性。
实施例2:mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物的制剂
根据一些实施方式,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物经由喷雾干燥、微粉化(例如,气流粉碎)配制为冻干粉末,或配制为用于喷雾的液体制剂。
喷雾干燥
在一些实施方式中,考虑到下列因素,喷雾干燥用于制备mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物:
(a)蛋白质和肽易于变性——即,对三级结构并且有时对二级结构的破坏;
(b)变性可以是可逆的或不可逆的,并且可以由各种条件造成,比如温度增加、温度降低、极端的ph、添加溶剂、压力、和剪切变性(此适用于微粉化);
(c)变性蛋白质是低活性和无治疗性的,有时是完全无活性的;
(d)喷雾干燥能够将这些无定形的大分子变为离散的球形颗粒,其通过加工参数控制而具有指定的颗粒大小分布;喷雾干燥颗粒可以是非常球形、环形的,并且通常是中空的,意味着>5µm的颗粒仍可以是可呼吸性的,但是对肺中的清除机制具有抗性;和
(e)利用或不利用赋形剂的喷雾干燥通常改进蛋白质的稳定性。
评估mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物的冻干制剂与喷雾干燥工艺的潜在协同性(例如,匹配的最佳湿度水平、缓冲液浓度/ph、赋形剂选择等),以确保肽稳定性的保护。
最初的喷雾干燥运行以限定喷雾干燥操作的工艺参数为目的,目标是相互同意的验收标准。对于吸入产品,颗粒大小被认为是重要的标准。对于感兴趣区域中的肺泡沉积(ii型),1-5微米的质量中值空气动力学直径(mmad)通常被接受为适于肺泡空间中的外周沉积(heyder,j.procamthoracsoc,1(4):315-320,2004,其通过引用并入本文)。其它研究已经表明1-3微米的mmad是用于喷雾干燥工艺的期望的起始靶标颗粒大小。由于mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的可能的生物空间靶标在肺泡区域中,最初靶向大约2微米范围中的mmad以确保沉积入肺泡空间。
验收标准包括但不限于(1)颗粒大小(即,大约2μm的d90);(2)湿度水平(即,小于3%w/w的湿度);(3)粉末密度;和(4)表面外观(球形、粗糙、环形)。
然后,进行工艺设计实验以优化喷雾干燥工艺参数,包括,例如,但不限于(1)入口压力和干燥温度;(2)原料浓度和进料速率(federate);和(3)肽/赋形剂比率(例如,赋形剂是缓冲盐和单糖)。
实施例3:用于持续气溶胶性能评估的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的批量生产
在上面描述的限定的工艺参数下进行2-3次喷雾干燥运行以生成用于气溶胶性能评估的材料。
喷雾干燥粉末良好地适于从吸入器递送,例如,微剂量(microdose)吸入器,但不限于此。利用此配制方案,对于纯或共喷雾干燥掺和物二者,微剂量都常规地实现高射出剂量,和高细小颗粒级分与剂量二者。喷雾干燥胰岛素的示例性气溶胶性能显示在图1和2中。
虽然干微粉化是小分子用于肺递送的优选的粉末生产方法,与喷雾干燥相比,它是有压力的方法,其使用高剪切力。因为使用高剪切力可以导致蛋白质和肽的断裂,干粉末化通常不用于大分子。此外,如果剂量大小很小,则需要增量剂以改进流动性和允许填充操作中粉末的精确测量。主要的赋形剂,和对于此目的批准用于肺递送的唯一一种赋形剂是乳糖,可能需要测试与mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或其功能等价物的化学相容性,因为乳糖与某些肽不相容。
微粉化工艺是本领域中相当简单和熟知的。简要而言,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物的冻干干粉经历研磨阶段直到达到规定的目标颗粒大小分布(即,mmad、d10、d50、d90)。测试此纯粉末化粉末的效能,以确保其粉末化后的活性,优化用于从吸入器递送,并且在初级(热封泡罩)包装中测试其化学和物理稳定性。然后,将纯粉末与优先选择的批准的肺用乳糖级掺和直至达到目标,测试掺和均一性,并且经历相同的吸入器优化和稳定性测试。
微剂量干粉吸入器(dpi)
根据一些实施方式,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物可以使用干粉吸入器(dpi)施用。例如,微剂量干粉吸入器(dpi)具有‘主动的’压电驱动气溶胶发生器,其是呼吸驱动的并且独立于患者的吸入流量和体积实现高效率的肺递送。与需要大约40-60升/分钟(lpm)流量的强且有力吸入以用于有效肺递送的‘被动的’dpi不同,微剂量dpi不需要呼吸动作(breathingmaneuver),因为它可以在低至10lpm多至90lpm的流量的非常宽的流速范围内有效地递送,而且具有等价的性能(参见图3和4中的性能实施例)。
根据一些其它实施方式,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物可以使用潮式呼吸应用来施用,比如‘干粉喷雾器’(dpn)。dpn与吸入潮式呼吸同步递送干粉剂量,具有低至2升/分钟(lpm)的触发(triggering)、5和15lpm之间的预期峰值流和低至30ml的潮气量,其是比成人ipf患者所预期的更加挑战的条件。此新型dpn已经成功地完成其第二次成人临床试验,而且在2011年11月完成其第一次研究。这些结果可经由互联网,在万维网(www)url“clinicaltrials.gov/ct2/show/nct01489306
微剂量电子吸入器系统是极端灵活的构想(formulation),可以精确地和高效地递送上述两种制剂模式,对喷雾干燥药物产品具有特别高的效率,并且已经显示对超过30种小分子和大分子具有这种性能。初级包装中的喷雾干燥胰岛素,例如,可以维持至少18个月。喷雾干燥肽和微粉化小分子二者的递送性能的实施例显示在图5-8中。
关于干粉制剂对肺膜(pulmonarymembrane)的作用(例如,致敏),干粉递送,尤其在低粉末负载(<4-5mg)下,不太可能影响肺膜或引起致敏(咳嗽等),除非这是活性分子的固有性质(我们在动物研究中还没有观察到)。选择具有卓越的肺生物相容性,已经被批准用于肺的赋形剂,并且其以非常低的量(即,低mg范围)存在。例如,低量的甘露醇不太可能具有效果。
液体喷雾
可选地,可以经由液体喷雾递送mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或其功能等价物。先前的临床前研究已经显示mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)可以经由改造适于动物使用的aerogen®喷雾器系统递送至啮齿动物。
为了特别地处理mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的递送能力以积极地影响被危害的肺,在博来霉素动物模型功效实验中,有效地气溶胶化mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的溶液。局部的肺mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)施用通过由aerogen®(www.aerogen.com)设计和制造的啮齿动物喷雾器装置实现。aeroneb®实验室微泵喷雾器使用高效气溶胶化技术,其用于临床前气溶胶调查和吸入研究,提供了临床前和临床产品研发之间的有价值的连接。流量是>0.3ml/min,并且设计为递送2mm大小的颗粒,而且分布入最深的肺泡。已经在肺纤维化的博来霉素小鼠模型中证明了雾化的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的功效和遍及肺的细胞摄取(参见图16)。局部的、临床相关的吸入施用在减弱mk2活化中等效于常规的全身注射。
实施例4:活化的mk2的水平在患有特发性肺纤维化(ipf)的患者肺的纤维化病变中增加
促分裂原活化蛋白激酶(mapk)-活化的蛋白激酶2(mk2)在通过p38mapk-α和β的应激之后被活化。p38mapk的这两种同种型与mk2的羧基端中的碱性停靠基序(basicdockingmotif)结合,其随后将其调节位点磷酸化。由于活化,mk2从细胞核输出至细胞质并且将活性p38mapk共转运至此区室。mk2稳定p38mapk定位并且对分化、迁移和细胞因子产生至关重要(kotlyarov,a.,molcellbiol.22(13):4827-4835,2002)。
因此,为了检查p38mapk-mk2信号传导途径在受ipf影响的肺中是否活化,利用针对mk2的活化形式的磷酸化-特异性抗体(抗磷酸化-thr334-mapkapk2)对从正常和ipf患者获得的肺切片进行染色。使用dab对正常肺和ipf肺组织进行免疫染色,并且利用苏木精复染细胞核。如图9中所示,与正常肺活检组织(左)相比,在来自患有ipf的肺组织外植体的纤维化病灶中的细胞中观察到活化mk2的表达增加。这些结果表明ipf患者的肺中的纤维化形成表征为p38mapk-mk2信号传导途径的异常活化。
实施例5:mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的雾化和全身施用保护小鼠抵抗博来霉素诱导的肺纤维化。
特发性肺纤维化(ipf)的标志之一是间充质细胞的活化和基质(特别是胶原)的丰富沉积。可以通过组织学和生物化学技术二者测量由此导致的肺中胶原的积聚,最显著地经由羟脯氨酸的积聚,其几乎完全源自肺中的胶原,并且因而充当整体肺胶原含量的替代(umezawah.等,cancer,20(5):891-895,1967)。
因此,使用博来霉素诱导的肺纤维化的小鼠模型,通过在预防或预纤维化阶段期间全身地(腹膜内)或局部地(经由雾化给药)递送mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)肽(即,从博来霉素损伤后第7天开始的药物施用;参见图10),并通过测量作为博来霉素小鼠中的纤维化指数的胶原水平,评估mmi-0100肽(yaraaarqarakalarqlgvaa;seqidno:1)对治疗肺纤维化的疗效。
简要而言,通过气管内递送大约0.025u的博来霉素(溶解于pbs)至c57bl/6小鼠,来诱导小鼠的肺中的纤维化部位。为了检查mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)对在预防/预纤维化期中的博来霉素损伤的肺的治疗的功效,从博来霉素递送后第7天(当炎症消退和纤维化机制被活化时)开始直到博来霉素递送后第21天(当观察到显著的纤维化时)(图10),每天腹膜内施用或经由喷雾施用对照(pbs)或mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)。在博来霉素递送后第21天,来自利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或对照(pbs)处理的博来霉素小鼠的肺组织被分离、固定、包埋在石蜡中、并且切片用于染色。简要而言,利用戊巴比妥钠注射(120mg/kg)处死小鼠并且打开胸腔。结扎右主支气管并且移除右肺。进行气管插管,并且在21cmh2o压力下,使用4%甲醛灌注左肺。然后,将组织块包埋在石蜡中,并且制备4-mm切片,并且利用苏木精和伊红(h&e;用于病理学检查)或利用马逊三色(用于胶原染色)进行染色。
如图11中所示,来自pbs处理的小鼠的肺切片展示出正常肺结构(nl)和气道(aw)。相比之下,来自博来霉素小鼠(第21天)的肺切片揭示出变窄的气道(aw)结构,并且在肺组织中具有纤维化病灶(ff)的形成(上图板;苏木精和伊红(h&e)染色)和增加的胶原积聚(下图板中的箭头;马逊三色染色),其令人联想起在ipf患者中发现的那些。然而,经由喷雾施用或腹膜内施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)显著地减少了博来霉素小鼠的肺中的纤维化部位形成的发展(上图板,mmi-0100(neb)和mmi-0100(ip))并且减少了胶原积聚(下图板,mmi-0100(neb)和mmi-0100(ip))。
接着,通过计算来自羟脯氨酸浓度的胶原的常量转化因子(7.5),定量地分析博来霉素损伤的小鼠的肺中的总胶原水平(图12)(neumanr.和loganm,jbiolchem.,186(2):549-56,1950,其通过引用并入)。如图12中所示,与博来霉素对照相比,在炎性后/预纤维化阶段期间,喷雾(bleo+nebulized)和全身(bleo+ip)施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)都显著地降低胶原沉积。
实施例6:mk2肽抑制剂在特发性肺纤维化预防模型中的剂量应答数据
接着,使用特发性肺纤维化的博来霉素小鼠模型(预防模型),体内检查增加剂量的mk2肽抑制剂对的胶原沉积的作用。简略地,c57-bl/6小鼠在第0天经历博来霉素损伤。从第7天开始和持续至第21天,小鼠经由腹膜内(ip)注射每天施用25、50或75µg/kg的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)。如图13中所示,马逊蓝色三色染色揭示出利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理的博来霉素损伤的小鼠的肺中的胶原水平的降低,这表明mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)可以以剂量依赖的方式预防由于博来霉素损伤造成的肺中的纤维化。这些数据表明mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)甚至在较高的剂量下保持其作为纤维化预防性(fibroprotective)化合物的潜能。
相比之下,利用mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)处理博来霉素损伤的小鼠在测试的剂量下没有减少,反而增加肺中的胶原沉积。然而,此结果与涉及mk2基因敲除小鼠和mk2-/-小鼠胚胎成纤维细胞(mef)的先前研究一致,其中所有mk2活性被消除,其展示出恶化的纤维化表型(liu等.,amjrespircellmolbiol,37:507-517,2007)。
不受限于理论,这些结果表明(1)所述发明的mk2抑制肽可以展示出针对具体组的激酶的抑制活性谱;(2)mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)可以区别地抑制mk2和其它激酶,这取决于应用的剂量,其有助于此抑制活性谱;(3)成肌纤维细胞形成和/或迁移也可能是纤维化的修复期的一部分,而不是纤维化的活性伤害;和(4)某一水平的mk2活性因此对发生的该过程是必需的(liu等.,amjrespircellmolbiol,37:507-517,2007)。
此外,所述发明的mk2抑制肽源自mk2下游靶标hspb1的底物结合位点。因此,它们可以竞争性抑制mk2向hspb1的激酶活性。不受限于理论,mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)对纤维化的差异效应可以归因于其序列差异、其与hspb1结合位点的同源性、其对mk2激酶活性向不同的靶蛋白结合位点的差异抑制、或其组合。
实施例7:施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)有效地阻断特发性肺纤维化预防模型中的系统性t-细胞活化
最近的研究强调了t淋巴细胞在博来霉素诱导的纤维化中的关键作用(wilson,m.等,thejournalofexperimentalmedicine,207(3):535-552,2010)。因此,为了调查脾(全)t细胞在利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理的博来霉素损伤的小鼠中的功能性作用,自体混合淋巴细胞反应(mlr)如先前描述的进行(wilkes,d.等,journalofleukocytebiology,64(5):578-586,1998,其通过引用并入本文)。具体地,在测定中检查c57bl/6纯化抗原呈递细胞诱导c57bl/6t淋巴细胞中的增殖的能力。
c57-bl/6小鼠在第0天经历博来霉素损伤。在第7天直到第21天,小鼠通过腹膜内(ip)注射或喷雾器(neb)每天施用50µg/kg/天的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)。脾t细胞被分离,和单独地或在存在自体抗原呈递细胞(来自c57-bl/6小鼠的apc)的情况下培养或利用针对cd3(α-cd3)的抗体刺激48h。然后,利用磨碎的腺苷放射性标记细胞16h并且评估增殖速率。
如图14中所示,不管如何处理,t细胞都单独地展示出非常低的增殖能力。然而,当t细胞与自体抗原呈递细胞(即,从c57-bl/6小鼠分离的apc)时,博来霉素损伤的小鼠的增殖能力比对照小鼠高。有趣地,在存在抗原呈递细胞的情况下看到的来自博来霉素处理的小鼠的t细胞的增殖通过全身施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)显著地减少,但是如期望的,不是通过吸入模式。这些数据表明mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)对脾t细胞活化的抑制,并且指示肽mk2抑制剂为纤维化预防性的。
还通过利用针对α-cd3的抗体——多克隆t细胞活化剂——刺激细胞来确认t细胞的生存能力。不论处理组,α-cd3诱导细胞的强健增殖。对多克隆活性剂的增殖反应表明mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)肽抑制剂不影响脾t细胞的功能性质,并且在此特定剂量下施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)不存在毒性。此外,缺少对雾化的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的脾t细胞应答表明在此肽递送模式的情况下发生的极少的全身分布。
实施例8:全身或雾化的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理在纤维化后阶段保护博来霉素损伤的肺
如图10中描述的,典型的博来霉素模型已经广泛地用于预纤维化阶段中的文献中以测试任意介入的功效。由于雾化和全身施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)二者显著地保护肺免于博来霉素诱导的纤维化,在纤维化后阶段进一步检查全身(腹膜内)或局部(雾化)施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)在治疗博来霉素损伤的肺中的作用,药物介入在第14天开始,这是当肺被显著地纤维化的时间点(图15)(pottier,n.等,americanjournalofrespiratoryandcriticalcaremedicine,176(11):1098-1107,2007,其通过引用并入本文)。此模型中显示的疤痕化肺的救护是临床相关的,只要ipf患者的肺在诊断时已经是疤痕化的。
更具体地,通过气管内递送大约0.025u的博来霉素(溶解于pbs)至c57bl/6小鼠来诱导肺中的纤维化部位。为了检查mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)在预纤维化后阶段中的博来霉素损伤的肺的治疗的功效,从博来霉素递送后第14天开始直到博来霉素递送后第28天,每天腹膜内施用或经由喷雾施用对照(pbs)或mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)至小鼠。在博来霉素递送后第28天,利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)或对照(pbs)处理的博来霉素小鼠的肺组织被分离、固定、包埋在石蜡中、并且切片用于染色。利用戊巴比妥钠注射(120mg/kg)处死小鼠并且打开胸腔。结扎右主支气管并且移除右肺。气管被插管并且左肺在21cmh2o压力下灌注有4%甲醛。组织块然后被包埋在石蜡中,并且制备4-mm切片,并且利用苏木精和伊红(h&e;用于病理学检查)或利用马逊三色(用于胶原染色)进行染色。
如图16中所示,不管药物施用的模式,即,无论腹膜内递送或局部应用至肺,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理“救护”严重疤痕化肺。采用组织学评估检查肺架构(苏木精和伊红(h&e)染色,上图板)和胶原分布(马逊蓝色三色染色,下图板)。组织化学结果显示虽然博来霉素损伤的肺是严重疤痕化的,但是mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理的小鼠具有更光洁的肺实质。
接着,通过使用整个左肺的标准的羟脯氨酸测定来定量地测定胶原沉积。通过分析博来霉素损伤后第28天的鼠肺中的羟脯氨酸浓度来评估总胶原(可溶的和不可溶的)沉积。从博来霉素损伤后第14天开始,通过腹膜内注射(ip)或喷雾器(neb)以50µg/kg/天的剂量施用mmi-0100(yaraaarqarakalarqlgvaa(seqidno:1))。
如图17中所示,与基线相比,在博来霉素损伤后第28天和开始mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理时,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理显著地停滞胶原沉积的进一步进展。这是显著的,因为虽然当前的文献显示了药物研发中的有效预防,但是当ipf患者被诊断时,存在已经存在的纤维化。这些结果还表明mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)具有有效地中止或减慢疾病的进一步进展和改善生活质量的潜能;并且如果在较高的剂量下使用和/或持续更长的治疗周期,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)肽可以导致肺组织学和病理学中甚至更大的改善,并且减少纤维化。
实施例9:全身或局部施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)与特发性肺纤维化的博来霉素小鼠模型中减少活化的mk2相关
如上面讨论的,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)和其功能等价物在肺中的主要靶标之一是mk2激酶,其在受影响的肺中引发炎性和纤维化反应。因此,为了进一步验证mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)的体内作用,在未处理的博来霉素损伤的小鼠以及mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理的小鼠中检查活化的mk2(磷酸化-thr334-mapkapk2)的水平。
简言之,c57-bl/6小鼠在第0天经历博来霉素损伤。在博来霉素损伤后第14天直到第28天,小鼠通过腹膜内(ip)注射或喷雾器(neb)每天施用50µg/kg的mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)。福尔马林固定的肺组织切片针对磷酸化-thr334mk2进行免疫染色。对照染色利用生物素化的二次igg抗体。链亲和素缀合的辣根过氧化物酶与3,3'-二氨基联苯胺一起用作底物,并且利用苏木精复染细胞核。然而,博来霉素小鼠显示了如果不处理活化的mk2存在(黑色结节)中可视的增加,最特别地在显著的胶原沉积的区域中,利用mmi-0100处理的小鼠展示出与正常组织相似的活化的mk2存在,而且这样的分布集中于外周气道和血管区域。
如图18中所示,不论递送模式,即,或者全身施用或者局部施用,与对照相比,雾化或气管内施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)与博来霉素小鼠模型中降低的磷酸化-thr334-mapkapk2染色(mk2的活化形式)相关联。
实施例10:mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)下调特发性肺纤维化治疗模型中的炎性细胞因子
mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)可以通过其抑制肺中的纤维化形成的一种潜在机制是通过降低促炎细胞因子的局部浓度,并且从而制止单核细胞的募集和通过肺中的巨噬细胞的细胞外重构(例如,增加胶原沉积、增加细胞粘附和迁移、降低基质降解)。为了探索这种可能性,通过在利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)腹膜内治疗或经由喷雾治疗后,测量白介素-6(il-6)和肿瘤坏死因子-α(tnf-α)水平的变化,检查mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)肽抑制促炎细胞因子的产生的能力。
白介素-6(il-6)是多功能细胞因子,其主要作用包括免疫球蛋白合成的增强、t细胞的活化、和急性期蛋白质合成的调节。已经许多不同类型的细胞产生il-6,包括单核细胞、巨噬细胞、内皮细胞和成纤维细胞,并且这些细胞中il-6基因的表达由各种诱导物调节。白介素-1β(il-1β)和肿瘤坏死因子(tnf-α)是il-6基因表达的两种关键的已知诱导物。其它诱导物包括蛋白激酶c的活化剂、钙离子载体a23187、和引起细胞内环amp(camp)水平升高的多种药剂。
肿瘤坏死因子(tnf,也称为tnf-α)是参与系统性炎症的细胞因子,并且是刺激急性期反应的细胞因子组的成员。研究已经显示tnf-α经由细胞内部三种不同的信号传导途径诱导il-6的表达,即,1)nf-κb途径、2)mapk途径、和3)死亡信号传导途径。
如图20中所示,在特发性肺纤维化的博来霉素小鼠模型中,气管内(bleo+mmi-0100(ip))或雾化(bleo+mmi-0100(neb))施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)显著地减少tnf-α(a,上图板)和il-6(b,下图板)二者的血浆水平。
实施例11:全身或局部施用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)有效地阻断鼠肺中由博来霉素损伤造成的显著疤痕化的成肌纤维细胞活化积聚。
特发性肺纤维化(ipf)的标志是纤维化病变处成肌纤维细胞的积聚和丰富的成肌纤维细胞活化的标志物α-平滑肌肌动蛋白(α-sma)的表达。此外,活化的成肌纤维细胞部分地负责肺实质的僵化和肺功能的恶化。
因此,在利用mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)全身(经由腹膜内施用)或局部(经由喷雾)处理的博来霉素损伤的小鼠的肺中评估博来霉素损伤的肺中α-sma的表达水平。如图21中所示,与未处理的博来霉素损伤的肺中α-sma的水平相比,α-sma的水平在mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)处理的肺中被显著地减弱。
实施例12:mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)在调节tgf-β1诱导的成肌纤维细胞活化中的体外剂量应答研究
特发性肺纤维化(ipf)的主要标志是存在非典型和凋亡上皮细胞,连同分泌旺盛量的基质蛋白(包括胶原、纤连蛋白和基质金属蛋白酶)的活化的成肌纤维细胞(horowitz,j和thannickal,v.,treatmentsinrespiratorymedicine,5(5):325-42,2006)。在正常伤口愈合过程中,临时性基质由成肌纤维细胞形成为暂时支架。临时性基质的收缩导致随后的再上皮化和最终的伤口愈合。然而,当活化的成肌纤维细胞耐受凋亡时,由此导致的旺盛的胶原沉积导致基质的稳定化(tomasek,j.等,naturereviewsmolecularcellbiology,3(5):349-63,2002)。未受抑制的成肌纤维细胞增殖、活化和耐受凋亡的最终结果导致纤维化病变以及由胶原沉积造成的稳定的基质,并且因而导致最终畸变的肺架构(yamashita,c.等,theamericanjournalofpathology,179(4):1733-45,2011)。
因此,由于成纤维细胞是参与疤痕形成的关键细胞,所以通过检查在利用tgf-β处理的培养的人胚胎肺成纤维细胞(imr-90细胞)中α-平滑肌肌动蛋白(α-sma)和纤连蛋白的蛋白质水平,评估mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)对成肌纤维细胞活化的作用。如图22和23中所示,mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)以剂量依赖的方式有效地防止由tgf-β诱导的成肌纤维细胞活化,如由α-平滑肌肌动蛋白(α-sma)(图22)和纤连蛋白(图23)二者的水平的降低显示的。
相比之下,如由成肌纤维细胞活化标志物α-平滑肌肌动蛋白(图21)和纤连蛋白(图23)的蛋白质水平中无变化指示的,测试剂量下的mmi-0200(yaraaarqarakalnrqlgva;seqidno:19)不影响tgf-β介导的成肌纤维细胞活化。不受限于理论,这些结果表明(1)所述发明的mk2抑制肽可以展示出针对具体组的激酶的抑制活性谱;(2)mmi-0100(seqidno:1)和mmi-0200(seqidno:19)可以区别地抑制mk2和其它激酶,这取决于应用的剂量,其有助于此抑制活性谱;(3)可能存在调节α-平滑肌肌动蛋白的代偿途径;(4)成肌纤维细胞形成和/或迁移也可能是纤维化的修复期的一部分,而不是纤维化的活性伤害;和(4)某一水平的mk2活性因此对发生的该过程是必需的(liu等.,amjrespircellmolbiol,37:507-517,2007)。
此外,所述发明的mk2抑制肽源自mk2下游靶标hspb1的底物结合位点。因此,它们可以竞争性抑制mk2向hspb1的激酶活性。不受限于理论,mmi-0200(seqidno:19)对纤维化的差异效应可以归因于其序列差异、其与hspb1结合位点的同源性、其对mk2激酶活性向不同的靶蛋白结合位点的差异抑制、或其组合。
实施例13:mmi-0100在体外增强异丙肾上腺素诱导的气道平滑肌舒张
平滑肌中的收缩活性主要通过肌球蛋白轻链的磷酸化状态测定。肌球蛋白轻链的钙活化的磷酸化起始平滑肌收缩。活化剂ca2+与酸性蛋白钙调蛋白形成复合体,其又活化肌球蛋白轻链(mlc)激酶以使肌球蛋白的轻链磷酸化。
除mlc激酶的ca2+依赖性活化之外,肌球蛋白轻链磷酸化的状态由mlc磷酸酶进一步调节,其从肌球蛋白的轻链移除高能磷酸以促进平滑肌舒张。存在mlc磷酸酶的三种亚基:37-kda催化亚基、20-kda可变亚基、和110-至130-kda肌球蛋白-结合亚基。当磷酸化时,肌球蛋白-结合亚基抑制mlc磷酸酶的酶促活性,其允许肌球蛋白的轻链保持磷酸化,从而促进收缩。小g蛋白rhoa和其下游靶标rho激酶在mlc磷酸酶活性的调节中起重要作用。rho激酶(一种丝氨酸/苏氨酸激酶)使mlc磷酸酶的肌球蛋白-结合亚基磷酸化,其抑制它的活性并且因而促进肌球蛋白轻链的磷酸化状态。rho激酶的药理学抑制剂(如法舒地尔和y-27632)通过竞争酶上的atp-结合位点阻断其活性。rho激酶抑制诱导相对许多不同的激动剂收缩的平滑肌的独立的区段的舒张。在完整动物中,rho激酶的药理学抑制剂已经显示在动脉中引起平滑肌的舒张,其导致血压-降低效果。认为受体活化经由鸟嘌呤核苷酸交换因子(rhogef)偶联至rhoa/rho激酶信号传导的异三聚体g蛋白。因为rhogef促进rhoa的活化,它们经由异三聚体g蛋白受体偶联调节持续信号传导的时间和强度。在人基因组中存在70种rhogef,其中的三种在平滑肌中已经被鉴定:pdz-rhogef、larg(白血病相关rhogef)和p115-rhogef。
几个近期研究建议mlc激酶和mlc磷酸酶的另外的调节物的作用。钙调蛋白-依赖性蛋白激酶ii通过降低mlc激酶对ca2+的敏感性促进平滑肌舒张。额外地,mlc磷酸酶活性由位相性(phasic)平滑肌中的16-kda蛋白质端蛋白刺激,并且被dg/蛋白激酶c的下游介体cpi-17抑制。
平滑肌舒张由于移除收缩刺激或通过刺激收缩机制的抑制的物质(例如,心钠素是血管舒张药)的直接作用发生。舒张的过程涉及肌动蛋白细胞骨架调节、降低的细胞内ca2+浓度、ca2+敏感性和增加的mlc磷酸酶活性。
涉及肌质网和质膜的几种机制与胞质ca2+的移除有关。ca2+摄取入肌质网依赖于atp水解。当磷酸化时,肌质网ca2+、mg2+-atp酶结合两个ca2+离子,其然后移位至肌质网的腔侧并且被释放。结合至atp酶的催化位点的mg2+对酶介导反应是必需的。肌质网ca2+、mg2+-atp酶被几种不同的药理学药剂抑制:钒酸酯、毒胡萝卜素和环匹阿尼酸(cyclopiazonicacid)。肌质网ca2+-结合蛋白还有助于降低的细胞内ca2+水平。近期研究已经将集钙蛋白和钙网蛋白鉴定为平滑肌中的肌质网ca2+-结合蛋白。
等长和等张肌肉收缩
如本文使用的,术语“等长收缩”指的是其中肌肉被活化但是其以恒定长度支持而不被允许伸长或缩短的肌肉收缩。因此,在等长收缩期间生成的力变为依赖于收缩同时的肌肉的长度。另一方面,如果肌肉被允许缩短,例如,如果仅肌肉的一端被固定并且肌肉以恒定的负荷缩短,则收缩称为等张收缩。
在体外,可以通过施加去极化溶液(例如,浓缩的氯化钾溶液)至待检验的肌肉来诱导平滑肌的等长收缩。高浓度的钾使肌肉细胞膜去极化并且打开电压控制钙通道,其导致细胞外钙的流入和收缩机器的活化。
质膜也包含ca2+、mg2+-atp酶,其提供了用于减小细胞中活化剂ca2+的浓度的另外的机制。此酶与肌质网蛋白的不同在于其具有可以受钙调蛋白约束的自抑制结构域,其引起质膜ca2+泵的抑制。
na+/ca2+交换页位于质膜上并且有助于降低细胞内ca2+。此低亲和力反向转运蛋白紧密地偶联至细胞内ca2+水平并且可以被阿米洛利和奎尼丁抑制。
在质膜中定位的受体操作的和电压操作的ca2+通道的抑制还可以引发舒张。通道拮抗剂比如二氢吡啶、苯烷基胺和苯并噻氮卓(benzothiazepine)结合至通道蛋白上不同的受体并且抑制平滑肌中的ca2+进入。
mmi-0100增强iso诱导的猪气道平滑肌的舒张。从第二代支气管分离猪气道平滑肌(pasm)环,剥离软骨并且然后悬挂在肌肉浴(musclebath)中并且在kreb缓冲液(kreb’sbuffer)中平衡3hrs。在使用缓冲液(未处理的)或使用100µmmmi-0100持续1hr处理之前或之后,使用1.5×10-7m氨甲酰胆碱(carbacholine)(cch,氨基甲酸胆碱酯)使环收缩并且然后使用10-7m或10-8m的异丙肾上腺素(iso)使其松弛,并且测量生成的力。iso是当紧张度(tone)高时使几乎各种各样的一些肌肉松弛的β-肾上腺素能激动剂,但是其作用大部分作用于支气管和胃肠平滑肌。其预防或减轻支气管收缩(bronchoconstrution)。其在哮喘中的作用可能部分地由于抑制抗原诱导的组胺的释放和炎症的其它介体的另外的作用;此作用由β2-受体-选择性刺激剂共享。goodman&gilman'sthepharmacologicalbasisoftherapeutics,joelg.hardman和leee.limberd,eds.,10thed.mcgraw-hill,newyork,2001),228页)。力被归一化为组织的重量和长度并且转换为应力和诱导的舒张,对其进行计算。
图26显示了mmi-0100治疗增强iso诱导的pasm的舒张13%(图板b)。星号(*)指示与未处理的相比的显著性,p=0.011,n=3。
mmi-0100增强iso诱导的人气道平滑肌(hasm)的舒张。完整人气道组织保持未处理或使用200µmmmi-0100预处理30min。图27显示了mmi-0100增强iso在肌肉浴中诱导完整人气道组织中的舒张并且在完整人气道平滑肌中减少mk2磷酸化。(a)力生成的代表性描图。对cch的累积的收缩应答(b)和对iso剂量的%舒张(c)。n=4;p<0.05。插图是显示mk2磷酸化水平的免疫印迹。hasm被悬挂在肌肉浴中并且被冷冻。通过sdspage和免疫印迹测定mk2磷酸化。因而,虽然mmi-0100可能不自身或自行引起平滑肌的舒张,但是其可以增强激动剂诱导的平滑肌的舒张。
mmi-100在哮喘中的模型。图28显示了通过mmi-0100缓解哮喘症状的建议的模型。不希望被理论限制,作为与β-激动剂或皮质类固醇联合治疗的效用,mmi-0100将遏制哮喘患者中的mk2介导的气道高敏性(ahr)、纤维化和炎症。mmi-0100抑制肌动蛋白细胞骨架调节剂比如hsp27和lim激酶,和mrna稳定蛋白比如hnrnpa0的磷酸化。
实施例14:mmi-0100(yaraaarqarakalarqlgvaa;seqidno:1)在鼠哮喘模型中的体内功效
小鼠的致敏:从charlesriverlaboratories(wilmington,ma)获得无病原体的8-10周龄雌性balb/c小鼠。在实验前,使小鼠在动物中心(animalunit)适应一周。为了致敏,将小鼠暴露于卵清蛋白。在第四周期间,经由雾化、滴鼻或气管内施用,进行pbs或100µlpbs中的mmi-0100肽(3、30、100、300ng/kg)的施用。在最后一次mch激发后一天(第36天),对于给定的增加剂量的mch,测定对静脉内醋甲胆碱(mch)的气道高反应性。
支气管肺泡灌洗(bal)细胞学的测定和对炎症的作用:通过计数用于差别分析的总bal细胞和染色总bal细胞来评估气道炎症。通过离心(1,500rpm下10分钟)制备无细胞的bal液,并且使用多重小鼠细胞因子/趋化因子测定试剂盒(millipore,billerica,ma)测量细胞因子水平。
气道重构:通过检验围绕气道的杯状细胞增生、胶原iii的沉积和α-平滑肌激动蛋白表达测定气道重构。将肺固定并且包埋在石蜡中。使用马逊三色(sigma-aldrich,st.louis,mo)和高碘酸-希夫(pas)染色(millipore,billerica,ma)使载玻片染色以分别检验胶原沉积和气道粘液。进行苏木精(sigma-aldrich,st.louis,mo)和伊红(sigma-aldrich,st.louis,mo)染色以检验上皮(上皮细胞和杯状细胞)肥大、气道平滑肌(asm)肥大与增生、和免疫细胞浸润。α-平滑肌肌动蛋白(r&dsystems,minneapolis,mn)的染色还将揭示负责上皮下增厚的细胞类型。
生物分布和毒性:使用荧光标记的mmi-0100肽测定mmi-0100肽的生物分布。使用odyssey红外成像系统(li-corbiosciences,lincoln,ne)进行整体式动物扫描(wholeanimalscanning)并且通过完整的代谢试验(completemetabolicpanel)测定毒性。
来自屋尘螨(housedustmite)(hdm)致敏小鼠的分离的气管区段的离体反应性的测定:为了直接测量对asm收缩性的作用,从对照和哮喘小鼠分离asm环,并且在肌肉浴中离体测量收缩功能。还使用来自人供体的肺组织气道组织测定生理学功能。测定mmi-0100对舒喘宁诱导的舒张的功能。
虽然已经参考其具体实施方案描述了所述发明,但是本领域技术人员应当理解,可以做出多种改变并且可以进行等价物替换,而不背离本发明的真实精神和范围。此外,对于所述发明的客观精神和范围,可以进行很多修改以适应具体的情况、材料、物质组成、过程、过程步骤或多个步骤。所有这样的修改都意欲落入所附权利要求书的范围内。
序列表
<110>莫伊莱矩阵公司
c.兰德
c.布拉菲
<120>用于预防或治疗以异常的成纤维细胞增殖和细胞外基质沉积为特征
的疾病、病况或进程的组合物和方法
<130>17456.0073
<140>pct/us2015/47390
<141>2015-08-28
<150>us14/473,339
<151>2014-08-29
<160>25
<170>patentinversion3.5
<210>1
<211>22
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>1
tyralaargalaalaalaargglnalaargalalysalaleualaarg
151015
glnleuglyvalalaala
20
<210>2
<211>11
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>2
lysalaleualaargglnleuglyvalalaala
1510
<210>3
<211>21
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>3
phealalysleualaalaargleutyrarglysalaleualaarggln
151015
leuglyvalalaala
20
<210>4
<211>23
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>4
lysalaphealalysleualaalaargleutyrarglysalaleuala
151015
argglnleuglyvalalaala
20
<210>5
<211>21
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>5
tyralaargalaalaalaargglnalaargalalysalaleualaarg
151015
glnleualavalala
20
<210>6
<211>21
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>6
tyralaargalaalaalaargglnalaargalalysalaleualaarg
151015
glnleuglyvalala
20
<210>7
<211>22
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>7
hisargargilelysalatrpleulyslysilelysalaleualaarg
151015
glnleuglyvalalaala
20
<210>8
<211>10
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>8
lysalaleualaargglnleualavalala
1510
<210>9
<211>10
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>9
lysalaleualaargglnleuglyvalala
1510
<210>10
<211>11
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>10
lysalaleualaargglnleuglyvalalaala
1510
<210>11
<211>11
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>11
tyralaargalaalaalaargglnalaargala
1510
<210>12
<211>14
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>12
trpleuargargilelysalatrpleuargargilelysala
1510
<210>13
<211>7
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>13
trpleuargargilelysala
15
<210>14
<211>11
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>14
tyrglyarglyslysargargglnargargarg
1510
<210>15
<211>12
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>15
trpleuargargilelysalatrpleuargargile
1510
<210>16
<211>10
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>16
phealalysleualaalaargleutyrarg
1510
<210>17
<211>12
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>17
lysalaphealalysleualaalaargleutyrarg
1510
<210>18
<211>11
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>18
hisargargilelysalatrpleulyslysile
1510
<210>19
<211>21
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>19
tyralaargalaalaalaargglnalaargalalysalaleuasnarg
151015
glnleuglyvalala
20
<210>20
<211>9
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>20
arglyslysargargglnargargarg
15
<210>21
<211>10
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>21
lyslysleuasnargthrleuservalala
1510
<210>22
<211>13
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>22
lyslyslysalaleuasnargglnleuglyvalalaala
1510
<210>23
<211>17
<212>prt
<213>未知
<220>
<223>哺乳动物
<220>
<221>misc_feature
<222>(3)..(12)
<223>其中“xaa”表示任何氨基酸以及长度为10个残基的氨基酸的序列
<400>23
lyslysxaaxaaxaaxaaxaaxaaxaaxaaxaaxaalysargarglys
151015
lys
<210>24
<211>7
<212>prt
<213>未知
<220>
<223>哺乳动物
<400>24
leuleulysargarglyslys
15
<210>25
<211>6
<212>prt
<213>未知
<220>
<223>哺乳动物
<220>
<221>misc_feature
<222>(1)..(1)
<223>其中“xaa”表示选自val、ile、leu、met和phe的大疏水残基
<220>
<221>misc_feature
<222>(2)..(2)
<223>其中“xaa”表示任何氨基酸
<220>
<221>misc_feature
<222>(4)..(5)
<223>其中“xaa”表示任何氨基酸以及长度为2个残基的氨基酸的序列
<220>
<221>misc_feature
<222>(6)..(6)
<223>其中“xaa”表示磷酸化ser或磷酸化thr
<400>25
xaaxaaargxaaxaaxaa
15
- 还没有人留言评论。精彩留言会获得点赞!