可缓释万古霉素骨支架及其制备方法与流程
本发明涉及一种可缓释万古霉素骨支架及其制备方法,属于材料学和骨科学技术领域。
背景技术:
感染性骨缺损的治疗一直以来都是临床骨科医生的一大难题。虽然目前可用的治疗方法很多,包括骨清创术、骨延长术、开放性植骨术、同种异体骨移植和感染骨无菌处理血管化后择期回植等,但均存在治疗周期长,操作繁琐,植入物需要二次手术取出等问题。如何构建一种既能长时间有效抗感染,又能作为一期骨修复材料的抗感染骨支架是非常迫切的研究课题。
技术实现要素:
本发明提供了一种可缓释万古霉素骨支架及其制备方法,有效抑菌时间长。本发明解决其技术问题所采用的技术方案是:
可缓释万古霉素骨支架的制备方法,包括步骤
选择牛股骨头,去除软骨及皮质骨,保留松质骨部分并制成圆柱状脱蛋白松质骨支架;
将万古霉素、聚乳酸乙醇酸溶于六氟异丙醇中制成电纺液;
电纺液存放在微量泵中,利用静电纺丝在脱蛋白松质骨支架表面贴附载万古霉素的纳米纤维膜。
一较佳实施例之中:还包括将附载万古霉素的纳米纤维膜的脱蛋白松质骨支架置于温箱,待溶剂挥发殆尽后消毒的步骤。
一较佳实施例之中:牛股骨是8月龄;圆柱状脱蛋白松质骨支架长轴骨小梁排列方向与松质骨长轴一致。
一较佳实施例之中:万古霉素40mg,聚乳酸乙醇酸240mg,六氟异丙醇1ml;聚乳酸乙醇酸分子量33OOODa;乳酸:乙醇酸为1:1。
一较佳实施例之中:圆柱状脱蛋白松质骨支架长1.5cm,直径0.5cm;圆柱状脱蛋白松质骨支架中部钻孔并串于接收棒上;静电纺丝参数为:电压30KV,电流4mA,针头内径0.42mm,马达转速300转/分,流速为3.0m I/h,正极与接收棒的距离为10cm。
一较佳实施例之中:温箱温度40℃,保温72h。
一较佳实施例之中:待溶剂挥发殆尽后用钴60照射消毒。
一种可缓释万古霉素骨支架,内部是牛股骨材质的脱蛋白松质骨,外表面包有一层载万古霉素的纳米纤维膜。
一较佳实施例之中:纳米纤维膜纳米纤维直径范围100-1200纳米。
一较佳实施例之中:纳米纤维间的孔径1-5微米。
本技术方案与背景技术相比,它具有如下优点:
可缓释万古霉素骨支架有效抑菌圈可以维持至少4周,有效抑菌时间长,且细胞相容性好,是修复感染性骨缺损的理想支架材料。
附图说明
下面结合附图和实施例对本发明作进一步说明。
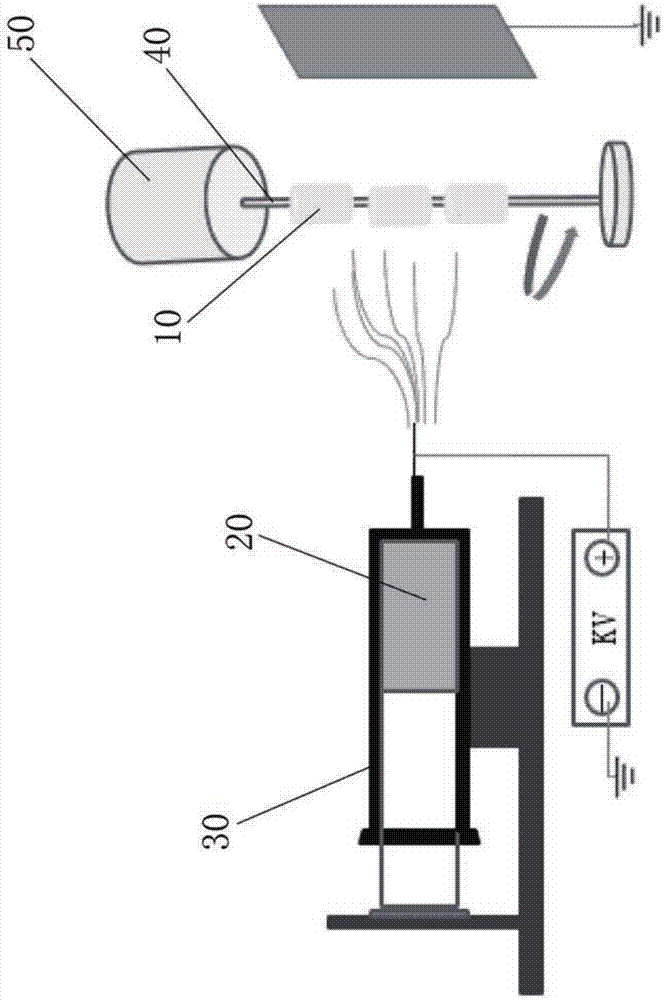
图1绘示了静电纺丝示意图。
图2a绘示了脱蛋白松质骨支架示意图。
图2b绘示了可缓释万古霉素骨支架示意图。
图3a绘示了脱蛋白松质骨支架电子显微镜(×30)示意图。
图3b绘示了脱蛋白松质骨支架电子显微镜(×6000)示意图。
图3c绘示了可缓释万古霉素骨支架电子显微镜(×7000)示意图。
图4a绘示了可缓释万古霉素骨支架的体外释放浓度变化示意图。
图4b绘示了可缓释万古霉素骨支架的体外累计释放率示意图。
图5a绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架第1天抑菌效果示意图。
图5b绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架第7天抑菌效果示意图。
图5c绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架第14天抑菌效果示意图。
图5d绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架第21天抑菌效果示意图。
图5e绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架第28天抑菌效果示意图。
图6绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架抑菌圈长径时间曲线图。
图7绘示了脱蛋白松质骨支架、未载药纳米纤维膜骨支架、载药纳米纤维膜骨支架细胞相容性曲线图。
具体实施方式
本发明的一种可缓释万古霉素骨支架,内部是牛股骨材质的脱蛋白松质骨,外表面包有一层载万古霉素的纳米纤维膜。纳米纤维膜纳米纤维直径范围100-1200纳米。纳米纤维间的孔径1-5微米。优选采用8月龄的牛股骨头。
请参照图1,可缓释万古霉素骨支架具体制造方法步骤如下:
(1)选择牛股骨头,去除软骨及皮质骨,保留松质骨部分并制成圆柱状脱蛋白松质骨支架10;
(2)将万古霉素、聚乳酸乙醇酸溶于六氟异丙醇中制成电纺液20;
(3)电纺液20存放在微量泵30中,利用静电纺丝在脱蛋白松质骨支架10表面贴附载万古霉素的纳米纤维膜。
(4)将附载万古霉素的纳米纤维膜的脱蛋白松质骨支架置于温箱,待溶剂挥发殆尽后消毒。
步骤(1)中,优选地:牛股骨是8月龄。圆柱状脱蛋白松质骨支架10长1.5cm,直径0.5cm。圆柱状脱蛋白松质骨支架10长轴骨小梁排列方向与松质骨长轴一致,使得样本表面孔隙密度保持基本相同。
步骤(2)中,优选地:万古霉素40mg,聚乳酸乙醇酸240mg,六氟异丙醇1ml;聚乳酸乙醇酸分子量33OOODa;乳酸:乙醇酸为1:1。
步骤(3)中,圆柱状脱蛋白松质骨支架10中部钻孔并串于接收棒40上。优选地:静电纺丝参数为电压30KV,电流4mA,针头内径0.42mm,马达50转速300转/分,流速为3.0ml/h,正极与接收棒40的距离为10cm。
步骤(2)中,优选地:温箱温度40℃,保温72h。待溶剂挥发殆尽后用钴60照射消毒。
请参照图2a、图2b、图3a、图3b、图3c,表面特征观察:脱蛋白松质骨支架和可缓释万古霉素骨支架用导电胶固定于样品杯上,表面镀金后,扫描电子显微镜(日立5-4200)扫描纳米纤维支架的表面形态:脱蛋白松质骨支架仍保留原骨组织网状孔隙系统,孔隙率为74.2士5.24%,孔径为350.54士50.60μm,局部表面放大后可见支架表面粗糙不平整,明显颗粒状晶体结构排列;可缓释万古霉素骨支架表面扫描结果显示,纤维直径范围为100-1200nm,均匀分布在颗粒状的松质骨支架表面,纳米纤维间的孔径约1-5μm。
请参照图4a、图4b,万古霉素释放试验:将载万古霉素脱蛋白松质骨支架放置在PH7.4磷酸盐缓冲液(PBS)中以观察万古霉素的释放速率。具体操作:将载药支架浸入到装有2mIPBS的离心管中,放于37℃的温箱中24h,收集洗脱液:然后再加入2ml新鲜PBS。该过程重复30d,最后采用高效液相色谱法测定不同时间点洗脱液中万古霉素的浓度。累计释放率计算公式如下:
体外累积释放率=(N1浓度+N2浓度+N3浓度+…)*V/M*100%
(V:洗脱液体积;M:支架载药量)
可缓释万古霉素骨支架在PBS中缓慢释放出的万古霉素浓度长时间维持在高于90%的最低抑制浓度[MIC90=2mg/l]以上,持续达30d。其中第1-2d仍然有一个较小的突释现象,但此后其浓度仍维持在较高水平,缓慢降低。到第30d时,万古霉素的释放率达到96%。
请参照图5a、图5b、图5c、图5d、图5e及图6,体外抑菌能力观察:将1.5x108CFU的金黄色葡萄球菌(ATCC25923)均匀涂布于琼脂板上,然后将空白骨支架、未载药纳米纤维膜的骨支架、载药纳米纤维膜的骨支架分别置于琼脂板中,在细菌培养箱37℃培养24h,观察抑菌活性并记录抑菌圈大小。所有的材料每24h更换新的细菌琼脂板,直到抗菌效果消失。01是脱蛋白松质骨支架,02是未载药纳米纤维膜骨支架,03是载药纳米纤维膜骨支架。
体外抑菌试验结果:载万古霉素骨支架(即可缓释万古霉素骨支架)在琼脂培养基中对金黄色葡萄球菌表现出明显的抑制作用,到第28d时仍可见明显抑菌圈存在,而未载药纳米纤维膜骨支架及脱蛋白松质骨支架均无抑菌效果。对抑菌圈长径进行为期28d的记录观察,结果显示载药纳米纤维膜支架,第1d时抑菌圈长径最大,随时间的推移,抑菌圈长径逐渐减小。
请参照图7,细胞相容性观察:取成年新西兰大白兔的骸骨骨髓,分离培养骨髓来源的间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)。取培养第三代的BMSCs,以3X 104/ml的密度接种到24孔板中,每组加入等量细胞培养基,然后将空白骨支架、未载药纳米纤维膜骨支架和载药纳米纤维膜骨支架分别加入到培养基中培养2周,以不做任何处理组作为对照组,然后用CCK-8法检测BMSCs的细胞增殖情况。培养1d,3d,6d,9d和14d后,各组分别选取6孔,PBS溶液洗涤3次,分别加入1ml的培养基和100μl的CCK-8kit(Sigma)溶液,继续在37℃培养箱孵育2h,然后取100μl孵育液到96孔板。利用酶标仪检测培养液在450nm处吸光度(A)值。计算细胞的相对存活系数(%)二(样本的A值/对照组的A值)X 100%。
BMSCs在各实验组中均表现较为缓慢的增殖趋势,细胞形态良好。各组的细胞相对生存率在培养6d后均出现不同程度的升高。在第1d,3d,6d,9d和14d时,三组细胞增殖数据使用单因素方差分析比较,对应的F值为0.185、0.095、0.135、0.328、0.138,P值分别为0.833、0.910、0.875、0.726、0.872,均大于0.05,各时间点各组细胞增殖率之间无统计学差异。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
- 还没有人留言评论。精彩留言会获得点赞!