一种RES巨噬细胞阻塞材料、肿瘤多步疗法系列药物及其应用的制作方法
本发明属于化学、药学、医学等多学科交叉领域,更具体地,涉及一种RES blockade策略联合羟乙基淀粉-聚乳酸纳米粒载药系统及其应用。
背景技术:
化疗是目前治疗癌症最有效的手段之一。化疗药物会随着血液循环遍布全身的绝大部分器官和组织。作为一种全身治疗手段,化疗是目前针对一些有全身扩撒倾向的肿瘤及已经发生转移的中晚期肿瘤最主要的治疗手段。但目前化疗药物存在着极大的缺陷:化疗药物的非特异靶向性导致化疗药物在杀伤肿瘤细胞的同时,也将正常细胞一同杀伤,治疗过程经常会对机体正常组织造成不可逆转的损害,降低人体的免疫能力,是一种“玉石俱焚”的治疗方法。因此,纳米药物载体就成为了提高抗肿瘤药物疗效,降低药物毒副作用的关键。
近几十年,纳米科学家对纳米载体材料做了各种筛选及修饰,其中包括对新材料、新靶向分子的创新,对纳米粒大小、电荷及表面物理化学性质的改造等等。尽管以上种种尝试与努力,纳米载药系统的抗肿瘤效率远远没有达到预期效果。根本原因在于分布在肝、肾、脾、肺、淋巴结等组织的网状内皮系统(RES)对载药纳米粒的非特异性摄取,最终导致富集于肿瘤部位的药物浓度低。
目前,已经有一系列的有机或无机材料被用来阻塞RES巨噬细胞,其中包括二氧化硅、碳、乳胶微球、氯化钆、葡聚糖硫酸酯、脂质体等等。可喜的是,应用这些材料来阻塞RES巨噬细胞在一定程度上均起到了效果,但是其中一些材料因为大的给药剂量给机体带来了极大的损伤,限制了其临床的使用。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明提供了一种RES巨噬细胞阻塞材料、肿瘤多步疗法系列药物及其应用,其目的在于通过合成不同接枝率的羟乙基淀粉-聚乳酸纳米粒分别用作RES系统临时阻塞RES blockade材料及药物载体材料,利用RES blockade策略联合羟乙基淀粉-聚乳酸载药纳米粒载药系统应用于肿瘤治疗,由此解决现有技术的网状内皮系统(RES)对载药纳米粒的非特异性摄取,最终导致富集于肿瘤部位的药物浓度低、肿瘤治疗效果差以及现有的RES巨噬细胞阻塞材料由于剂量过大而引起的机体损伤的技术问题。
为实现上述目的,按照本发明的一个方面,提供了一种网状内皮系统巨噬细胞阻塞材料,其特征在于,所述阻塞材料包括羟乙基淀粉-聚乳酸嵌段聚合物,所述羟乙基淀粉-聚乳酸嵌段聚合物具有如下的通式:
其中,m在70至300之间,n在300至3000之间,所述聚乳酸在羟乙基淀粉上接枝率为1~2。
优选地,所述m为390,n为70,所述接枝率为1.62。
优选地,所述羟乙基淀粉-聚乳酸嵌段聚合物的平均粒径为500~1000nm,优选为700nm。
按照本发明的另一个方面,提供了一种肿瘤多步疗法系列药物,包括药物A和药物B,所述药物A包括如权利要求1~3任意一项所述的阻塞材料,所述药物B为抗肿瘤药物。
优选地,所述药物B为羟乙基淀粉-聚乳酸嵌段聚合物的纳米载药系统,所述纳米载药系统的纳米粒的尺寸为100~200nm。
优选地,所述纳米载药系统的纳米粒的尺寸为140nm。
优选地,所述纳米载药系统的载药为阿霉素。
按照本发明的另一个方面,提供了一种所述的系列药物在制备治疗肿瘤的药物中的用途。
优选地,所述系列药物的药物A的剂量为200~600mg/kg,所述药物B的剂量为4~6mg/kg。
优选地,所述系列药物被制备用于:
(1)向肿瘤患者施用200~600mg/kg剂量的药物A;
(2)等待0.5~4h的时间段向该患者施用4~6mg/kg剂量的药物B;
优选地,所述药物A的剂量为400mg/kg。
优选地,所述药物B的剂量为4mg/kg。
优选地,所述时间段为1.5小时。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,能够取得下列有益效果。
(1)本发明利用合成的不同接枝率的羟乙基淀粉-聚乳酸纳米粒分别用作RES系统临时阻塞RES blockade材料及药物载体材料,显著性的提高了抗肿瘤药物在肿瘤部位的聚集,从而提高了肿瘤的治疗效率。
(2)RES blockade策略联合包载抗肿瘤药物阿霉素的羟乙基淀粉-聚乳酸纳米粒的给药方式显著减少了阿霉素的心脏毒性以及肝毒性。
(3)本发明提供的网状内皮系统(RES)巨噬细胞阻塞材料,具有良好的生物相容性及生物可降解性,同时也没有免疫原性,是一种极其安全的可用于注射的材料,使用时400mg/kg的剂量,对机体损伤很小。
(4)本发明利用RES blockade策略联合羟乙基淀粉-聚乳酸载药纳米粒载药系统应用于肿瘤治疗,显著提高了肿瘤的疗效,并且大大降低了药物的毒副作用,为肿瘤的治疗提供了一种新的治疗手段。
附图说明
图1为本发明制备的两亲性嵌段聚合物羟乙基淀粉-聚乳酸的制备方法(HES-g-PLA)的合成路线图;
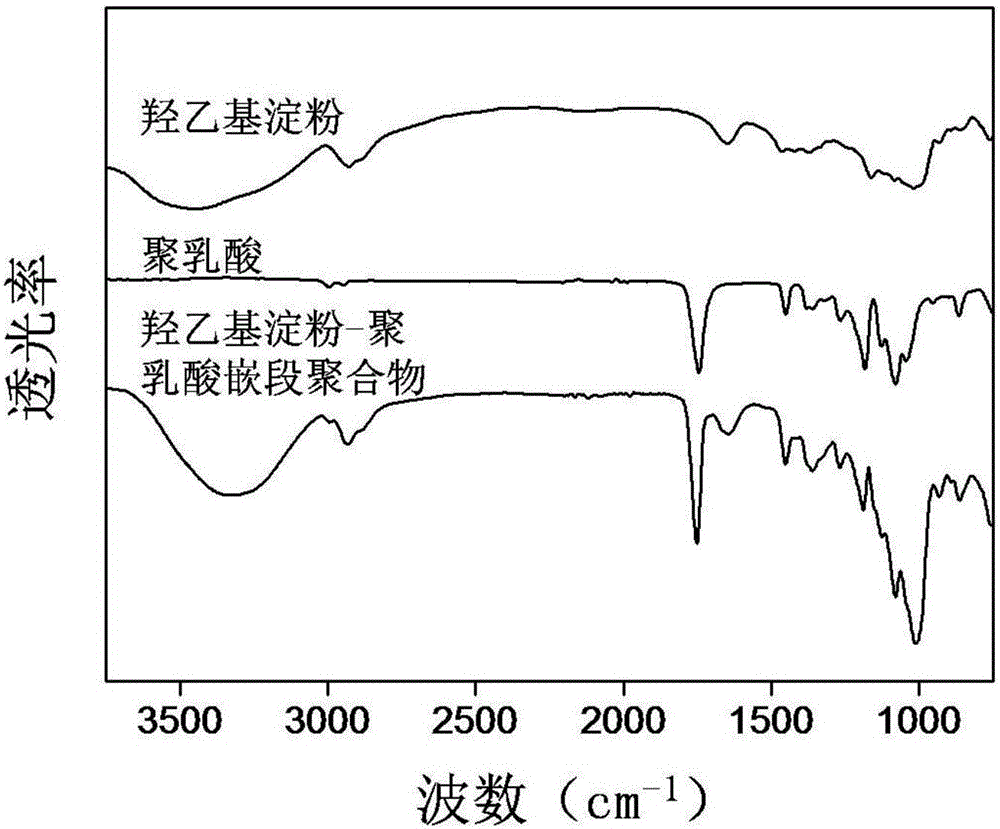
图2为本发明制备的羟乙基淀粉-聚乳酸嵌段聚合物、羟乙基淀粉和聚乳酸的红外光谱图(FT-IR);
图3为本发明制备的羟乙基淀粉-聚乳酸嵌段聚合物、羟乙基淀粉和聚乳酸的红外光谱图核磁共振谱图(1H-NMR);
图4是本发明考察的注射RES blockade羟乙基淀粉-聚乳酸纳米粒与注射载药羟乙基淀粉-聚乳酸纳米粒的最佳时间间隔的小动物成像图;
图5为本发明考察的RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的组织分布图;
图6为本发明考察的RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的肿瘤生长曲线图及肿瘤重量图;
图7为本发明考察的RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的生化指标(CK、ALB、TP)图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明针对网状内皮系统RES对肿瘤治疗药物载药纳米粒的非特异性摄取,导致能够富集于肿瘤部位的药物浓度低,肿瘤治疗效率低,而现有的RES巨噬细胞阻塞材料使用时由于剂量过大导致机体损伤的问题,提供了一种新型的网状内皮系统(RES)巨噬细胞阻塞材料,其为羟乙基淀粉-聚乳酸嵌段聚合物,具有以下的通式:
其中,m在70到300之间,n在300到3000之间,所述聚乳酸在羟乙基淀粉上接枝率为1~2,优选为1.62,所述羟乙基淀粉-聚乳酸嵌段聚合物的尺寸500~1000nm,优选为500~800nm,进一步优选为700nm。
本发明利用RES blockade策略,即通过合成不同接枝率的羟乙基淀粉-聚乳酸纳米粒先后分别用作RES系统临时阻塞RES blockade材料及药物载体材料,利用RES blockade策略联合羟乙基淀粉-聚乳酸载药纳米粒载药系统应用于制备治疗肿瘤药物的研究。
本发明还提供了一种肿瘤多步疗法系列药物,优选两步疗法,包括药物A和药物B,所述药物A包括上述网状内皮系统(RES)巨噬细胞阻塞材料,所述药物B为抗肿瘤药物,优选为羟乙基淀粉-聚乳酸的纳米载药系统,所述纳米载药系统接枝率为0.5~1,优选为0.86,尺寸为100~200nm,优选为140nm左右,所述载药优选为阿霉素。
所述的网状内皮系统巨噬细胞阻塞材料的制备方法,包括如下步骤:
(1)溶解聚乳酸并活化其末端羧基:向端羧基的聚乳酸0.2~0.7g中加入催化剂N-N’-二环己基碳二亚胺和4-二甲氨基吡啶,以无水二甲亚砜作为溶剂,所述聚乳酸质量优选为0.3~0.4g,50~70℃下反应25~45分钟,使其完全溶解,得到端羧基活化的聚乳酸;所述聚乳酸、N-N’-二环己基碳二亚胺和4-二甲氨基吡啶的投料摩尔比为1:4:2;
(2)溶解羟乙基淀粉:氮气保护条件下,在50~70℃下将0.5g羟乙基淀粉充分溶解于无水二甲亚砜中,得到羟乙基淀粉的二甲亚砜溶液;
(3)酯化反应:将步骤(1)得到的端羧基活化的聚乳酸与步骤(2)得到的羟乙基淀粉的二甲亚砜溶液混合,发生酯化反应,在氮气保护下,50~70℃下反应24~36h,得到所述两亲性羟乙基淀粉偶联聚乳酸共聚物粗品;
(4)纯化:将所述步骤(3)得到的两亲性羟乙基淀粉偶联聚乳酸共聚物粗品使用去离子水进行透析,透析袋分子量为3500,共透析2~4天,以除去体系中的DMSO溶剂,透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸嵌段聚合物的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所述的两亲性羟乙基淀粉偶联聚乳酸共聚物(HES-g-PLA)。
(4)超声分散:最后将所得的羟乙基淀粉-聚乳酸嵌段聚合物溶解于超纯水中,聚合物的浓度为100mg/ml,超声10min,得到用作RES blockade羟乙基淀粉-聚乳酸纳米粒的阻塞材料。
所述药物B,即羟乙基淀粉-聚乳酸的纳米载药系统的制备方法,包括如下步骤:
(1)溶解聚乳酸并活化其末端羧基:向端羧基的聚乳酸0.2~0.7g中加入催化剂N-N’-二环己基碳二亚胺和4-二甲氨基吡啶,以无水二甲亚砜作为溶剂,50~70℃下反应25~45分钟,使其完全溶解,得到端羧基活化的聚乳酸;所述聚乳酸、N-N’-二环己基碳二亚胺和4-二甲氨基吡啶的投料摩尔比为1:4:2;
(2)溶解羟乙基淀粉:氮气保护条件下,在50~70℃下将0.5g羟乙基淀粉充分溶解于无水二甲亚砜中,得到羟乙基淀粉的二甲亚砜溶液;
(3)酯化反应:将步骤(1)得到的端羧基活化的聚乳酸与步骤(2)得到的羟乙基淀粉的二甲亚砜溶液混合,发生酯化反应,在氮气保护下,50~70℃下反应24~36h,得到所述两亲性羟乙基淀粉偶联聚乳酸共聚物粗品;
(4)纯化:将所述步骤(3)得到的两亲性羟乙基淀粉偶联聚乳酸共聚物粗品使用去离子水进行透析,透析袋分子量为3500,共透析2~4天,以除去体系中的DMSO溶剂,透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸嵌段聚合物的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所述的两亲性羟乙基淀粉偶联聚乳酸共聚物(HES-g-PLA)。
(5)超声乳化:将步骤(4)得到的两亲性羟乙基淀粉偶联聚乳酸共聚物溶解于水中,在冰浴下超声破碎,同时加入已脱去盐酸的阿霉素的乙醇二氯甲烷溶液,得到超声后的乳液;
(6)高压均质:将步骤(5)得到的乳液在高压均质机中,高压匀质压力600~1000bar,匀质2次以上,纯化得到包载有阿霉素的两亲性羟乙基淀粉偶联聚乳酸共聚物的纳米载药系统。
本发明所述羟乙基淀粉原料购买于武汉华科大生命科技有限公司,所购羟乙基淀粉的分子量为70~480kDa,优选70kDa,羟乙基的取代度为0.5。本发明所述聚乳酸原料购买于济南岱罡生物工程有限公司,聚乳酸的分子量为10~30kDa,优选为10kDa。本发明所述阿霉素原料药购买于北京华奉联博科技有限公司,纯度为99%。
所述的肿瘤两步法系列药物,用于制备治疗肿瘤的药物,被制备后用于:
(1)向肿瘤患者施用200~600mg/kg剂量的药物A;
(2)等待0.5~4h的时间段向该患者施用4~6mg/kg剂量的药物B。
所述药物A的剂量优选为400mg/kg,所述药物B的剂量优选为4mg/kg,时间段优选为1.5小时。
药物A为RES blockade羟乙基淀粉-聚乳酸纳米粒,用于临时阻塞网状内皮系统巨噬细胞对纳米载体的非特异性摄取,然后再施用载药纳米粒,能极大的减少纳米载药系统被RES系统摄取,因此药物能通过EPR效应更多的富集于病灶处,提高了药物的靶向性,减少系统毒性的同时进一步提高了治疗效果。
以下为实施例:
实施例1
制备一种肿瘤两步疗法系列药物,包括药物A和药物B,药物A RES blockade羟乙基淀粉-聚乳酸嵌段聚合物的制备步骤如下:
将0.323g端羧基的聚乳酸(PLA-COOH)、N-N’-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),(其中PLA、DCC、DMAP三者投料摩尔比为1:4:2)置于100mL干燥的圆底烧瓶中。同时加入氮气保护的15mL无水二甲亚砜(DMSO)溶剂,60℃搅拌30min使反应物完全溶解且活化其末端羧基。
与此同时,将0.5g羟乙基淀粉HES溶解于10mL的无水DMSO溶剂中,60℃反应时间为30min。将PLA、DCC、DMAP的DMSO溶液加入到充分溶解了的HES溶液中,并加入5ml的无水DMSO润洗溶解PLA的烧瓶,之后将润洗液加入反应液。60℃反应24小时。整个反应过程均在氮气保护下完成。待反应结束后,将反应体系置于透析袋(MWCO-3500)中,使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去体系中的DMSO溶剂。透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸接枝聚合物(HES-b-PLA)的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所需的羟乙基淀粉-聚乳酸嵌段聚合物。
最后将所得的羟乙基淀粉-聚乳酸嵌段聚合物溶解于超纯水中,聚合物的浓度为100mg/ml,超声10min,得到用作RES blockade羟乙基淀粉-聚乳酸纳米粒的阻塞材料。该聚合物的接枝率为1.62,得到的纳米粒平均粒径为700nm。
制备药物B,即载药羟乙基淀粉-聚乳酸嵌段聚合物的纳米载药系统的纳米粒,制备步骤如下:
将0.565g端羧基的聚乳酸(PLA-COOH)、N-N’-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),(其中PLA、DCC、DMAP三者投料摩尔比为1:4:2)置于100mL干燥的圆底烧瓶中。同时加入氮气保护的15mL无水二甲亚砜(DMSO)溶剂,60℃搅拌30min使反应物完全溶解且活化其末端羧基。
与此同时将0.5g羟乙基淀粉溶解于10mL的无水DMSO溶剂中,60℃反应时间为30min。将PLA、DCC、DMAP的DMSO溶液加入到充分溶解了的HES溶液中,并加入5ml的无水DMSO润洗溶解PLA的烧瓶,之后将润洗液加入反应液。60℃反应24小时。整个反应过程均在氮气保护下完成。待反应结束后,将反应体系置于透析袋(MWCO-3500)中,使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去体系中的DMSO溶剂。透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸接枝聚合物(HES-b-PLA)的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所需的羟乙基淀粉-聚乳酸嵌段聚合物。
将得到的羟乙基淀粉-聚乳酸的嵌段聚合物溶解于水中,利用超声破碎仪,在冰浴下,一边超声一边加入已脱去盐酸的阿霉素的乙醇二氯甲烷溶液(其中乙醇与二氯甲烷的体积比为1:1),超声时间一共5min。将超声后的乳液加入高压匀质机中,在600bar的压力下匀质两次,匀质完成后利用旋转蒸发仪除去乳液中的有机溶剂,最终得到粉红色澄清透明溶液。将所得溶液置于透析袋(MWCO-3500)中使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去没有包载到聚合物纳米粒中的阿霉素。最后将透析得到中的载药聚合物纳米粒的水溶液冻干备用。该步骤全程在避光的条件下进行。最后将得到的包载阿霉素的羟乙基淀粉-聚乳酸的冻干粉,按照11.6mg/ml的浓度溶解于超纯水中,超声10min,得到载药羟乙基淀粉-聚乳酸纳米粒。该聚合物的接枝率为0.86,得到的纳米粒粒径为140nm。
图1为本发明制备的两亲性嵌段聚合物羟乙基淀粉-聚乳酸(HES-g-PLA)的合成路线;图2和图3分别为本发明制备的两亲性嵌段聚合物羟乙基淀粉-聚乳酸(HES-g-PLA)的红外光谱(FT-IR)及核磁共振谱(1H-NMR)图。采用红外光谱(FT-IR)及核磁共振谱(1H-NMR)确认本发明制备的羟乙基淀粉-聚乳酸嵌段聚合物的化学结构。傅里叶红外光谱:本试验采用德国Bruker Vertex 70傅里叶变换红外光谱仪,通过溴化钾压片法得到检测样品,扫描波长范围为4000-500cm-1,得到了HES,PLA和HES-g-PLA嵌段聚合物的红外谱图。核磁波谱1H-NMR:本实验采用瑞士Bruker AV600核磁波谱仪,以氘代二甲基亚砜(d6-DMSO)为溶剂,测定了HES,PLA以及合成得到的HES-g-PLA嵌段聚合物的核磁谱图。从HES的红外谱图中可以看到,3400cm-1,2926cm-1,1649cm-1分别为OH的伸缩振动峰,C-H的震动吸收峰和分子内氢键。对比纯HES的FT-IR谱图,HES-g-PLA在2997cm-1,1753cm-1和1191cm-1处出现了三个新峰,它们分别是PLA-CH3伸缩振动峰,PLA酯基中的C=O振动峰,以及C-O-C的对称振动峰。在3400~3500cm-1处的羟基峰变小,表明只有部分HES的羟基偶联了聚乳酸链段,同时1649cm-1处的峰变小,代表着偶联改性后分子内的氢键作用力减弱。纯PLA的羰基振动峰在1745cm-1,而此峰在HES-g-PLA的谱图中向高波数移动(从1745移动到1753cm-1),这也是表明PLA接枝到HES上。这些新出现的吸收峰证明聚乳酸成功的偶联到羟乙基淀粉上。同时在所合成的羟乙基淀粉-聚乳酸嵌段聚合物(HES-g-PLA)的核磁共振氢谱上既存在羟乙基淀粉葡萄糖糖环上羟基质子峰,即化学位移为4.5ppm到6ppm之间的多重峰,也能发现化学位移为在1-2ppm之间的聚乳酸的特征峰:甲基质子峰。核磁谱图结果进一步证实了HES-g-PLA的结果。
实施例2
制备一种肿瘤两步疗法系列药物,包括药物A和药物B,药物A RES blockade羟乙基淀粉-聚乳酸嵌段聚合物的制备步骤如下:
将0.404g端羧基的聚乳酸(PLA-COOH)、N-N’-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),(其中PLA、DCC、DMAP三者投料摩尔比为1:4:2)置于100mL干燥的圆底烧瓶中。同时加入氮气保护的15mL无水二甲亚砜(DMSO)溶剂,60℃搅拌30min使反应物完全溶解且活化其末端羧基。
与此同时,将0.5g羟乙基淀分HES溶解于10mL的无水DMSO溶剂中,60℃反应时间为30min。将PLA、DCC、DMAP的DMSO溶液加入到充分溶解了的HES溶液中,并加入5ml的无水DMSO润洗溶解PLA的烧瓶,之后将润洗液加入反应液。60℃反应24小时。整个反应过程均在氮气保护下完成。待反应结束后,将反应体系置于透析袋(MWCO-3500)中,使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去体系中的DMSO溶剂。透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸接枝聚合物(HES-b-PLA)的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所需的羟乙基淀粉-聚乳酸嵌段聚合物。
最后将所得的羟乙基淀粉-聚乳酸嵌段聚合物溶解于超纯水中,聚合物的浓度为100mg/ml,超声10min,得到用作RES blockade羟乙基淀粉-聚乳酸纳米粒的阻塞材料。得到的纳米粒平均粒径为620nm。
制备药物B,即载药羟乙基淀粉-聚乳酸嵌段聚合物的纳米载药系统的纳米粒,制备步骤如下:
将0.565g端羧基的聚乳酸(PLA-COOH)、N-N’-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),(其中PLA、DCC、DMAP三者投料摩尔比为1:4:2)置于100mL干燥的圆底烧瓶中。同时加入氮气保护的15mL无水二甲亚砜(DMSO)溶剂,60℃搅拌30min使反应物完全溶解且活化其末端羧基。
与此同时将0.5g羟乙基淀粉溶解于10mL的无水DMSO溶剂中,60℃反应时间为30min。将PLA、DCC、DMAP的DMSO溶液加入到充分溶解了的HES溶液中,并加入5ml的无水DMSO润洗溶解PLA的烧瓶,之后将润洗液加入反应液。60℃反应24小时。整个反应过程均在氮气保护下完成。待反应结束后,将反应体系置于透析袋(MWCO-3500)中,使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去体系中的DMSO溶剂。透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸接枝聚合物(HES-b-PLA)的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所需的羟乙基淀粉-聚乳酸嵌段聚合物。将得到的羟乙基淀粉-聚乳酸的嵌段聚合物溶解于水中,利用超声破碎仪,在冰浴下,一边超声一边加入已脱去盐酸的阿霉素的乙醇二氯甲烷溶液(其中乙醇与二氯甲烷的体积比为1:1),超声时间一共5min。将超声后的乳液加入高压匀质机中,在600bar的压力下匀质两次,匀质完成后利用旋转蒸发仪除去乳液中的有机溶剂,最终得到粉红色澄清透明溶液。将所得溶液置于透析袋(MWCO-3500)中使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去没有包载到聚合物纳米粒中的阿霉素。最后将透析得到中的载药聚合物纳米粒的水溶液冻干备用。该步骤全程在避光的条件下进行。最后将得到的包载阿霉素的羟乙基淀粉-聚乳酸的冻干粉,按照11.6mg/ml的浓度溶解于超纯水中,超声10min,得到载药羟乙基淀粉-聚乳酸纳米粒。该聚合物的接枝率为0.86,得到的纳米粒粒径为140nm。
实施例3
制备一种肿瘤两步疗法系列药物,包括药物A和药物B,药物A RES blockade羟乙基淀粉-聚乳酸嵌段聚合物的制备步骤如下:
将0.485g端羧基的聚乳酸(PLA-COOH)、N-N’-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),(其中PLA、DCC、DMAP三者投料摩尔比为1:4:2)置于100mL干燥的圆底烧瓶中。同时加入氮气保护的15mL无水二甲亚砜(DMSO)溶剂,60℃搅拌30min使反应物完全溶解且活化其末端羧基。
与此同时,0.5g羟乙基淀粉HES溶解于10mL的无水DMSO溶剂中,60℃反应时间为30min。将PLA、DCC、DMAP的DMSO溶液加入到充分溶解了的HES溶液中,并加入5ml的无水DMSO润洗溶解PLA的烧瓶,之后将润洗液加入反应液。60℃反应24小时。整个反应过程均在氮气保护下完成。待反应结束后,将反应体系置于透析袋(MWCO-3500)中,使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去体系中的DMSO溶剂。透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸接枝聚合物(HES-b-PLA)的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所需的羟乙基淀粉-聚乳酸嵌段聚合物。
最后将所得的羟乙基淀粉-聚乳酸嵌段聚合物溶解于超纯水中,聚合物的浓度为100mg/ml,超声10min,得到用作RES blockade羟乙基淀粉-聚乳酸纳米粒的阻塞材料。得到的纳米粒平均粒径为550nm。
制备药物B,即载药羟乙基淀粉-聚乳酸嵌段聚合物的纳米载药系统的纳米粒,制备步骤如下:
将0.565g端羧基的聚乳酸(PLA-COOH)、N-N’-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),(其中PLA、DCC、DMAP三者投料摩尔比为1:4:2)置于100mL干燥的圆底烧瓶中。同时加入氮气保护的15mL无水二甲亚砜(DMSO)溶剂,60℃搅拌30min使反应物完全溶解且活化其末端羧基。
与此同时将0.5g羟乙基淀粉溶解于10mL的无水DMSO溶剂中,60℃反应时间为30min。将PLA、DCC、DMAP的DMSO溶液加入到充分溶解了的HES溶液中,并加入5ml的无水DMSO润洗溶解PLA的烧瓶,之后将润洗液加入反应液。60℃反应24小时。整个反应过程均在氮气保护下完成。待反应结束后,将反应体系置于透析袋(MWCO-3500)中,使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去体系中的DMSO溶剂。透析完毕后将透析袋中的液体转移至塑料培养皿中,先放入-20℃冰箱中冷冻4h,然后放入-50℃的冻干机中冷冻干燥,将冷冻干燥后得到了羟乙基淀粉-聚乳酸接枝聚合物(HES-b-PLA)的冻干粉,利用索氏提取器抽提除去未反应的聚乳酸,具体条件是:以二氯甲烷为提取液,提取温度为设为70℃,反应时间为36小时。将提取后的样品在70℃的烘箱中,干燥10min,得到所需的羟乙基淀粉-聚乳酸嵌段聚合物。将得到的羟乙基淀粉-聚乳酸的嵌段聚合物溶解于水中,利用超声破碎仪,在冰浴下,一边超声一边加入已脱去盐酸的阿霉素的乙醇二氯甲烷溶液(其中乙醇与二氯甲烷的体积比为1:1),超声时间一共5min。将超声后的乳液加入高压匀质机中,在600bar的压力下匀质两次,匀质完成后利用旋转蒸发仪除去乳液中的有机溶剂,最终得到粉红色澄清透明溶液。将所得溶液置于透析袋(MWCO-3500)中使用去离子水进行透析,每天早晚换水两次,共透析3天,以除去没有包载到聚合物纳米粒中的阿霉素。最后将透析得到中的载药聚合物纳米粒的水溶液冻干备用。该步骤全程在避光的条件下进行。最后将得到的包载阿霉素的羟乙基淀粉-聚乳酸的冻干粉,按照11.6mg/ml的浓度溶解于超纯水中,超声10min,得到载药羟乙基淀粉-聚乳酸纳米粒。该聚合物的接枝率为0.86,得到的纳米粒粒径为140nm。
实施例4
RES blockade策略联合羟乙基淀粉-聚乳酸纳米粒载药系统抗肿瘤效率考察:
利用小鼠H22肝癌模型考察了注射RES blockade羟乙基淀粉-聚乳酸纳米粒与注射载药羟乙基淀粉-聚乳酸纳米粒的最佳时间间隔,具体步骤如下:
在雄性BALB/c小鼠右后肢近腋下皮下接种小鼠肝癌H22细胞悬液1×105个细胞/100μL,建立小鼠肝癌H22皮下移植瘤小鼠模型。当皮下瘤体积为50-120mm3时,将小鼠随机分为4组,各组3只。其中一组单一尾静脉注射20μg/ml的包载了荧光染料(DiR)的羟乙基淀粉-聚乳酸纳米粒100ul,其它三组首先尾静脉注射400mg/kg用作RES blockade羟乙基淀粉-聚乳酸纳米粒,0.5h、1.5h、4h之后再分别注射20μg/ml包载荧光染料(DiR)的羟乙基淀粉-聚乳酸纳米粒100ul,再利用小动物活体成像检测:置于LuminaⅡ操作台近红外线进行活性检测,小鼠全程异氟烷麻醉,整个操作过程中操作台温度保持37℃。小动物成像实验表明注射RES blockade羟乙基淀粉-聚乳酸纳米粒与注射载药羟乙基淀粉-聚乳酸纳米粒的最佳时间间隔为1.5h,因为这样的注射间隔时间荧光染料在肿瘤部位的富集最多。
图4为本发明考察的注射RES blockade羟乙基淀粉-聚乳酸纳米粒与注射载药羟乙基淀粉-聚乳酸纳米粒的最佳时间间隔的小动物成像图。从附图4可知,RES blockade策略在三个时间点均能增加DiR在小鼠肿瘤部位的富集,减少DiR在RES系统的富集。其中,与0.5小时、4小时相比,1.5小时,DiR在肿瘤的富集量最多,在肝脏的富集量最少,与空白对照组相比,有显著性差异。这一结果表明,注射RES blockade羟乙基淀粉-聚乳酸纳米粒与注射载药羟乙基淀粉-聚乳酸纳米粒的最佳时间间隔为1.5h。
实施例5
RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的组织分布行为考察:
本发明建立了H22小鼠肝癌皮下瘤模型,考察了RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的组织分布行为,具体步骤如下:
在雄性BALB/c小鼠右后肢近腋下皮下接种小鼠肝癌H22细胞悬液1×105个细胞/100μL,建立小鼠肝癌H22皮下移植瘤小鼠模型。当皮下瘤体积为50-120mm3时,将小鼠随机分为3组,各组3只,分别经尾静脉注射给予游离阿霉素、包载阿霉素的羟乙基淀粉-聚乳酸纳米粒以及RESblockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗。其中RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的注射方法具体是:首先注射RES blockade羟乙基淀粉-聚乳酸纳米粒,1.5h后再注射包载阿霉素的羟乙基淀粉-聚乳酸纳米粒。治疗中阿霉素的剂量为4mg/kg,用作RES blockade羟乙基淀粉-聚乳酸纳米粒的给药剂量为400mg/kg。四组注射完成12h后处死小鼠,取出心、肝、脾、肺、肾、肿瘤,首先组织匀浆萃取组织中的阿霉素,然后通过高效液相色谱检测组织中的药物含量。组织分布实验表明RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的给药方式显著提高了阿霉素在肿瘤部位的聚集。
图5为本发明考察的RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的组织分布图。从附图5及表1可知,尾静脉羟注射12h后,阿霉素原料治疗组中相较于载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组以及RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组来说,通过静脉给药的方式,本发明制备的包载阿霉素的羟乙基淀粉偶联聚乳酸纳米粒可以显著的增加阿霉素在肿瘤部位的聚集。
表1
实施例6
RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒载药系统在体内的抗肿瘤效应考察:
本发明利用小鼠H22肝癌模型考察了RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒载药系统在体内的抗肿瘤效应,具体步骤如下:
在雄性BALB/c小鼠右后肢近腋下皮下接种小鼠肝癌H22细胞悬液1×105个细胞/100μL,建立小鼠肝癌H22皮下移植瘤小鼠模型。当皮下瘤体积为50-120mm3时,将小鼠随机分为4组,各组5只,分别经尾静脉注射给予生理盐水、游离阿霉素、包载阿霉素的羟乙基淀粉-聚乳酸纳米粒、RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗,RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的注射方法具体是:首先注射RES blockade羟乙基淀粉-聚乳酸纳米粒,1.5h后再注射包载阿霉素的羟乙基淀粉-聚乳酸纳米粒。治疗中阿霉素的剂量为4mg/kg,用作RES blockade羟乙基淀粉-聚乳酸纳米粒的给药剂量为400mg/kg。记第一天给药时间为第0天,再分别于第4、8天按上述剂量给药。自第0天起,每隔一天测量一次小鼠体重及皮下瘤体积,绘制瘤体积-时间曲线。在第12天处死小鼠,剥离皮下瘤称重。体内抗肿瘤活性实验表明RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的给药方式取得了良好的抗肿瘤效果。
图6为本发明考察的RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的肿瘤生长曲线图及肿瘤重量图。从附图6可知,与生理盐水组相比,阿霉素原料治疗组、载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组、RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的相对肿瘤体积都有明显的减少。治疗十二天之后,阿霉素原料治疗组的抑瘤率为59.4%、载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的抑瘤率为56.5%、RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的抑瘤率为86.8%。实验结果表明,与阿霉素原料药治疗组相比较,载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的抑瘤率相差不大,但是RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的抑瘤率明显提高。RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的抑瘤率是阿霉素原料药的1.5倍,与组织分布结果吻合。
实施例7
RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的安全性考察:
本发明建立了H22小鼠肝癌皮下瘤模型,考察了RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的安全性,具体步骤如下:
在雄性BALB/c小鼠右后肢近腋下皮下接种小鼠肝癌H22细胞悬液1×105个细胞/100μL,建立小鼠肝癌H22皮下移植瘤小鼠模型。当皮下瘤体积为50-120mm3时,将小鼠随机分为4组,各组4只,分别经尾静脉注射给予生理盐水、游离阿霉素、包载阿霉素的羟乙基淀粉-聚乳酸纳米粒以及RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗。其中RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的注射方法具体是:首先注射RES blockade羟乙基淀粉-聚乳酸纳米粒,1.5h后再注射包载阿霉素的羟乙基淀粉-聚乳酸纳米粒。治疗中阿霉素的剂量为4mg/kg,用作RES blockade羟乙基淀粉-聚乳酸纳米粒的给药剂量为400mg/kg。注射4小时后,从小鼠的眼眶静脉丛取血0.5mL,3500rmp离心10min,取血清100μL,用以测试生物指标肌酸激酶(CK)、总蛋白(TP)以及白蛋白(ALB)。生化指标实验数据表明RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的给药方式显著减少了阿霉素的心脏毒性以及肝毒性。
图7为本发明考察的RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的的生化指标(CK、ALB、TP)图。从图4可以看到,RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组、载阿霉素的羟乙基淀粉-聚乳酸纳米粒与生理盐水组相比,CK,ATP,ALP值基本一致,与阿霉素原料药相比,载阿霉素的羟乙基淀粉偶联聚乳酸纳米粒给药组具有更低的CK,ATP,ALP值,表明RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组能显著降低阿霉素的心脏及肝脏的毒副作用。
实施例8
本发明建立了H22小鼠肝癌皮下瘤模型,考察了RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的安全性,具体步骤如下:
在雄性BALB/c小鼠右后肢近腋下皮下接种小鼠肝癌H22细胞悬液1×105个细胞/100μL,建立小鼠肝癌H22皮下移植瘤小鼠模型。当皮下瘤体积为50-120mm3时,将小鼠随机分为4组,各组4只,分别经尾静脉注射给予生理盐水、游离阿霉素、包载阿霉素的羟乙基淀粉-聚乳酸纳米粒以及RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗。其中RES blockade羟乙基淀粉-聚乳酸纳米粒结合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒治疗组的注射方法具体是:首先注射RES blockade羟乙基淀粉-聚乳酸纳米粒,1.5h后再注射包载阿霉素的羟乙基淀粉-聚乳酸纳米粒。治疗中阿霉素的剂量为6mg/kg,用作RES blockade羟乙基淀粉-聚乳酸纳米粒的给药剂量为600mg/kg。注射4小时后,从小鼠的眼眶静脉丛取血0.5mL,3500rmp离心10min,取血清100μL,用以测试生物指标肌酸激酶(CK)、总蛋白(TP)以及白蛋白(ALB)。生化指标实验数据表明RES blockade策略联合包载阿霉素的羟乙基淀粉-聚乳酸纳米粒的给药方式显著减少了阿霉素的心脏毒性以及肝毒性。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!