一种治疗骨性关节炎的制剂及治疗方法与流程
本发明属于再生医学与骨病学领域,特别涉及一种治疗骨性关节炎的制剂及治疗方法。
背景技术:
骨关节炎(osteoarthritis, OA)是一种常见的以关节软骨退行性病变、继发性骨质增生为特征的慢性病。OA发病率高,尤其是中老年人群,50岁以上人群发病率超过50%,且OA的致残率高达53%,位居所有病种首位,危害程度甚于心脑血管疾病。目前我国患者约有1.5亿,WHO推测到2025年全球患者将超过8亿,已成为严重影响人类健康的重要疾病,并将每年10月12日定为世界关节炎日。
OA的治疗,依据病情轻重,主要包括物理疗法、药物治疗和手术治疗。这些常规的治疗方式,总体疗效并不理想,甚至存在远期副作用和并发症等系列问题。近些年来,针对严重的OA患者,自体或异体软骨组织块移植、自体软骨细胞移植等技术应用,有一定的疗效。但软骨细胞有限的生存时间、有限的供体来源、异体移植物免疫原性、引起关节纤维化并发症等问题。因此,就OA的治疗,目前尚无根治之良策,也是骨病学领域关注的重点课题。
干细胞的自我更新及在特定条件下分化成多种功能细胞,乃至组织器官的潜能,为组织器官损伤及一些疑难杂症的治疗带来了希望。干细胞主要包括胚胎干细胞、成体干细胞和诱导多能干细胞,基于伦理学问题和治疗风险,以骨髓间充质干细胞、脂肪间充质干细胞等成体干细胞,成为干细胞移植治疗的主要种子细胞资源。这些间充质干细胞均具有自我更新与多向分化能力的细胞,可以分化为骨、软骨、脂肪等多种组织,具有治疗OA的潜力。近来大量的研究表明,人羊膜间充质干细胞(human amniotic mesenchymal stem cells, hAMSCs)比骨髓间充质干细胞、脂肪间充质干细胞等成体干细胞有更强的扩增能力、分化能力,并呈低免疫原性,无致瘤风险和伦理学限制,以及可分泌免疫抑制因子和抗炎因子等优势,被认为是干细胞移植治疗的理想种子细胞 (肖建辉. 人羊膜干细胞:再生医学的理想种子细胞资源. 遵义医学院学报 2015, 38: 439~449)。我们实验室的前期研究提示,在一定条件下,hAMSCs呈现良好的成软骨细胞分化能力(宋秀军,陈代雄,方宁, 等. 人羊膜间充质干细胞具有分化成软骨及成骨细胞的潜能.中国组织工程研究, 2007, 11: 10056~10060),是移植治疗OA的理想种子细胞。然而,迄今尚未见利用hAMSCs移植治疗OA的报道。
透明质酸是一种由D-葡萄糖醛酸、N-乙酰氨基-D-葡萄糖,以-1,3糖苷键和-1,4糖苷键交接形成的非蛋白类直链高分子酸性粘多糖。也是细胞外基质主要结构成分。而细胞外基质决定细胞的形状、影响细胞的活力、迁移、增殖分化,并参与信号传递,透明质酸在其中扮演了重要角色,并在机体正常和病理状态下发挥多重生物学功能。而且,有研究组发现透明质酸能明显促进幼鼠颅盖骨祖细胞增殖和诱导分化成骨细胞的能力,它还被认为是构建软骨组织工程支架材料的重要元素。譬如,把透明质酸加入到壳聚糖支架材料中,能明显增进种子细胞粘附能力和软骨基质生成;透明质酸作为胶原支架材料中,极显著促进SOX-9、II型胶原蛋白以及软骨基质生成。
技术实现要素:
针对现有骨性关节炎治疗方法的不足,本发明的目的在于提供一种安全、高效的hAMSCs联合透明质酸移植治疗骨性关节炎的制剂及治疗方法。
一种治疗骨性关节炎的制剂,该制剂的制备方法为:将健康足月剖宫产新鲜胎盘钝性机械剥离羊膜,用含1%双抗的D-Hank’s液反复冲洗羊膜,除去残留血渍和表面粘液后,将羊膜剪成1~3 cm2大小,分装于50 mL离心管内,加入约羊膜组织2倍体积的含0.02% EDTA-2Na 的0.05% 胰蛋白酶消化液,于35~37℃恒温水浴箱中,150~185 rpm旋转消化约30 min,经300目不锈钢滤网过滤后,弃去含有羊膜上皮细胞的消化液,重新加入新鲜的含0.02% EDTA-2Na 的0.05% 胰蛋白酶消化液,重复消化一次,再次经300目不锈钢滤网过滤后,弃去消化液;经上述胰蛋白酶消化后剩余的羊膜组织用含1% 双抗的D-Hank’s液清洗一次,除去残留的胰蛋白酶消化液,加入含0.05 mg/mL DNase I的 0.5 mg/mL II型胶原酶消化液,于35~37℃恒温水浴箱中,150~185 rpm旋转消化1~2 h,直至剩余的羊膜组织碎片完全消化成絮状,经300目不锈钢网过滤,收集细胞滤液;1500rpm,4℃离心10 min,弃上清,细胞沉淀即为hAMSCs;用含10%胎牛血清的低糖DMEM重悬细胞,种于T25细胞培养瓶,在35~37℃,含1~10% CO2及85~100%空气饱和湿度恒温培养,待细胞融合度达80%以上进行传代培养;将人羊膜间充质干细胞与0.01~2mg/mL透明质酸溶液混匀,细胞密度1×106 ~1×109个/mL,即得治疗骨性关节炎的细胞制剂。
所述用于治疗的hAMSCs为2~5代。
所述透明质酸的分子量为20~2200KD。
采用上述制剂治疗骨性关节炎的方法为:采用局部注射hAMSCs细胞制剂0.01~1mL到骨性关节炎哺乳动物模型的关节腔内,每3~5周进行局部注射等量的hAMSCs悬液,连续2~5次。
所述hAMSCs联合透明质酸用于治疗骨性关节炎,也包括在其中加入药学上可接受的载体。
本发明基于hAMSCs和透明质酸的良好特性,首次建立了hAMSCs联合透明质酸移植治疗骨性关节炎的制剂,并有显著疗效,可为广大患者减轻病疼。
附图说明
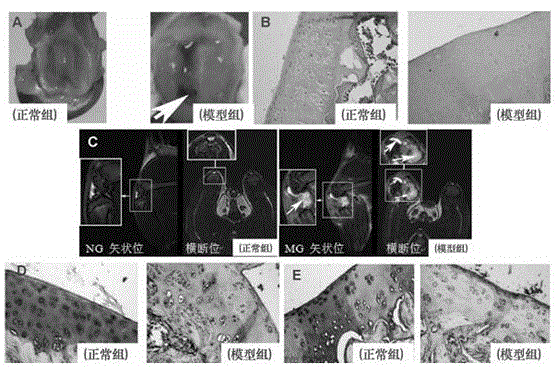
图1为正常SD大鼠动物关节软骨与骨性关节炎SD大鼠模型的大体观察(A)、组织病理变化(B)、核磁共振成像(C)、糖胺聚糖分布(D)及II型胶原蛋白表达(E)(×200);
图2为人羊膜间充质干细胞标记超顺磁氧化铁前后的形态特征(×200);
图3为人羊膜间充质干细胞与透明质酸联用治疗骨性关节炎SD大鼠模型的疗效,(A)切开关节囊后的大体观察(×200),(B)核磁共振成像;
图4为人羊膜间充质干细胞与透明质酸联用治疗骨性关节炎SD大鼠模型后的病理组织HE染色形态特征(×200);
图5为人羊膜间充质干细胞与透明质酸联用治疗骨性关节炎SD大鼠模型后软骨组织的糖胺聚糖分布检测(×200);
图6为人羊膜间充质干细胞与透明质酸联用治疗骨性关节炎SD大鼠模型后软骨组织的II型胶原蛋白的表达分析(×200);
图7为人羊膜间充质干细胞与透明质酸联用治疗骨性关节炎SD大鼠模型后软骨Col2α1基因表达情况
图8 为人羊膜间充质干细胞与透明质酸联用治疗骨性关节炎SD大鼠模型后血浆及滑液中炎性因子(A)、抗炎因子及骨保护素(B)的表达情况。
具体实施方式
本发明通过如下实施例和附图作进一步说明,但本发明的实施方式不限于此。
实施例1:人羊膜间充质干细胞联合透明质酸治疗骨性关节炎制剂的制备方法及应用
1、人羊膜间充质干细胞的分离培养
健康足月剖宫产新鲜胎盘钝性机械剥离羊膜,用含1%双抗的D-Hank’s液(终浓度为青霉素:100 IU/mL,链霉素:100 IU/mL,临用前新鲜配制)反复冲洗羊膜,除去残留血渍和表面粘液后。将羊膜剪成1~3 cm2大小,分装于50 mL离心管内,加入约羊膜组织2倍体积的含0.02% EDTA-2Na 的0.05% 胰蛋白酶消化液,于35~37℃恒温水浴箱中,150~185 rpm旋转消化约30 min,经300目不锈钢滤网过滤后,弃去含有羊膜上皮细胞的消化液,重新加入新鲜的含0.02% EDTA-2Na 的0.05% 胰蛋白酶消化液,重复消化一次,再次经300目不锈钢滤网过滤后,弃去消化液。经上述胰蛋白酶消化后剩余的羊膜组织用含1% 双抗的D-Hank’s液清洗一次,除去残留的胰蛋白酶消化液,加入含0.05 mg/mL DNase I的 0.5 mg/mL II型胶原酶消化液,于35~37℃恒温水浴箱中,150~185 rpm旋转消化1~2 h,直至剩余的羊膜组织碎片完全消化成絮状,经300目不锈钢网过滤,收集细胞滤液(即消化液),1500 rpm,4℃离心10 min,弃上清,细胞沉淀即为hAMSCs。用含10%胎牛血清的低糖DMEM重悬细胞,种于T25细胞培养瓶,在35~37℃,含1~10% CO2及85~100%空气饱和湿度恒温培养,待细胞融合度达80%以上进行传代培养,收集第2~5代用于实验。
2、骨性关节炎模型的制备
SPF级SD大鼠,鼠龄13~14周,体重:220 ± 24g,腹腔注射6%水合氯醛(0.5mL/100g体重)麻醉。电动剃须刀剔除右后肢膝关节处的被毛,75%消毒酒精对膝关节常规消毒,关节腔内注射(穿过髌韧带)20g/L碘乙酸钠100μL。正常组予以等量生理盐水,造模2周后,正常组与模型组随机取2~3只,进行核磁共振(MRI)检查膝关节部位,并在膝关节股骨和胫骨上下约1 cm切开关节囊,进行大体观察;对关节软骨组织进行HE、甲苯胺蓝及免疫组织化学染色;模型大鼠表现为关节注射部位肿胀、炎症、关节积液、HE染色细胞排列紊乱、潮线模糊,甲苯胺蓝淡染或失染、II型胶原表达与否等指标中的一项或多项发生(图1A-E)。
3、超顺磁氧化铁(SPIO)标记hAMSCs
为方便检查治疗效果,采用SPIO标记了hAMSCs。即收集拟用于治疗的hAMSCs前(细胞生长融合度70~80%),倾弃培养基,加入D-PBS清洗3次,吸净残留D-PBS后,加入无FBS的LG-DMEM培养基现配制的Fe3+浓度为25μg/mL 的SPIO溶液,置于37℃, 5% CO2,85~100%空气饱和湿度的培养箱中孵育18 h,进行标记,普鲁士蓝染色后可见细胞中蓝色的铁颗粒(图2)。然后,消化、洗涤、收集hAMSCs,用D-PBS配制的细胞悬液(细胞密度1×106 ~1×109个/mL)。
4、动物分组与hAMSCs联合透明质酸移植治疗
动物分为正常对照组(NG)、模型组(MG)、透明质酸治疗组(HA)、hAMSCs治疗组(hAMSCs), hAMSCs+透明质酸联用治疗组(CG),每组12只。D-PBS配制的细胞悬液中加入0.01~2mg/mL透明质酸溶液,混匀。透明质酸的分子量为20~2200KD。hAMSCs联合透明质酸用于治疗骨性关节炎,也包括在其中加入药学上可接受的载体。
在病发部位关节腔进行局部注射治疗,并在首次治疗后的第3~5周进行第2次注射治疗。
5、hAMSCs联合透明质酸移植治疗骨性关节炎效果评价
(1)大体观察、影像学检查及组织病理变化
治疗后8 周,解剖开膝关节部位,大体观察显示,与MG组对比,HA组无明显修复效果;hAMSCs组显示出一定的修复效果;而CG组损伤软骨修复效果显著(图3A)
图3B核磁共振成像结果提示,在治疗后第8周,模型组(MG)关节软骨组织主要呈现明显的高信号,表明出现炎症。而在关节腔内软骨损伤组织处,HA组和hAMSCs,尤其是CG组的信号明显偏弱,提示hAMSCs已迁移至软骨损伤部位。
病理组织HE染色结果提示,在受损的关节软骨组织中,MG组已观察不到明显的细胞形态,损伤已达软骨下骨处;HA组和hAMSCs组发现有少量软骨细胞;CG组软骨组织,细胞排列整齐,潮线清晰(图4),提示其对软骨修复效果好。
(2)糖胺聚糖和II型胶原的表达
利用甲苯胺蓝检测软骨组织糖胺聚糖分泌情况,结果提示,MG组失染,HA组和hAMSCs组淡染,NG组和GC组浓染,表明两组糖胺聚糖表达量较多(图5),提示GC组对软骨组织的修复有良好的作用。
II型胶原蛋白检测如图6免疫组化结果所示,模型组(MG)的II型胶原蛋白呈阴性,HA组和hAMSCs组II型胶原蛋白表达较低,正常组(NG)和联用组(CG)II型胶原蛋白呈强阳性,提示GC组对软骨组织的修复有良好的作用。
(3)软骨Col2α1基因的表达情况
HA组和hAMSCs组Col2α1的表达量虽然略微高于MG组,而CG组的Col2α1的表达量明显高于MG组(图7),提示HA和hAMSCs联用具有良好的损伤修复效果。
(4)炎性因子、抗炎因子及OPG的表达情况
图8的提示,与MG组相比,HA组、hAMSCs组及CG组血浆和滑液中促炎因子TNF-α、IL-6及IL-1β表达水均有所下调,其中CG组下调效果最为明显。相反,与MG组相比,HA组、hAMSCs组及CG组血浆和滑液中OPG和抗炎因子IL-4、IL-10表达水平均有所上调,其中CG组上调效果最为明显。因此,单独使用透明质酸、hAMSCs以及二者联用都可调节炎症因子的表达,减轻炎症反应,促进OPG的分泌,尤其是联用后抗炎效果显著。
实施例2.人羊膜间充质干细胞和透明质酸联用在其它方面的用途
如上述结果所述,人羊膜间充质干细胞和透明质酸联用,能明显增强与软骨组织密切相关的糖胺聚糖、II型胶原蛋白的表达,以及有利于人羊膜间充质干细胞在骨性关节炎模型病变部位存活定植和分化成新的软骨细胞,其对软骨损伤均有良好的防治作用。而且,人羊膜间充质干细胞和透明质酸联用,用于异种SD大鼠骨性关节炎治疗,亦不发生免疫排斥反应。
实施例3.将人羊膜间充质干细胞和0.01~2mg/mL透明质酸溶液混匀,细胞密度1×106 ~1×109个/mL,可作为治疗骨性关节炎和软骨损伤用于注射的细胞制剂。也可在该制剂中加入药学上可接受的载体,如促软骨修复的生长因子等。
- 还没有人留言评论。精彩留言会获得点赞!