一种提高人参散剂药效的炮制方法及其产品和用途与流程
本发明涉及一种人参的炮制方法,特别涉及一种能够提高人参散剂预防和治疗冠状动脉硬化及相关高血脂疾病的炮制方法,以及该散剂在治疗冠状动脉硬化及相关高血脂疾病方面的应用。本发明属于药材加工领域。
背景技术:
人参为五加科人参属草本植物人参(panaxginsengc.a.meyer)的干燥根,多于秋季采挖洗净经晒干或烘干。被誉为“百草之王”,是闻名世界的珍贵保健品。人参的主要成分有多种人参皂苷,人参多糖,挥发油,多种氨基酸,肽类及多种维生素等。大量研究表明,人参的主要药用活性成分人参皂苷,具有抗肿瘤,抗疲劳,抗衰老,抗休克,抗病毒和抗炎症,抗感染,抗组织损伤,抗神经细胞凋亡,治疗老年痴呆,改善心脏等功效,还可以用于降血糖降血脂,增强机体适应性来达到治疗冠状动脉硬化等高血脂疾病的作用。
人参作为一种名贵中药材,常被加工成颗粒很细的散剂,不仅容易周转和保存,而且具有极好的可分散性、可混合性及可吸收性。常规的炮制方法主要是取干人参直接碾细制散剂。该方法工艺简单、易于操作,但不温和,容易造成有效物质的流失,且一些有害物质如农残和重金属等有害物质也易残留,对人体有着潜在的危害,同时生产周期较长。有必要开发一种具有针对性的人参散剂炮制方法,既保留所有天然活性物质,又能减少有害物质的残留,提高质量和效率。
加入vc、vc钠、vc磷酸酯、茶多酚等天然抗氧化剂作为保护剂,可减少鲜人参炮制过程中发生氧化反应,还无毒无害。选用酶对人参进行预处理,能分解构成细胞壁的纤维素、糖苷键及果胶,从而破坏细胞壁的结构,产生局部的坍塌、溶解、疏松,去除来自细胞壁和细胞间质的阻力,加快有效成分溶出细胞的速率;采用酶解法提取,还能提高后续工艺中干燥的效率。采用超微破碎技术加工制备人参散剂,其颗粒达到超细粉末的水平,比表面积显著增强,药物在胃肠道里的溶解度明显增加,加快了药物起效时间。此外,由于超微粒的粘附性及小的粒径,有利于延长局部用药的滞留时间以及药物与肠壁接触的时间,加大接触面积,进而提高药物口服吸收的生物利用度。
近年来,微波技术的应用以其穿透力强、选择性好、加热效率高等特点得到很大发展。微波辐射可以大大加快反应速度,反应时间以分、秒计。在真空状态下,水的沸点相应降低,真空不仅能使产品保持低温,还能产生压力梯度提高干燥速率。在低温条件下操作,也可以减少相关挥发油的丧失,不会影响其药理作用和气味。低温微波真空炮制作为一种新型干燥技术兼备了微波加热和真空干燥的诸多优点,具有干燥速度快、干燥效率高、干燥均匀和干燥质量好等特点,同时还具杀菌功能,不但可以保证质量,还能大幅降低生产成本,具有广泛的应用前景。
技术实现要素:
本发明针对常规炮制方法的不足,根据人参的生物学特性,提供了一种能够提高人参散剂预防和治疗冠状动脉硬化及相关高血脂疾病药效的炮制方法,以及该散剂在治疗冠状动脉硬化及相关高血脂疾病方面的应用。
为了达到上述目的本发明采用了以下技术手段:
本发明的一种人参散剂的炮制方法,包括以下步骤:
(1)清洗:
将采挖到的新鲜人参根,洗净沥干后切碎;
(2)加复合抗氧化保护剂:
向切碎的鲜人参颗粒中加入由vc、vc钠、vc磷酸酯以及茶多酚所组成的复合抗氧化保护剂;
(3)粗破碎:
将含有复合抗氧化保护剂的鲜人参颗粒用破碎机再作粗破碎处理,备用;
(4)酶解:
按照料液比1:10-15的比例向步骤(3)得到的鲜人参粗颗粒中加入纯水,然后加入鲜人参粗颗粒重量2%~8%的复合酶进行酶解,所述复合酶由纤维素酶、淀粉酶以及果胶裂解酶组成;
(5)超微破碎:
将步骤(4)酶解后的浆料置于微波破碎仪中进行超微破碎,制得300-500目的浆料;
(6)低温微波真空干燥:
对步骤(5)中超微破碎后的浆料进行低温微波真空干燥,制得无菌人参干燥超微粉,备用;
(7)精细粉碎:
将步骤(6)制得的人参干燥超微粉作进一步精细粉碎处理,过800~1000目筛,得人参散剂粉,备用。
在本发明中,优选的,步骤(2)中所述的复合抗氧化保护剂由vc、vc钠、vc磷酸酯以及茶多酚按照重量比为1~10:1~10:1~10:1~10组成。更优选的,vc、vc钠、vc磷酸酯以及茶多酚的重量比为1.5:2:2.5:3。
在本发明中,优选的,步骤(2)中所加入的复合抗氧化保护剂的量为鲜人参颗粒重量的0.3-1.0%。更优选的,所加入的复合抗氧化保护剂的量为鲜人参颗粒重量的0.6%。
在本发明中,优选的,步骤(4)中所述的酶解按照以下方法进行:按照料液比1:14的比例向得到的鲜人参粗颗粒中加入纯水,然后加入鲜人参粗颗粒重量5%的复合酶,调节ph为4.8~5.8,于45~65℃水浴中酶解2.5~4.5h。
在本发明中,优选的,步骤(4)中所述的复合酶是由纤维素酶、淀粉酶以及果胶裂解酶按照重量比为1~4:1~4:1~2组成,更优选的,纤维素酶、淀粉酶以及果胶裂解酶按照重量比为3.5:2:3.5。
在本发明中,优选的,步骤(5)中所述的超微破碎是将步骤(4)酶解后的浆料置于微波破碎仪中,在输出频率2450mhz,功率750~800w,预处理时间80s,后持续250~350s的条件下处理,制得300-500目的浆料。
在本发明中,优选的,步骤(6)中所述的低温微波真空干燥是在微波功率0.6~3.5kw,压力100~150pa,温度60~80℃的条件下对步骤(5)中超微破碎后的浆料进行低温微波真空干燥,制得无菌人参干燥超微粉,备用。
在本发明中,优选的,还包括将得到的人参散剂粉与其他散剂混合制成复散剂,或根据用药需要,制成溶液散、煮散、吹散、内服散或外用散。
为了说明本发明的人参散剂的药效,本发明对制备得到的人参散剂的药物效应动力学进行了研究:本发明成功建立了大鼠实验性混合型高脂血症模型,对本发明制备的人参散剂i及用传统方法制备的人参散剂ii的降血脂药效学进行了系统研究。研究结果发现,两者均能降低血清中tc和tg水平,并能显著降低ldl-c水平和升高hdl-c水平,但人参散剂i高剂量组效果远好于人参散剂ii高剂量组,表明本发明的人参散剂i具有更显著的调脂作用。
本发明成功建立大鼠药代动力学模型,较系统的研究了人参散剂i和人参散剂ii对人参皂苷rg1体内过程的作用。结果发现,人参散剂i的峰浓度cmax较人参散剂ii的显著增大;与人参散剂ii相比,人参散剂i有效成分在体内的平均滞留时间(mrt)有一定程度的增加,血药浓度-时间曲线也体现出达峰时间的后移。通过本发明方法制备的人参散剂i与传统方法制备的人参散剂ii相比,生物利用度显著提高。
对人参散剂的疗效作临床学验证。对具有可对比性的人参散剂i较人参散剂ii患者的高密度脂蛋白胆固醇(hdl-c)、低密度脂蛋白胆固醇(ldl-c)、总胆固醇(tc)以及甘油三酯(tg)的浓度的调节作用更显著。说明本发明制备的人参散剂i对冠状动脉硬化高脂血症患者的治疗效果远好于传统方法制备的人参散剂ii的治疗效果,且发生不良反应的几率更少。
因此,进一步的,本发明还提出了按照以上任一项所述的炮制方法制备得到的人参散剂。以及所述的人参散剂在制备治疗冠状动脉硬化及相关高血脂疾药物中的用途。
综上,本发明从中医药理论实际出发,通过对现代中药炮制方法进行创新,提出了一种能够提高人参散剂预防和治疗冠状动脉硬化及相关高血脂疾病药效的炮制方法,炮制的主要工艺包括将新鲜人参直接切碎后,加保护剂破碎、酶解、超微破碎、微波真空干燥后再粉碎的方法。该方法操作简便、生产周期短,还能增加活性物质的溶出、减少有效成分的散失,提高了生物利用度;同时色泽均匀,气味良好,且无菌,易受欢迎。运用现代药理学方法,建立药物效应动力学和药物代谢动力学模型,且在临床进行验证,对人参治疗冠状动脉硬化及相关高血脂疾病的药效学和代谢学进行了较系统的研究,证明本发明方法制备的人参散剂i的生物利用度更高,对降血脂具有更好的药效和疗效。
相较于现有技术,本发明的有益效果在于:
1、本发明采用新鲜人参进行加工,可以保证制备的人参散剂具有良好的色泽和气味,表面灰黄,断面处均呈黄白色,气微,伴青草香,味甘微苦;
2、加入vc、vc钠、vc磷酸酯、茶多酚等天然复合抗氧化剂作为保护剂,可减少鲜人参炮制过程中发生氧化反应,并且无毒无害;
3、选用酶对人参进行预处理,能分解构成细胞壁的纤维素、糖苷键及果胶,从而破坏细胞壁的结构,产生局部的坍塌、溶解、疏松,去除来自细胞壁和细胞间质的阻力,加快有效成分溶出细胞的速率;采用酶解法提取,还能提高后续工艺中干燥的效率;
4、采用超微破碎技术加工制备人参散剂,其颗粒达到超细粉末的水平,比表面积显著增强,药物在胃肠道里的溶解度明显增加,加快了药物起效时间。此外,由于超微粒的粘附性及小的粒径,有利于延长局部用药的滞留时间以及药物与肠壁接触的时间,加大接触面积,进而提高药物口服吸收的生物利用度;
5、采用低温微波真空干燥技术加工制备人参散剂,在真空状态下,水的沸点相应降低,真空不仅能使产品保持低温,还能产生压力梯度提高干燥速率。在低温条件下操作,也可以减少相关挥发油的丧失,不会影响其药理作用和气味。并且具有干燥速度快、干燥效率高、干燥均匀和干燥质量好等特点,同时还具杀菌功能,不但可以保证质量,还能大幅降低生产成本。
附图说明
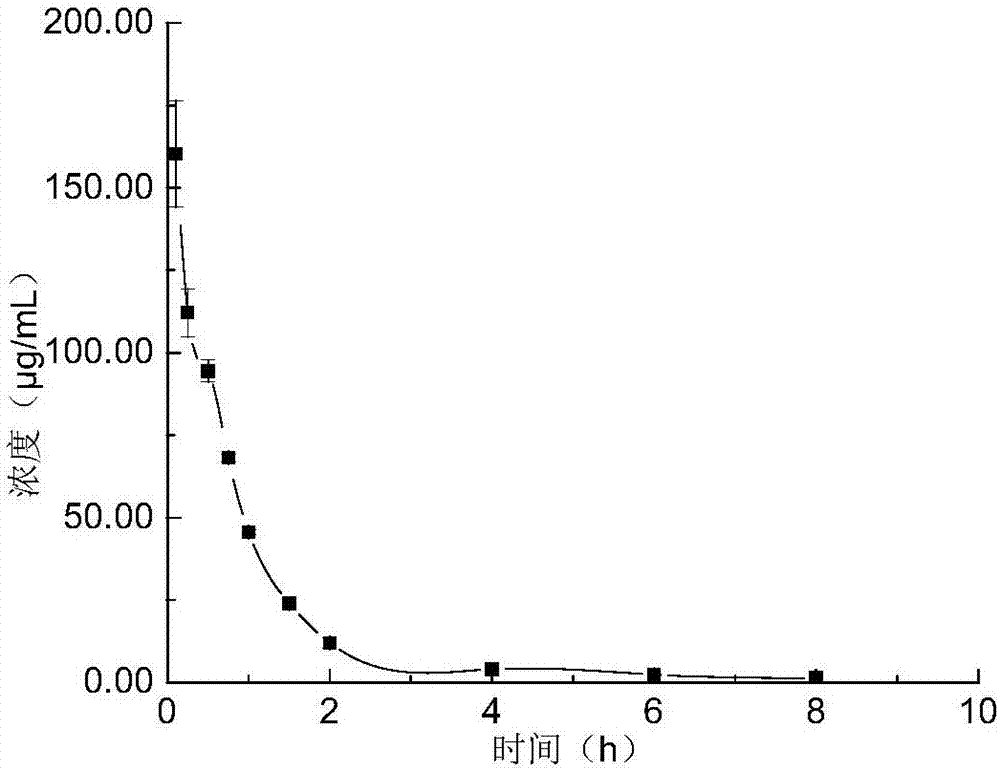
图1为不同时间内有效成分含量的变化;
图2为大鼠静脉注射rg1原液后的血药浓度-时间曲线;
图3为大鼠口服人参散剂i或人参散剂ii后的人参皂苷rg1血药浓度-时间曲线。
具体实施方法
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1人参散剂的炮制
(1)清洗:
将采挖到的新鲜人参根,洗净沥干后切碎;
(2)加入复合抗氧化保护剂:
向切碎的鲜人参颗粒中加入其重量0.6%的由vc、vc钠、vc磷酸酯以及茶多酚所组成的复合抗氧化保护剂;所述的复合抗氧化保护剂由vc、vc钠、vc磷酸酯以及茶多酚按照重量比为1.5:2:2.5:3组成;
(3)粗破碎:
将含有复合抗氧化保护剂的鲜人参颗粒用破碎机再作粗破碎处理,备用;
(4)酶解:
按照料液比1:14的比例向步骤(3)得到的鲜人参粗颗粒中加入纯水,然后加入鲜人参粗颗粒重量5%的复合酶进行酶解,所述的复合酶是由纤维素酶、淀粉酶以及果胶裂解酶按照重量比为3.5:2:3.5组成,调节ph为5.0,于50℃水浴中酶解3h;
(5)超微破碎:
将步骤(4)酶解后的浆料置于微波破碎仪中,在输出频率2450mhz,功率750w,预处理时间80s,后持续300s的条件下进行超微破碎处理,制得400目的浆料;
(6)低温微波真空干燥:
在微波功率2.5kw,压力150pa,温度70℃的条件下对步骤(5)中超微破碎后的浆料进行低温微波真空干燥,制得无菌人参干燥超微粉,备用。
(7)精细粉碎:
将步骤(6)制得的人参干燥超微粉作进一步精细粉碎处理,过800目筛,得人参散剂粉,备用。
还可将得到的人参散剂粉与其他散剂混合制成复散剂,或根据用药需要,制成溶液散、煮散、吹散、内服散或外用散。
实施例2人参散剂的炮制
(1)清洗:
将采挖到的新鲜人参根,洗净沥干后切碎;
(2)加入复合抗氧化保护剂:
向切碎的鲜人参颗粒中加入其重量0.8%的由vc、vc钠、vc磷酸酯以及茶多酚所组成的复合抗氧化保护剂;所述的复合抗氧化保护剂由vc、vc钠、vc磷酸酯以及茶多酚按照重量比为2:4:3:3组成;
(3)粗破碎:
将含有复合抗氧化保护剂的鲜人参颗粒用破碎机再作粗破碎处理,备用;
(4)酶解:
按照料液比1:12的比例向步骤(3)得到的鲜人参粗颗粒中加入纯水,然后加入鲜人参粗颗粒重量8%的复合酶进行酶解,所述的复合酶是由纤维素酶、淀粉酶以及果胶裂解酶按照重量比为2:1:2组成,调节ph为5.0,于55℃水浴中酶解2.5h;
(5)超微破碎:
将步骤(4)酶解后的浆料置于微波破碎仪中,在输出频率2450mhz,功率800w,预处理时间80s,后持续250s的条件下进行超微破碎处理,制得400目的浆料;
(6)低温微波真空干燥:
在微波功率1kw,压力100pa,温度65℃的条件下对步骤(5)中超微破碎后的浆料进行低温微波真空干燥,制得无菌人参干燥超微粉,备用。
(7)精细粉碎:
将步骤(6)制得的人参干燥超微粉作进一步精细粉碎处理,过800目筛,得人参散剂粉,备用。
还可将得到的人参散剂粉与其他散剂混合制成复散剂,或根据用药需要,制成溶液散、煮散、吹散、内服散或外用散。
实施例3人参散剂的炮制
(1)清洗:
将采挖到的新鲜人参根,洗净沥干后切碎;
(2)加入复合抗氧化保护剂:
向切碎的鲜人参颗粒中加入其重量1.0%的由vc、vc钠、vc磷酸酯以及茶多酚所组成的复合抗氧化保护剂;所述的复合抗氧化保护剂由vc、vc钠、vc磷酸酯以及茶多酚按照重量比为2:5:4:4组成;
(3)粗破碎:
将含有复合抗氧化保护剂的鲜人参颗粒用破碎机再作粗破碎处理,备用;
(4)酶解:
按照料液比1:10的比例向步骤(3)得到的鲜人参粗颗粒中加入纯水,然后加入鲜人参粗颗粒重量8%的复合酶进行酶解,所述的复合酶是由纤维素酶、淀粉酶以及果胶裂解酶按照重量比为3:1:2组成,调节ph为5.0,于65℃水浴中酶解3h;
(5)超微破碎:
将步骤(4)酶解后的浆料置于微波破碎仪中,在输出频率2450mhz,功率800w,预处理时间80s,后持续350s的条件下进行超微破碎处理,制得400目的浆料;
(6)低温微波真空干燥:
在微波功率3.0kw,压力150pa,温度70℃的条件下对步骤(5)中超微破碎后的浆料进行低温微波真空干燥,制得无菌人参干燥超微粉,备用。
(7)精细粉碎:
将步骤(6)制得的人参干燥超微粉作进一步精细粉碎处理,过800目筛,得人参散剂粉,备用。
还可将得到的人参散剂粉与其他散剂混合制成复散剂,或根据用药需要,制成溶液散、煮散、吹散、内服散或外用散。
实验例1抗氧化保护剂的保护效果
1、方法
取清洗、切碎完毕的鲜人参碎块适量,均匀分为两组,实验组和对照组。向实验组的人参碎块中加入其重量0.6%的由vc、vc钠、vc磷酸酯、茶多酚按照重量比为1.5:2:2.5:3组成的复合抗氧化保护剂,并使其与人参碎块混合均匀;对照组则不加抗氧化保护剂。每隔5d对实验组和对照组进行取样观察,并测定皂苷和挥发油含量。
2、结果分析
观察发现,初始阶段,实验组和对照组无明显差别,味甘微苦,表面灰黄,断面处均呈黄白色,气微,伴青草香;但当放置10d后,对照组出现发霉迹象,实验组无变化;当放置15d后,对照组有明显的霉点出现,断面处发黑并有霉味产生,而实验组虽有轻微变化,但不明显。
如图1所示,与对照组相比,实验组的皂苷和挥发油含量均保持基本平稳的水平,而对照组的皂苷含量上下波动呈不稳定状态,挥发油水平急剧下降,表明抗氧化剂对鲜人参中溢出的皂苷和挥发油有一定的保护作用,能使活性成分保持较稳定状态。随着时间的延长,可能受到鲜人参发霉的影响,测得的对照组总皂苷含量在波动的同时还呈现下降的趋势,挥发油成分则基本散失,与感官质量评价结果一致。而实验组的总皂苷和挥发油含量虽然也有一定程度的降低,但不明显。由以上结果可知,本发明在制备人参散剂过程中添加复合抗氧化剂是可行的,并且与不添加抗氧化剂的对照组相比,具有更好的感官质量和更明显的活性成分的保护作用。
实验例2本发明的人参散剂的整体动物药效学实验
1、实验分组
人参散剂i组:采用本发明实施例1方法制备的人参干燥散剂。
人参散剂ii组:采用传统方法制备的人参干燥散剂。
2、实验仪器安捷伦1200高效液相色谱仪。
3、实验试剂
总胆固醇(tc)生化试剂盒、甘油三酯(tg)生化试剂盒、高密度脂蛋白胆固醇(hdl-c)生化试剂盒、低密度脂蛋白胆固醇(ldl-c)试剂盒生化试剂盒,作血脂检测用。
人参皂苷rgl(批号:110703-201530)对照品,购于中国药品生物制品检定所,供含量测定用。
4、实验方法
参照卫生部《保健食品检验与评价技术规范》(2012版)中辅助降血脂功能评价方法进行。采用混合型高脂血症动物模型。购买体重为180-220g的雄性大鼠60只,适应性饲养一周后,按体重随机分为2组:正常对照组(10只)、高脂模型对照组(50只)。正常对照组喂饲普通饲料,造模组大鼠喂饲高脂饲料,10d后,称重,采血并尽快分离血清,测定血清tc、tg水平。根据血脂水平和体重将造模组大鼠随机分成5组,即模型对照组、人参散剂i低、高(0.5、1.0g·kg-1)剂量组和人参散剂ii低、高(0.5、1.0g·kg-1)剂量组,每组各10只。正常对照组和模型对照组给予0.5%的吐温-80溶液,给药组给予相应的受试样品,每天1次,实验期间除正常对照组喂养基础饲料外,其他组大鼠均喂饲高脂饲料,自由摄食和饮水。
30天后做最后一次给药,并于次日大鼠不禁食采血,分离上层血清。将各组大鼠血清按照每种试剂盒的说明书规范操作,检测血清中甘油三脂(tg)、总胆固醇(tc)、高密度脂蛋白胆固醇(hdl-c)、低密度脂蛋白胆固醇(ldl-c)。
造模结束后,与正常对照组相比,造模组大鼠的体重均显著增加,说明喂饲高脂饲料会导致大鼠体重显著增加。给药结束后,与模型对照组相比,人参散剂i低、高剂量组和人参散剂ii低、高剂量组大鼠的体重均有一定程度的降低,表明人参散剂在对抗高脂血症大鼠体重异常增长方面有作用。
5、实验结果
人参散剂i和人参散剂ii对大鼠血脂水平的影响如表1所示:
表1人参散剂i和人参散剂ii对大鼠血脂水平的影响(n=10,
注:和模型对照组相比,*p<0.05,**p<0.01;△p<0.05,△△p<0.01。
如表1中所示,与正常对照组相比,模型对照组大鼠血清的总胆固醇(tc)、甘油三酯(tg)、低密度脂蛋白胆固醇(ldl-c)含量均有显著升高,血清高密度脂蛋白胆固醇(hdl-c)含量显著降低,表明大鼠实验性混合型高脂血症模型建立成功。与模型对照组相比,人参散剂i低剂量组及人参散剂ii高剂量组大鼠的血清总胆固醇(tc)和血清甘油三酯(tg)水平均有显著降低,人参散剂i高剂量组的tc和tg水平极显著性降低;与模型对照组相比,人参散剂i低、高两个剂量组及人参散剂ii低、高两个剂量组的ldl-c水平均有降低,人参散剂i高剂量组的血清hdl-c和ldl-c均表现极显著差异。与人参散剂ii低剂量组相比,人参散剂i低剂量组的ldl-c含量更低;与人参散剂ii高剂量组相比,人参散剂i高剂量组的hdl-c含量显著升高。由以上结果可知,本发明方法制备的人参散剂i各剂量组较传统方法制备的人参散剂ii各剂量组在降低血清tc、tg水平上作用更明显,而在升高血清hdl-c和降低血清ldl-c水平上,本发明制备的人参散剂i高剂量组效果远好于传统方法制备的人参散剂ii高剂量组。
实验例3本发明的人参散剂的临床验证
1、一般资料
选择2015年10月至2016年2月期间在某院接受治疗的186例冠状动脉硬化患者,随机分为两组,实验组和对照组,每组93人。其中实验组患者运用人参散剂i(采用本发明实施例1方法制备的人参干燥散剂)治疗,对照组患者运用人参散剂ii(采用传统方法制备的人参干燥散剂)治疗。所有患者均符合世界卫生组织对于冠状动脉硬化高脂血症的诊断标准。
实验组中男性患者54人,女性患者39人,年龄52~75岁,平均年龄为(53.26±11.57)岁,病程为9个月~11年,平均病程为(7.52±1.35)年。对照组中男性患者52人,女性患者41人,年龄51~74岁,平均年龄为(54.48±13.64)岁,病程为8个月~11年,平均病程为(7.42±1.33)年。经过统计学分析后可知两组治疗方法对应患者的年龄、性别、平均病程以及病变程度等一般资料均不存在统计学差异(p<0.05),认为两组病例选择对象上具有可比性。
2、治疗方法
对于两组冠心病患者分别给予两种人参散剂进行治疗观察,实验组每次口服人参散剂i,对照组则口服人参散剂ii;两组每次服药量均为3g,每天2次,两组患者的疗程均为4个月。在治疗前和治疗后的12h内做血常规,血糖及血脂检查,并记录不良反应表现。测定高密度脂蛋白胆固醇(hdl-c)、低密度脂蛋白胆固醇(ldl-c)、总胆固醇(tc)和甘油三酯(tg)的浓度。
3、实验结果
对两组冠状动脉硬化高脂血症患者进行治疗前与治疗后的观察,对两组患者的高密度脂蛋白胆固醇(hdl-c)、低密度脂蛋白胆固醇(ldl-c)、总胆固醇(tc)以及甘油三酯(tg)的浓度进行对比。
表2冠心病高脂血症患者血脂水平对比
注:治疗前后对比,*p<0.05,**p<0.01;治疗后两组对比,#p<0.05,##p<0.01。
结果如表2所示,两组患者低密度脂蛋白胆固醇(ldl-c)、总胆固醇(tc)以及甘油三酯(tg)的浓度都有显著降低,高密度脂蛋白胆固醇(hdl-c)显著增高;实验组治疗前后对比,发现治疗后高密度脂蛋白胆固醇(hdl-c)、低密度脂蛋白胆固醇(ldl-c)、总胆固醇(tc)以及甘油三酯(tg)改变均极其显著;治疗后的实验组与对照组作对比,发现实验组在高密度脂蛋白胆固醇(hdl-c)、低密度脂蛋白胆固醇(ldl-c)、总胆固醇(tc)以及甘油三酯(tg)上均存在极显著差异。说明本发明制备的人参散剂i对冠状动脉硬化高脂血症患者的治疗效果远好于传统方法制备的人参散剂ii的治疗效果。
4、不良反应
治疗后根据血脂水平统计用药疗效,实验组中出现头痛发热不适症状的为2例,对照组则出现5例;实验组中出现失眠烦躁症状的为3例,对照组则为6例,且对照组比实验组具有更明显的不良反应;两组均未出现其他不良反应。实验组中不良反应的发生率为5.4%,对照组中患者不良反应的发生率为11.8%,两组中不良反应的发生率均有统计学意义。
实验例4本发明的人参散剂的药代动力学实验
1、实验方法
购买体重为240-270g的雄性大鼠18只,分3组,口服人参散剂i、ii组和静脉注射,每组6只。实验前禁食12h(自由饮水)。给药前15分钟于股静脉抽取空白血样5ml,口服进药组分别口服人参散剂i和人参散剂ii,口服给药300mg·kg-1;注射进药组分别静脉注rg1原液,给药剂量为10mg·kg-1。静脉注射给药后于0.1、0.25、0.5、0.75、1.0、1.5、2.0、4.0、6.0、8.0h抽血测定血浆中人参皂苷rg1浓度;口服给药后于0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、6.0、8.0h抽血测定血浆中rg1浓度。给药后5h统一进食和饮水。
2、检测方法
按照中国药典2015年版一部。
3、实验结果
①大鼠静脉注射rg1原液
结果如表3及图2所示。
②大鼠口服人参散剂i或人参散剂ii
结果如表4及图3所示。
表3大鼠静脉注射rg1原液后人参皂苷rg1的血药浓度(μg·ml-1,
表4大鼠口服人参散剂i和人参散剂ii后rg1的血药浓度(μg·ml-1,
根据大鼠口服给药后血药浓度的测定结果,剂量校正后,建立药代动力学模型,计算药动学参数,获得人参皂苷rg1的auc0-t数据。综合大鼠静脉注射给药后的rg1的auc0-t和口服给药后的rg1的auc0-t,计算得出rg1的绝对生物利用度。
表5药动学参数auc0-t(μg·ml-1·h)
③人参散剂i和人参散剂ii中rg1的生物利用度
生物利用度(bioavailability,f)是指药物经血管外途径给药后吸收进入全身血液循环的相对量。与药物作用的强度和速度有关,是药物制剂质量和评价制剂吸收程度的重要指标。
口服制剂与注射剂的绝对生物利用度f(%)计算公式为:
其中:auc为血药浓度-时间曲线下面积。
rg1的绝对生物利用度如表6所示。
表6人参散剂i和人参散剂ii中rg1的绝对生物利用度
以上实验研究了iv和po给药后人参皂苷的体内药物动力学过程,以及人参散剂i和人参散剂ii对rg1体内过程的作用。
大鼠分别口服人参散剂i和人参散剂ii后,人参散剂i的峰浓度cmax较人参散剂ii的显著增大,说明两种人参散剂均含有有效皂苷,与人参散剂ii相比较,人参散剂i更能提高rg1的吸收速率和吸收量,说明人参散剂i中暴露出更多可被体内吸收的有效成分。
与人参散剂ii相比,人参散剂i各成分在体内的平均滞留时间(mrt)均有不同程度的增加,血药浓度-时间曲线也体现出达峰时间的后移,说明超微状的人参散剂i更易与血浆蛋白结合,从而促进药物在肠道被更好地吸收。
人参散剂绝对生物利用度的结果表明,通过本发明方法制备的人参散剂i与传统方法制备的人参散剂ii相比,生物利用度提高2.48倍。
- 还没有人留言评论。精彩留言会获得点赞!