选择性时空刺激脊髓的系统的制作方法
本发明涉及用于运动紊乱的脊髓神经修复的领域。
具体来说,其涉及选择性时空刺激脊髓的系统。
背景技术:
多种神经病症会破坏脊柱上中心与脊柱回路之间的通信矩阵,由此导致一系列运动残疾。
举例来说,神经性运动障碍可以是脊髓损伤(SCI)、由中风造成的局部缺血性损伤或神经退化性疾病(如帕金森病(Parkinson disease))的结果。
具体来说,在脊髓病变之后,颈椎或胸部的运动神经群并不会接收来自脊柱上结构的输入,但脊柱运动回路仍保留功能性。
神经调节策略提供了存活的回路和路径以缓解这些缺陷(1、2)。具体来说,腰椎脊髓的电化学神经调节已介导患有SCI的动物模型(3-7)和人类(6、8-11)的下肢运动控制的显著改善。
计算机模拟(12-14)和实验研究(7、15-17)已证明应用于腰椎节段背面的电神经调节主要接合通过刺激背侧根纤维恢复的本体感受反馈回路。普遍的看法是恢复这些神经路径会激活中枢模式产生网络(9、18)并且使脊柱回路的兴奋性提高到能够使感觉信息变为运动控制来源的程度(19)。
然而,动作产生通过沿脊髓协同激活运动神经群来安排,所述运动神经群在特定和精确时刻下通过中枢神经系统激活。
具体来说,肢体动作的产生涉及在精确时间顺序(23、24)之后激活空间分布的运动神经元(21、22),所述精确时间顺序经由感觉反馈(25)连续调节。
因此,有效治疗的目的应在于在空间和时间上精确激活脊柱回路。
这一框架对电神经调节治疗的临床应用制定了两个基本限制。首先,刺激的空间位置仍限制于根据经验映射实验选择的单个脊髓区域(9、20)。其次,刺激方案的时间结构限制于在运动执行期间保持恒定的非调节模式,这与下肢动作的当前状态无关(8、9、15)。
因此,临床环境中有助于运动控制的时空神经调节治疗的设计依赖于一系列大型方法学进展。首先,可经由恢复背侧根纤维特定地靶向运动回路的空间选择性植入物的设计。其次,靶向位于有限空间区域中的实时运动神经元的特定时间的刺激模式的设计。
当前刺激方案和系统并不试图再现有助于动作的运动神经元激活的这些时空模式。实际上,其保持非特异性,限制于单个区域并且连续传输。
因此,需要一种集成空间选择性和时间结构的系统来改进刺激功效并且因此控制运动。
具体来说,仍需要一种在精确时间分辨率下刺激特定脊柱根的系统,以使得不同的特定的运动神经群可在不同步态阶段期间激活。
计算模型和实验工作(12、13、15、16)已显示腰椎脊髓(EES)的硬膜外刺激主要恢复位于背侧根的大的有髓神经传入纤维。传出纤维也可以具体地讲在尾侧/骶骨层面得以恢复。在脊髓损伤之后,在非特定EES期间,肌肉活动性由通常称为脊柱反射的背侧根传入的恢复产生的单突触和多突触成分突发构成(12)。这一肌肉活动性通过脊柱回路调节(7、12)和闸控以建构运动模式并且调节运动变量(7)。
这些结果已在患有重度运动缺陷的实验性动物和人类中获得(9、19)。
然而,不完全病变也可以导致无法运动,但仍保留运动控制能力。
此外,临床病变因病变的性质、位置和严重程度不同而使各病例不同。各患者显示必须选择性地靶向以恢复运动功能的特定运动缺陷。
为选择性纠正这些缺陷,EES的效应应该聚焦于受损关节/功能。关节/功能特异性EES因此将需要选择性刺激背侧根的子集以触发关节/功能特异性脊柱反射。
鉴于上文,应选择性地靶向脊柱背侧根以促成特定肢体动作,从而使运动恢复。
此外,为确保足够的特异性水平,应靶向单个支根,以这种方式准予接入位于特定节段的运动神经群,从而改善肌肉特异性。
在脊髓损伤康复中使用多电极阵列装置用于硬膜外刺激是公知的(33)。
然而,其不能够实现高特异性刺激,特别是特定选择的背侧根和肌肉的高特异性刺激。
实际上,现有技术的多电极阵列被设计成基于电极和所述刺激节段之间的紧密接近来激活特定的脊柱节段。。因此,根据基础纵向节段结构将电极沿喙尾长度每隔一定距离置放于脊髓的背侧表面。这一设计主要由疼痛应用来驱动,其中背柱纤维被靶向。实际上,当前临床装置已经设计为特定地靶向含于背柱中的有髓神经纤维以根据闸控理论抑制神经性疼痛(26)。
鉴于上文,仍需要一种选择性空间靶向并且刺激特定脊柱根,特别是脊柱背侧根的系统。
如上所述,疼痛治疗领域中用于脊柱神经刺激的装置是公知的。
US20070179579公开了一种用于神经刺激以治疗多个疼痛部位的方法。在所述方法中,使用多列多行浆式导线刺激背柱纤维以作用于疼痛部位,确定电极组合能解决疼痛并且根据所述电极组合使用IPG传输脉冲。
US2010280570公开了一种用于疼痛治疗的刺激脊髓的设备,其中所述脊髓接触表面被排列成多个行,其中所述行以横向延伸到脊髓范围并且相邻行的刺激接触表面沿脊髓长度方向彼此隔一段距离排列。
US5643330公开了一种使用多信道脉冲发生器和横向并面对脊髓的电极的用于EES的设备。
US20070168008和US2006122678公开了一种横向三极刺激,其中电极可以相对于脊髓横向方向排列。
US2007179579公开了一种浆式导线,其可以植入患者中以进行疼痛治疗。
US2014088674公开了靶向脊柱根(背侧和腹侧)和运动神经支根以进行疼痛治疗。
使用上文公开的装置进行疼痛治疗,这是一个与作为本发明领域—运动紊乱领域完全不同的领域。实际上,在疼痛治疗中,意外动作是治疗的副作用,因此应当小心避免。设计和使用装置以靶向与疼痛有关的脊柱区域并且避免靶向与运动有关的脊柱区域。相反,本申请的目的是实现运动,并且特别是特定地靶向与动作产生有关的脊柱结构。
现已发现一种用于电神经调节治疗的系统,其能够集成空间选择性和时间结构,从而符合运动神经元激活的固有动力学,并且改进刺激功效,从而增强SCI之后下肢动作的质量和活力。
具体来说,已发现一种刺激系统,其能够在空间和时间上特定地靶向脊柱背侧根,以实现所期望的运动回路的更具选择性的激活,并且因此实现更高效的动作产生。
已进一步发现,适用于背侧根解剖的多电极阵列以及多极刺激使得可调节刺激场的形状,从而增强刺激特异性。
技术实现要素:
本发明的目的是一种时空电神经刺激个体脊髓的系统,其包括:
a)信号处理装置,其接收来自所述个体的信号并且操作信号处理算法以推敲刺激参数设定,所述信号处理装置可操作地连接,
b)可植入脉冲发生器(IPG),其接收来自所述信号处理装置a)的刺激参数设定并且能够将独立的电流或电压脉冲同时传输到一个或多个多电极阵列;所述可植入脉冲发生器可操作地连接,
c)一个或多个多电极阵列,其适合于覆盖所述个体的脊髓的至少一部分以向所述个体施用脊柱回路及/或背侧根的选择性时空刺激,
其中所述IPG b)与所述一个或多个多电极阵列可操作地连接以提供多极刺激。
上述根据本发明的系统有利地通过选择性地刺激需要控制运动功能的个体脊髓的背侧根而使得可实现运动功能的有效控制。背侧根多极刺激的特征在于时空选择性。
在所述系统中,所述信号处理装置根据由所述信号提供的来自个体的信息,例如根据特定步态阶段或步态参数(如肌肉活动性、步伐高度和足加速度)为所述IPG提供刺激参数设定。
在一优选实施例中,所述IPG在最小延迟下接收来所述自信号处理装置的所述设定。
示例性刺激参数设定包括电极组合,亦即应触发哪个电极的信息和当前配置。
来自所述个体的所述信号可以是神经信号、提供所述个体的运动特征的信号、运动学信号和/或肌电信号。
所述信号可以例如通过运动跟踪系统、加速器、陀螺仪、力传感器、肌电传感器、神经传感器、肌肉传感器获得。
在一优选实施例中,此类信号检测各肢体的轨迹并且向信号处理装置提供信息,所述信号处理装置计算最佳刺激参数设定并且经由IPG触发多电极阵列的特定电极组合的激活。
在一个更优选实施例中,当肢体端点的角坐标超过用户定义的阈值时触发靶向伸肌和屈肌相关热点的电极的开启和关闭状态。
本发明的系统可使得以时空选择性刺激个体脊髓的特定节段,因此在与连续神经调节相比时改善肢体动作。
在一优选实施例中,所述IPG b)包括中性返回电极作为参考。
在一优选实施例中,所述信号处理装置a)包括于所述IPG b)中。
所述多电极阵列以硬膜外或硬膜下的方式置放。
使用特别适合背侧根解剖的多电极阵列使得可选择性刺激投射到不同脊柱节段的背侧根。此类选择性刺激可使得诱导特定的肌肉反应,因此使运动恢复。
在一优选实施例中,所述多电极阵列包括:
-至少一个包括相对于所述脊髓横向排列的电极的部分,以及
-至少一个包括相对于所述脊髓纵向排列的电极的部分。
优选地,此类横向和纵向部分以替代方式安置于阵列中。
根据本发明的多电极阵列的横向部分以“环”配置接合脊髓的背侧根,因此以一定方式围绕脊髓的背侧,以使得可精确选择待刺激的背侧根。这可以通过可操作地设定信号处理装置a)和IPG b)以调节多极刺激来实现,以“聚焦”所期望的目标背侧根。这将参考图4更详细地解释。
优选地,在需要刺激腰椎脊柱根时使用所述阵列。
在另一优选实施例中,所述多电极阵列包括以相对于所述脊髓纵向安置的两个或更多个列排列的多个电极。
特别优选地是当需要刺激颈椎或骶骨脊柱背侧根时使用此类阵列。
使用能够在多个电极上同时传输独立的电流或电压源的可植入脉冲发生器(IPG)使得可执行多极刺激。此类多极刺激通过用额外电流源调节刺激场的形状将刺激场引导到所期望的位置,因此增强刺激的空间特异性。
本发明的另一目的是一种用于电神经刺激个体脊髓的系统,其包括:
a)可植入脉冲发生器(IPG),其能够在多个电极上同时传输独立的电流或电压脉冲;所述可植入脉冲发生器可操作地连接,
b)一个或多个多电极阵列,其适合于覆盖脊髓的至少一部分以选择性刺激脊柱回路和/或背侧根,其中所述IPG b)与所述一个或多个多电极阵列可操作地连接以提供多极刺激。
这一根据本发明的另一系统有利地通过选择性地刺激脊髓的背侧根而使得实现较高肌肉特异性。背侧根多极刺激的特征在于空间选择性。
多电极阵列优选地具有上述配置。
使用此类系统使得可选择性地靶向所期望的背侧根,因此增强肌肉特异性。
本发明的另一个目的是本发明系统有促进患有神经性运动障碍的个体的运动功能的用途和促进所述个体的运动功能的相关方法。
在本发明的一实施例中,所述神经性运动障碍选自于由肢体的部分或完全麻痹组成的群组,所述肢体麻痹可以是单侧或两侧的。具体来说,所述神经性运动障碍是脊髓损伤、由中风造成的局部缺血性损伤或神经退化性疾病(例如帕金森病)的结果。
本发明的目的还是一种用于促进有需要的个体的运动控制的方法,其包括以下步骤:
a)获取来自所述个体的信号;
b)将所述信号输送到信号处理装置;
c)借助于所述信号处理装置计算电刺激参数设定;
d)向能够将独立的电流或电压脉冲同时传输到一个或多个多电极阵列的可植入脉冲发生器(IPG)提供所述设定,其中所述IPG为所述一个或多个多电极阵列提供多极刺激;
e)经由覆盖脊髓的至少一部分的所述一个或多个多电极阵列向所述个体应用电刺激,由此提供脊柱回路和/或背侧根的选择性时空刺激。
本发明的另一目的是一种用于使患有神经性运动障碍的个体的运动的自主控制恢复的系统,其包括
a)如上所界定脊髓的电刺激的系统,以及
b)选自于由跑步机或机器人辅助的体重支撑或多方向躯干支撑系统中的至少一个组成的群组的设备。
本发明的另一目的是电神经刺激个体脊髓以精细控制动作的闭合回路系统,其包括:
a)实时监测组件,其包括连续获取来自所述个体的反馈信号的传感器,所述实时监测组件可操作地连接,
b)信号处理装置,其接收所述反馈信号并且操作实时自动控制算法以推敲电刺激参数设定,所述信号处理装置可操作地连接,
c)可植入脉冲发生器(IPG),其在最小延迟下接收来自所述信号处理装置b)的所述刺激参数设定并且能够将独立的电流或电压脉冲同时传输到多个电极;
d)一个或多个多电极阵列,其适合于覆盖脊髓的至少一部分以向个体应用脊柱回路及/或背侧根的选择性刺激,其中所述IPG为所述一个或多个多电极阵列提供多极刺激。
此类闭合回路系统使得可精细调整并且控制动作;由于从个体刺激参数(如刺激幅度和频率)获取的反馈信号可以连续地调节,因此使得能够精细控制动作。举例来说,在步态阶段期间精细控制下肢的伸展/弯曲等级可以使用此类闭合回路系统实现以调节刺激频率;这使得可精细控制肢体伸展和足运动轨迹。
本发明的另一个目的是一种有助于患有神经性运动障碍的个体的站立和行走功能的方法,其包括以下步骤:
a)使用上文提及的闭合回路系统以使运动的自主控制恢复;
b)使用所述多电极阵列在可调节刺激参数下向所述个体提供第一硬膜外和/或硬膜下电刺激;
c)从所述个体获取反馈信号,所述信号是神经信号和/或提供所述个体的运动特征的信号;
d)将所述反馈信号输送到所述信号处理装置;
e)借助于所述信号处理装置操作即时自动控制算法计算新的电刺激参数;
f)使用所述多电极阵列在步骤e)中计算的所述新的电刺激参数向所述个体提供第二硬膜外和/或硬膜下电刺激,
并且任选地
g)在投予所述第一和/或所述第二电刺激之前和/或期间向所述个体投予包括至少一种单胺能受体的激动剂的医药组合物。
附图说明
现将参考以下图式和实例详细地描述本发明。
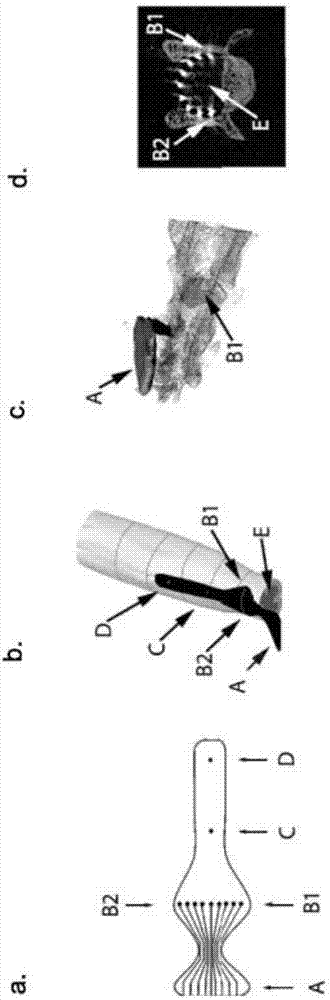
图1:骶髓的横向图像显示由位置更偏腹侧的喙侧支根和位置更偏背侧的尾侧支根组织的纵向支根的横向拓扑学组织。(来自大鼠的组织结构,人类中的类似图片可见于(13))
图2:用于选择性根刺激的硬膜外电极的可能的设计和植入程序。这一本发明的实施例描述用于腰椎背侧根的最佳刺激的横向配置。在这一实施例中,一行电极(B1-B2)位于骶骨层面处。来自实验性大鼠的微CT扫描(3D重建和S1节段的横向截面(E))显示在慢性动物模型中成功植入。接头A位于硬膜外腔的外部。C和D表示中线活性部位。
图3:实验性动物(大鼠)中的慢性实验显示本发明的实施例的可行性和特异性。已特定植入横向骶骨的实施例(A、B和图4),从最左边到最右边电极的接口的单个部位参考刺激显示支根从全左特异性切换到全右特异性的逐渐恢复。单个支根刺激也可以见于E1与E4部位和E9与E6部位之间的比较中。左侧和右侧(L和R)分别在胫骨肌(TA)与腓肠肌(MG)之间的相对阈值。在E1和E9中,TA的阈值低于MG,在E4和E6中,MG的阈值低于TA。靶向TA的支根的位置更偏腹侧,而靶向MG的支根的位置更偏背侧,因此更偏背侧的部位(E4和E6)能够特异性地靶向MG支根。腹侧部位(E1和E9)实际上可以靶向更偏腹侧的支根。
图4:大鼠中的实验显示特异性改进可以通过在横向腰椎实施例中使用本发明的双极而非单个单极刺激来实现。L2根的特异刺激可以通过平衡E5部位中的正电场(参见图3)与E1部位中的负电场(图3)来获得。脊柱映射显示每个背侧根的恢复强度,也表示腹侧根(与背侧根成镜向)。可以通过平衡E7触点上的正电场与E5电极的负电场代替地获得L5/L6根的靶向。与用E5单极刺激获得的两侧脊髓刺激相反,这致使左侧L5/L6根的选择性恢复。
图5:人类个体的术中测试显示本发明的另一可能实施例的特异性。颈椎背侧根(C7或C8)的选择性参考单极刺激会诱导臂和手肌肉的特异性响应。可以观察到,在两个个体中,C7根的刺激均会诱导肱三头肌的特异性响应。尽管C8根的刺激会诱导手外在肌肉的肌肉反应,但不会诱导肱三头肌。
图6:颈椎、腰椎和骶骨植入物的可能设计。
图7:触发神经调节治疗的时间结构、空间配置和刺激参数的调节的计算平台。大鼠在运动期间以机器人系统提供的立式支撑双足支撑于电动化跑步机带上。高分辨率视频系统可使得实时监测左侧和右侧肢体端点(足)。如灰色虚线所示,将肢体端点围绕计算旋转中心的角位移转化为角坐标。当角坐标超过用户定义的针对每只大鼠个性化的阈值时触发靶向伸肌和屈肌相关热点的电极的开启和关闭状态。刺激概况模块使得能够根据治疗师或控制策略调整刺激的幅度和频率。图式表示足垂直位移与伸肌和屈肌热点激活之间的关系,并且空间选择性电极如何开启和关闭以复制这一激活图案的方式。
图8:(a)大鼠接受完全SCI和如(i)中所描绘具有常规中线电极和空间选择性外侧电极的脊柱植入物;(b)在无刺激下、在腰椎和骶骨节段的中线上应用连续神经调节下并且在时空神经调节期间,记录跑步机上的运动。对于每个条件(相同大鼠)和完好的大鼠,左侧肢体动作的棒图分解连同肢体端点的连续轨迹、足尖离地时的足轨迹的速度和方位(具有箭头的矢量)、两个肢体的站立、打滑和摆动状态以及连续步伐序列期间的垂直地面反作用力一起示出,水平条棒指示电极的当前状态,计算10个连续步伐的运动神经元激活的对应时空映射。(c)不同神经调节条件下5只大鼠中所有步态周期表的记录示于PC空间中。直方图报告垂直地面反作用力的平均峰值幅度和不同神经调节条件和完好的大鼠的摆动期间足的平均峰值速度。误差条,SEM。*,p<0.05;**,p<0.01。
图9:(a)靶向伸肌(左侧与屈肌(右侧)热点的电极在时空神经调节期间两种刺激幅度水平下记录的运动序列。示出了每个条件的肢体动作的代表性棒图分解。阴影与调制的电极开启的时段对应。在下文中,一系列步伐的踝伸肌和踝屈肌的肌电活动性以及肢体长度变化一起显示。右上图解释肢体长度的计算,其组合了肢体的多个关节的变化;下方展示刺激的时空图案,条棒高度与刺激幅度成正比。(b)报导站立期间调制伸展电极的幅度时测量的平均垂直地面反作用力和摆动期间调制弯曲电极时间测量的平均步伐高度的直方图,(c)运动期间对伸展与弯曲电极调节的不同刺激频率下的垂直足位移,点强调步伐高度,每个刺激脉冲表示于下方所示的刺激的时空图案中。曲线显示所有大鼠一起和个别每个大鼠(细线)的刺激频率与步伐高度之间的关系。大鼠数目示于各图中。误差条棒,SEM。*,p<0.05。
图10:A.模拟显示横向双极EES可以用以通过引入将负电场“推”到相对方向的正电场改变负(兴奋性)电势的形状。B.传统双极刺激和参考双极刺激的电压场(a)和神经系统(b)中的激活功能(13)的模拟。
具体实施方式
定义
在本发明的框架内,提供以下定义。
“设备”:意思是包括一个或多个合作以提供更复杂功能的装置的组件。设备的实例是计算机、监测组件。设备也可以集成在系统中。
“系统”:意思是一个或多个合作以提供更复杂功能的设备和/或装置的集合。
“可操作地连接”意思是能够在两个或更多个输入和/或输出数据端口之间传送数据流的连接。连接可以是任何适合类型、有线或无线连接。
“信号处理装置”:意思是能够加工输入信号并且产生输出信号的任何装置。所述装置可以是并入更复杂设备或系统(例如计算机)中的处理器。
“最小延迟”意思是接近实时,举例来说,其意思是包括约0.1与约75.0ms之间的延迟。
“纵向”、“外侧”和“内侧”以其常见的医学上可接受的含义使用,例如“纵向”指的是脊髓的轴向方向。
术语“横向”包括相对于脊髓的外侧方向和相对于脊髓成对角线的方向,但在任一情况下,术语“横向”意指关于脊髓限定的中心线或点的一些交叉。
“个体”意思是具有脊髓的动物,特别是哺乳动物,更特别是人类。
运动特征或步态特征是表征步态周期的运动学参数。
多电极阵列
类似于人类(13),大鼠腰椎脊髓被背侧根(图1)包围,所述背侧根延脊髓纵向延伸并且在L6/S1节段显示特异拓扑学组织。神经支配喙侧节段的根位于更内侧,而神经支配尾侧节段的根位于内侧,从而形成左/右对称组织。
因此,应使用适用于背侧根解剖学的多电极阵列。
根据想要刺激的感兴趣的脊柱节段,可以使用具有不同设计的多电极阵列。
已发现当靶向腰椎脊柱根(L2、L3、L4、L5和S1)时,相对于脊髓横向安置电极使得背侧根的刺激更具选择性。
实际上,选择性刺激可以通过横向安置电极获得,所述横向安置遵循腰骶层面周围的支根的拓扑学组织。
因此,在一优选实施例中,所述多电极阵列包括:
-至少一个部分包括相对于所述脊髓横向方向排列的电极,以及
-至少一个部分包括相对于所述脊髓纵向方向排列的电极。
具体来说,为了选择性刺激腰椎背侧根,阵列的第一部分相对于脊髓横向方向安置于骶骨层面,以便有效刺激与腰椎脊柱节段有关的脊柱背侧根。
此类阵列优选地位于T12和L1椎骨下。
示例性实施例表示于图6B中。
优选地,所述横向排列的部分包括包括至少5个电极的行。
在一更优选实施例中,所述多电极阵列有3至9个横向电极置放于骶骨层面且有2至6个中线电极置放于L4和L2层面。在一甚至更优选实施例中,所述阵列包括9个横向电极和2个中线电极,此类优选配置的示例性表示参见图4。
使用此类阵列会显著增强刺激的特异性,因为可以靶向单个背侧支根,同时减缓传出神经纤维的恢复。
中线电极提供增强的刺激。
横向安置的电极提供增强刺激或多极刺激。
根据本发明,如下文所更充分解释,当阵列与多极刺激一起使用时实现选择性。
这种电极排列特别优选用于L4,L5和S1根的选择性刺激。因为在骶骨层面这些根极接近脊髓的中心部分(参见图3),所以选择性肢体的特定刺激因脑脊液中的电流扩展可能引起对侧刺激而难以由常规手段实现。在所述电极配置下,可以有利地执行L4和L5根的选择性刺激;因此,在不激活较高腿部肌肉下实现胫骨肌和腓肠肌的选择性刺激(通过L4和L5根神经支配)。
在另一优选实施例中,所述多电极阵列包括以相对于所述脊髓纵向安置的两个或更多个列排列的多个电极。
当所期望靶向的是骶骨和颈椎根时,将此类阵列使用于本发明的系统中尤其有利。实际上,在骶骨和颈椎脊柱部分中,根具有左/右对称组织并且对于颈椎根其以包括90°与45°之间的角度进入脊髓中,并且对于骶骨根以45°与60°之间的角度。
使用电极的此类纵向配置使得仅选择性地靶向所期望的背侧根,因此提供高肌肉特异性。
为了靶向颈椎根(C3、C4、C5、C6、C7、C8和T1根),优选地将阵列植入C2-T1脊椎下,示例性实施例描绘于图6A中。
为了靶向骶骨根(L5和S1根),优选地将阵列植入L5-S1脊椎下,示例性实施例描绘于图6C中。
根据本发明,可以将所述多电极阵列的电极设定为阴极(-)、阳极(+)或高阻抗NULL。
优选刺激部位是用于下肢刺激的腰椎和骶骨部位以及用于上肢刺激的颈椎部位。应用下肢刺激,例如以有助于个体的站立和行走;应用上肢刺激,例如以有助于伸出和握紧。
在本发明的系统中可以一起使用多于一个多电极阵列,每个阵列必须连接到IPG。
在一实施例中,具有根据上述实施例的两种不同电极配置的两个多电极阵列一起被使用,以便获得感兴趣的根,并且随后肌肉的甚至更具选择性的刺激。
电极的位置可以通过所属领域的技术人员根据待治疗个体的神经解剖特征的一般知识来确定。
根据本发明电极和阵列可以用常规材料和方法根据所属领域中的一般知识来制造。
优选地,其可以使用基于聚二甲基矽氧烷(PDMS)的技术来制造(27)。
可适用的刺激频率可以包括在5与120Hz之间,优选地其包括在25与95Hz之间。
脉冲宽度通常保持恒定为包括在0.1与1.0ms之间,优选地0.2ms的值。幅度通常设定在约0.1与约20.0mA之间,实际范围和子范围可以随各个体而变化。
将脊柱植入物插入并且稳定于硬膜外或硬膜下空间中的手术方法在本领域是公知的。
举例来说,可以在脊椎层面执行椎板切除术以产生植入物的入口和出口点。可以在术中执行电生理测试以精细调整电极的位置。
可以参考例如库尔蒂纳(Courtine)等人,2009(4)和万登布兰德(van den Brand),2012(31)。
IPG-可植入脉冲刺激器
在本发明的系统中,一个或多个多电极阵列可操作地连接到IPG。
IPG是传输电刺激的植入身体中的电池供电的微电子装置。
市售IPG适用于本发明。
市售IPG的实例是先进神经调节系统公司(Advanced Neuromodulation Systems,Inc.)制造的Eon可充电IPG。
具体来说,本发明的IPG能够将独立量的电流同时传输到多个电极,因此控制独立电流源。
可以将每个电极设置为用作阴极或阳极或对于既定脉冲设置为高阻抗状态。
本发明的多电极阵列的每个电极在单极刺激下靶向单个支根。
根据本发明的电极以及本发明的IPG一起放置使得有效使用多极刺激策略以达到选择性刺激支根的目的。
因此,本发明的阵列在多极刺激下使用。
对于多极刺激,其意味着同时具有多于一个电极触点的刺激。
利用多电极阵列结构的多极刺激方案的使用使得改变并且增加背侧根刺激的特异性。
多极刺激方案可以由所属领域的技术人员根据所属领域、特别是关于通过脊柱根神经支配肌肉的领域的常识来设计。
使用包括中性返回电极作为参考的IPG使得通过对中性接地电压参考远场来执行电极的参考多极刺激。
脊柱节段的选择性恢复在传统方案下尤其难以实现(12)。就脊髓刺激的空间特异性来说,耦接到对于多极刺激方案具有独立来源控制的IPG的多电极阵列能够胜过传统方法。
电压或电流源和共同参考相对电极的独立源控制使得从单极切换到具有未确定数目的阴极或阳极的多极刺激,所述多极刺激可用以将刺激场引导到所期望的位置并且增强刺激特异性(如果需要)。
在一优选实施例中,将IPG壳体设定成中性参考接地。
在一更优选实施例中,将IPG设定成中性参考接地并且独立地设定阳极(+)和阴极(-)触点的电压/电流值。在这一具有至少3个电极的方法下,电压发生器独立地控制阳极与参考和阴极与参考之间的电压差,从而也间接确保阳极与阴极之间的电压差,产生最佳并且可靠的多极刺激。
举例来说,可选地参考的多极刺激可以有利地用于通过刺激并且“隔离”特定路径来增强单个肢体弯曲或伸展。
举例来说,正极位于一侧并且负极位于中线的双极性刺激(参见例如图4)因正电场将防止同侧纤维去极化故会引起对侧伸展,而负电场通过接合更偏背侧的支根的正极源将限于另一侧。反相组合实际上将“屏蔽”对侧并且刺激“同侧”部位的更偏腹侧的支根。
示例性实施例表示于图4中。
在部位E5应用阳极源以及刺激E2部位限制对L2背侧根的激活,从而实现单根特异性(图4B)。这是归因于产生将阴极场限制于阴极周围的小区域的双极场。
为选择性地靶向主要神经支配踝和足的伸肌(配置称为对侧单肢伸展)的L5和L6左侧根,将阳极源应用于部位E7以将应用到E5部位的负电场限制到左侧的最接近于中线的根,从而实现左侧L5和L6根的选择性刺激(图4D)。
在一更优选实施例中,存在多于五个电极以使得激发和抑制路径的精细调整通过在不同的可能组合上横向移动“兴奋性”(即阴极)和“屏蔽”(即正极)刺激部位而成为可能。
所属领域的技术人员能够确定适合的电极排列以便根据其在所属领域的常识和上文提及的示例性实施例获得感兴趣的路径的所期望的刺激和抑制。
将IPG耦接到信号处理装置,提供具有刺激参数设定的IPG。
信号处理装置
信号处理装置接收来自个体的信号作为输入并且提供具有刺激个体的刺激参数(输出)的IPG。
使用信号处理演法基于步态变数和参数推敲刺激参数设定。
举例来说,刺激参数根据特定步态阶段或步态参数(如肌肉活动性、步伐高度和足加速度)来推敲。
优选地,触发每个电极是基于步态事件的自动检测,步态事件的自动检测是通过信号处理装置使用用了外部信号的特征检测算法推导的。
此类算法使得可检测步态事件,如足撞击或足尖离地。通过这些算法,处理器为IPG提供关于特定电极开启或关闭的信息,以促进例如整个肢体弯曲和整个肢体伸展,以增加相关肌肉的肌肉活动性并且因此改进运动输出。
经由监测足运动学特征并且根据如由运动学状态与肌肉激活所定义的步态周期内的时刻推导最佳步态事件的特征检测算法获得每个电极的适合触发时间。
优选地,所述信号处理算法根据肢体运动学的实时追踪检测步态事件的时刻。
举例来说,实时监测组件可以用以从个体获取信息(信号)。
为了优化脊柱植入物的每个相关电极的刺激起始和结束的时刻,执行使待治疗个体的刺激时刻与功能效应连接的全面映射。
获取的信号是神经信号和/或提供个体的运动特征的信号和/或肌电信号。
在一实施例中,实时监测组件通过例如运动捕捉系统或加速器或任何其它等效构件检测个体的动作。在一优选实施例中,实时监测组件是包括肢体位置标记的运动捕捉系统。这些标记置放于个体的被刺激的肢体上。通常,标记是反射型的,反射型的意思是其反射摄像机发射的红外光,因此使得其可追踪,但可以使用其它类型。其它适用于本发明的标记的实例是光学系统、电磁系统、超声波系统和通过称为“传感器融合”的方法适当集成的系统的组合(一种使用射频天线和惯性传感器的三角测量系统)。个体的标记位置实时获取并且与根据基于高精确度追踪每一个体构建的用户定义的运动学模型的特定标识(标识可以是例如脊突、髋、膝、踝、足)相关联。所述模型评估比较每一标记的X、Y和Z坐标的组规则,并且推导出哪组坐标与哪个标识相对应。所述运动学模型因此使标记的3D位置与其所连接的关节相匹配。标记位置可以是例如脊突、髋、膝、踝和足。
所述组规则以三个步骤操作:在第一步骤中,评估标记的中侧坐标以区分所述标记与右侧肢体有关还是与左侧肢体有关,因此鉴别两个子组;在第二步骤中,对于这些两个子组中的每一个,自顶向下规则使用垂直坐标区分:脊突(最高标记)、髋/膝对(低于脊突)和踝/足对(两个最低的标记)、足的旋转中心。最终(第三步骤),对于这些两个对中的每一个,前坐标有助于将膝与髋(膝比髋更靠前)和足与踝(足比踝更靠前)区分开。
举例来说,可以使用威康运动学系统(Vicon Kinematic System)(奈克瑟斯(Nexus))作为实时监测组件,其它市售或定制系统均适用于本发明。
接着将所获取的坐标输送到信号处理装置。
在另一实施例中,实时监测组件从个体获取神经信号,所述神经信号提供关于个体的运动或运动学状态和神经元活动性的信息并且将其传输到处理装置。
神经信号提供与步态周期相关的信息并且可以用以实时控制或改善电极的触发,分别用上文所述的运动学反馈算法替代或与其合作。
在一例示性实施例中,植入个体感觉运动皮层的肢体区域中的电极阵列收集关于个体运动意向的信息。使用机器学习方法,可以将这一信息解码并且辨别为两种行为状态,“静止”或“行走”。接着将译码输送到处理装置并且接通或断开控制器,以使得实现所期望的运动模式。
关于机器学习方法,可以参考综述“脊髓损伤之后恢复运动的皮质脊髓神经修复(Corticospinal neuroprostheses to restore locomotion after spinal cord injury)”,D.博顿(D.Borton)、M.博尼萨托(M.Bonizzato)、J.鲍普兰特(J.Beauparlant)、J.迪乔凡娜(J.Digiovanna)、E.M.莫罗(E.M.Moraud)、N.威戈(N.Wenger)、P.缪西恩科(P.Musienko)、I.R.米涅夫(I.R.Minev)、S.P.拉库(S.P.Lacour)、J.d.R.米兰(J.d.R.Millan)、S.米克拉(S.Micera)和G.库尔蒂纳,公开于《神经科学研究(Neuroscience Research)》,第78卷,第21-29页,2014中。
在信号处理装置上,包括自动控制算法的程序同时与运动学数据流和/或与神经数据流,即来自实时监测组件的数据流交接。程序和算法可以是能够实时操作的任何编程语言;例如可以是C、C++、C#、Simulink/xPC。优选地,其是C++,其可以根据所属领域的技术人员的一般知识使用定制或市售软件(例如TDT)来编译。所述程序经编程以实时检测足撞击并且在每个步态周期提供电刺激参数。
具体来说,神经数据流是来自实时神经信号监测组件的数据流,而运动学数据流是来自检测个体动作的实时监测组件的数据流。
在一例示性实施例中,信号处理算法根据两侧肢体运动学的实时追踪检测步态事件的时刻。步态事件的连续时间序列从特定关节(例如肢体端点,优选地是足)围绕其连续更新的旋转中心的角位移推导出。关节的这一空间进展透漏步态的当前时刻。记录系统产生标记的原始3D位置,将其实时导入C++环境中。开发用于经由三角测量在线内插缺失的标记且将每一标记重新标注于适当关节标志处的自定义算法。所有信号使用最小均方自适应滤波器在线过滤。控制逻辑根据左侧和右侧肢体端点的轨迹触发个别电极,单独地提取每个电极的触发事件。控制算法连续计算围绕矢状平面内虚拟旋转中心的关节的角轨迹。当角度值超过先前对于每个电极和个体优化的用户定义的阈值时触发每个电极配置的开/关状态的变化。
对于每个步态周期k,算法将矢状平面内从每个关节的轨迹推导出的虚拟旋转中心的估计位置Ck计算成:
其中xmax是最高步伐高度点(ymax)的x坐标,并且N是每个步态周期记录的数据点的数目。为防止由于各周期间变化的抖动,在每个步态周期可以将旋转中心的评估迭代地更新成:
其中更新因子μ=0.2。这一因子可以根据特定个体需要来调节。
这一方法捕捉步态期间站立和摆动阶段的自然交替,但步态周期内和其间存在固有变化。这一程序对于缩放也是固有不变的,并且与在退化的步态动作下展现可变性增加的其它方法相比,以较高的保真度检测触发时间。
这些控制算法提供灵活的工具以研究并且实时实施步态期间神经修复系统的阶段依赖性调制。
使用本发明系统的电刺激可以与使用选自于由跑步机或机器人辅助的体重支撑或多方向躯干支撑系统组成的群组的设备一起执行。
在一优选实施例中,所述支撑系统是能够评估、启用并且训练患神经性运动障碍的个体的运动模式产生和平衡机器人接口。对于所述机器人接口的描述,可以参考论文“神经运动病症后评估、启用并且训练运动和平衡多功能机器人接口(Versatile robotic interface to evaluate,enable and train locomotion and balance after neuromotor disorders)”,多米尼西N(Dominici N)、凯勒U(Keller U)、瓦勒里H(Vallery H)、弗里德里L(Friedli L)、万登布兰德R、斯塔基ML(Starkey ML)、缪西恩科P、瑞纳R(Riener R),《自然医学(Nat Med.)》,2012年7月;18(7):1142-7。doi:10.1038/nm.2845。也可以进一步参考万登布兰德R、赫特希厄J(Heutschi J)、巴罗Q(Barraud Q)、35迪乔凡娜J(35DiGiovanna J)、巴尔托迪K(Bartholdi K)、许尔利曼M(Huerlimann M)、弗里德里L、弗莱威特I(Vollenweider I)、莫罗EM、蒂斯S(Duis S)、多米尼西N、米克拉S、缪西恩科P、库尔蒂纳G的论文,“麻痹性脊髓损伤后运动自主控制的恢复(Restoring voluntary control of locomotion after paralyzing spinal cord injury)”,《科学(Science)》,2012年6月,1;336(6085):1182-5。
也可以参考WO2013179230。
此外,在投予电刺激之前和/或期间,可以向个体投予包括至少一种单胺能受体的激动剂的医药组合物。
实际上,在一优选实施例中,本发明的系统可以与药理学治疗组合使用以进一步促进运动功能。具体来说,系统与药理学治疗的组合对运动功能提供协同效应。具体来说,可以向个体投予包括至少一种单胺能受体,特别是血清素能、多巴胺能和肾上腺素能受体的激动剂的医药组合物。
举例来说,可以使用包括至少一种选择性激活α2c肾上腺素能受体亚型和/或阻断α2a肾上腺素能受体亚型的分子的医药组合物,如WO2013179230和WO2015000800中所公开。
也可以使用血清素能激动剂,优选地,所述激动剂是8-OHDPAT。举例来说,可以使用组合5HT2A激动剂喹哌嗪和5HT1A/7激动剂8-OHDPAT的血清素能替代治疗。
闭合回路刺激
先前已展示刺激幅度和频率的调制会使得逐渐调节肢体动作(7)。
现已发现,此类调制可以有利地用于本发明的系统以精细控制动作。
举例来说,使得可增强伸展分量与弯曲分量,从而使得控制站立期间的肢体伸展和摆动期间的足轨迹。
对于此类闭合回路系统的示例性描述和详细描述,可以参考WO2015063127和威戈等人,2014(7)。
医疗用途
使用本发明的系统可以促进患有运动系统损伤,尤其是由于神经性运动障碍,特别是患有肢体部分或完全麻痹的个体的运动功能。
因此,本发明的目的是使用所述系统用于促进患有神经性运动障碍的个体的运动功能。
具体来说,所述神经性运动障碍可以是肢体的部分或完全麻痹。
所述神经性运动障碍可能由脊髓损伤、帕金森氏病(PD)、由中风造成的局部缺血性损伤或神经运动疾病(例如肌肉萎缩性侧索硬化(ALS)或多发性硬化症(MS))所致。
优选地,使用所述装置用于促进脊髓损伤、帕金森氏病(PD)或中风后个体的运动功能。
现通过以下实例说明本发明。
实例方法
动物和动物照护
所有程序和手术均获瑞士沃州的兽医办公室(Veterinarian Office Vaud,Switzerland)批准。实验在成年雌性路易斯大鼠(200g体重,维耶饲养中心(Centre d'Elevage R.Janvier))上进行。在12小时光-暗循环中单独圈养大鼠,可任意获取食物和水。
外科手术和术后照护
程序已在先前详细描述(4、31)。所有干预在全身麻醉和无菌条件下执行。简单来说,在一个实验中,将一对涂布特富龙的不锈钢导线插入到的两个后肢的腓肠内侧肌和胫骨前肌中,而在双极配置实验中,臀中肌和腰大肌也双向植入。电极通过移除小部分(约1mm缺口)绝缘材料产生。简单来说,在椎骨层面L3-L4和T12-T13执行2次部分椎板切除术以产生植入物的入口点和出口点。使用手术缝合线将植入物轻轻拉到硬脑膜上。在术中执行电生理测试以精细调整电极的安置。将植入物的接头紧固到L3-L4脊椎的顶部上使用新混合的牙粘固粉涂抹的保护罩中。将充当相对电极的共同地线皮下插入到右侧肩膀上。
微型计算机断层扫描
使用微型计算机断层扫描仪Skyscan 1076(布鲁克微型计算机断层扫描(BrukerμCT))进行脊柱植入物在活体内重复成像。调节扫描仪设定以避免通过椎骨矫形器的金属部件诱发的伪影(0.5-1mm铝过滤器,电压70-100kV,电流100-140pA,暴露时间120-160ms,旋转步长0.5度)。所得投影图像使用NRecon和GPURecon服务器(布鲁克微型计算机断层扫描)重构成3D透视图。在扫描期间将大鼠保持异氟醚麻醉下以减少运动伪影。用(FEI可视化科学集团(FEI Vizualisation Sciences Group))构建分段和3D模型。
大鼠:恢复曲线
在双足站立期间在80%体重支撑下在支撑带中记录EES诱发的运动反应;通过植入电极(12)以0.5Hz输送矩形脉冲(0.2ms持续时间);电刺激的强度逐渐增加直到达到反应饱和;记录植入的肌肉中EES诱发的运动电势;将EMG信号(12.207kHz)放大,过滤(1-5,000-Hz带通)并且储存以用于离线分析;通过Matlab中的定制软件测定不同组分在化合物动作电势中的起始潜伏期和峰值振幅。急性双极实验在氨基甲酸酯(1g/kg,腹膜内)麻醉下执行。
根和运动神经元激活映射
为观察根和运动神经元激活映射,将肌电信号映射到运动神经群的喙尾分布上[21]。这一方法对节段层面而非个别肌肉层面的运动神经元激活提供解释。所述映射由将每个肌肉的贡献添加到每个脊柱节段的总活动性来构建。通过以下等式评估每一脊柱节段Si的运动输出模式:
其中ni是位于第i节段的肌肉的数目,EMGj表示第j肌肉的标准化活动性,MNij是与肌肉j有关但位于节段i处的运动神经元的数目,MNj是肌肉j的运动神经元的总数,Ni是由第i脊柱节段神经支配的肌肉的数目。
人类:恢复曲线
在标准术中常规电生理学测量期间记录EES诱发的运动反应。通过位于硬膜外空间的颈椎根C7和C8上的单极电极(12)以0.5Hz传输矩形平衡两相脉冲(0.3-0.5ms持续时间);电刺激的强度逐渐增加直到达到反应饱和;记录植入的肌肉中刺激触发的EES诱发的运动电势;将EMG信号(10kHz)放大,过滤(1-2000-Hz带通)并且储存以用于离线分析;通过Matlab中的定制软件测定不同组分在化合物动作电势中的起始潜伏期和峰值振幅。
实时监测平台
实时监测和控制平台在四核微软视窗7(Microsoft Windows 7)计算机上运作的多线程C++代码内实施(Visual Studio 2010,微软(Microsoft))。刺激模式经由连接到MS16刺激隔离器(塔克戴维斯技术(Tucker-Davis Technologies))的RZ5处理单元(塔克戴维斯技术)施加。集成威康(Vicon)记录系统会产生标记的原始3D位置,其使用DataStream SDK软件经由以太网(Ethernet)(软)实时导入C++环境中。我们开发了一种自定义算法,经由三角测量在线内插缺失的标记且将每个标记重新标注于适当关节标志处。所有信号使用最小均方自适应滤波器在线过滤。
控制逻辑根据左后肢和右后肢端点的轨迹触发单个电极。单独地提取每个电极的触发事件。控制算法连续计算围绕矢状平面内虚拟旋转中心的足的角轨迹。当角度值超过在映射实验期间对于每个电极和大鼠达到预先优化的用户定义的阈值时触发每个电极配置的开/关状态的变化。
对于每个步态周期k,算法将矢状平面内从每个足的轨迹推导出的虚拟旋转中心的估计位置Ck计算为:
其中xmax是最高步伐高度点(ymax)的x坐标,并且N是每个步态周期记录的数据点的数目。为防止由各周期间变化的抖动,在每个步态周期将旋转中心的评估迭代地更新成:
其中更新因子μ=0.2,这一方法捕捉步态期间站立和摆动阶段的自然交替,但步态周期内和其间存在固有变化,这一程序对于缩放也是固有不变的,并且与在退化的步态动作下展现可变性增加的其它方法相比,足以以较高的保真度检测触发时间。这些控制算法提供灵活的工具以研究并且实时实施步态期间神经修复系统的阶段依赖性调节。
为评估这一回路的处理时间的延迟,模拟输入并且记录适应刺激参数所需的时间。这一延迟包括通过运动捕捉系统处理视频录像、经由以太网将这一资料传输到实时控制计算机中、使用专用文库处理这一资料、刺激隔离器参数的变化和经由安装于大鼠头部上的塞子传输修改后的刺激脉冲。对于大于100个连续周期,在回路相对末端输送伴随脉冲,并且计算每次迭代之后两种信号之间的差异,计算的延迟保持低于20ms。定制开发的C++和TDT(塔克戴维斯技术)代码在G.C请求时经由材料转移协议而变得可用。
行为记录
大鼠在两种条件下进行记录。首先,在跑步机上记录双足运动,同时机器人体重支撑系统提供针对重力方向的最佳支撑并且防止侧摔;其次,在平坦表面沿直线跑道并且沿组合一系列4个台阶的阶梯记录四足运动,如先前所描述([32])。将记录阶段内和之间的所有实验条件随机分组。
患有的完全SCI大鼠的时空神经调节
电化学刺激方案根据患有完全和不完全SCI的大鼠中的大量先前研究来选择[5、7]。在测试之前全身投予训练期间所用的血清素能替代治疗。在几分钟之后,单极电刺激电流在植入物的相关电极与位于皮下的中性接地端之间传输。调整电脊髓刺激的强度(40Hz,20-200pA,双相矩形脉冲,0.2ms持续时间)以获得视觉上的最佳步进。
为了优化脊柱植入物的每个相关电极的刺激起始和结束时刻,执行全面映射,使胸部脊髓完全横断的大鼠的刺激时刻与功能效应连接。对于每个大鼠(n=5),将步态周期的持续时间(800±156ms,SD)标准化,且接着划分成10个充当触发事件以开启或关闭刺激的相等区间。对于靶向伸肌与屈肌的电极,在整个区间范围内刺激开启或关闭。通常记录每个电极和区间的总计10个步伐。根据表征刺激的预期效应的几个步态参数的调制来优化时间结构。电极靶向伸肌的时刻由踝伸肌活动的幅度、垂直地面反作用力的量和蹬出时足加速的强度和量来驱动。电极靶向屈肌的时刻由屈肌活动的幅度、足打滑的量、步伐高度和摆动起始时足加速的强度和方向来驱动。将这些参数同等加权以鉴别伸展与弯曲选择性电极或电极组合的最佳时间结构。
在时间结构优化之后,在同一大鼠中在跑步机上双足运动期间测试与连续神经调节相比经时空神经调节以介导优良地促进运动的能力。在经由位于脊柱节段L2/L3和S1中线上的电极(常规方案)和经由位于同一节段外侧面上的空间选择性电极施用的连续神经调节(40Hz,20-200pA,双相矩形脉冲,0.2ms持续时间)期间记录总计10到20个连续步伐。将运动性能与通过具有确定的时间结构的同一空间选择性外侧电极施用的神经调节相比较。在各条件下机器人辅助的体重支撑的量维持恒定。调节每个条件的刺激幅度。不可以将对于时空神经调节最佳的幅度用于连续神经调节,因为这些值致使性能减弱,并且偶尔可能阻断后肢动作。
在SCI后约3周,测试连续神经调节和时空神经调节下每个挫伤性SCI大鼠的最大重量承载能力。从最佳垂直重量支撑条件来说,在每个序列10个有成效步伐之后,辅助量增量减小5%,直到大鼠虚脱,在整个这些评估中记录运动学和肌肉活动性。
SCI后约3周,在对于动物随机选取的不同的两天记录挫伤性SCI大鼠的耐久性。从最佳垂直重量支撑条件来说,大鼠在连续神经调节或时空神经调节下举步直到其在跑步机上虚脱,使用伴随运动学记录以测量每个步伐的步伐高度。
在SCI后2个月,当功能恢复达到稳定时,在四足运动期间评估挫伤性SCI大鼠[5]。大鼠在无刺激但有血清素能替代治疗和时空神经调节下沿跑道与阶梯执行10次连续试验。在这些试验期间记录两侧后肢和躯干的运动学特征。根据视频录像计算摔倒、触碰和越过台阶的百分比。摔倒定义为在整个台阶上执行过程中打滑,然而触碰是步态周期的特征,在此期间脚爪开始与台阶接触但成功地越过台阶。当脚爪在整个摆动阶段期间不与台阶接触时,将事件归类为“越过”。
统计分析
除非另外说明,所有计算的参数都定量并且在测试组之间进行比较。统计基于每个大鼠的平均值进行。除非另外规定,所有资料均以平均值+/-SEM报导。当数据正态分布时,使用成对斯图登氏t检验(Student's t-test)、ANOVA或重复测量的ANOVA分析重要性。使用克鲁斯卡尔-沃利斯测试(Kruskal-Wallis test)执行事后比较。使用非参数测试曼-惠特尼(Mann-Whitney)比较少于6只大鼠。
结果
空间特定性
实例1
腰椎、骶骨和颈椎根刺激的选择性接口的设计
我们发现选择性背侧根刺激在根特异性方面具有优于传统方法的性能。因此,我们调整了大鼠S1脊柱节段的腰椎硬膜外阵列的设计。
类似于人类(13),大鼠腰椎脊髓被背侧根(图1)包围,所述背侧根延脊髓纵向延伸并且在L6/S1节段显示特异性拓扑学组织。背侧根由感觉传入纤维的集合形成,所述感觉传入纤维包括由脊髓硬膜外刺激恢复的大的有髓神经本体感受和皮肤纤维。在骶骨层面,在哺乳动物中,根被组织在以环绕脊髓到达每个支根的入口点的纵向亚结构。骶髓的横向图像显示由位置更偏腹侧的喙侧支根和位置更偏背侧的尾侧支根组织的纵向支根的横向拓扑学组织。选择性刺激已由横向安置硬膜外接口的活性部位获得,所述横向安置遵循骶骨层面周围的支根的拓扑学组织。(来自大鼠的组织结构,人类中的类似图片可见于(13))
神经支配喙侧节段的根的位置更偏向内侧,而神经支配尾侧节段的根位于内侧,从而形成左/右对称组织。
我们发现具有围绕S1节段背侧面的电极的神经接口使得可进行特定根激活。
我们使用[27]中所呈现的基于PDMS的技术设计并且实施(图2)此类接口。在大鼠中稳定植入已得以实现并且在损伤后1周在动物上所获取的微型CT扫描确定围绕S1节段的背侧面的与活性部位接口的正确置放(图2)。
实例2
验证大鼠腰椎根刺激:单极特异性
在大鼠中在L2椎骨下方在S1脊柱节段上我们植入用于选择性背侧根刺激的我们的多电极阵列(图2和图3A、图3B)。将电极横向安置于S1脊柱节段的背侧面上。在动物两个肢体的踝屈肌和踝伸肌中植入慢性EMG电极(胫骨前肌和腓肠内侧肌,分别为TA和MG)。
通过遍及9个活性部位中的每一个用增大电流幅度下的单脉冲EES刺激动物完成肌肉诱发电势的恢复曲线(图3)。结果显示从最左边(部位E1)到最右边(部位E9)活性部位的肌肉恢复的进展。E1部位的刺激以高肢体特异性诱导左侧TA和左侧MG(LTA和LMG)的明显激活。TA的阈值低于MG,这反映了与MG相比TA由更偏喙侧节段地神经支配的事实[12],因此神经支配TA的背侧根更偏外侧,而神经支配MG的背侧根更偏内侧/背侧。结果显示,沿着根的横向背侧组织,当更偏向内侧移动时,用单极刺激来刺激每个单个部位逐渐诱导MG/TA激活顺序的变换。接着在中线部位(E5)达到左侧和右侧与下MG阈值之间的完全对称。最终,由右侧部位E6到E9实现右腿肌肉的对称恢复。这些结果证明,选择性根刺激甚至在单极刺激下仍能实现高肌肉特异性,由于我们新开发的多电极阵列,其适用于背侧根解剖。我们的靶向背侧根的策略在与传统方法相比时在啮齿动物中尤其在屈肌/伸肌特异性方面展示优良的特异性[12、16]。
实例3
验证大鼠腰椎根刺激:双极特异性
在实验性验证单极电极配置下的选择性背侧根刺激之后,我们采用我们的多电极阵列的设计进行背侧根的多极刺激。
多极刺激确实可以通过用阳极电流源调制刺激场(阴极)的形状增加特异性。
我们发现我们的横向多电极阵列可以在多极刺激模式下使用,旨在限制阴极场的横向扩散以增加根特异性。
为此,我们将我们的多电极阵列与脉冲发生器连接,所述脉冲发生器控制独立的电流源并且以皮下置放于右肩上的作为参考的公共返回电极为特征。
首先,我们寻求选择性地靶向已知主要神经支配在起始运动中起至关重要作用的髋屈肌[28]的L2根,将这种配置称为同侧反射。图4示出了具有由围绕脊髓的圆圈所示的腹侧与背侧根的S1节段的理想化图像。腹侧根位于腹侧(顶部)并且背侧根围绕节段的背侧部分(底部)。递增幅度下的单脉冲刺激显示部位E2的刺激(参见图3)使左侧根恢复,然而腹侧与背侧根皆得以刺激(图4A)。在部位E5应用阳极源(参见图3)会限制L2背侧根的激活,从而实现单根特异性(图4B)。这是由于产生将阴极场限制于阴极周围的小区域的双极场。
其次,我们寻求选择性地靶向主要神经支配踝和足的伸肌的L5和L6左侧根,将这种配置称为对侧单肢体伸展,仅实现L5和L6的选择性刺激。当用E5部位刺激时,主要恢复左侧与右侧L5和L6根(图4C),在部位E7应用阳极源会将负电场限于左侧的最接近于中线的根,从而实现左侧L5和L6根的选择性刺激(图4D)。
尾侧节段的选择性恢复尤其难以由传统方案实现[12],因此用于多极刺激方案的由共同参考耦接到独立源控制的我们的多电极阵列就脊髓刺激的空间特异性来说能够胜过传统方法。
这些结果也证明由充分利用我们的多电极阵列结构的多极刺激方案改变并且增加背侧根刺激特异性的能力。电压或电流源和公共参考相对电极的独立源控制对于这些结果十分关键,因为其由未确定数目的负极或正极可使得从单极切换到多极刺激,所述负极或正极可以用于将刺激场引导到所期望的位置并且增加刺激特异性(如果需要)。
实例4
验证人类的颈椎根刺激
我们发现选择性背侧根刺激可以用于诱导脊髓损伤之后在EES下运动恢复后构成基本机制的肢体的特定肌肉反应。
我们首先在大鼠中测试当刺激腰椎脊髓时的此情况。
其次我们测试选择性背侧根刺激是否可以也在人类上肢中产生特定肌肉活动性。
这一测试使得我们的发现可对上肢运动障碍的概括。
为此,我们在两个接受颈椎间盘突出手术的患者中执行术中电生理测试。
我们由位于尾骨的皮下区域的相对电极应用对背侧颈椎根的单极阴极刺激。与腰椎区域相反,颈椎脊髓的背侧根以包括在90°与45°之间的角度进入脊髓中(图5)。这一解剖学组织提供稳固并且良好的分离拓扑结构,根沿脊髓物理分离并且这会增加刺激的特异性。活性部位可以位于纵向配置的每个颈椎根上(图5)。
我们刺激两个患者的C7和C8根,显示在刺激C7根期间,主要恢复肱三头肌,而在C8刺激期间,更多地选择性恢复手和前臂较远端的肌肉。如在腰椎EES的情况下,诱发的电势的潜伏期形状表明这些活性部位主要由单突触组分构成。
其它脊髓结构的概述
我们已经证明在腰椎与颈椎脊髓处调适用于背侧根刺激的多电极阵列可以实现高特异性,因此可以对于脊髓的其它区域推断出类似结论。举例来说,大部分骶骨节段中的根的组织与颈椎区域类似,因此电极的纵向位移将再现根的解剖学组织并且允许我们在腰椎和颈椎脊髓中显示的结果。
时间特异性
动作产生通过沿脊髓协同激活运动神经群来安排,所述运动神经群在特定和精确时刻下通过中枢神经系统激活。在脊髓病变之后,颈椎或胸部运动神经群不接收来自脊椎上结构的输入,但脊柱运动回路保留功能性。因此,有效治疗的目的必须在于在空间和时间上精确激活脊柱回路。
我们先前已演示了靶向背侧根的多电极阵列和在独立源和公共相对电极下多极刺激可以如何实现高空间特异性。在这一部分中,我们演示与空间选择性植入物有关联的时间特定性可以如何实现优于传统增强的刺激方案的性能。
为此,展示在实验性大鼠的腰椎脊髓中施用的实例。
实例5
软件:经由动作反馈调节的时空神经调节
我们采用先进的实时控制平台[7]支持耦接到称为时空神经调节治疗的空间选择性植入物的时间特定的刺激模式的实施。我们详细阐述了根据两侧后肢运动学的实时追踪检测步态事件的时刻的信号处理算法(图7)。步态事件的连续时间序列从后肢端点(足)围绕其连续更新的旋转中心的角位移推导出(图7)。足在空间中的这一进展类似于透漏步态的当前时刻的时钟。
当后肢端点轨迹超过用户定义的角阈值时,有限态机器并行逻辑(参见方法)会独立地触发每个电极的激活(图7)。另外,幅度或频率的调节可以根据用户定义的参数或控制策略来调整[7](图7)。根据动作反馈触发刺激所需的时间保持低于20ms(参见方法),这一处理时间是比大鼠中平均步态周期持续时间(800±146ms)快40倍。对于限于小于相对步态周期持续时间的5%(n=140个步态周期)内的时间窗口,以97.8%的准确度触发刺激。
这一计算基础设施提供用于基于高保真度运动学反馈的多个电极上神经调节参数的实时调节的技术框架。
实例6
时空神经调节再现自然后肢运动神经元激活
我们接下来采用开发的硬件和软件来改进时间选择性刺激模式并且测试时空神经调节治疗是否比传统连续刺激方案更能改善运动。
成年大鼠接受完全脊髓横断,双极电极到后肢肌肉和脊柱植入物中(图8a)。当双足安置于机器人体重支撑系统中时,病变后五周,所有大鼠显示后肢完全麻痹[4](图8b)。测试之前十分钟,我们投予补偿损伤后中断的单胺能调节源的血清素能替代治疗[4、5]。如先前所报导[4],L2/L3和S1节段中线上传输的连续电神经调节使得所有测试的大鼠能够响应于跑步机运动进行协同运动(图8b)。然而,运动神经元激活的时空映射明显不同于完好大鼠中观察到的此等映射(图8b)。伸肌和屈肌运动神经元激活的不适当时空图案会转化成降低的垂直地面反作用力(p<0.01;图8b)和受伤大鼠在摆动期间与完好大鼠相比规模不大的足动作(p<0.01;图8b)。
我们接下来寻求优化时空神经调节治疗的时间结构。为此,我们计算了与伸展与弯曲分量有关的步态变量,并且评估经由多电极阵列的空间选择性电极而改变刺激的起始或结束的影响。靶向弯曲的电极的激活时刻的调节致使逐渐调整摆动期间的屈肌活动性、步伐高度和足加速度。当改变靶向伸肌的电极的激活时刻时,检测伸肌活动性、垂直地面反作用力和足打滑的相同调制。对于每个电极,我们选择步态参数的集合产生最佳值的时刻。所得时间结构与暴露在完好大鼠中的肌肉协同作用的时间激活概况相匹配。
我们测试这一优化刺激方案是否能够再现基于完好大鼠的运动的运动神经元激活的时空映射。在所有测试大鼠中,时空神经调节治疗会加强肌电图信号的幅度并且改进几乎所有记录的后肢肌肉的激活时刻。这一稳固调制会产生后肢运动神经元激活的时空映射,所述时空映射类似于完好大鼠中所观察到时空映射(图8b)。
最终,我们评估与连续神经调节相比时空神经调节是否会改进后肢运动控制。为定量步态效能,我们从运动学、动力学和肌肉活动性记录计算了许多参数(n=137)),为了客观地加权其相对重要性,我们将记录的所有步态周期的所有参数进行主分量(PC)分析[4、5]。我们观测到通过PC 1-2产生的新颖空间中的步态模式,其中PC 1说明最高方差量(27%)并且反映与完好大鼠的相似程度(图8c)。PC 1上的评分分析显示,与连续神经调节相比,时空神经调节促进步态模式更接近完好大鼠的步态模式(p<0.05)。提取与PC 1高度相关的参数(|值|>0.5,因子负载),并且重新分组成与基本动作特征对应的功能群,这一分析显示时空神经调节会使后肢动作的许多关键特征标准化(41/137显著改进的参数)。经由4个空间选择性外侧电极传输的连续刺激未能改进步态效能(p<0.05;图8c),从而确定空间选择性与时间结构之间的协同性。
实例7
选择性调节伸展与弯曲动作
我们先前表明调制刺激幅度和频率致使逐渐调节后肢动作[7]。我们试问这种调制是否可以叠加于时空神经调节治疗上。
我们首先改变经由空间选择性外侧电极中的一者传输的刺激的幅度。靶向伸展与弯曲的电极的刺激幅度的逐渐增加促进所有测试大鼠的刺激侧上伸肌与屈肌活动性的选择性和逐步增强(n=5,p<0.05;图9a)。这种调整转化成伸展与弯曲分量的递增增强(图9b),其支持站立期间的后肢伸展控制和在达到运动的解剖学界限的范围内的摆动期间的足轨迹。相反,当刺激不在时间结构下传输时,刺激幅度的增加会快速阻止后肢动作。肌肉活动性由在每个刺激脉冲后诱发的一系列运动反应引起,其可能来源于本体感受反馈回路的恢复[7、12、29、30]。刺激幅度的增加致使这些运动反应的幅度相称地增强。
接着我们验证在时空神经调节期间保持先前观察到的由调节刺激频率来调节步伐高度[7]。在所有大鼠中,调节刺激频率致使伸展与弯曲分量逐步并且协同增加。所有大鼠均展示刺激频率和足高度之间的线性关系(图9c)。这些关系支持对连续运动期间的复杂足轨迹加以控制[7],并且因此可以与时空神经调节组合。
参考文献
1.博顿,D.等人,个人化神经修复学(Personalized neuroprosthetics),《科学转化医学(Sci Transl Med)》,2013.5(210):第210rv2页。
2.洛扎诺,A.M(Lozano,A.M.)和N.李普曼(N.Lipsman),使用深度大脑刺激探测并且调节功能异常回路(Probing and regulating dysfunctional circuits using deep brain stimulation),《神经元(Neuron)》,2013.77(3):第406-24页。
3.巴泰勒米,D.(Barthelemy,D.)、H.勒布隆(H.Leblond)和S.罗西尼奥尔(S.Rossignol),脊柱猫中由脊柱内微刺激和背侧根刺激诱导的运动的特征和机制(Characteristics and mechanisms of locomotion induced by intraspinal microstimulation and dorsal root stimulation in spinal cats),《神经生理学杂志(J Neurophysiol)》,2007.97(3):第1986-2000页。
4.库尔蒂纳,G.等人,在大脑输入缺失之后非功能性脊柱回路转化成功能性状态(Transformation of nonfunctional spinal circuits into functional states after the loss of brain input),《自然神经科学(Nature neuroscience)》,2009.12(10):第1333-42页。
5.万登布兰德,R.等人,麻痹性脊髓损伤后运动自主控制的恢复,《科学》,2012.336(6085):第1182-5页。
6.赫林斯基,B.J.(Holinski,B.J.)等人,使用来自背侧根神经节的记录实时控制行走(Real-time control of walking using recordings from dorsal root ganglia),《神经工程学报(J Neural Eng)》,2013.10(5):第056008页。
7.威戈,N.等人,完全脊髓损伤之后脊柱感觉运动回路的闭合回路神经调节控制改善的运动(Closed-loop neuromodulation of spinal sensorimotor circuits controls refined locomotion after complete spinal cord injury),《科学转化医学》,2014.6(255):第255ra133页。
8.卡哈特,M.R.(Carhart,M.R.)等人,不完全脊髓损伤之后硬膜外脊髓刺激有助于恢复功能性行走(Epidural spinal-cord stimulation facilitates recovery of functional walking following incomplete spinal-cord injury),《神经系统和康复工程会刊(IEEE Trans Neural Syst Rehabil Eng)》,2004.12(1):第32-42页。
9.安杰利,C.A.(Angeli,C.A.)等人,人类慢性完全麻痹之后改变脊髓兴奋性使得能够进行自主动作(Altering spinal cord excitability enables voluntary movements after chronic complete paralysis in humans),《大脑(Brain)》,2014。
10.格拉西梅,Y.(Gerasimenko,Y.)等人,麻痹后运动下行控制的非侵入性再激活(Noninvasive Reactivation of Motor Descending Control after Paralysis),《神经外伤杂志(J Neurotraum)》,2015。
11.赫尔曼,R.(Herman,R.)等人,在慢性不完全脊髓受伤中脊髓刺激有助于功能性行走(Spinal cord stimulation facilitates functional walking in a chronic,incomplete spinal cord injured),《脊髓(Spinal Cord)》,2002.40(2):第65-8页。
12.卡柏罗索,M.(Capogrosso,M.)等人,脊柱感觉运动回路的硬膜外电刺激的计算模型(A computational model for epidural electrical stimulation of spinal sensorimotor circuits),《神经科学杂志(J Neurosci)》,2013.33(49):第19326-40页。
13.劳陶伊,F.(Rattay,F.)、K.米纳西安(K.Minassian)和M.R.迪米特里杰维奇(M.R.Dimitrijevic),人类腰骶脊髓的后部结构的硬膜外电刺激:2.通过计算机模型化进行定量分析(Epidural electrical stimulation of posterior structures of the human lumbosacral cord:2.quantitative analysis by computer modeling),《脊髓》,2000.38(8):第473-89页。
14.兰德鲍尔,J.(Ladenbauer,J.)等人,用植入的表面电极刺激人类腰椎脊髓:计算机模拟研究(Stimulation of the human lumbar spinal cord with implanted and surface electrodes:a computer simulation study),《神经系统和康复工程会刊》,2010.18(6):第637-45页。
15.霍夫施塔特,U.S.(Hofstoetter,U.S.)等人,重复诱发的人类腰骶脊髓的单突触反射的周期性调制(Periodic modulation of repetitively elicited monosynaptic reflexes of the human lumbosacral spinal cord),《神经生理学杂志》,2015:第jn 00136 2015页。
16.格拉西梅,Y.P.(Gerasimenko,Y.P.)等人,正常苏醒的大鼠中由硬膜外脊髓刺激诱导的脊髓反射(Spinal cord reflexes induced by epidural spinal cord stimulation in normal awake rats),《神经科学方法杂志(J Neurosci Methods)》,Neurosci Methods,2006.157(2):第253-63页。
17.萨耶科,D.G.(Sayenko,D.G.)等人,瘫痪个体中由硬膜外脊髓刺激诱导的肌肉诱发电势的神经调节(Neuromodulation of evoked muscle potentials induced by epidural spinal cord stimulation in paralyzed individuals),《神经生理学杂志》,2013。
18.丹纳,S.M.(Danner,S.M.)等人,人类脊柱运动控制是基于灵活组织的突发产生器(Human spinal locomotor control is based on flexibly organized burst generators),《大脑》,2015.138(Pt 3):第577-88页。
19.埃杰顿,V.R.(Edgerton,V.R.)等人,练习运动网络(Training locomotor networks),《大脑研究评论(Brain Res Rev)》,2008.57(1):第241-254页。
20.雷耶茨,E.(Rejc,E.)、C.安杰利(C.Angeli)和S.哈克玛(S.Harkema),人类慢性完全麻痹后腰骶脊髓硬膜外刺激对于站立的效应(Effects of Lumbosacral Spinal Cord Epidural Stimulation for Standing after Chronic Complete Paralysis in Humans),《公共科学图书馆(一)(PLoS One)》,2015.10(7):第e0133998页。
21.雅科文科,S.(Yakovenko,S.)等人,在运动步骤周期中时空激活腰骶运动神经元(Spatiotemporal activation of lumbosacral motoneurons in the locomotor step cycle),《神经生理学杂志》,2002.87(3):第1542-53页。
22.卡佩利尼,G.(Cappellini,G.)等人,脊髓中运动神经群活动性的迁移反映人类运动中的身体机制(Migration of motor pool activity in the spinal cord reflects body mechanics in human locomotion),《神经生理学杂志》,2010.104(6):第3064-73页。
23.伊凡宁柯,Y.P.(Ivanenko,Y.P.)等人,由人类脊髓表示的运动模式的时间分量反映足运动学(Temporal components of the motor patterns expressed by the human spinal cord reflect foot kinematics),《神经生理学杂志》,2003.90(5):第3555-65页。
24.多米尼西,N.等人,初生婴儿和其发育过程中的运动基元(Locomotor primitives in newborn babies and their development),《科学》,2011.334(6058):第997-9页。
25.基恩,O.(Kiehn,O.),哺乳动物脊髓中的运动回路(Locomotor circuits in the mammalian spinal cord),《神经科学年鉴(Annu Rev Neurosci)》,2006.29:第279-306页。
26.张,T.C.(Zhang,T.C.)、J.J.雅尼克(J.J.Janik)和W.M.格里尔(W.M.Grill),用于治疗神经性疼痛的脊髓刺激的机制和模型(Mechanisms and models of spinal cord stimulation for the treatment of neuropathic pain),《大脑研究(Brain Res)》,2014.1569:第19-31页。
27.米涅夫,I.R.等人,用于长期多模态神经接口的电子硬脑膜(Electronic dura mater for long-term multimodal neural interfaces),《科学》,2015.347(6218):第159-163页。
28.西尔莫,C.M.(Schirmer,C.M.)等人,使用直接术中神经根刺激的人类生肌节神经支配的启发式映射:临床报道(Heuristic map of myotomal innervation in humans using direct intraoperative nerve root stimulation:Clinical article),《神经外科杂志:脊柱(Journalof Neurosurgery:Spine)》,2011.15(1):第64-70页。
29.拉夫罗夫,I.(Lavrov,I.)等人,成年脊柱大鼠中硬膜外刺激诱导的脊柱运动网络的调制(Epidural stimulation induced modulation of spinal locomotor networks in adult spinal rats),《神经科学杂志》,2008.28(23):第6022-9页。
30.米纳西安,K.(Minassian,K.)等人,由腰椎脊髓的硬膜外刺激诱导的患有完全脊髓损伤的人类的步进样动作:复合肌肉作用电势的肌电研究(Stepping-like movements in humans with complete spinal cord injury induced by epidural stimulation of the lumbar cord:electromyographic study of compound muscle action potentials),《脊髓》,2004.42(7):第401-16页。
31.万登布兰德,R.等人,麻痹性脊髓损伤后运动自主控制的恢复,《科学》,2012.336(6085):第1182-1185页。
32.多米尼西,N.等人,在神经运动病症后评估、启用和训练运动和平衡的多功能机器人接口(Versatile robotic interface to evaluate,enable and train locomotion and balance after neuromotor disorders),《自然医学(Nat Med)》,2012.18(7):第1142-7页。
33.加德,P.(Gad,P.)等人,开发用于脊髓硬膜外刺激的多电极阵列以促进成年大鼠在完全脊髓损伤后的步进和站立(Development of a multi-electrode array for spinal cord epidural stimulation to facilitate stepping and standing after a complete spinal cord injury in adult rats),《神经工程和康复治疗杂志(Journal of neuroengineering and rehabilitation)》,10,2(2013)。
- 还没有人留言评论。精彩留言会获得点赞!