含作为活性成分的来源于乳酸菌的细胞外囊泡的预防或治疗炎性疾病的组合物的制作方法
本发明涉及用于预防、改善或治疗炎性疾病的组合物,其包含作为活性成分的来源于乳酸菌的细胞外囊泡,以及涉及用于诊断特应性皮炎的方法。
背景技术:
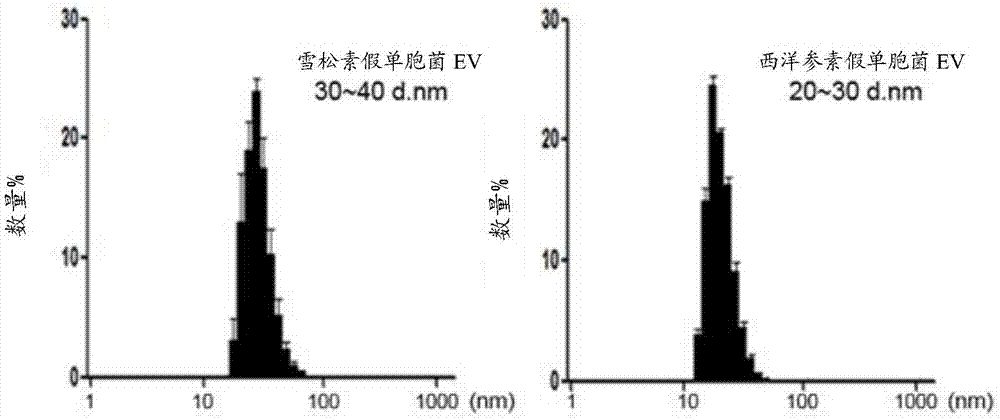
:近年来,由于生活方式的改变,疾病模式已从急性传染病转变为慢性炎性疾病。炎症是身体内的响应于进入体内的外部有毒物质的防御机制。急性炎症是由环境细菌、真菌等的短期感染引起的,当环境中存在的致病因子(如微生物、过敏原等)持续吸收到体内时,引发慢性炎症。最近强调了感染原因对发生被认为是非传染性原因引发的慢性炎性疾病的重要性。有代表性的是,由于已知在胃中共存的幽门螺杆菌(helicobacterbacteria)已被鉴定为胃炎、胃癌等的关键致病因子,因此已知共存于该环境的细菌和来源于该细菌的物质最近作为慢性炎性疾病和慢性炎症并发症引发的癌症致病因子引起了关注。特应性皮炎是一种在婴儿早期和儿童期最常发现的真皮疾病,也是特应性病程(atopicmarch)发展为哮喘或过敏性鼻炎的第一个信号。此外,特应性皮炎是一种慢性炎性疾病,其特征在于慢性瘙痒和皮肤反复发炎,因此不仅在身体上和精神上影响患者本身,而且影响家庭生活质量。近年来,特应性皮炎全球患病率的增加正受到越来越多的关注。在韩国,根据韩国儿科过敏呼吸学会进行的国际儿童过敏和哮喘研究(isaac)调查,对于特应性皮炎,与1995年相比,到目前为止,在2000年,从6岁到12岁的年龄范围的患病率(1995年为15.3%,2000年为17.0%)和从12岁到15岁年龄范围的患病率(1995年为7.2%,2000年为9.2%)都提高了,并且在最近12个月,对于特应性皮炎,在2000年,从6岁到12岁的年龄范围的患病率(1995年为7.3%,2000年为10.7%)和从12岁到15岁年龄范围的患病率(1995年为3.9%,2000年为6.1%)都提高了。特应性皮炎等过敏性疾病是由遗传因素与环境因素的结合的相互作用引起的,并且最近的增长趋势不足以仅由遗传因素来解释。虽然取决于国家的过敏性疾病发病率的差异反映出种族群体之间的差异,即遗传因素的重要性,但与前东德地区在回归后激增的过敏性疾病所显示的结果相同的结果表明,环境因素也很重要。这种过敏性疾病的激增涉及西化生活,并且可能有三个可能的原因:首先,因为通常在室内花费更多的时间而导致在室内暴露于尘螨的增加;其次,由于环境卫生和使用抗生素而导致暴露于广泛的微生物;第三,西化饮食习惯。特应性皮炎患者经常患有由皮肤屏障的功能紊乱或免疫功能障碍引起的皮肤感染。特别是葡萄球菌(staphylococcus)引起的细菌感染、由单纯疱疹病毒引起的病毒感染以及真菌感染是常见的。其中,在90%的特应性皮炎患者中检测到金黄色葡萄球菌(staphylococcusaureus),并且在没有明显感染症状的皮肤病灶中也检测到金黄色葡萄球菌,且金黄色葡萄球菌毒素作为增强过敏免疫反应的超抗原,已知其会加剧皮肤瘙痒和病变。特应性皮炎的预后根据患者的皮肤状况、刺激因素、伴随的过敏性疾病、以及细菌感染的不同而变化。一般来说,特应性皮炎随着年龄的增长而逐渐改善,而年龄较小时症状严重,慢性病变仍然存在。然而,有报道显示,约有40%的患者在5岁左右改善了症状,但这种改善的原因是有争议的。治疗由于各种原因而加剧的特应性皮炎的最具代表性的方法包括消除致病因子,同时局部和全身施用类固醇或局部施用免疫抑制剂以及适当使用保湿剂。然而,最近的研究表明,除了这些因素之外,可以使用乳酸菌或其培养物来降低特应性皮炎的严重性。哮喘和慢性阻塞性肺病(copd)是具有由慢性气道炎症引起的气道阻塞特征的疾病,其中哮喘的特征在于可逆性气道阻塞,copd的特征在于不可逆性气道阻塞。已知对由作为哮喘的致病因子的屋尘螨导致的过敏原的过敏反应在嗜酸粒细胞性哮喘的发病机制中是重要的,近年来,研究集中在来源于细菌的物质对嗜中性粒细胞性炎症的重要性,该嗜中性粒细胞性炎症是严重哮喘或copd的特征性病理特征。特别地,已经报道了下述发现:来源于在室内尘埃中存在的病原菌的细胞外囊泡在哮喘和copd发作中是重要的。此外,据报道,鼻腔中共存的细菌和源自该细菌的物质在慢性鼻窦炎的发病机理中起重要作用,并且鼻腔中细菌菌群的多样性减少并且特定病原体(特别是葡萄球菌(staphylococci))增加在慢性鼻窦炎的发病中是重要的。细菌分泌双层结构的脂蛋白,即通常称为纳米囊泡的进入细胞外环境的细胞外囊泡(ev)。来源于革兰氏阴性细菌的细胞外囊泡或外膜囊泡(omv)含有毒性蛋白质与细菌dna和rna以及脂多糖,而来源于革兰氏阳性细菌的细胞外囊泡也含有细菌细胞壁成分,如肽聚糖和脂磷壁酸以及毒性蛋白质和核酸。近年来,据报道,从代表性的革兰氏阳性菌金黄色葡萄球菌(staphylococcusaureus)分泌的ev是特应性皮炎、慢性鼻窦炎、嗜中性粒细胞性哮喘和copd的重要致病因子,并且,据报道,来源于病原性革兰氏阴性细菌(如铜绿假单胞菌(pseudomonasaeruginosa)和鲍曼不动杆菌(acinetobacterbacumannii))存在于室内粉尘中,并且在吸入时成为哮喘、copd和肺癌的重要致病因子。同时,也称为环境基因组学的宏基因组学可以是对从环境样品中获得的宏基因组材料进行的分析。最近,可以通过基于16s核糖体rna(16srrna)碱基序列的方法对人类微生物群落的细菌组成进行编目,并使用454flx钛平台对16srrna进行测序。同时,在对根据患者样品分析的宏基因组进行研究的同时,不知道来源于细菌的ev存在于血清中还是尿液中,因此未对从血清或尿液中分离的来源于细菌的ev进行宏基因组分析。另外,根据使用从患者血清或尿液中分离出来的ev的dna进行宏基因组分析的结果,不存在使用来源于细菌的ev来预防或治疗诸如特应性皮炎、哮喘、copd、慢性鼻炎、慢性鼻窦炎和败血症等炎性疾病的情况。技术实现要素:【技术问题】本发明人通过使用从特应性皮炎患者和正常人的尿液中分离出的ev的dna进行宏基因组分析的结果,证实了与特应性皮炎患者相比,正常人的尿液中的来源于乳酸菌的ev明显增加,并且来源于乳酸菌的ev有效抑制由来源于金黄色葡萄球菌(staphylococcusaureus(s.aureus))和铜绿假单胞菌(pseudomonasaerugionsa(p.aeruginosa))的ev引起的炎性反应,金黄色葡萄球菌和铜绿假单胞菌是炎性疾病的主要致病因子,因此完成了本发明。因此,本发明涉及提供一种用于预防、改善或治疗炎性疾病的组合物,其包含作为活性成分的来源于乳酸菌的ev。本发明还涉及提供用于诊断特应性皮炎的方法。然而,本发明中要解决的技术问题不限于上述问题,本领域普通技术人员将根据下面的描述充分理解本文中未描述的其它问题。【技术方案】一方面,本发明提供一种用于预防或治疗炎性疾病的药物组合物,其包含作为活性成分的来源于乳酸菌的ev。另一方面,本发明提供一种用于改善炎性疾病的化妆品组合物,其包含作为活性成分的来源于乳酸菌的ev。另一方面,本发明提供了用于改善炎性疾病的健康功能性食品组合物,其包含作为活性成分的来源于乳酸菌的ev。另一方面,本发明提供一种用于预防或治疗炎性疾病的吸入剂组合物,其包含作为活性成分的来源于乳酸菌的ev。在本发明的一个示例性实施方式中,乳酸菌可以包括乳杆菌目(lactobacillales)中的细菌。在本发明的另一个示例性实施方式中,乳杆菌目(lactobacillales)中的细菌可以包括乳球菌(lactococcus)属,乳杆菌属(lactobacillus)或明串珠菌(leuconostoc)属中的细菌。在本发明的另一个示例性实施方式中,乳杆菌属(lactobacillus)中的细菌可以包括植物乳杆菌(lactobacillusplantarum)。在本发明的另一示例性实施方式中,ev可以具有10nm至300nm的平均直径。在本发明的另一个示例性实施方式中,ev可以与乳酸菌的培养物分离。在本发明的另一个示例性实施方式中,ev是从乳酸菌天然或通过人工分泌的。在本发明的另一个示例性实施方式中,炎性疾病可以是选自由特应性皮炎、慢性鼻炎、慢性鼻窦炎、哮喘、copd和败血症组成的群组中的疾病。在另一方面,本发明提供了一种诊断特应性皮炎的方法,其包括以下步骤:(a)从分离自临床样品的ev中提取基因;(b)对所述基因测序;以及(c)通过测序确定当来源于乳酸菌的ev的分布低于正常人的时,存在特应性皮炎的高风险。在本发明的一个示例性实施方式中,该基因可以是dna或rna。在本发明的另一个示例性实施方式中,临床样品可以是尿液或血液。在本发明的另一个示例性实施方式中,可以通过聚合酶链式反应(pcr)进行测序。另一方面,本发明提供了一种预防或治疗炎性疾病的方法,其包括将含有作为活性成分的来源于乳酸菌的ev的组合物施用于受试者。在另一方面,本发明提供了来源于乳酸菌的ev用于预防或治疗炎性疾病的用途。在另一方面,本发明提供了来源于乳酸菌的ev用于诊断特应性皮炎的用途。【有益效果】本发明人通过体外和体内实验确认,与特应性皮炎患者相比,较大量的来源于乳酸菌的ev显著分布在正常人中,由于暴露于来源于葡萄球菌(staphylococcus)或假单胞菌属细菌(pseudomonas)的ev而在上皮细胞和炎性细胞中的炎性反应被来源于乳酸菌的ev有效地抑制,并且包含作为有效成分的来源于乳酸菌的ev的用以防止、改善或治疗诸如特应性皮炎、慢性鼻炎、慢性鼻窦炎、哮喘、慢性阻塞性肺病或败血症等炎性疾病的组合物预期可用于开发药物、化妆品或健康功能食品。此外,由于在尿液或血液样品中检测到来源于乳酸菌的ev的分布,所以来自乳酸菌的ev可用于诊断特应性皮炎。附图说明图1显示了使用电子显微技术分别从诸如雪松素假单胞菌(pseudomonascedrina(p.cedrina))和西洋参素假单胞菌(pseudomonaspanacis(p.panacis))之类的肠杆菌的体外培养物中分离出的来源于p.cedrina和p.panacis的ev。图2显示了通过动态光散射测得的来源于p.cedrina和p.panacis的ev的大小。图3显示了通过sds-page获得的cbb-r-250-染色的凝胶,以评估在p.cedrina和p.panacis和来源于p.cedrina和p.panacis的ev中所含的蛋白质的表达。图4示出了全身图像,其示出了在将来源于p.cedrina和p.panacis的ev口服给小鼠之后的预定时间,细菌和ev在小鼠中的分布。图5示出了在将来源于p.cedrina和p.panacis的ev口服给小鼠之后12小时,从小鼠的血液、心脏、肺、肝脏和肾脏中提取的细菌和ev的分布。图6示出了在将来源于p.panacis的ev直接施用于肠后10分钟,在肠毛细血管中存在的ev。图7示出了细菌门级别的比较从特应性皮炎患者的尿液和血清中分离的来源于细菌的ev的分布的宏基因组分析结果。图8示出了细菌纲级别的比较从特应性皮炎患者的尿液和血清中分离的来源于细菌的ev的分布的宏基因组分析结果。图9示出了细菌目级别的比较从特应性皮炎患者的尿液和血清中分离的来源于细菌的ev的分布的宏基因组分析结果。图10示出了细菌科级别的比较从特应性皮炎患者的尿液和血清中分离的来源于细菌的ev的分布的宏基因组分析结果。图11示出了细菌属级别的比较从特应性皮炎患者的尿液和血清中分离的来源于细菌的ev的分布的宏基因组分析结果。图12示出了细菌门级别的比较从特应性皮炎患者和正常人的尿液中分离的来源于细菌的ev的分布的宏基因组分析结果。图13示出了细菌纲级别的比较从特应性皮炎患者和正常人的尿液中分离的来源于细菌的ev的分布的宏基因组分析结果。图14示出了细菌目别的比较从特应性皮炎患者和正常人的尿液中分离的来源于细菌的ev的分布的宏基因组分析结果。图15示出了细菌科级别的比较从特应性皮炎患者和正常人的尿液中分离的来源于细菌的ev的分布的宏基因组分析结果。图16示出了细菌属级别的比较从特应性皮炎患者和正常人的尿液中分离的来源于细菌的ev的分布的宏基因组分析结果。图17是显示从特应性皮炎患者和正常人的尿液中分离的来源于细菌的ev的宏基因组分析结果的热图。图18示出了使用电子显微技术获得的从植物乳杆菌(lactobacillusplantarum)的培养物分离出的ev的图像。图19通过动态光散射示出了从植物乳杆菌(lactobacillusplantarum)的培养物分离出的ev的大小。图20通过纳米跟踪测定(nanotraffickingassay:nta)示出了从植物乳杆菌的培养物分离的ev的数量。图21示出了在来源于金黄色葡萄球菌的ev(s.aureusev)、来源于痤疮丙酸杆菌(propionibacteriumacne)的ev(p.acnesev)和来源于乳酸菌的ev(cjlp133ev)被施用到皮肤上皮细胞后通过elisa测得的il-6分泌水平。图22示出了在来源于乳酸菌的ev(cjlp133ev)被施用到皮肤上皮细胞后在来源于金黄色葡萄球菌的ev(s.aureusev)或者来源于痤疮丙酸杆菌(propionibacteriumacne)的ev(p.acnesev)被施用到皮肤上皮细胞前12小时,通过elisa测得的il-6分泌水平。图23示出了在来源于金黄色葡萄球菌的ev(s.aureusev)或者来源于乳酸菌的ev(cjlp133ev)被施用到腹膜巨噬细胞后通过elisa测得的il-6和tnf-α分泌水平。图24示出了在来源于乳酸菌的ev(cjlp133ev)被施用到腹膜巨噬细胞后在来源于金黄色葡萄球菌的ev(s.aureusev)被施用到腹膜巨噬细胞前12小时,通过elisa测得的il-6和tnf-α分泌水平。图25示出了在来源于乳酸菌的ev(cjlp133ev)被施用到皮肤上皮细胞后在来源于金黄色葡萄球菌的ev(s.aureusev)被施用到皮肤上皮细胞前12小时,通过mtt测定法评估的凋亡程度。图26示出了在来源于乳酸菌的ev(cjlp133ev)被施用到腹膜巨噬细胞后在来源于铜绿假单胞菌(pseudomonasaeruginosa)的ev(p.aeruginosaev)被施用到腹膜巨噬细胞前12小时,通过elisa测定的il-6和tnf-α分泌水平。图27示出了将来源于铜绿假单胞菌(pseudomonasaeruginosa)的ev(p.aeruginosaev)与来源于乳酸菌的ev(cjlp133ev)一起施用于腹膜巨噬细胞后,通过elisa测定的il-6和tnf-α分泌水平。图28示出了用于评估在由来源于金黄色葡萄球菌的ev(s.aureusev)引起的特应性皮炎小鼠模型中由来源于乳酸菌的ev(cjlp133ev)的真皮施用引起的治疗效果的方案。图29示出了用于评估在由来源于金黄色葡萄球菌的ev(s.aureusev)引起的特应性皮炎小鼠模型中经皮施用来源于乳酸菌的ev(cjlp133ev)后的治疗效果的皮肤图像。图30示出了在向由来源于金黄色葡萄球菌的ev(s.aureusev)引起的特应性皮炎小鼠模型经皮施用来源于乳酸菌的ev(cjlp133ev)后,在真皮组织中的il-17的浓度。图31示出了用于评估在向由来源于金黄色葡萄球菌的ev(s.aureusev)引起的特应性皮炎小鼠模型口服施用来源于乳酸菌的ev(cjlp133ev)的治疗效果的方案。图32示出了用于评估在向由来源于金黄色葡萄球菌的ev(s.aureusev)引起的特应性皮炎小鼠模型中口服施用来源于乳酸菌的ev(cjlp133ev)后的治疗效果的皮肤图像。图33示出了在向由来源于金黄色葡萄球菌的ev(s.aureusev)引起的特应性皮炎小鼠模型口服施用来源于乳酸菌的ev(cjlp133ev)后,在真皮组织中的作为免疫应答标记的il-4、il-6、il-17和ifn-γ的浓度。图34示出了用于通过大剂量口服施用来源于乳酸菌的ev(cjlp133ev)评估毒性的方案。图35示出了在多次口服施用高剂量的来源于乳酸菌的ev(cjlp133ev)后的体重变化。图36示出了在多次口服施用高剂量的来源于乳酸菌的ev(cjlp133ev)后的小鼠的摄食量。图37示出了在多次口服施用高剂量的来源于乳酸菌的ev(cjlp133ev)后的体温变化。图38示出了在多次口服施用高剂量的来源于乳酸菌的ev(cjlp133ev)后血液中血细胞的变化(wbc:白细胞数,rbc:红细胞数,hgb:血红蛋白浓度,hct:血细胞比容,mcv:平均红细胞体积(红细胞平均体积),mch:平均红细胞血红蛋白(平均血红蛋白数),mchc:平均红细胞血红蛋白浓度(血红蛋白平均浓度)和plt:血小板数量)。具体实施方式作为使用从特应性皮炎患者和正常人的尿液中分离出的ev的dna进行宏基因组分析的结果,证实了与特应性皮炎患者相比,正常人的尿液中的来源于乳酸菌的ev明显增加,并且来源于乳酸菌的ev有效抑制由来源于炎性疾病的诸如金黄色葡萄球菌(s.aureus)和铜绿假单胞菌(pseudomonasaerugionsa(p.aeruginosa))之类的主要致病因子的ev引起的炎性反应,因此完成了本发明。在本发明的一个示例性实施方式中,作为通过从身体中的肠杆菌(例如p.cedrina和p.panacis)分离ev并且将该细菌和来自该细菌的ev口服施用给小鼠来确定分布和排泄模式的结果,证实了肠杆菌不被全身吸收,而来源于肠杆菌的ev被系统地吸收,然后在尿中排出(参见实施例1和2)。在本发明的另一示例性实施方式中,对自特应性皮炎患者的尿液和血清中分离的来源于细菌的ev的dna分别在细菌门级、纲级、目级、科级或者属级进行宏基因组分析,结果,证实了,在尿液和血清中的来源于细菌的ev的分布完全一致(参见实施例3)。在本发明的另一示例性实施方式中,基于上述结果,使用从特应性皮炎患者和正常人的尿液分离的ev的dna进行宏基因组分析。作为分析细菌门级、纲级、目级、科级和属级的ev分布的结果,与正常人相比,在特应性皮炎患者的尿液中,来源于脂环酸杆菌(alicyclobacillus)属、甲基杆菌(methylobacterium)属、链球菌(streptophyta)目、丙酸杆菌(propionibacterium)属和假单胞菌(pseudomonas)属中的细菌的ev显著增加,但来自乳杆菌目(lactobacillales)、乳杆菌属(lactobacillus)、明串珠菌(leuconostoc)属和乳球菌(lactococcus)属中的细菌的ev都显著降低。在本发明的另一个示例性实施方式中,基于宏基因组测定结果,作为对在体外培养从发酵食品分离的诸如植物乳杆菌(lactobacillusplantarum)之类的乳酸菌之后分离的ev的特征分析的结果,具有约15nm的平均直径的球形囊泡能够被分离(见实施例5),并且证实了在用囊泡处理真空上皮细胞和巨噬细胞后,通过从金黄色葡萄球菌(s.aureus)和铜绿假单胞菌(p.aeruginosa)分泌的ev的处理引起的炎性反应被显著抑制,其中金黄色葡萄球菌(s.aureus)和铜绿假单胞菌(p.aeruginosa)是炎性疾病的主要致病因子(参见实施例6至9)。在本发明的另一示例性实施方式中,基于体外试验结果,证实当将来源于乳酸菌的囊泡口服或经皮施用于由来源于金黄色葡萄球菌的ev引起的特应性皮炎小鼠模型时,由来源于金黄色葡萄球菌的囊泡引起的真皮炎症被来源于乳酸菌的囊泡有效地抑制(参见实施例10和11),并且根据向小鼠多次口服高剂量的来源于乳酸菌的ev,证实了各种生物标志物与对照无差异,导致ev的稳定性得以验证(参见实施例12)。因此,一方面,本发明提供了用于预防或治疗炎性疾病的药物组合物,其包含作为活性成分的来源于乳酸菌的ev。本文使用的术语“炎性疾病”包括通过暴露于感染因子(如细菌或来源于细菌的囊泡、毒素、病毒或真菌、变应原)诱发的感染性炎性疾病,通过暴露于变应原引诱发的过敏性炎性疾病和通过自身抗原引起的自身免疫性炎性疾病。本文使用的术语“炎性疾病”是由感染因素引起的炎性疾病的通用术语,诸如特应性皮炎、慢性鼻炎、慢性鼻窦炎、哮喘、慢性阻塞性肺病(copd)和败血症等。本文使用的术语“变应性炎性疾病”是由变应原引起的炎性疾病的通用术语,诸如特应性皮炎、慢性鼻炎、慢性鼻窦炎、哮喘和慢性阻塞性肺病(copd)等。本文使用的术语“特应性皮炎”是伴随在皮肤上长期发生的瘙痒的皮肤疾病的通用术语。本文使用的术语“预防”是指通过施用根据本发明的药物组合物来抑制或延迟炎性疾病的所有作用。本文使用的术语“治疗”是指通过施用根据本发明的药物组合物减轻或有益地改变炎性疾病的症状所涉及的所有作用。本发明的乳酸菌可以包括乳杆菌目(lactobacillales)、乳球菌(lactococcus)属、乳杆菌属(lactobacillus)、或明串珠菌(leuconostoc)属中的细菌,但本发明不受限于此。乳杆菌属(lactobacillus)中的细菌优选包括植物乳杆菌(lactobacillusplantarum),但本发明不受限于此。本发明的ev可以从乳酸菌的培养物或用乳酸菌发酵的食品中分离,并且可以从乳酸菌天然或通过人工分泌,但本发明不受限于此。从本发明的乳酸菌的培养物或发酵食品分离ev的方法没有被特别地限制,只要培养物或发酵食品中含有ev即可。例如,可以使用离心、超速离心、利用过滤器的过滤、凝胶过滤色谱法、自由流动电泳、毛细管电泳或其组合来分离ev,并且该方法可以进一步包括用于除去杂质的洗涤和所获得的ev的浓缩。通过本发明的方法分离的ev可以具有10nm至300nm的平均直径,优选为10nm至200nm,但本发明不受限于此。根据本发明的药物组合物包含作为活性成分的来源于乳酸菌的ev和药学上可接受的载体。药学上可接受的载体通常用于制备,并且可以是但不限于盐溶液、蒸馏水、林格氏溶液、缓冲盐水、环糊精溶液、葡萄糖溶液、麦芽糖糊精溶液、甘油、乙醇或脂质体等,并且可以根据需要进一步包括其它常规添加剂,例如抗氧化剂或缓冲剂。此外,药学上可接受的载体可以通过进一步添加稀释剂、分散剂、表面活性剂、粘合剂、润滑剂等制备成可注射形式(例如水溶液、悬浮液、以及乳剂)、丸剂、胶囊、颗粒或片剂。可以使用remington’spharmaceuticalscience中公开的方法根据每种成分制备合适的药学上可接受的载体及其制备物。本发明的药物组合物不限于剂型,因此可以制备成注射剂、吸入剂、用于皮肤的局部制剂或口服药物。本发明的药物组合物可以根据所期望的方法口服或胃肠外(例如静脉内、皮下、经皮、经鼻或气管内)施用,本发明的药物组合物的剂量可通过本领域普通技术人员根据患者的状况和体重、疾病的严重性、剂型、施用途径和持续时间选择。以药学上的有效量施用本发明的药物组合物。在本发明中,“药学上的有效量”是指足以以适合于医疗的合理利益/风险比治疗疾病的量,有效剂量可以通过包括患者的疾病类型、严重程度、药物活性、对药物的敏感性、给药时间、给药途径和排泄率、治疗的持续时间和同时使用的药物等在内的参数以及医学界公知的其他参数来确定。本发明的药物组合物可以单独施用或与其它治疗剂组合施用,并且可以与常规治疗剂相继或同时施用,或以单剂量或多剂量施用。考虑到所有上述参数,重要的是以最小剂量实现最大效果而没有副作用,并且这种剂量可以容易由本领域普通技术人员确定。具体地,根据本发明的化合物的有效量可以根据患者的年龄、性别和体重而变化,并且通常可以按每天或每隔一天或每天一至三次以0.001mg/kg体重至150mg/kg体重,优选0.01mg/kg体重至100mg/kg体重施用。然而,有效量可以根据给药途径、肥胖的严重程度、性别、体重或年龄而变化,因此本发明的范围不会通过任何方式而受限于该剂量。在另一方面,本发明提供一种用于改善炎性疾病的化妆品组合物,其包含作为活性成分的来源于乳酸菌的ev。本发明的化妆品组合物可以包括常规用于化妆品组合物中的成分以及来源于乳酸菌的ev,该成分例如常规添加剂和载体,常规添加剂包括抗氧化剂、稳定剂、增溶剂、维生素、颜料和调味剂。此外,除了来源于乳酸菌的ev以外,本发明的组合物还可以与常规使用的有机防晒霜组合使用,只要不损害皮肤保护作用即可。有机防晒霜可以包括选自由以下物质组成的组中的至少一种:甘油基paba、甲酚曲唑三硅氧烷(drometrizoletrisiloxane)、苯并三唑基甲基苯酚(drometrizole)、棓酰棓酸三油酸酯(digalloyltrioleate)、苯基二苯并咪唑四磺酸二钠(disodiumphenyldibenzimidazoletetrasulfonate)、二乙基己基丁酰胺三唑酮(diethylhexylbutamidotriazone)、二乙基氨基羟基苯甲酰己基苯甲酸酯(diethylaminohydroxybenzoylhexylbenzoate)、dea-甲氧基肉桂酸酯(dea-methoxycinnamate)、劳森/二羟基丙酮混合物(lawson/dihydroxyacetonemixture)、亚甲基双苯并三唑基四甲基丁苯酚(methylenebis-benzotriazolyltetramethylbutyphenol)、4-甲基亚苄基樟脑(4-methylbenzylidenecamphor)、邻氨基苯甲酸薄荷酯(menthylanthranilate)、二苯甲酮-3(氧苯酮)(benzophenone-3(oxybenzone))、二苯甲酮-4(benzophenone-4)、二苯甲酮-8(二甲氧基苯甲酮)(benzophenone-8(dixoyphebenzone))、丁基甲氧基二苯甲酰甲烷(butylmethoxydibenzoylmethane)、二乙基己氧基苯酚甲氧基苯基三嗪(bisethylhexyloxyphenolmethoxyphenyltriazine)、甲对甲氧肉硅酸乙氧乙酯(cinoxate)、乙基二羟丙基paba(ethyldihydroxypropylpaba)、氰双苯丙烯酸辛酯(octocrylene)、乙基己基二甲基paba(ethylhexyldimethylpaba)、甲氧基肉桂酸乙基己酯(ethylhexylmethoxycinnamate)、水杨酸乙基己酯(ethylhexylsalicylate)、乙基己基三嗪酮(ethylhexyltriazone)、对甲氧基肉桂酸异戊酯(isoamyl-p-methoxycinnamate)、多晶硅-15(二甲基硅酮二乙基苄基丙二酸酯)(polysilicon-15(dimethicodiethylbenzalmalonate))、对苯二亚甲基二樟脑磺酸(terephthalylidenedicamphorsulfonicacid)及其盐、tea-水杨酸酯(tea-salicylate)和氨基苯甲酸(paba)(aminobenzoicacid(paba))。可以含有本发明的化妆品组合物的产品包括例如化妆品(如收敛剂(astringent)、保湿乳液、滋养洗剂、各种乳膏剂、香精(essence)、面膜包装、粉底(foundation)等)、清洁剂、肥皂、治疗剂和其他化妆品液体。本发明的化妆品组合物的具体类型包括皮肤洗剂、皮肤柔软剂、皮肤调色剂、收敛剂、洗剂、乳液、保湿乳液、滋养洗剂、按摩膏、滋养霜、保湿霜、护手霜、香精、滋养香精、填料(pack)、肥皂、洗发水、清洁泡沫、清洁乳液、清洁霜、身体乳液、身体清洁剂、乳剂、口红、化妆底物、粉底、压粉、松散粉和眼影。另一方面,本发明提供了用于改善炎性疾病的健康功能性食品组合物,其包含作为活性成分的来源于乳酸菌的ev。本文使用的术语“改善”是指至少减少与要治疗的病症相关的参数(例如症状程度)的所有类型的动作。在本发明的健康功能性食品组合物中,活性成分可以单独添加到食品中,或者根据常规方法与另一种食品或其他食品成分一起合适地使用。活性成分的含量可以根据使用目的(用于预防或改善)适当确定。通常,在制备食品或饮料时,相对于所有成分,本发明的组合物的添加量为15重量%或以下,优选为10重量%或以下。然而,为了健康和卫生或者管理健康的目的,在长期吸收的情况下,含量可能低于上述比例。本发明的健康功能性食品组合物除了以上述比例的作为基本成分的活性成分之外,还在没有特别限制的情况下含有任何成分,并且可以含有多种调味剂或作为附加成分的天然碳水化合物,如常规饮料。上述天然碳水化合物的示例包括常规的糖,常规的糖包括:单糖,如葡萄糖、果糖等;二糖,如麦芽糖、蔗糖等;和多糖,如糊精、环糊精等,以及糖醇,如木糖醇、山梨糖醇、赤藓糖醇等。除了上述调味剂之外,天然调味剂(索马甜(thaumatin),甜叶菊提取物(例如甜叶菊甙a(rebaudiosidea),甘草甜素(glycyrrhizin)等))和合成调味剂(糖精、阿斯巴甜等)可以优选用作调味剂。天然碳水化合物的比例可以通过本领域普通技术人员的选择来适当地确定。除了上述成分之外,本发明的健康功能性食品组合物可以含有多种营养物质、维生素、矿物质(电解质)、包括合成和天然调味剂在内的调味剂、着色剂和填充剂(干酪、巧克力等)、果胶酸及其盐、藻酸及其盐、有机酸、保护胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇或用于软饮料的碳酸化剂。这些成分可以单独使用或组合使用。这样的添加剂的比例也可以由本领域普通技术人员适当选择。在另一方面,本发明提供了一种用于预防或治疗炎性疾病的吸入剂组合物,其包含作为活性成分的来源于乳酸菌的ev。在本发明的吸入剂组合物中,可以根据常规方法将活性成分直接加入到吸入剂中或与其它成分组合使用。活性成分的含量可以根据使用目的(用于预防或治疗)适当地确定。在另一方面,本发明提供一种诊断特应性皮炎的方法,其包括:从分离自临床样品的ev中提取基因;对所述基因测序;以及通过该测序确定当来源于乳酸菌的ev的分布低于正常人时,特应性皮炎的风险将是高的。基因可以是dna或rna,但是本发明不受限于此。临床样品可以是尿液或血液,但是本发明不受限于此。可以通过聚合酶链式反应(pcr)进行测序,但本发明不受限于此。在本发明的另一方面,本发明提供一种预防或治疗炎性疾病的方法,其包括向受试者施用包含作为活性成分的来源于乳酸菌的ev的组合物。本文使用的“受试者”是指具有待治疗的疾病的靶标,更具体地说是指人或哺乳动物,例如非人灵长类动物、小鼠、大鼠、狗、猫、马或牛。在下文中,将提供示例性实施例来帮助理解本发明。然而,仅提供以下实施例以更容易理解本发明,但本发明的范围不限于以下实施例。[实施例]实施例1。来源于肠杆菌的ev的分离和特征评价将ev从肠杆菌菌株(例如p.cedrina和p.panacis)分离,并分析其特征,将两种株菌分别在30℃和25℃下在luria-bertani液体培养基(lb液体培养基)中培养。将每种细菌培养物以5,000g离心30分钟,进行两次,以使用0.45μm瓶顶过滤器(corning)过滤上清液,然后使用quixstandtm(gehealthcarebio-sciencesab)浓缩洗脱的样品。再次使用0.22μm瓶顶过滤器(corning)过滤浓缩的样品以分离ev,并使用bca测定法(thermoscientific)测量ev的蛋白质浓度。使用电子显微技术观察从细菌培养物分离的ev,将生理盐水(pbs,50μg/ml)中的ev置于300目铜网格(electronmicroscopysciences)上,用2%的乙酸铀酰染色12小时。然后,使用jem1011显微镜(jeol)在100kv的加速电压下拍摄图像,以观察ev。结果,如图1所示,观察到来源于p.cedrina和p.panacis的ev具有球形形状。另外,为了通过动态光散射(dls)测量从细菌培养物分离的ev的大小,使用zetasizernanos(malverninstrumentsltd.,633nm激光线,散射强度10×30s)测量ev的直径。结果,如图2所示,分别在30nm至40nm和20nm至30nm测定了来源于p.cedrina和p.panacis的ev的直径。随后,为了评估来自两个菌株的ev中所含的蛋白质的表达,对蛋白质样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)。将从细菌细胞和来自细菌的ev(ev)获得的全细胞裂解物(wcl)加载到15%的拆分凝胶(resolvinggel)中,进行电泳,然后将凝胶(其中按大小分离蛋白质)用cbbr-250(考马斯亮蓝r-250)染色。结果,如图3所示,细菌的两种菌株及来自这两种菌株的ev显示出不同的蛋白质组成。实施例2.对来源于p.cedrina和p.panacis的ev的吸收、分布和排泄的评估为了评估口服来源于p.cedrina和p.panacis的ev后的吸收、分布和排泄,使用jacksonlaboratory提供的c57bl/6j(6至8周龄)雄性小鼠进行实验。p.panacis和来源于p.panacis的ev在室温下用cy7(gehealthcare)标记1小时,然后在过夜禁食后以20μg/小鼠的剂量给小鼠喂食。在0小时(h)、5分钟(min)、3小时(h)和12小时(h)之后,使用ivis光谱ct(selectscience)在780至800nm的波长下拍摄小鼠的全身图像。结果,如图4所示,口服给药后5分钟内在胃中发现p.panacis,然后被排泄而不被吸收。然而,证实了,口服给药后5分钟,来源于p.panacis的ev(ev)被系统吸收,在给药后3小时被分布到心血管系统、肺和肝脏中,并被膀胱排出。之后,为了评价该细菌和来源于该细菌的ev的组织分布,口服给药后12小时提取心脏、肺、肝脏、和肾脏,使用ivis谱ct检测荧光物质。结果,如图5所示,在血液、心脏、肺、肝脏和肾脏中,证实发现了来源于p.panacis的ev,没有发现p.panacis。此外,为了检查来源于细菌的ev是否实际上在肠内通过肠内血管吸收,从经历过夜禁食的小鼠中提取大肠,并且在密封其两端之后,将用10μg发出绿色荧光的gfp标记的来源于p.panacis的ev注入该肠内。之后,使用tcssp5显微镜(leica)拍摄大肠固有层的血液的图像。给药后10分钟,通过双光子显微镜获得图像,如图6所示,证实在毛细血管中发现了ev。实施例3.使用特应性皮炎患者的尿液和血清进行的来源于细菌的ev的宏基因组分析3-1.从特应性皮炎患者的尿液和血清中分离ev基于根据实施例2将吸收的来源于细菌的ev排泄在尿液中并分布在血液中的结果,分离存在于特应性皮炎患者的尿液和血清中的来源于细菌的ev,然后提取其中包含的dna。在首尔市顺天乡大学儿科过敏呼吸中心就诊的患者中,针对年龄大到17岁的满足特应性皮炎的hanifin和rajka诊断标准的特应性皮炎患者。患有其他皮肤疾病或在过去14天内接受局部、口服或注射抗生素的患者被排除。作为正常对照,选择没有任何皮肤病(包括特应性皮炎)、过敏性疾病、重大病史和药物使用的婴儿。从同意本研究的特应性皮炎患者组和正常对照组中的患者获得尿液和血清样品。然后,通过实施例1的方法从尿液和血清样品中分离ev,并在高温下煮沸以提取dna,然后在进行下一步之前使用nanodroptm仪器检测dna的数量和规格。3-2.从存在于尿液和血清中的ev中分离的dna宏基因组分析通过实施例3-1的方法,对从存在于特应性皮炎患者的尿液和血清样品中的ev分离的dna进行宏基因组分析。首先,对每个克隆进行pcr,以使用16srdna融合引物和faststarthighfidelitypcrsystem(roche,basel,switzerland)进行测序以扩增v1-v3区。16srdna融合引物的序列如表1所示。[表1]引物序列27f正向5’-gagtttgatcmtggctcag-3’518r反向5’-wttaccgcggctgctgg-3’对通过混合油和扩增子制备的乳液进行pcr扩增,以利用tissuelyserii(qiagen)和gs-flxplusempcr试剂盒(454lifesciences)产生含有扩增混合物和单个珠粒的“微反应器”。将乳液分配到96孔板中,并将每个dna样品的20ng等分试样包含在50μlpcr反应混合物中,随后根据制造商的方案进行pcr(第一步:在94℃下,3分钟;第二步:在94℃下,15秒,在55℃下,45秒,在72℃下,1分钟,循环35次;最终步骤:在72℃下,8分钟)。通过乳液pcr(empcr)扩增每个dna,并使用ampurebead试剂盒(beckmancoulter,brea,ca,美国)纯化扩增子,然后使用picogreen方法(invitrogen,carlsbad,ca,美国)进行定量。随后,使用gs-flxtitanium测序仪(roche,basel,瑞士)对扩增子进行稀释和分析。在pcr扩增后,将各乳液化学分解,通过过滤洗涤具有扩增dna文库的珠粒。使用生物素化引物a(与衔接子a互补)纯化阳性珠粒,并连接到链霉亲和素包被的磁珠上。随后,通过熔化双螺旋结构将附着于磁珠的dna文库珠粒与磁珠分离,从而允许单链dna通过。测序引物再次用于产生扩增的单链dna。最后,使用粒子计数器(beckmancoulter)对含有扩增的单链dna的珠粒计数。使用genomesequencerflx钛(454lifesciences)进行测序,并将每个样品加载到70mm至75mm的picotiter板(454lifesciences)中。对于通过生物信息学进行的宏基因组分析,检测了phred质量分数(平均phred数>20)和阅读长度(>300bp)以收集高质量序列。使用uclust和usearch(edgar,2010)分析操作分类单位(out),并使用qiime(lozupone,etal.,2006)分析系统发育分类。基于相似度,所有16srna序列以以下系统发育水平分类:种>97%的相似度;属>94%的相似度;科>90%的相似度;目>85%的相似度;纲>80%的相似度;门>75%的相似度。当特应性皮炎患者组和正常对照组之间的组合物的显著差异被检测到为两倍或更高时,将属级细菌组合物绘制为热图。当组合物的显著差异为两倍或更高时,或在特应性皮炎患者组与正常对照组之间在属级水平上具有1%或更多的平均组合物时,进行层次聚类。3-3.尿液和血清中存在的来源于细菌的ev之间的关系的分析根据实施例3-1的方法从存在于特应性皮炎患者的尿液和血清中的来源于细菌的ev中分离出dna后,根据实施例3-2的方法通过宏基因组分析来分析16srdna的碱基序列以比较存在于尿液和血清中的来源于细菌的ev的分布。图7至11分别显示了门级、纲级、目级、科级和属级的宏基因组分析结果,每个患者的尿液样品(煮沸的尿液)中的ev分布由红色下划线表示,其血清样品(血清)中的ev分布用蓝色下划线表示。结果,可以看出,存在于特应性皮炎患者的尿液中的来源于细菌的ev的分布和存在于特应性皮炎患者的血清中的来源于细菌的ev的分布完全一致。实施例4.特应性皮炎患者和正常人尿液中的来源于细菌的ev分布的差异的分析根据实施例3-1和3-2的方法评估特应性皮炎患者和正常人的尿液中的来源于细菌的ev的分布的差异。图12至16分别显示了门级、纲级、目级、科级和属级的宏基因组分析的结果,正常人(对照)的尿液样品中的ev分布由蓝色下划线表示,在特应性皮炎患者(病例)的尿液样品的ev分布由红色下划线表示。结果证实,特应性皮炎患者和正常人的尿液中的来源于细菌的ev的分布在所有的门级、纲级、目级、科级和属级都存在显著差异。更具体地,如图17和下表1所示,相比于正常人(对照),在以1%或以上存在于尿液中的来源于细菌的ev中,来源于脂环酸芽孢杆菌(alicyclobacillus)的ev(正常人比特应性皮炎患者为:0.31%比8.49%)、来源于甲基杆菌(methylobacterium)的ev(正常人比特应性皮炎患者为:0.22%比2.02%)、来源于链形植物(streptophyta)的ev(正常人比特应性皮炎患者为:2.87%比7.89%)、来源于丙酸杆菌(propionibacterium)的ev(正常人比特应性皮炎患者为:2.78%比7.6%)和来源于假单胞菌(pseudomonas)的ev(正常人比特应性皮炎患者为:9.56%比21.91%)在特应性皮炎患者的尿液(病例)中显著增加。然而,证实了,与正常人相比,在以1%或以上存在于尿液中的来源于细菌的ev中,来源于乳杆菌属(lactobacillus)的ev(正常人比特应性皮炎患者为:20.92%比4.61%),来源于明串珠菌属(leuconostoc)的ev(正常人比特应性皮炎患者为:14.60%比0.12%)、来源于乳杆菌目(lactobacillales)的ev(正常人比特应性皮炎患者为:18.19%比0.05%)和来源于乳球菌(lactococcus)的ev(正常人比特应性皮炎患者为:11.57%比0.03%)在特应性皮炎患者的尿液中显著降低。[表2]实施例5.乳酸菌的培养物中的ev的分离及其特性的分析根据实施例4的结果,既然证实了,与正常人相比,特应性皮炎患者的尿液中的乳杆菌属(lactobacillus)和来源于乳杆菌属(lactobacillus)的ev显著降低,因此对来源于乳杆菌属(lactobacillus)的ev的免疫反应和炎性反应的作用被研究。为此,培养从泡菜分离的诸如植物乳杆菌(lactobacillusplantarum)之类的乳酸菌,然后以10,000×g将乳酸菌的培养物离心20分钟,然后仅收集上清液并用0.22mm过滤器过滤。将尺寸为100kda或以上的在分离滤液中的ev浓缩至一定量后,以150,000×g在4℃下超速离心3小时,弃去上清液后剩余的ev簇用生理盐水稀释(pbs),然后使用bca蛋白测定法(pierce,usa)测量其浓度。之后,为了确认从乳酸菌分离出的ev的物理性质是相同的,进行动态光散射和电子显微技术。通过电子显微技术,如图18所示,观察到来自乳酸菌的ev具有球形形状,并且如图19所示,通过动态光散射证实它们具有约15nm的平均直径。之后,为了确定分离的ev的量,进行纳米粒子跟踪分析(nanosight:lm10hs)。浓度调整为500ng/ml的2ml的ev样品被制备后,将0.3ml至0.4ml的样品置于lm-10hs仪器的室中,并使用照相机进行聚焦,使颗粒清晰可见。在照相机被聚焦之时升高到最大水平时,通过逐级降低水平来捕获样品,以确认样品是否没有漂移。在确认样品的浓度、聚焦和漂移后,将捕获持续时间设定为30秒,从而获得数据。结果,如图20所示,基于1μg的蛋白质证实存在2.47×108的ev。实施例6.来源于乳酸菌的ev对通过在皮肤上皮细胞中的s.aureusev刺激引起的免疫应答的免疫调节作用的确定为了看到来源于乳酸菌的ev在炎性反应中的作用,分别用浓度为10ng至25μg/ml的已知为炎性疾病的主要致病因子的来源于金黄色葡萄球菌的ev(s.aureusev)和来源于痤疮丙酸杆菌的ev(p.acnesev)以及用浓度为10ng至25μg/ml的通过实施例5的方法分离的来源于乳酸菌的ev(cjlp133ev)处理皮肤上皮细胞系(hacat)的2×105个细胞,培养12小时,并通过elisa检测到导致上清液中th17免疫应答的细胞因子il-6的分泌水平。结果,如图21所示,与来源于金黄色葡萄球菌(s.aureus)和来源于痤疮丙酸杆菌(p.acnes)的囊泡相比,当用来源于乳酸菌的ev处理时,确定出il-6的分泌水平显著较低。另外,用不同浓度(0.1μg/ml、1μg/ml和10μg/ml)的来源于乳酸菌的ev处理皮肤上皮细胞,12小时后,再用25μg/ml的来源于金黄色葡萄球菌(s.aureus)和来源于痤疮丙酸杆菌(p.acnes)的囊泡处理,然后培养12小时,接着通过elisa确定上清液中炎性细胞因子il-6的分泌水平。结果,如图22所示,当来源于乳酸菌的ev(s.aureusev)被预处理时,由来源于金黄色葡萄球菌(s.aureus)的囊泡引起的il-6分泌物依赖于浓度地减少,但来源于乳酸菌的ev对来源于痤疮丙酸杆菌的囊泡(p.acnesev)引起的il-6分泌的ev没有影响。这样的结果表明,来源于乳酸菌的ev通过来源于金黄色葡萄球菌(s.aureus)的ev抑制th1介导的免疫应答和炎性反应,并且具体地作用于通过来源于金黄色葡萄球菌(s.aureus)的ev引起的免疫功能的异常。实施例7.确定来源于乳酸菌的ev对炎症细胞中通过来源于金黄色葡萄球菌(s.aureus)的ev刺激引起的炎性反应的抗炎作用。检测了来源于乳酸菌的ev对炎性细胞中由来源于金黄色葡萄球菌(s.aureus)的ev引起的炎性反应的作用。首先,用1μg来源于金黄色葡萄球菌(s.aureus)的ev或10ng、100ng或1μg的来源于乳酸菌的ev(cjlp133)处理炎症细胞,即小鼠腹膜巨噬细胞系(raw264.7)12小时,因此检测并比较从腹膜巨噬细胞分泌的炎性细胞因子il-6和tnf-α的量。结果,如图23所示,与使用来源于金黄色葡萄球菌(s.aureus)的囊泡进行处理相比,当用来源于乳酸菌的ev进行处理时,il-6和tnf-α的分泌显著地减少,而与浓度无关。这意味着,与来源于金黄色葡萄球菌(s.aureus)的囊泡相比,当来源于乳酸菌的ev被吸收在小鼠中时,其安全得多。基于此结果,用来源于乳酸菌的ev以不同的浓度(0.01μg/ml、0.1μg/ml和1μg/ml)处理小鼠腹膜巨噬细胞系,12小时后,以1μg/ml的浓度处理来源于金黄色葡萄球菌(s.aureus)的ev,然后再过12小时后,通过elisa检测炎性细胞因子il-6和tnf-α的量。结果,如图24所示,证实了当来源于乳酸菌的ev被预处理时,由来源于金黄色葡萄球菌(s.aureus)的ev引起的il-6和tnf-α分泌被抑制。这意味着来源于乳酸菌的ev可以有效地抑制由来源于金黄色葡萄球菌(s.aureus)的ev引起的炎性细胞的炎性反应。实施例8.确定通过来源于金黄色葡萄球菌(s.aureus)的ev刺激引起的皮肤上皮细胞凋亡中来源于乳酸菌的ev对凋亡的抑制作用为了评估在通过来源于金黄色葡萄球菌(s.aureus)的ev引起的皮肤上皮细胞的凋亡中来源于乳酸菌的ev对凋亡的抑制作用,皮肤上皮细胞用来源于乳酸菌的ev在实施例6中使用的浓度和条件相同的浓度和条件下预处理,然后以25μg的浓度处理来源于金黄色葡萄球菌的囊泡(s.aureusev)24小时,并进行mtt测定(sigma,usa)。结果,如图25所示,由来源于金黄色葡萄球菌(s.aureus)的囊泡引起的皮肤上皮细胞的凋亡通过以0.1μg/ml或1μg/ml的浓度的来源于乳酸菌的ev处理而被有效地抑制。实施例9.鉴定来源于乳酸菌的ev对由来源于铜绿假单胞菌(p.aeruginosa)的ev引起的炎症的抗炎作用铜绿假单胞菌(p.aeruginosa)是属于假单胞菌(pseudomonas)属的抗生素抗性的主要致病菌,也称为败血症的主要致病菌。最近,来源于铜绿假单胞菌(p.aeruginosa)的ev由于通过气道的反复接触而已知是慢性肺疾病(如哮喘)、慢性阻塞性肺病(copd)或肺癌的主要致病因子。在此背景下,评估来源于乳酸菌的ev对由来源于铜绿假单胞菌(p.aeruginosa)的囊泡引起的炎性反应的抗炎作用。为此,以不同浓度(0.01μg/ml、0.1μg/ml和1μg/ml)的来源于乳酸菌的ev(cjlp133ev)处理炎症细胞(腹膜巨噬细胞系(raw264.7)),12小时后,以1μg/ml的浓度处理来源于铜绿假单胞菌的ev(p.aeruginosaev),然后通过elisa检测炎性细胞因子il-6和tnf-α的浓度。结果,如图26所示,证实了,通过来源于铜绿假单胞菌(p.aeruginosa)的囊泡刺激的il-6和tnf-α的分泌几乎与被处理的来源于乳酸菌的ev的浓度成比例地被完全抑制。此外,根据用来源于铜绿假单胞菌(p.aeruginosa)的ev和来源于乳酸菌的ev对腹膜巨噬细胞系的同时处理以及炎性细胞因子的分泌水平的评价,如图27所示,证实了,通过来源于乳酸菌的囊泡的处理,可明显地抑制由来源于铜绿假单胞菌(p.aeruginosa)的ev刺激引起的il-6和tnf-α的分泌。上述结果表明,已知为慢性肺部疾病和败血症的致病因子的来源于铜绿假单胞菌(p.aeruginosa)的囊泡引起的炎症被来源于乳酸菌的囊泡有效地抑制。实施例10.确定通过真皮施用来源于乳酸菌的ev对由于来源于金黄色葡萄球菌(s.aureus)的ev导致的特应性皮炎的抑制作用由于根据实施例6至8确定了通过来源于乳酸菌的ev抑制由来源于金黄色葡萄球菌(s.aureus)的ev引起的免疫调节、抗炎和真皮细胞凋亡的效果,因此就评估通过皮肤施用来源于乳酸菌的ev而产生的实用的特应性皮炎治疗效果。为此,根据图28所示的方案,skh-1无毛小鼠每周三次重复涂敷10μg来源于金黄色葡萄球菌的ev(s.aureusev),持续4周,以产生特应性皮炎模型,在涂敷来源于金黄色葡萄球菌的ev(s.aureusev)前12小时ev,通过用来源于乳酸菌的ev(cjlp133ev)涂敷皮肤观察到对特应性皮炎发展的治疗效果。在这里,作为阳性对照,以300μg的浓度腹膜内注射用作特应性皮炎药物的免疫抑制剂地塞米松(dexamethasone),并且实验在相同的条件下进行。结果,如图29所示,与未经涂敷的小鼠模型相比,当用来源于乳酸菌的ev涂敷由来源于金黄色葡萄球菌(s.aureus)的ev诱导的特应性皮炎小鼠模型时,皮肤病灶的尺寸减少,并且当施用100μg来源于乳酸菌的囊泡时,证实了,与腹膜内施用免疫抑制剂地塞米松的情况类似地抑制皮肤病灶。此外,作为测量在真皮组织中引起th17炎症的代表性免疫标记物il-17的结果,如图30所示,当将来源于乳酸菌的ev施加于皮肤时,与未施用来源于乳酸菌的ev相比,检测到低浓度的il-17,与阳性对照(dexa)的浓度相似。上述结果表明,当经皮肤施用来源于乳酸菌的ev时,可以有效地抑制诸如特应性皮炎等真皮炎性疾病。实施例11.口服施用来源于乳酸菌的ev对来源于金黄色葡萄球菌(s.aureus)的ev引起的真皮炎症的治疗效果的确定为了评价通过口服施用来源于乳酸菌的ev来治疗特应性皮炎的效果,根据图31所示的方案,将来源于10μg金黄色葡萄球菌的囊泡(s.aureusev)每周三次重复施用于skh-1无毛小鼠,持续四周,以产生特应性皮炎模型,并且在施用来源于金黄色葡萄球菌(s.aureus)的囊泡前12小时,通过口服施用来源于乳酸菌的ev(cjlp133ev)来观察对特应性皮炎发展的治疗效果。结果,如图32所示,与未施用来源于乳酸菌的ev时相比,当口服施用来源于乳酸菌的ev时,皮肤病灶的尺寸减少,并且在以10μg或100μg施用来源于乳酸菌的ev的小鼠中,没有观察到皮肤病灶。另外,为了评估真皮组织中的免疫和炎症标记物,作为测量真皮组织中il-4、il-5、il-17和ifn-γ的浓度的结果,如图33所示,口服施用来源于乳酸菌的ev时,证实了,细胞因子的分泌被显著抑制。上述结果表明,当口服施用来源于乳酸菌的ev时,有效地抑制了诸如特应性皮炎之类的真皮炎性疾病。实施例12.通过多次口服高剂量的来源于乳酸菌的ev评估安全性为了评估大剂量重复施用来源于乳酸菌的ev产生的毒性,每周三次口服施用500μg来源于乳酸菌的ev(cjlp133),按如图34所示的方法持续四周(共12次)。之后,在未施用囊泡的对照和口服施用来源于乳酸菌的囊泡的组中,检测每只小鼠的体重、进食量和体温。结果,如图35至图37所示,证实了,在对照组和施用了来源于乳酸菌的囊泡的组的所有三个指标之间没有显著差异。此外,口服施用后4周,提取血液以分析血细胞成分,结果是,在图38所示的在对照组和施用了来源于乳酸菌的囊泡的组之间的8种类型的指标(wbc:白细胞数,rbc:红细胞数,hgb:血红蛋白浓度,hct:血细胞比容,mcv:平均红细胞体积,mch:平均红细胞血红蛋白,mchc:平均红细胞血红蛋白浓度,和plt:血小板数量)中没有显著差异。上述结果表明,当以高剂量口服施用时,来源于乳酸菌的ev可以安全地呈现治疗效果。本领域普通技术人员应当理解,本发明的上述说明是示例性的,并且在不脱离本发明的技术精神或基本特征的情况下,本文公开的示例性实施方式可以容易地修改为其他具体形式。因此,上述示例性实施方式应被解释为说明性的,并且不受限于任何方面。<210>1<211>19<212>dna<213>人工序列<220><223>16srdna融合引物_27f<400>1gagtttgatcmtggctcag19<210>2<211>17<212>dna<213>人工序列<220><223>16srdna融合引物_518r<400>2wttaccgcggctgctgg17序列表<110>md保健株式會社<120>含作为活性成分的来源于乳酸菌的细胞外囊泡的预防或治疗炎性疾病的组合物<130>mpo17-031cn<150>kr10-2015-0033698<151>2015-03-11<150>kr10-2016-0029069<151>2016-03-10<150>pct/kr2016/002473<151>2016-03-11<160>2<170>siposequencelisting1.0<210>1<211>19<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(1)..(19)<223>16srdna融合引物_27f<400>1gagtttgatcmtggctcag19<210>2<211>17<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(1)..(17)<223>16srdna融合引物_518r<400>2wttaccgcggctgctgg17当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1