使用天然化合物和/或饮食治疗炎症的方法与流程
相关申请的交叉引用
本申请要求2015年6月26日提交的美国临时申请序列号62/185,001的权益,其全部内容通过引用并入本文,包括所有附图,表格和氨基酸或核酸序列。
炎症疾病是一个重大的健康问题。目前可用的治疗涉及小分子化合物或针对参与炎症途径的各种试剂的抗体。目前针对炎症疾病的治疗会导致严重的副作用。
背景技术:
本发明提供了减轻炎症和治疗炎症疾病的方法,其不显示不良副作用。在一个实施方式中,本发明提供了一种治疗炎症疾病的方法,所述方法包括向需要抗炎症疾病治疗的受试者施用包含一种或多种天然产物(化合物)的组合物,并且任选地同时向受试者提供低碳水化合物饮食。在本发明的某些实施方式中,低碳水化合物饮食是生酮饮食(kd),改良的生酮饮食(mkd)或阿特金斯(atkins)类饮食。因此,治疗炎症疾病的方法包括向受试者施用包含一种或多种选自表没食子儿茶素-3-没食子酸酯(egcg)、姜黄素、硫配糖体和/或其衍生物(如硫代葡萄糖苷(glucoraphanin)(grp)和/或萝卜硫素(sfn)(如在西兰花芽或其他十字花科蔬菜的芽苗菜中发现的),和中链甘油三酯(mct)的化合物(组分),并且任选地向受试者提供低碳水化合物饮食例如阿特金斯饮食、mkd或kd。本申请提供一种天然化合物或与mct、kd、mkd和酮组合用于治疗炎症疾病的各种天然化合物。这些组合治疗被称为:nu.001=[egcg+姜黄素+硫配糖体]+[kd或mkd]+mct;nu.002=[egcg+姜黄素+硫配糖体];nu.003=[egcg+姜黄素+硫配糖体]+mct;nu.004=[egcg+姜黄素+硫配糖体]+酮;和nu.005=mkd+mct。
附图说明
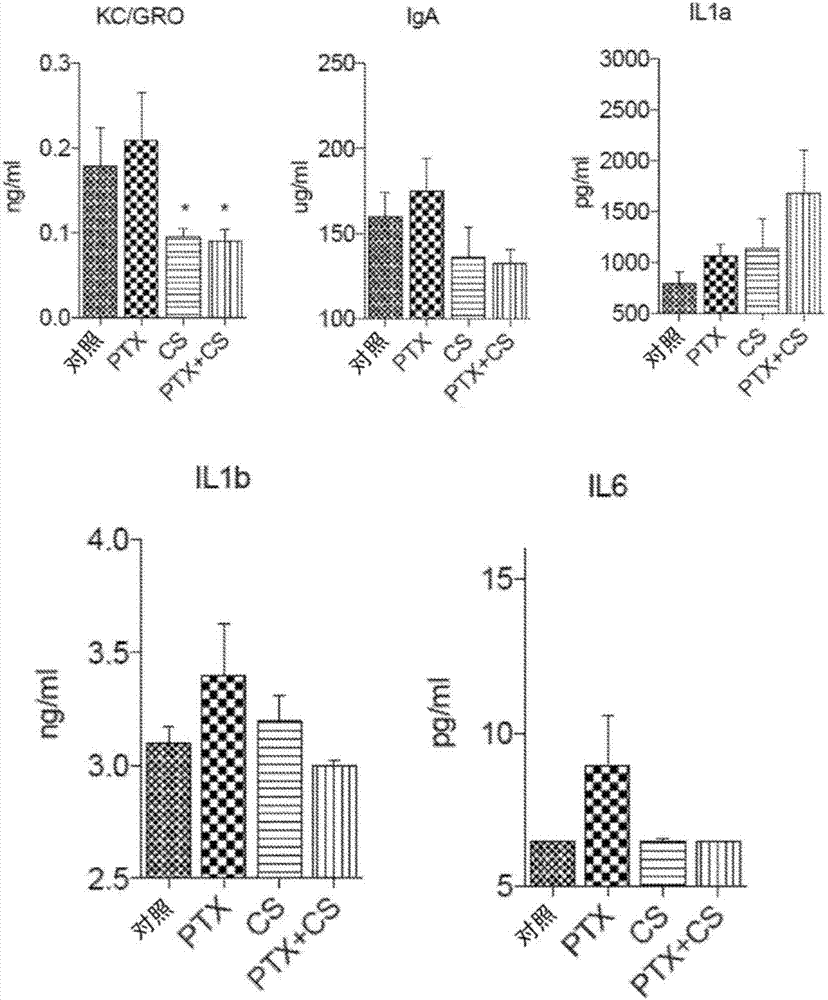
图1.使用药物诱导的炎症模型,使用细胞因子阵列来测量炎性细胞因子,免疫系统改变以及治疗减轻和重建正常状态的能力。从用不同处理方式(对照,紫杉醇[ptx,40mg/kg],nu.001[cs]和ptx+nu.001[ptx+cs])处理的小鼠中分离血浆。*表示与对照相比p<0.05和**表示p<0.01,单因素方差分析或t-检验。与ptx相比,#表示p<0.05和##表示p<0.01,单因素方差分析或t-检验。
图2.nu.001减少药物诱导的炎症模型中的炎症信号。动物接受口服递送nu.001或对照饮食3-4周。施用微管稳定剂紫杉醇[累积40mg/kg]诱导炎症。使用细胞因子阵列来测量炎症和免疫系统状态,并评估nu.001减弱或重新建立正常细胞因子水平的能力。从用不同处理方式(对照,紫杉醇,nu.001和紫杉醇+nu.001)处理的小鼠中分离血浆。结果显示炎症相关细胞因子在紫杉醇的影响下上调,并且引入nu.001能够重新建立淋巴细胞趋化因子、血小板生成素、血管内皮生长因子a[vegf-a]和白细胞介素18[il-18]的水平类似于对照水平。与对照相比,*,p<0.05,单因素方差分析。处理组合物如下:[1]对照=55%碳水化合物,30%蛋白质,15%脂肪,[2]nu.001=10-20%碳水化合物,50-60%脂肪(约一半来自mct),30%蛋白质+姜黄素[每千克体重1200mg],egcg[每千克体重1200mg]),sfn[每千克体重25mg]。
图3.nu.001能够减少促炎性细胞因子效应物。用对照饮食或nu.001饮食饲喂3-4周后,将小鼠抽血以用于随后的血浆分离。细胞因子阵列用于评估炎症状态。结果表明nu.001减少促炎性细胞因子效应物的能力,如金属蛋白酶组织抑制剂-1[timp1]、巨噬细胞炎症蛋白-1γ[mip1-g]、瘦素、巨噬细胞菌落刺激因子[mcsf]和角质形成细胞源性细胞因子/生长相关蛋白[kc/gro]。*,p<0.05,t-检验。
图4a-4b。nu.001增加白血病抑制因子[lif]和ccl22的水平。a.用对照饮食或nu.001饮食饲喂3-4周后,分离血浆用于细胞因子筛选。图4a显示了nu.001刺激lif表达的能力。已经提出lif预防或治疗外周神经病变。*,p<0.05,t-检验。b.紫杉醇治疗引起了巨噬细胞源性趋化因子[mdc/ccl22]的减少,已描述所述细胞因子在被诊断为多发性硬化症的患者中下调。本图表证实nu.001作为免疫调节剂具有减轻、预防或显著延迟mdc/ccl22缺少的能力。与对照相比,**,p<0.01,单因素方差分析,与紫杉醇相比,#,p<0.05,t-检验。
具体实施方式
术语“约”或“大约”是指在由本领域技术人员确定的特定值的可接受误差范围内,其将部分取决于如何测量或确定该值,即,测量系统的限制。例如,根据本领域的实践,“约”可以指1个以内或多于1个标准偏差。或者,“约”可以表示在给定值的0-20%,0-10%,0-5%或至多1%的范围。或者,特别是关于生物系统或方法,该术语可以指数值的一个数量级以内,优选在5倍以内,更优选在2倍以内。在本申请和权利要求书中描述特定值的情况下,除非另有说明,术语“约”应当假设对于特定值在可接受的误差范围内。在含有使用术语“约”或“大约”的组分含量的组合物的情况下,这些组合物含有所述量的组分,其值在0-20%的附近变化(误差范围)(x±20)。当在本文中使用范围时,如对于剂量范围,范围的组合和子组合(例如,所公开的范围内的子范围)和其中的具体实施方式旨在被明确地包括在内。
术语“治疗(treatment)”,“治疗(treating)”,“缓和”和“改善”(以及这些术语的任何语法变型)可以互换使用。这些术语是指用于获得有益的或期望的结果包括但不限于治疗益处的方法。通过根除或改善(减轻)与潜在病症相关的一种或多种生理症状来实现治疗益处,使得在患者中观察到改善,尽管患者仍可能患有潜在的病症。在本发明的上下文中,症状的改善包括将受试者的测量的细胞因子水平恢复(减少)至非炎性(正常)水平。在某些实施方式中,测量的细胞因子水平降低至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多。类似地,在本发明的上下文中,症状的改善包括提高由于治疗、损伤、疾病、生理失衡或失调而可能降低的细胞因子水平。在本发明的上下文中,通过增加正常的细胞因子水平可以改善由于治疗、疾病、损伤、生理平衡或失调而导致的生理症状的改善。
本发明提供了向受试者施用某些天然化合物,任选地与mkd或kd联合,改变已充分确立为炎症促进剂的炎性细胞因子。例如,用紫杉醇处理的动物表现出增加的细胞因子和相关的炎性分子。当用本发明提供的天然产物的组合任选地与mkd或kd组合处理时,这些动物表现出细胞因子在血液中恢复至对照水平,其中作为紫杉醇治疗的结果,细胞因子的表达和/或量发生改变。
因此,本发明的一个实施方式提供了治疗受试者的炎性疾病的方法,所述方法包括向所述受试者施用包含一种或多种选自以下的组分的组合物:egcg;姜黄素;硫配糖体和/或其衍生物和mct,单独或与低碳水化合物饮食如kd或mkd组合。组分可以单独或以各种组合(例如,两组分,三组分组合物或含有所有组分的单一组合物)施用于受试者。本发明的另一个实施方式提供了用对应于nu.001;nu.002;nu.003;nu.004或nu.005的组合治疗来治疗受试者以减少受试者的炎性疾病。
egcg是绿茶中含量最丰富的儿茶素。众所周知,来源于绿茶的多酚具有抗炎、抗氧化的特性,并已被证明在多种癌症动物模型中起抑制肿瘤细胞增殖的作用。这些作用在微摩尔浓度下可以通过口服摄取egcg来实现。
egcg:保护作用和炎症
egcg已经在许多环境和细胞类型中表现出抗炎作用和保护作用。例如,egcg保护神经元免受各种有毒物质的伤害。它直接起到活性氧(ros)清除剂的作用并激活抗氧化酶。egcg另外降低神经元细胞凋亡的激活和降低小神经胶质细胞的活化炎症信号。egcg激活蛋白激酶cγ信号传导,其减少凋亡信号并防止细胞骨架降解。此外,egcg似乎刺激神经突生长,这可能促进恢复失去的神经功能。目前egcg正在进行在阿尔茨海默氏病、发性硬化症、糖尿病和帕金森病中的神经保护作用的临床试验。
egcg的安全性
已发现在啮齿类动物中高达500mg/kg的口服剂量没有基因毒性或短期毒性,其剂量显著高于针对人类提出的剂量。类似地,当以500mg/kg/天以分开的剂量项预先喂食的狗递送13周后,没有观察到不良反应或毒性。流行病学数据显示,日本近四分之一的人每天消耗10杯以上的绿茶,相当于每天约1000毫克的egcg。根据本发明可以施用的egcg的量在约1mg/kg至约500mg/kg的范围内。在某些实施方式中,egcg以约1mg/kg至约250mg/kg,约5mg/kg至约50mg/kg,或约10mg/kg至约25mg/kg的量施用。优选人类剂量为约1mg/kg至约20mg/kg。
姜黄素是膳食调味品姜黄的活性成分。姜黄素的生物学功能是多样的,包括抗肿瘤、抗氧化、抗病毒、抗淀粉样蛋白、抗菌和抗肝毒性活性。已经使用许多神经病模型评估了姜黄素,特别是降低了奥沙利铂诱导的脱髓鞘作用,并且防止了顺铂介导的神经突生长抑制而不降低抗癌作用。姜黄素在坐骨神经痛和腕管综合症患者的临床试验中表现出减轻神经性疼痛。已经证明通过单胺系统的作用来减轻神经性疼痛,并且通过在动物模型中减少氧化应激和抑制nf-kb激活tnf-α和il-6来减少糖尿病性神经病变。在通过nf-κb信号传导介导的局部缺血模型中也观察到这种抗炎作用。目前,在人体试验中,姜黄素对神经病理学的作用是针对阿尔茨海默病、视神经病变和脊髓损伤的。
姜黄素的安全性
常规的印第安人饮食中姜黄素的平均消耗量约为每天100毫克。在动物中高剂量的几项毒性研究表明它在临床前模型如大鼠、豚鼠(guineapigs)和猴子中是安全的。临床研究显示姜黄素的安全性为在长达3个月的剂量下可达8000毫克/天。剂量从5000到12000毫克/天,没有显著的不良副作用。一些临床研究(主要是单臂ii期)已经表明姜黄素在慢性炎症、恶变前和恶性病变以及aids中的有效性。根据要求保护的发明可以施用的姜黄素的量范围(以每日剂量计)为约1mg至约12000mg。在某些实施方式中,姜黄素以约1mg至约8000mg,5000mg至约12000mg或约1000mg/kg至约10000mg/kg的量施用。优选人类剂量约1mg/kg至约200mg/kg。
十字花科蔬菜含有异硫氰酸酯(itc),它们是通过其前体母体分子硫配醣体水解而形成的。研究最多的十字花科蔬菜itc之一是sfn,其前体硫代葡萄糖苷[grp]在西兰花、菜花和卷心菜中含量丰富,西兰花芽中含量最高。grp的水解需要存在于蔬菜本身和结肠微生物群落中的黑芥子酶的活性。sfn被快速吸收,具有80%的生物利用度,在2小时内达到血浆峰值水平,并具有长末端消除阶段的特征。重要的是,sfn是i期酶的有效抑制剂和ii期酶的刺激剂[通过nrf2],并且可以降低氧化应激并抑制nf-kb。另外,sfn是一种有效的hdac抑制剂。
sfn:保护作用和炎症
像其他异硫氰酸酯一样,sfn已经显示出提高组织谷胱甘肽水平,增强几乎所有细胞内固有的细胞抗氧化防御。另外的动物和人的研究已经显示了包括超氧化物歧化酶、过氧化氢酶、nad(p)h:奎宁氧化还原酶1、谷胱甘肽过氧化物酶、谷胱甘肽还原酶和谷胱甘肽-s-转移酶在内的许多ii期酶(通过上述nrf2途径)的诱导。一项随机双盲临床试验也证实了sfn能够降低2型糖尿病的氧化应激。已经显示sfn通过激活nrf2来保护神经线粒体并且通过抑制nf-kb减少神经炎症。此外,主要研究了sfn的抗癌作用,并对其在新生大鼠模型中对缺氧缺血性损伤的抗氧化和神经保护作用进行了研究。观察到sfn处理增加了nrf2抗氧化转录因子在脑中的表达。sfn还可以减少缺氧缺血24小时后的梗塞比例,并显著减少凋亡细胞的数量。
sfn的安全性
西兰花芽被广泛用作世界各地的食物,没有任何报道的不良影响。在人体内进行的研究并没有显示施用sfn或富含sfn的饮食来源物品如西兰花芽的任何显著不良影响。越来越多的证据支持sfn被认为是低毒的观点。
已证明口服68克西兰花芽提供了在癌症模型中被证明是治疗性的sfn的安全无毒剂量[100mg]。治疗患有2型糖尿病的81例患者4周,剂量高达10克的西兰花芽粉,没有报道副作用。根据要求保护的本发明可以施用的硫代葡萄糖苷或其衍生物例如sfn的量范围(作为日剂量)为约1mg至约1000mg。在某些实施方式中,以约1mg至约800mg,50mg至约120mg或约10mg/kg至约250mg的量施用葡萄糖磷脂或其衍生物如sfn。优选人类剂量为约0.1mg/kg至约5mg/kg。
十字花科蔬菜含有一组称为硫配醣体的物质,它们是含硫化学物质。在消化、食物制备或咀嚼过程中,硫配醣体分解成许多生物活性化合物,包括但不限于:吲哚、腈、硫氰酸酯、异硫氰酸酯、吲哚-3-甲醇和sfn。
sfn是从十字花科蔬菜(例如,球芽甘蓝,卷心菜,菜花,白菜,无头甘蓝(kale),羽衣甘蓝(collard),芥兰菜,芜菁(broccoliraab),大头菜(kohlrabi),芥末,芜菁甘蓝(turnip),萝卜(radish),芝麻菜(arugula)和豆瓣菜(watercress)等)中发现的硫配醣体前体grp的转化衍生的生物活性分子。西兰花芽中含有最高浓度的sfn。有效剂量的硫配醣体如grp及其生物活性分解产物,包括sfn,可以通过食用来自上述十字花科蔬菜或来自芸苔属(brassica)植物的芽或芽粉末来递送。
短语“包含硫配醣体和/或其衍生物如grp和/或sfn”或“包含硫配醣体的组合物”或“包含grp的组合物”或“包含sfn的组合物”可以包含芸苔属成熟植物或成熟十字花科蔬菜的一种或多种粉末,芸苔属成熟植物或成熟十字花科蔬菜的消耗性营养物质,芸苔属植物的脱水或非脱水芽或十字花科蔬菜的芽或从十字花科蔬菜或芸苔属植物获得的粉状芽菜。
在一些实施方式中,包含硫配醣体和/或其衍生物的组合物包含芸苔属成熟植物或成熟十字花科蔬菜的粉末,芸苔属成熟植物或成熟十字花科蔬菜的可消耗营养物质,芸苔属植物的脱水或非脱水芽或十字花科蔬菜的芽的粉末或从十字花科蔬菜或芸苔属植物获得的粉状芽菜。如上所述,来自一种或多种十字花科蔬菜或来自芸苔属植物的粉末可以组合成包含硫配醣体和/或其衍生物的组合物。上面讨论的粉末可以以冻干粉末的形式提供。这种粉末的给药可向待治疗的受试者递送硫配醣体,包括grp,随后被黑芥子酶代谢成sfn的一种化合物。
kd饮食刺激肝生酮代谢途径。kd可能是许多神经疾病的潜在治疗方法,其广泛的神经保护特性可能通过改变细胞代谢介导,使神经细胞抵抗代谢变化,并通过抗氧化剂和抗炎机制上调保护机制。kd具有高脂肪[90%的卡路里摄入]和非常低的碳水化合物[低于5%],导致血清酮体增加,葡萄糖水平降低,模拟禁食或饥饿的效果。kd有几种变体可用,例如改良的阿特金斯饮食和mct饮食,其目的在于减轻由传统的生酮饮食造成的严重的碳水化合物限制和过量的脂肪消耗,并通过使饮食更可口和更健康来增加饮食依从性。
因此,kd是其中碳水化合物含量小于或等于受试者每天总热量摄入的约5%且饮食平衡的由脂肪或蛋白质组成的饮食。因此,作为每天总热量摄入的函数,饮食提供约5%或更少的碳水化合物,约30%至约90%的脂肪和约5%至约70%的蛋白质。在某些实施方式中,饮食提供约3%(或更少)的碳水化合物,约57%至约95%的脂肪和约5%至约40%的蛋白质。在一些实施方式中,受试者饮食的脂肪含量的约30%至约70%(例如,约30%,约40%,约50%,约60%或约70%)可以由mct组成。其他实施方式提供了mct构成受试者饮食的脂肪含量的约50%。
开发mkd
虽然kd可能具有调节炎症的应用,但由于其严格的性质(90-95%的脂肪)而难以实施。生酮饮食中发生的两个关键的生理变化是葡萄糖水平的降低和循环酮的升高。mkd模仿kd的关键生理学效应。mkd涉及消耗低碳水化合物饮食[10-20%范围]以降低葡萄糖水平并且消耗mct,其提高血液酮水平。
mkd是含有至少5%且不超过约20%碳水化合物的饮食(作为受试者每天总热量摄入的函数),并且受试者的饮食平衡包括脂肪和蛋白质。因此,作为每天总卡路里摄取量的函数,饮食可以包含约5%至约20%的碳水化合物,约30%至约75%的脂肪和约5%至约65%的蛋白质。在某些实施方式中,饮食可以提供约8%至约15%的碳水化合物,约50%至约70%的脂肪和约18%至约42%的蛋白质。在一些实施方式中,受试者饮食的脂肪含量的约30%至约70%(例如,约30%,约40%,约50%,约60%或约70%)可以由mct组成。其他实施方式提供了mct构成受试者饮食的脂肪含量的约50%。
作为基于每天摄入2000千卡路里的食物总量(克)的函数(并且基于1克碳水化合物提供4千卡路里,1克脂肪提供9千卡路里,1克蛋白质提供4千卡路里和1gmct提供6.8千卡的事实),改良的生酮饮食是含有至少25g且不超过100g碳水化合物的饮食,并且受试者的饮食平衡包括脂肪和蛋白质。因此,作为每天总摄入克数的函数,饮食可以包含约25g至100g碳水化合物,约67g至约167g脂肪和约25g至约325g蛋白质。在某些实施方式中,饮食可以提供约40g至约75g的碳水化合物,约111g至约155g的脂肪和约90g至约210g的蛋白质。在一些实施方式中,受试者饮食的脂肪含量的约30%至约70%(例如,约30%,约40%,约50%,约60%或约70%)可以由中链甘油三酯(mct)组成。这代表约40g至约165g的mct。
在本发明的另一个实施方式中,治疗包括向需要炎性疾病治疗的受试者提供mkd或kd饮食,并且任选地给予包含一种或多种egcg,姜黄素,硫配醣体和/或其衍生物和mct的组合物。各种实施方式提供了向受试者施用包含egcg,姜黄素,硫配醣体和/或其衍生物和mct的组合物。
在本发明的一个实施方式中,组合物包含egcg,姜黄素,硫配醣体和/或其衍生物如grp或sfn和mct中的一种或多种,其中这些化合物中的至少一种天然存在。此外,施用于受试者的组合物可以作为单一组合给药(例如,egcg,姜黄素,包含硫配醣体和/或其衍生物的组合物,例如单一组合物中的grp或sfn,和/或mct)或者每种组分(egcg,姜黄素,包含硫配醣体和/或其衍生物如grp或sfn和mct的组合物)分别提供同时或依次食用(例如,以胶囊、胶囊片、片剂、粉末、凝胶或其他单位剂型)。
本发明涉及炎性疾病,例如自身免疫性疾病的治疗。根据本发明治疗的各种自身免疫疾病包括但不限于急性播散性脑脊髓炎(adem),阿狄森氏病,斑秃,淀粉样变性,自身免疫性视网膜病变,自身免疫性甲状腺疾病,轴突和神经元性神经病变,慢性疲劳综合症,慢性炎性脱髓鞘性多发性神经病变(cidp),克罗恩病,柯萨奇病毒性心肌炎,疱疹样皮炎,实验性过敏性脑脊髓炎,伊文思(evans)综合征,纤维肌痛,肾小球性肾炎,肉芽肿性多血管炎(gpa,原名韦格纳氏肉芽肿病wegener'sgranulomatosis),格雷夫斯病,格林-巴利综合征,桥本氏脑炎,桥本氏甲状腺炎,溶血性贫血,川崎综合征,狼疮(sle),莱姆病,梅尼埃病,多发性硬化症,重症肌无力,肌炎,嗜睡症,视神经脊髓炎(devic’s),嗜中性白血球减少症,硬皮病,舍格伦综合征,僵人综合征。
在一个实施方式中,根据本发明治疗的炎性疾病是化学或生物治疗(例如化疗)后产生的炎症。在一个实施方式中,化疗包括施用紫杉醇,5-氟尿嘧啶(5-fu),顺铂,甲氨蝶呤,放线菌素,博来霉素,白消安,卡培他滨,环磷酰胺,阿糖胞苷,道诺霉素,正定霉素,多西他赛,阿霉素脂质体,阿霉素,依托泊苷,氟尿苷,羟基脲,氮芥,美法仑,丝裂霉素,米托蒽醌,丙卡巴肼,6-巯基嘌呤,6-硫鸟嘌呤,噻替派,长春花碱或长春瑞滨。
在某些实施方式中,炎性疾病表现出改变的水平,例如一种或多种细胞因子或相关的生物分子的改变的血液水平。在进一步的实施方式中,炎性疾病显示出一种或多种细胞因子或相关的生物分子的改变的血液水平,细胞因子或相关的生物分子选自分化簇40配体(cd-40l),嗜酸细胞趋化因子,纤维蛋白原,生长激素(gh),角质形成细胞衍生的细胞因子或gro1致癌基因(kc/gro),白介素-1β(il-1β),il-6,il-18,淋巴细胞趋化因子,髓过氧化物酶(mpo),金属蛋白酶组织抑制因子1(timp-1),血管内皮生长因子a(vegf-a),c-反应蛋白(crp),巨噬细胞源性趋化因子(mdc),巨噬细胞炎症蛋白-1α(mip-1α),vwf和制瘤素。
表1提供了显示某些细胞因子和相关生物分子改变的水平的疾病的非限制性实施例。
在某些实施方式中,可根据本发明治疗的炎性疾病涉及失调的炎性机制、氧化应激和免疫稳态的紊乱。
可以用本发明的治疗进行治疗的疾病和病症包括但不限于过敏症,阿尔茨海默病,强直性脊柱炎,哮喘,自身免疫性疾病,关节炎,动脉粥样硬化,腕管综合征,腹腔,克罗恩病,憩室炎,湿疹,纤维化,格林-巴利病,狼疮,多发性硬化症,肾炎,神经病变,胰腺炎,帕金森病,牛皮癣,风湿性多肌痛,类风湿性关节炎,硬皮病和血管炎。
可根据本发明治疗的自身免疫疾病的非限制性实施例包括急性播散性脑脊髓炎(adem),阿狄森氏病,斑秃,淀粉样变性,自身免疫性视网膜病变,自身免疫性甲状腺疾病,轴突和神经元性神经病,慢性疲劳综合症,慢性炎性脱髓鞘性多发性神经病变(cidp),克罗恩病,柯萨奇病毒性心肌炎,疱疹样皮炎,实验性过敏性脑脊髓炎,伊文思(evans)综合征,纤维肌痛,肾小球性肾炎,肉芽肿性多血管炎(gpa,原名韦格纳氏肉芽肿病wegener'sgranulomatosis),格雷夫斯病,格林-巴利综合征,桥本氏脑炎,桥本氏甲状腺炎,溶血性贫血,川崎综合征,狼疮(sle),莱姆病,慢性病,梅尼埃病,多发性硬化症,重症肌无力,肌炎,嗜睡症,视神经脊髓炎(devic’s),嗜中性白血球减少症,硬皮病,舍格伦综合征,僵人综合征。
用于治疗炎性疾病的本发明任何上述方面可进一步包括施用一种或多种其他的治疗或疗法以治疗炎性疾病。这种其他的治疗的非限制性实施例包括抗炎性抗体疗法,例如抗ige疗法或抗炎性小分子疗法,例如抗组胺疗法,甾体或非甾体类抗炎药(nsaids)例如阿司匹林,塞来昔布,双氯芬酸,二氟尼柳,etofolac,布洛芬,吲哚美辛,酮洛芬,酮咯酸,萘普酮,萘普生,奥沙普秦,吡罗昔康,双水杨酯,舒林酸,托美丁或其组合。其他的抗炎剂对于本领域技术人员来说是公知的,并且这样的实施方案在本发明的范围内。
包含ecgc、姜黄素、硫配醣体和/或其衍生物和mct的组合物可以以粉末,饮剂,乳剂,凝胶,胶囊,片剂或其混合物的形式施用于受试者。需要炎性疾病治疗的受试者可以直接或通过将其与其它食物或饮料(例如水,果汁,酸奶,汤,炖汤,意大利面等)混合来摄取本发明提供的组合物。此外,组合物(或单个组分)也可以掺入其他食品中,例如蛋糕,饼干,谷物条等。
本文提及或引用的所有专利、专利申请、临时申请和公开均以其与本说明书的明确教导不矛盾的程度以引用的方式全部并入本文,包括所有附图和表格。
以下是说明实施本发明的步骤的实施例。这些实施例不应被解释为限制。除非另有说明,所有的百分比均以重量或卡路里计,所有溶剂混合物的比例均以体积计。
实施例1-使用lc/mct/姜黄素/egcg/sfn预防炎症中的促炎效应物
化疗剂紫杉醇用于诱导炎症。通过紫杉醇[累积40mg/kg]治疗使动物受到应激,导致参与炎症过程的许多细胞因子和相关分子改变。用nu.001处理动物3-4周,并采血进行血浆分离。使用rodentmap[敏锐德(myriad)/rbm]筛选一组细胞因子。图1和图2示出许多因紫杉醇治疗而改变其表达的细胞因子恢复到对照水平。这些结果表明nu.001具有减少炎症的能力。
实施例2-nu.001抑制涉及疼痛和有丝分裂(mitogenesis)的促炎细胞因子
比较用对照饮食或nu.001饮食治疗3-4周的动物的多种促炎细胞因子的水平。细胞因子筛选的结果显示nu.001显著抑制timp-1、mip-1g,瘦蛋白、巨噬细胞集落刺激因子(mcsf)和(kc/gro)的能力(图3)。在患有神经性疼痛的受试者中timp-1增加。mip-1g、瘦蛋白和m-csf的水平升高与疼痛有关。高水平的m-csf也与强直性脊柱炎和类风湿性关节炎有关。最后,kc/gro已经证实有促进有丝分裂性质,并涉及黑色素瘤的发病机制。这些数据一起证明了nu.001调节疼痛和有丝分裂的能力。
实施例3-nu.001刺激调节外周神经病变和多发性硬化的因素
比较用对照饮食或nu.001饮食治疗的动物中白血病抑制因子(lif)的水平。治疗4周后,取血并分离血浆以测量细胞因子的水平。结果显示与对照组相比,用nu.001处理的动物中lif浓度增加,证实了我们的治疗调节神经病变的潜力(图4a)。在多发性硬化症患者中观察到的较低ccl22水平使用紫杉醇获得。紫杉醇联合nu.001治疗的动物显示出更高浓度的细胞因子。假设ccl22在多发性硬化症的发病机制中发挥关键作用,特别是在女性中。这些结果表明nu.001可以用于治疗多发性硬化症。
应该理解的是,这里描述的实施例和实施方式仅用于说明的目的,并且将启示本领域技术人员对其进行各种修改或改变,并且将包括在本申请的精神和范围内。此外,本文公开的任何发明或其任何实施方式的任何元素或限制可以与本文公开的任何和/或所有其他元素或限制(单独地或以任何组合)或任何其他发明或其实施方式组合,并且所有这样的组合预期包含在本发明的范围内,但不限于此。
参考文献
1.youm,y.h.etal.theketonemetabolitebeta-hydroxybutyrateblocksnlrp3inflammasome-mediatedinflammatorydisease.natmed21,263-269,doi:10.1038/nm.3804(2015).
2.yang,x.&cheng,b.neuroprotectiveandanti-inflammatoryactivitiesofketogenicdietonmptp-inducedneurotoxicity.jmolneurosci42,145-153,doi:10.1007/s12031-010-9336-y(2010).
3.kono,h.etal.protectiveeffectsofmedium-chaintriglyceridesontheliverandgutinratsadministeredendotoxin.annalsofsurgery237,246-255,doi:10.1097/01.sla.0000048450.44868.b1(2003).
4.bachmeier,b.e.etal.curcumindownregulatestheinflammatorycytokinescxcl1and
-2inbreastcancercellsvianfkappab.carcinogenesis29,779-789,doi:10.1093/carcin/bgm248(2008).
5.killian,p.h.etal.curcumininhibitsprostatecancermetastasisinvivobytargetingtheinflammatorycytokinescxcl1and-2.carcinogenesis33,2507-2519,doi:10.1093/carcin/bgs312(2012).
6.yun,j.m.,jialal,i.&devaraj,s.effectsofepigallocatechingallateonregulatorytcellnumberandfunctioninobesev.leanvolunteers.brjnutr103,1771-1777,doi:10.1017/s000711451000005x(2010).
7.yang,c.s.,wang,x.,lu,g.&picinich,s.c.natrevcancervol.9,429-439(2009).
8.dinkova-kostova,a.t.&kostov,r.v.glucosinolatesandisothiocyanatesinhealthanddisease.trendsinmolecularmedicine18,337-347,doi:10.1016/j.molmed.2012.04.003(2012).
9.innamorato,n.g.etal.thetranscriptionfactornrf2isatherapeutictargetagainstbraininflammation.journalofimmunology181,680-689(2008).
10.kaley,t.j.&deangelis,l.m.therapyofchemotherapy-inducedperipheralneuropathy.brjhaematol145,3-14,doi:10.1111/j.1365-2141.2008.07558.x(2009).
11.jafarzadeh,a.etal.lowerserumlevelsofth2-relatedchemokineccl22inwomenpatientswithmultiplesclerosis:acomparisonbetweenpatientsandhealthywomen.inflammation37,604-610,doi:10.1007/s10753-013-9775-z(2014).
12.gasior,m.,rogawski,m.a.&hartman,a.l.neuroprotectiveanddisease-modifyingeffectsoftheketogenicdiet.behaviouralpharmacology17,431-439(2006).
13.gano,l.,patel,m.&rho,j.m.ketogenicdiets,mitochondriaandneurologicaldiseases.journaloflipidresearch,jlr.r048975,doi:10.1194/jlr.r048975(2014).
14.gasior,m.m.,rogawski,m.a.m.&hartman,a.l.a.neuroprotectiveanddisease-modifyingeffectsoftheketogenicdiet.behaviouralpharmacology17,431-439,doi:10.1097/00008877-200609000-00009(2006).
15.ruskin,d.n.,kawamura,j.,masahito&masino,s.a.reducedpainandinflammationinjuvenileandadultratsfedaketogenicdiet.plosone4,e8349,doi:10.1371/journal.pone.0008349(2009).
16.carlestafstrom,j.m.r.theketogenicdietasatreatmentparadigmfordiverseneurologicaldisorders.frontiersinpharmacology3,doi:10.3389/fphar.2012.00059(2012).
17.freeman,j.m.,kossoff,e.h.&hartman,a.l.theketogenicdiet:onedecadelater.pediatrics119,535-543,doi:10.1542/peds.2006-2447(2007).
18.shimazu,t.etal.suppressionofoxidativestressbybeta-hydroxybutyrate,anendogenoushistonedeacetylaseinhibitor.science,doi:10.1126/science.1227166(2012).
19.tipoe,g.l.,leung,t.m.,hung,m.w.&fung,m.l.greenteapolyphenolsasananti-oxidantandanti-inflammatoryagentforcardiovascularprotection.cardiovascular&hematologicaldisordersdrugtargets7,135-144(2007).
20.aggarwal,b.b.&harikumar,k.b.potentialtherapeuticeffectsofcurcumin,theanti-inflammatoryagent,againstneurodegenerative,cardiovascular,pulmonary,metabolic,autoimmuneandneoplasticdiseases.theinternationaljournalofbiochemistry&cellbiology41,40-59(2009).
21.nallasamy,p.etal.sulforaphanereducesvascularinflammationinmiceandpreventstnf-α-inducedmonocyteadhesiontoprimaryendothelialcellsthroughinterferingwiththenf-κbpathway.thejournalofnutritionalbiochemistry25,824-833,doi:10.1016/j.jnutbio.2014.03.011(2014).
22.yang,c.,wang,x.,lu,g.&picinich,s.cancerpreventionbytea:animalstudies,molecularmechanismsandhumanrelevance.natrevcancer,doi:10.1038/nrc2641(2009).
23.wu,c.h.,wu,c.f.,huang,h.w.,jao,y.c.¥,g.c.naturallyoccurringflavonoidsattenuatehighglucose-inducedexpressionofproinflammatorycytokinesinhumanmonocyticthp-1cells.molnutrfoodres53,984-995,doi:10.1002/mnfr.200800495(2009).
24.zheng,y.,toborek,m.&hennig,b.epigallocatechingallate-mediatedprotectionagainsttumornecrosisfactor-alpha-inducedmonocytechemoattractantprotein-1expressionishemeoxygenase-1dependent.metabolism:clinicalandexperimental59,1528-1535,doi:10.1016/j.metabol.2010.01.018(2010).
25.kim,i.b.etal.inhibitionofil-8productionbygreenteapolyphenolsinhumannasalfibroblastsanda549epithelialcells.biological&pharmaceuticalbulletin29,1120-1125(2006).
26.wheeler,d.s.etal.epigallocatechin-3-gallate,agreentea-derivedpolyphenol,inhibitsil-1beta-dependentproinflammatorysignaltransductioninculturedrespiratoryepithelialcells.jnutr134,1039-1044(2004).
27.heo,j.,lee,b.r.&koh,j.w.protectiveeffectsofepigallocatechingallateafteruvirradiationofculturedhumanlensepithelialcells.koreanjournalofophthalmology:kjo22,183-186,doi:10.3341/kjo.2008.22.3.183(2008).
28.singh,r.,akhtar,n.&haqqi,t.m.greenteapolyphenolepigallocatechin-3-gallate:inflammationandarthritis.[corrected].lifesci86,907-918,doi:10.1016/j.lfs.2010.04.013(2010).
29.fu,y.&koo,m.w.egcgprotectsht-22cellsagainstglutamate-inducedoxidativestress.neurotoxicityresearch10,23-30(2006).
30.schroeder,e.k.etal.greenteaepigallocatechin3-gallateaccumulatesinmitochondriaanddisplaysaselectiveantiapoptoticeffectagainstinducersofmitochondrialoxidativestressinneurons.antioxidredoxsignal11,469-480,doi:10.1089/ars.2008.2215(2009).
31.lee,s.j.&lee,k.w.protectiveeffectof(-)-epigallocatechingallateagainstadvancedglycationendproducts-inducedinjuryinneuronalcells.biological&pharmaceuticalbulletin30,1369-1373(2007).
32.mandel,s.,weinreb,o.,amit,t.&youdim,m.b.h.cellsignalingpathwaysintheneuroprotectiveactionsofthegreenteapolyphenol(-)-epigallocatechin-3-gallate:implicationsforneurodegenerativediseases.signalingpathwaysinegcgneuroprotection88,1555-1569,doi:10.1046/j.1471-4159.2003.02291.x(2004).
33.mandel,s.a.etal.multifunctionalactivitiesofgreenteacatechinsinneuroprotection.modulationofcellsurvivalgenes,iron-dependentoxidativestressandpkcsignalingpathway.neuro-signals14,46-60,doi:10.1159/000085385(2005).
34.menard,c.,bastianetto,s.&quirion,r.neuroprotectiveeffectsofresveratrolandepigallocatechingallatepolyphenolsaremediatedbytheactivationofproteinkinasecgamma.frontiersincellularneuroscience7,281,doi:10.3389/fncel.2013.00281(2013).
35.reznichenko,l.,amit,t.,youdim,m.b.&mandel,s.greenteapolyphenol(-)-epigallocatechin-3-gallateinducesneurorescueoflong-termserum-deprivedpc12cellsandpromotesneuriteoutgrowth.jneurochem93,1157-1167,doi:10.1111/j.1471-4159.2005.03085.x(2005).
36.isbrucker,r.a.,bausch,j.,edwards,j.a.&wolz,e.safetystudiesonepigallocatechingallate(egcg)preparations.part1:genotoxicity.foodandchemicaltoxicology:aninternationaljournalpublishedforthebritishindustrialbiologicalresearchassociation44,626-635,doi:10.1016/j.fct.2005.07.005(2006).
37.isbrucker,r.a.,edwards,j.a.,wolz,e.,davidovich,a.&bausch,j.safetystudiesonepigallocatechingallate(egcg)preparations.part2:dermal,acuteandshort-termtoxicitystudies.foodandchemicaltoxicology:aninternationaljournalpublishedforthebritishindustrialbiologicalresearchassociation44,636-650,doi:10.1016/j.fct.2005.11.003(2006).
38.isbrucker,r.a.,edwards,j.a.,wolz,e.,davidovich,a.&bausch,j.safetystudiesonepigallocatechingallate(egcg)preparations.part3:teratogenicityandreproductivetoxicitystudiesinrats.foodandchemicaltoxicology:aninternationaljournalpublishedforthebritishindustrialbiologicalresearchassociation44,651-661,doi:10.1016/j.fct.2005.11.002(2006).
39.imai,k.&nakachi,k.crosssectionalstudyofeffectsofdrinkinggreenteaoncardiovascularandliverdiseases.bmj310,693-696(1995).
40.maheshwari,r.k.,singh,a.k.,gaddipati,j.&srimal,r.c.multiplebiologicalactivitiesofcurcumin:ashortreview.lifesciences78,2081-2087,doi:10.1016/j.lfs.2005.12.007(2006).
41.kunnumakkara,a.b.,anand,p.&aggarwal,b.b.curcumininhibitsproliferation,invasion,angiogenesisandmetastasisofdifferentcancersthroughinteractionwithmultiplecellsignalingproteins.cancerletters269,199-225,doi:10.1016/j.canlet.2008.03.009(2008).
42.almoundhri,m.s.,al-salam,s.,almahrouqee,a.,beegam,s.&ali,b.h.theeffectofcurcuminonoxaliplatinandcisplatinneurotoxicityinrats:somebehavioral,biochemical,andhistopathologicalstudies.journalofmedicaltoxicology:officialjournaloftheamericancollegeofmedicaltoxicology9,25-33,doi:10.1007/s13181-012-0239-x(2013).
43.
44.dipierro,f.&settembre,r.safetyandefficacyofanadd-ontherapywithcurcuminphytosomeandpiperineand/orlipoicacidinsubjectswithadiagnosisofperipheralneuropathytreatedwithdexibuprofen.journalofpainresearch,497,doi:10.2147/jpr.s48432(2013).
45.zhao,x.etal.curcuminexertsantinociceptiveeffectsinamousemodelofneuropathicpain:descendingmonoaminesystemandopioidreceptorsaredifferentiallyinvolved.neuropharmacology62,843-854,doi:10.1016/j.neuropharm.2011.08.050(2012).
46.zhao,w.c.etal.curcuminameliorateddiabeticneuropathypartiallybyinhibitionofnadphoxidasemediatingoxidativestressinthespinalcord.neuroscilett560,81-85,doi:10.1016/j.neulet.2013.12.019(2014).
47.joshi,r.p.etal.sneddscurcuminformulationleadstoenhancedprotectionfrompainandfunctionaldeficitsassociatedwithdiabeticneuropathy:aninsightintoitsmechanismforneuroprotection.nanomedicine9,776-785,doi:10.1016/j.nano.2013.01.001(2013).
48.tu,x.k.etal.curcumininhibitstlr2/4-nf-kappabsignalingpathwayandattenuatesbraindamageinpermanentfocalcerebralischemiainrats.inflammation,doi:10.1007/s10753-014-9881-6(2014).
49.shah,b.h.etal.inhibitoryeffectofcurcumin,afoodspicefromturmeric,onplatelet-activatingfactor-andarachidonicacid-mediatedplateletaggregationthroughinhibitionofthromboxaneformationandca2+signaling.biochemicalpharmacology58,1167-1172,doi:10.1016/s0006-2952(99)00206-3(1999).
50.shankar,t.n.,shantha,n.v.,ramesh,h.p.,murthy,i.a.&murthy,v.s.toxicitystudiesonturmeric(curcumalonga):acutetoxicitystudiesinrats,guineapigs&;monkeys.indianjournalofexperimentalbiology18,73-75(1980).
51.deshpande,s.s.,ingle,a.d.&maru,g.b.chemopreventiveefficacyofcurcumin-freeaqueousturmericextractin7,12-dimethylbenz[a]anthracene-inducedratmammarytumorigenesis.cancerletters123,35-40,doi:10.1016/s0304-3835(97)00400-x(1998).
52.cheng,a.l.etal.phaseiclinicaltrialofcurcumin,achemopreventiveagent,inpatientswithhigh-riskorpre-malignantlesions.anticancerresearch21,2895-2900(2001).
53.lao,c.d.etal.doseescalationofacurcuminoidformulation.bmccomplementaryandalternativemedicine6,10-10,doi:10.1186/1472-6882-6-10(2006).
54.deodhar,s.d.,sethi,r.&srimal,r.c.preliminarystudyonantirheumaticactivityofcurcumin(diferuloylmethane).theindianjournalofmedicalresearch71,632-634(1980).
55.lal,b.etal.efficacyofcurcumininthemanagementofchronicanterioruveitis.phytotherapyresearch:ptr13,318-322,doi:10.1002/(sici)1099-1573(199906)13:4<;318::aid-ptr445>;3.0.co;2-7(1999).
56.holt,p.r.p.,katz,s.s.&kirshoff,r.r.curcumintherapyininflammatoryboweldisease:apilotstudy.digestivediseasesandsciences50,2191-2193,doi:10.1007/s10620-005-3032-8(2005).
57.durgaprasad,s.s.,pai,c.g.c.,vasanthkumar,alvres,j.f.j.&namitha,s.s.apilotstudyoftheantioxidanteffectofcurcuminintropicalpancreatitis.theindianjournalofmedicalresearch122,315-318(2005).
58.getahun,s.m.&chung,f.l.conversionofglucosinolatestoisothiocyanatesinhumansafteringestionofcookedwatercress.cancerepidemiology,biomarkers&;prevention:apublicationoftheamericanassociationforcancerresearch,cosponsoredbytheamericansocietyofpreventiveoncology8,447-451(1999).
59.hanlon,n.etal.absolutebioavailabilityanddose-dependentpharmacokineticbehaviourofdietarydosesofthechemopreventiveisothiocyanatesulforaphaneinrat.britishjournalofnutrition99,559-564,doi:10.1017/s0007114507824093(2007).
60.hanlon,n.,coldham,n.,gielbert,a.&sauer,m.repeatedintakeofbroccolidoesnotleadtohigherplasmalevelsofsulforaphaneinhumanvolunteers.cancerletters(2009).
61.fimognari,c.sulforaphaneasapromisingmoleculeforfightingcancer.mutationresearch/reviewsinmutationresearch(2007).
62.song,m.-y.m.etal.sulforaphaneprotectsagainstcytokine-andstreptozotocin-inducedbeta-celldamagebysuppressingthenf-kappabpathway.235,57-67,doi:10.1016/j.taap.2008.11.007(2009).
63.nair,s.etal.synergisticeffectsofacombinationofdietaryfactorssulforaphaneand(-)epigallocatechin-3-gallateinht-29ap-1humancoloncarcinomacells.pharmaceuticalresearch25,387-399,doi:10.1007/s11095-007-9364-7(2007).
64.dashwood,r.h.&ho,e.dietaryagentsashistonedeacetylaseinhibitors:sulforaphaneandstructurallyrelatedisothiocyanates.nutritionreviews66suppl1,s36-38,doi:10.1111/j.1753-4887.2008.00065.x(2008).
65.ho,e.,clarke,j.d.&dashwood,r.h.dietarysulforaphane,ahistonedeacetylaseinhibitorforcancerprevention.thejournalofnutrition139,2393-2396,doi:10.3945/jn.109.113332(2009).
66.myzak,m.,dashwood,w.,orner,g.&ho,e.sulforaphaneinhibitshistonedeacetylaseinvivoandsuppressestumorigenesisinapcminmice.thefasebjournal(2006).
67.mulcahy,r.t.,wartman,m.a.,bailey,h.h.&gipp,j.j.constitutiveandbeta-naphthoflavone-inducedexpressionofthehumangamma-glutamylcysteinesynthetaseheavysubunitgeneisregulatedbyadistalantioxidantresponseelement/tresequence.jbiolchem272,7445-7454(1997).
68.thimmulappa,r.k.etal.identificationofnrf2-regulatedgenesinducedbythechemopreventiveagentsulforaphanebyoligonucleotidemicroarray.cancerres62,5196-5203(2002).
69.bahadoran,z.etal.broccolisproutsreduceoxidativestressintype2diabetes:arandomizeddouble-blindclinicaltrial.europeanjournalofclinicalnutrition65,972-977,doi:10.1038/ejcn.2011.59(2011).
70.miller,d.m.,singh,i.n.,wang,j.a.&hall,e.d.administrationofthenrf2-areactivatorssulforaphaneandcarnosicacidattenuates4-hydroxy-2-nonenal-inducedmitochondrialdysfunctionexvivo.freeradicbiolmed57,1-9,doi:10.1016/j.freeradbiomed.2012.12.011(2013).
71.negi,g.,kumar,a.&sharma,s.s.nrf2andnf-κbmodulationbysulforaphanecounteractsmultiplemanifestationsofdiabeticneuropathyinratsandhighglucose-inducedchanges.currentneurovascularresearch8,294-304(2011).
72.ping,z.etal.sulforaphaneprotectsbrainsagainsthypoxic-ischemicinjurythroughinductionofnrf2-dependentphase2enzyme.brainres1343,178-185,doi:10.1016/j.brainres.2010.04.036(2010).
73.myzak,m.c.,tong,p.,dashwood,w.-m.,dashwood,r.h.&ho,e.sulforaphaneretardsthegrowthofhumanpc-3xenograftsandinhibitshdacactivityinhumansubjects.experimentalbiologyandmedicine(maywood,n.j.)232,227-234(2007).
74.lakhan,s.e.&avramut,m.matrixmetalloproteinasesinneuropathicpainandmigraine:friends,enemies,andtherapeutictargets.painresearchandtreatment2012,952906,doi:10.1155/2012/952906(2012).
75.rodriguezparkitna,j.etal.comparisonofgeneexpressionprofilesinneuropathicandinflammatorypain.journalofphysiologyandpharmacology:anofficialjournalofthepolishphysiologicalsociety57,401-414(2006).
76.dawes,j.m.,kiesewetter,h.,perkins,j.r.,bennett,d.l.&mcmahon,s.b.chemokineexpressioninperipheraltissuesfromthemonosodiumiodoacetatemodelofchronicjointpain.molpain9,57,doi:10.1186/1744-8069-9-57(2013).
77.doupis,j.etal.microvascularreactivityandinflammatorycytokinesinpainfulandpainlessperipheraldiabeticneuropathy.thejournalofclinicalendocrinologyandmetabolism94,2157-2163,doi:10.1210/jc.2008-2385(2009).
78.bali,k.k.etal.transcriptionalmechanismsunderlyingsensitizationofperipheralsensoryneuronsbygranulocyte-/granulocyte-macrophagecolonystimulatingfactors.molpain9,48,doi:10.1186/1744-8069-9-48(2013).
79.yang,p.t.etal.increasedexpressionofmacrophagecolony-stimulatingfactorinankylosingspondylitisandrheumatoidarthritis.annalsoftherheumaticdiseases65,1671-1672,doi:10.1136/ard.2006.054874(2006).
80.anisowicz,a.,bardwell,l.&sager,r.constitutiveoverexpressionofagrowth-regulatedgeneintransformedchinesehamsterandhumancells.procnatlacadsciusa84,7188-7192(1987).
81.haskill,s.etal.identificationofthreerelatedhumangrogenesencodingcytokinefunctions.procnatlacadsciusa87,7732-7736(1990).
- 还没有人留言评论。精彩留言会获得点赞!