以APE1/REF‑1为靶标抑制缺氧传输信号基因的方法与流程
相关申请的交叉引用
本申请要求2016年3月11日提交的美国临时专利申请no.62/307,000和2015年5月21日提交的美国临时专利申请no.62/164,795的优先权,所述两个美国临时专利申请以引用的方式全部并入本文。
背景技术:
本发明通常涉及以无嘌呤/无嘧啶核酸内切酶/氧化还原因子1(ape1/ref-1)为靶标的方法。更特别地,通过抑制ape1/ref-1,抑制缺氧介导的信号传输,从而减少暴露在缺氧条件下的肿瘤细胞的存活和入侵。在一个特别的实施方案中,本发明涉及施用ape1/ref-1抑制剂和碳酸酐酶ix(ca9)抑制剂的组合的方法。
被诊断出具有胰腺导管腺癌(pdac)的患者一半由于其疾病在一年内去世。用化学疗法治疗没有改变该疾病的自然进程。提出了在pdac的侵略性的、治疗耐受性的表型中起作用的几种途径,包括缺氧适应,其导致潜在转移的增加并有损化学疗法和放射疗法的效力。细胞中一种主要的氧传感器为缺氧诱发因子-1α(hif-1α),一种在常氧条件下快速降解的转录因子,但是在有助于肿瘤微环境中存活、转移和血管生成信号传输的缺氧条件下上调了大量基因。最显著的hif靶标之一是碳酸酐酶ix(ca9),其通过保持稳定的细胞内ph同时酸化微环境促进了肿瘤细胞存活和转移,从而促进上皮间叶细胞转化(epithelialmesenchymaltransition)并有助于细胞外基质降解。
无嘌呤/无嘧啶核酸内切酶/氧化还原因子1(ape1/ref-1)是在碱基切除修复中具有dna修复功能,以及减少转录因子的能力并使转录因子连接至其dna靶序列的多功能蛋白。ape1/ref-1控制几种在避免细胞凋亡、存活途径和缺氧信号传输中涉及的转录因子,包括hif-1α。
基于上文内容,本发明涉及妨碍ape1/ref-1以进一步妨碍hif-1α街道的信号传输,导致暴露在缺氧条件下的肿瘤细胞的存活和入侵的减少。
发明概述
本发明大体涉及以无嘌呤/无嘧啶核酸内切酶/氧化还原因子1(ape1/ref-1)为靶标的方法。更特别地,通过抑制ape1/ref-1,抑制缺氧介导的信号传输,从而减少暴露在缺氧条件的肿瘤细胞的存活和入侵。
因此,一方面,本发明涉及用于在有需要的受试者中抑制缺氧传输信号基因的方法。该方法包括向受试者施用有效量的3-[(5-(2,3-二甲氧基-6-甲基-1,4-苯醌基)]-2-壬基-2-丙烯酸、其药学可接受的盐或其药学可接受的溶剂化物,其选择性抑制ape1/ref-1的氧化还原功能。
在另一方面,本发明涉及用于在有需要的受试者中抑制胰腺导管腺癌(pdac)的方法。所述方法包括向受试者施用有效量的3-[(5-(2,3-二甲氧基-6-甲基-1,4-苯醌基)]-2-壬基-2-丙烯酸、其药学可接受的盐或其药学可接受的溶剂化物,其选择性抑制ape1/ref-1的氧化还原功能。
在又一方面,本发明涉及用于在有需要的受试者中抑制癌细胞生长的方法。所述方法包括向受试者施用有效量的3-[(5-(2,3-二甲氧基-6-甲基-1,4-苯醌基)]-2-壬基-2-丙烯酸、其药学可接受的盐或其药学可接受的溶剂化物,其选择性抑制ape1/ref-1的氧化还原功能,和向受试者施用至少一种另外的治疗剂。在一个特别的实施方案中,受试者具有胰腺导管腺癌(pdac)。在另一个实施方案中,受试者具有恶性外周神经鞘膜瘤(mpnst)(也称为神经鞘瘤或肉瘤,并可以与神经纤维肉瘤(nf1)的形式相关联)。
在另一方面,本发明涉及用于在有需要的受试者中抑制恶性外周神经鞘膜瘤(mpnst)的方法。所述方法包括向受试者施用有效量的3-[(5-(2,3-二甲氧基-6-甲基-1,4-苯醌基)]-2-壬基-2-丙烯酸、其药学可接受的盐或其药学可接受的溶剂化物,其选择性抑制ape1/ref-1的氧化还原功能。
附图说明
本发明将被更好的理解,并且当考虑以下其细节描述时,除了上述以外的特征、方面和优势将变得明晰。所述细节描述参照以下附图,其中:
图1描绘了在实施例1中制备的hif-1-/-mef代(generation)中的hif的缺失。使用从hif-1-floxed小鼠胚胎成纤维(mef)细胞收集的dna进行2-loxp/1-loxppcr,该hif-1-floxed小鼠胚胎成纤维细胞用ad-cmv-cre(cre腺病毒)或ad-gfp(对照)载体转导。
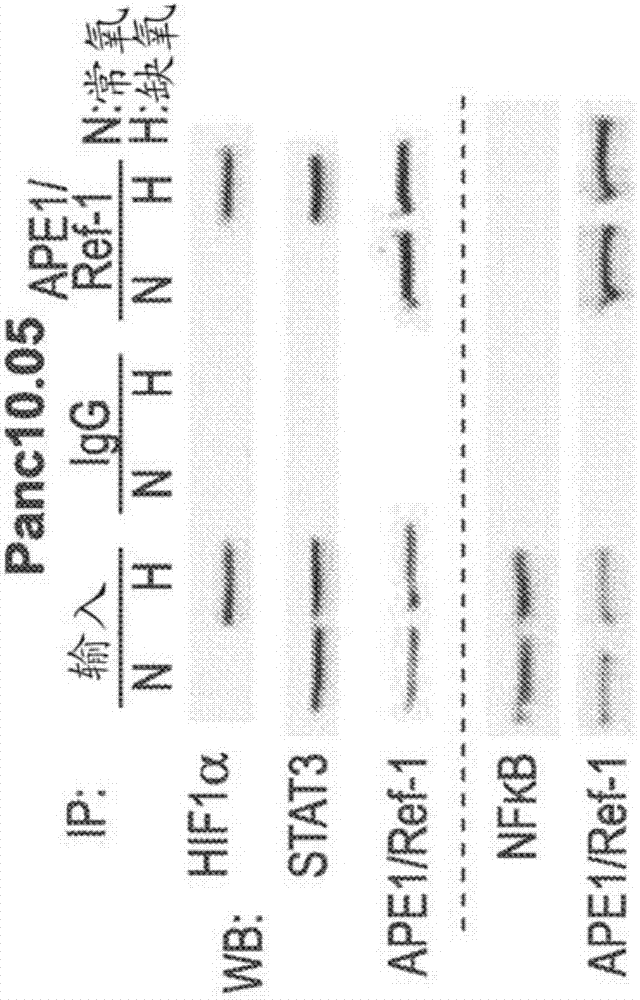
图2a-2d描绘了在细胞系中存在hif1α、stat3和nfκb以及如在实施例1中分析的在缺氧条件下ape1/ref-1与stat3和hif1α的相互作用。特别地,ape1/ref-1与hif1α和stat3的相互作用通过在pdac细胞中的缺氧刺激。在内源性表达的ape1/ref-1的收集和免疫沉淀反应之前,将panc10.05(图2a)和pa03c(图2b)细胞在正常或缺氧(0.2%氧)条件下培养24小时。使用wt-ape/lenti-cmv-gfp生成稳定细胞系过度表达的ape1/ref-1并与lenti-cmv-gfp、“载体”(图2c:10.05;图2d:pa03c)对比,并且在暴露至0.2%的氧24小时之后进行ape1/ref-1的免疫沉淀反应。用hif1α、stat3、ape1/ref-1、nfκb和stat1抗体进行ip的western分析。
图3a和3b描绘了ape1/ref-1和用tnfα或il-6在常氧条件下处理的细胞中的转录因子之间的相互作用。在表示的时间内,过渡表达ape1/ref-1的稳定的panc10.05细胞系(wt-ape/lenti-cmv-gfpvs.lenti-cmv-gfp,“载体”)被暴露至il-6(图3a)或tnfα(图3b),并且ape1/ref-1被免疫沉淀。用stat3、ape1/ref-1和nfκb抗体进行ip的western分析。
图4a-4c描绘了ape1/ref-1与hif1α和stat3的相互作用通过在癌症相关联的成纤维(caf)细胞中的缺氧刺激。特别地,在内源性表达的ape1/ref-1的收集和免疫沉淀反应之前,将uh1303-02htert(caf)细胞在常氧或缺氧(0.2%氧)下培养24小时(图4a)。使用wt-ape/lenti-cmv-gfp(vs.lenti-cmv-gfp,“载体”)生成过度表达ape1/ref-1的稳定细胞系(图4b和4c),并且在常氧(图4b)或0.2%氧(图4c)中培养24小时之后进行ape1/ref-1的免疫沉淀反应。用hif1α、stat3、ape1/ref-1和nfκb抗体进行ip的western分析。
图5a-5i表示ape1/ref-1蛋白表达有助于缺氧诱导的hif1α-介导的转录。特别地,用hif1α驱动的荧光素酶共转染mia-paca2细胞,并且renilla报告者与杂乱(sc)sirna(scrambledsirna)或ape1/ref-1指向sirna一起构建。ape1/ref-1的去除通过免疫印迹法确定(图5a),并且转染之后3-4天在缺氧条件(0.2%氧,vs.常氧对照)24小时后评估hif1α-驱动的荧光素酶表达(图5b)。ca9mrna水平通过在细胞系中的qpcr评估,所述细胞系使用如所示的由scsirna或ape1/ref-1指向sirna转染和在缺氧条件下24小时之后收集的样品描述(图5c-5e)。ape1/ref-1在具有三个不同的sirna的mia-paca2细胞中的去除通过免疫印迹法确定(图5f),并且在缺氧条件(0.2%氧,vs.常氧对照)下24小时后,通过sc和来自所有三个sirna的去除的样品中的qpcr评估ca9mrna水平(图5g—n=3的典型实验)。在用scsirna或ape1/ref-1指向sirna转染和在1%氧培养24小时之后通过在10.05和caf19细胞中的免疫印迹法评估ca9蛋白水平(图5h-5i)。*p<0.001(tukey多重比较检验);**p<0.01和#p<0.001(ancova)。对于ca9免疫印迹法(图5h-5i),对于scvs.siape在缺氧下p<0.05(tukey多重比较检验)。
图6a和6b显示了ape1/ref-1蛋白表达影响另外的pdac细胞系中ca9mrna水平。特别地,如所示的,ca9mrna水平通过在panc10.05(图6a)和pa02c(图6b)细胞中的qpcr使用由scsirna或ape1/ref-1指向sirna转染和在缺氧条件下24小时之后收集的样品评估。**p<0.01和#p<0.001(ancova)。
图7a-7e显示了ape1/ref-1氧化还原信号传输以hif-1依赖的方式影响ca9的转录。特别地,hif-1-充足的(+/+)和hif-1-缺陷的(-/-)小鼠胚胎成纤维细胞(mef)被暴露在0.2%的氧下24小时,并且通过qpcr评估ca9hmrna水平(图7a)。在收集和通过qpcr评估ca9mrna水平之前由scsirna或ape1/ref-1指向sirna转染hif-1-/-mef并在0.2%氧下培养24小时(图7b—n=3的典型实验)。使用暴露在apx3300和1%氧下24小时之后收集的样品描述(图7c和7d—n=3的典型实验)的细胞系中的qpcr评估ca9mrna水平。如所示的,从存在或不存在caf下生长之后用apx3330处理的单层(2d)培养物和3d肿瘤球状体培养物中收集pa03c细胞,并且通过免疫印迹法评估ca9蛋白水平(图7e)。*p<0.01和**p<0.001(tukey多重比较检测)。
图8a和8b显示了在缺氧下,ca9蛋白水平提升,但是ape1水平没有提升。特别地,在所表示的时间内,pdac细胞被暴露至0.2%氧,并通过免疫印迹法评估ca9和ape1/ref-1蛋白水平。
图9a-9c显示了以ca9和ape1/ref-1为双靶标使pdac细胞酸化并抑制在缺氧下的细胞增殖。在分析细胞内ph之前,将panc10.05细胞用所表示的浓度的apx3330和slc-0111处理并暴露在缺氧(0.2%o2)下48小时(图9a)。将pa02c细胞用所表示浓度的apx3330和slc-0111(图9b)或fc13-555a(图9c)处理并暴露在缺氧(0.2%)下六天。*p>0.05和**p<0.01(dunnett多重比较检验);#p>0.05和##p<0.01(sidak多重比较检验)。在每个实验中,使用额外的平方和f检验之后通过邦费罗尼校正(bonferronicorrection)确定处理的各组之间的非线性回归曲线中的差异(p<0.05,对于双重处理的曲线vs.单剂曲线)。
图10a-10f显示了以ca9和ape1/ref-1为双靶标抑制3d共培养模型中pdac肿瘤的生长。特别地,pa03c(图10a、10c和10e)和panc10.05(10b、10d和10f)肿瘤细胞(用tdtomato转导)在3d培养物中在存在或不存在caf(用egfp转导)下生长。球状体用slc-0111单独处理(图10a和10b)和用其与apx3330的组合处理(图10c和10d),在培养物中12天之后量化肿瘤和caf的面积。双重处理实验的有代表性的图像显示在图10e和10f。在双重处理实验中,使用额外的平方和f检验之后通过邦费罗尼校正(bonferronicorrection)确定处理的各组之间的非线性回归曲线中的差异(p<0.01,对于每条曲线vs.仅在肿瘤细胞中仅apx3330的曲线,p<0.01,对于用50μmslc-0111的曲线vs.在肿瘤+caf共培养中仅apx3330的曲线)。
图11a-11d显示了ape1表达与pdac中降低的存活相关联,并在pdac中上调ca9。pdac患者中总体存活与ape1/ref-1mrna的低vs.高的表达的对比获自癌症基因组图谱(tcga)数据库(图11a)。在正常胰腺vs.pdac(图11b和11d)或胰腺癌前病变vs.pdac(图11c)中ca9mrna水平的对比获自logsdon等(图11b和11c)或pei等(11d)提供的oncomine使用数据(oncomineusingdata)。
图12a和12b为用pg-s3-001(图12b)和未经stat3抑制(图12a)的共同培养的肿瘤球状体的共聚焦图像。
图13描绘了使用thermoarrayscan的3d细胞平板接种(cellplating),其中处理了3d结构的二维投影以量化每个细胞群的总强度和总面积的差异。第10天:肿瘤=pa03c红色,cafs=caf19绿色。底下的线条显示肿瘤被消灭其中红色(肿瘤)消失而绿色(caf)保留。板的右侧的黄色是红色(肿瘤)和绿色(caf)重叠的结果。所有的颜色在提交的图中没有显示。
图14描绘了在与caf共培养中评估的pdac细胞的药物效能。
图15描绘了rux与apx3330的组合对消灭肿瘤的作用。
图16描绘了rux与apx3330的组合对pdac存活率的双靶标作用。
图17描绘了在st8814mpnst细胞系中e3330对肿瘤形成的作用。超过4天和7天监控肿瘤生长。10倍物镜。
图18a和18b描绘了e3330对st8814mpnst细胞系的伤口闭合的作用。图18a描绘了随时间变化的刮伤区域。比例尺代表在放大倍数为10倍的显微镜下成像250μm/细胞。图18b是描绘迁移细胞百分比的图。
图19a和19b描绘了e3330对s624mpnst细胞系的伤口闭合的作用。图19a描绘了随时间变化的刮伤区域。比例尺代表在放大倍数为10倍的显微镜下成像250μm/细胞。图19b是描绘迁移细胞百分比的图。
发明详述
除非另有定义,本文使用的所有技术术语、符号和其他科学用词都用以表示通常本发明涉及的领域的普通技术人员理解的常规意思。在一些情况下,具有常规理解的意思的术语在本文中定义以便清楚和/或方便查找,并且本文包含这样的定义不一定被解释为表示与本领域通常理解的实质性差异。本文描述或参照的技术和过程是本领域技术人员通常熟知和用常规方法通常使用的。除非另有说明,适当地,涉及使用市售试剂盒和试剂的程序通常根据制造商定义的方案和/或参数进行。
a.定义
如本文所使用的,术语“样品”是指从感兴趣的受试者获得或衍生的成分,其包含待表征和/或待鉴定的细胞实体和/或其他分子实体,例如基于物理特征、生物化学特征、化学特征和/或生理特征。例如,短语“疾病样品”及其变体是指从预期或已知含有待表征的细胞实体和/或分子实体的感兴趣受试者获得的任何样品。“组织”或“细胞样品”是指从受试者或患者的组织获得的类似细胞的集合。组织或细胞样品的来源可以是来自受试者的血液或任何血液成分(例如全血,血浆,血清)。组织样品也可以是原代或培养的细胞或细胞系。任选地,组织或细胞样品获自患病组织/器官。组织样品可以包含不与天然组织天然混合的化合物,例如防腐剂,抗凝血剂,缓冲剂,固定剂,营养素,抗生素等。
如本文所使用的,术语“对照”,“对照组”,“参照样品”,“参照细胞”,“参照组织”,“对照样品”,“对照细胞”和“对照组织”是指从已知或相信的来源获得的样品、细胞或组织,不会患有本发明的方法或组合物用于鉴定的疾病或病症。对照可以包含一个对照或多个对照。在一个实施方案中,参照样品、参照细胞、参照组织、对照样品、对照细胞或对照组织从其中使用本发明的组合物或方法确定疾病或病症的相同的受试者或患者的身体的健康部分获得。在一个实施方案中,参照样品、参照细胞、参照组织、对照样品、对照细胞或对照组织从这样的个体的身体的健康部分获得,该个体不是其中使用本发明的组合物或方法确定疾病或病症的受试者或患者。
术语“受试者”在本文中与“患者”可互换使用以指代待治疗的个体。受试者是哺乳动物(例如,人、非人灵长类动物、大鼠、小鼠、牛、马、猪、绵羊、山羊、狗、猫等)。受试者可以是临床患者、临床试验志愿者、实验动物等。可以怀疑受试者患有或有风险患有病症(例如pdac或mpnst)或被诊断患有病症(例如pdac或mpnst)。该受试者还可能被怀疑患有或有风险患有pdac、mpnst、肾癌和膀胱癌。根据一个实施方案,根据本发明待治疗的受试者是人。
术语“抑制”及其派生术语包括其通常接受的含义,其包括减少、阻止、预防、抑制和减缓、停止或逆转进展或严重性。因此,本方法酌情包括医疗治疗和预防性施用。如此,当涉及本文的治疗用途时,有需要的受试者是经鉴定需要或期望医学干预的受试者。
“有效量”是抑制本文所述的病理性疾病和紊乱所必需的药剂的量。当至少一种另外的治疗剂施用于受试者时,这些药剂可以顺序地、同时地或同步地施用,以获得所述药剂的益处。
如本文所使用的,“治疗(treating)”,“治疗(treatment)”,“减轻”,“缓解”和“减轻”是指其中目标是预防或减缓(减轻)靶向病理状况或紊乱或缓解紊乱的一些症状的措施。需要治疗的受试者可以包括已经患有这种紊乱的受试者以及容易患有这种紊乱的受试者,处于患有该紊乱的风险的受试者以及紊乱将被预防的受试者。
许多肿瘤(例如胰腺肿瘤、脑瘤、卵巢癌、膀胱癌、肾癌、前列腺癌和肉瘤)中的缺氧状态与预后不良有关。缺氧导致缺氧诱导因子1α(hif1α)的稳定,hif1α是一种上调多种因素的转录因子,所述多种因素促进肿瘤细胞的增强的耐药性、增殖和迁移/侵袭。hif-1转录活性依赖于稳定其α亚基,其靶向于通过脯氨酸羟基化和随后的vonhippel-lindau蛋白(vhl)-介导的泛素化在常氧条件下降解。稳定的hif1α与组成性表达的β亚基二聚化以在其启动子中用缺氧应答元素(hre)激活基因。目前没有hif-1特异性抑制剂存在,因此靶向其重要的转录靶标和调节hif-1活性的酶是调节癌细胞中缺氧信号传输的有希望的方式。
本发明总体上涉及以无嘌呤/无嘧啶核酸内切酶1/氧化还原因子1(ape1/ref-1)为靶标的方法。特别地,通过抑制ape1/ref-1抑制缺氧介导的信号传输,从而降低暴露于缺氧条件的肿瘤细胞的存活和入侵。在一个具体实施方案中,本发明涉及施用ape1/ref-1抑制剂和另外的治疗剂的方法。如实施例中所示,在用ape1/ref-1抑制剂和另外的治疗剂阻断多个缺氧信号传输途径时,即使在癌症相关成纤维细胞(caf)的存在下,肿瘤生长也显著降低。
发现apel/ref-1的氧化还原功能被3-[(5-(2,3-二甲氧基-6-甲基-1,4-苯醌基)]-2-壬基-2-丙酸(在下文中称为“e3330”或“3330”或“apx3330”)选择性抑制。关于apx3330的进一步信息可以在abe等的美国专利no.5,210,239中找到,在与本文一致的程度上以引用的方式并入本文。
有趣的是,下面的实施例表明apel/ref-1的氧化还原功能的选择性阻断不引起正常细胞中的任何细胞凋亡或任何可感知的细胞凋亡。人们可能会很好地预期,导致癌细胞凋亡增加的选择性阻断也会损害正常细胞。然而,事实并非如此。
当考虑受试者应用时,特别是在人类中时,有必要以适合于预期应用的形式制备药物组合物。通常,这将需要制备基本上不含可能对受试者有害的杂质的组合物。
药剂可以以基于受试者的体重和疾病进展程度的剂量口服、静脉内、肌内、胸膜内或腹膜内给药,并且可以每天一次,两次或甚至四次给药。
人们通常希望使用合适的盐和缓冲剂来使药剂稳定并允许被靶细胞吸收。本发明的水性组合物包含溶解或分散在药学上可接受的载体或水性介质中的有效量的药剂。这样的组合物也被称为无毒的。短语“药学上的”或“药理学上可接受的”是指当施用于受试者时不产生副反应、过敏反应或其他不良反应的分子实体和组成。如本文所用,药学上可接受的载体包括任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。这样的介质和用于药物活性物质的药剂的使用在本领域是公知的。补充活性成分也可以掺入组合物中。
用于本发明的组合物可以包括经典的药物制剂。根据本发明的这些组合物的施用将通过任何常用途径进行,只要靶组织可通过该途径获得即可。途径包括口服、鼻腔、含服、直肠、阴道或局部。或者,可以通过原位、皮内、皮下、肌内、腹膜内或静脉内注射给药。如本文所述,这些组合物通常作为药学上可接受的组合物施用。
例如,化合物可以与普通的赋形剂、稀释剂或载体一起配制,并形成片剂、胶囊剂、混悬剂、粉剂等。适合于这种制剂的赋形剂、稀释剂和载体的实例包括以下:填充剂和延展剂(extenders),如淀粉、糖、甘露糖醇和硅酸衍生物;粘合剂如羧甲基纤维素和其它纤维素衍生物,藻酸盐,明胶和聚乙烯吡咯烷酮;保湿剂如甘油;崩解剂如碳酸钙和碳酸氢钠;阻滞溶解剂如石蜡;吸收促进剂如季铵化合物;表面活性剂如鲸蜡醇、甘油单硬脂酸酯;吸附载体如高岭土和膨润土;和润滑剂如滑石,硬脂酸钙和硬脂酸镁,以及固体聚乙二醇。
活性化合物也可以肠胃外或腹膜内给药。作为游离碱或药理学上可接受的盐的活性化合物的溶液可以在适当地与表面活性剂如羟丙基纤维素混合的水中制备。分散体也可以在甘油、液体聚乙二醇及其混合物和油中制备。在通常的储存和使用条件下,这些制剂含有防腐剂以防止微生物的生长。
适于注射使用的药物形式包括无菌水溶液或分散液和用于临时制备无菌注射溶液或分散液的无菌粉末。在一些特别合适的实施方案中,所述形式是无菌的,并且是通过注射器容易给药的程度的流体。它在制造和储存条件下可以稳定,可在防止微生物,如细菌和真菌的污染作用下保存。载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其合适的混合物和植物油的溶剂或分散介质。例如,通过使用诸如卵磷脂的包衣,通过在分散的情况下维持所需的粒径和通过使用表面活性剂来维持适当的流动性。可以通过各种抗菌剂和抗真菌剂,例如对羟基苯甲酸酯,氯丁醇,苯酚,山梨酸,硫柳汞等来预防微生物的作用。在许多情况下,优选包括等渗剂,例如糖或氯化钠。可以通过在组合物中使用延迟吸收的试剂例如单硬脂酸铝和明胶来延长可注射组合物的吸收。
无菌可注射溶液通过如下步骤制备:将所需量的活性化合物与上述各种其他成分(如果需要)在合适的溶剂中混合,然后过滤灭菌。通常,通过将各种灭菌的活性成分掺入到含有基本分散介质和上面列举的所需其它成分的无菌载体中来制备分散液。在用于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥技术和冷冻干燥技术,该制备方法由先前的无菌过滤溶液产生活性成分加任何另外的所需成分的粉末。
对于本发明的口服给药剂,可以将其与赋形剂混合并以不可摄入的漱口剂和洁齿剂的形式使用。可以将所需量的活性成分掺入合适的溶剂如硼酸钠溶液(dobell'ssolution)中来制备漱口剂。或者,可将活性成分掺入含有硼酸钠、甘油和碳酸氢钾的防腐洗涤剂中。活性成分也可分散在洁齿剂中,包括凝胶、糊剂、粉末和浆液。可将活性成分以治疗有效量加入糊剂洁牙剂中,所述糊剂洁牙剂可包含水、粘合剂、研磨剂、调味剂、发泡剂和湿润剂。
用于本发明的组合物可以配制成中性形式或盐形式。药学上可接受的盐包括与无机酸如盐酸或磷酸,或有机酸如乙酸、草酸、酒石酸、扁桃酸等形成的酸加成盐(与蛋白质的游离氨基形成)。与游离羧基形成的盐也可以衍生自无机碱,例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,以及有机碱如异丙胺、三甲胺、组氨酸、普鲁卡因等。
配制后,溶液将以与剂型相容的方式并以治疗有效的量施用。该制剂易于以各种剂型如可注射溶液、药物释放胶囊等给药。例如,对于在水溶液中的肠胃外给药,如果需要,溶液应适当地缓冲,并且首先用足够的盐水或葡萄糖使液体稀释剂等渗。这些特定的水溶液特别适用于静脉内、肌肉内、皮下和腹膜内给药。就此而言,根据本发明,可以使用的无菌水性介质将是本领域技术人员已知的。例如,可以将一个剂量溶解在1ml等渗的nacl溶液中,并或将其加入到1000ml皮下灌注液中,或者在建议的输注部位注射(参见例如“remington'spharmaceuticalsciences”第15版,第1035-1038和1570-1580页)。剂量的一些变化将根据所治疗的受试者的状况而必然发生。无论如何,负责给药的人员将确定个体受试者的适当剂量。此外,对于人体给药,制剂应满足fda和国外相关机构要求的无菌性,一般安全性和纯度标准。
在一些方面,如上所述,ape1/ref-1抑制剂与一种或多种另外的治疗剂组合施用。示例性的另外的治疗剂包括信号转导和转录激活因子3(stat3)抑制剂(例如,2-羟基-4-(((4-甲基苯基)磺酰氧基)乙酰基)氨基)-苯甲酸/s3i-201、6-硝基苯并[b]噻吩-1,1-二氧化物/stattic、ochromycinone、4-[[(4-环己基苯基)甲基][2-[甲基[(2,3,4,5,6-五氟苯基)磺酰基]氨基]乙酰基]氨基]-苯甲酸(sh-4-54)、4-(n-(4-环己基苄基)-2-(2,3,4,5,6-五氟-n-甲基苯基磺酰氨基)乙酰氨基)-2-羟基苯甲酸(bp-1-102)以及基于bp-1-102结构的其它抑制剂(例如karan等描述的pg-s3-001、pg-s2-002和pg-s3-003,mol.cancerther.2016feb12,pii:molcanther.0003.2015(结构如下所示)和dr-4-89))、碳酸酐酶ix(ca9)抑制剂、血管内皮生长因子(vegf)抑制剂和/或vegf受体(vegf-r)抑制剂(例如
在一个特别适合的实施方案中,另外的治疗剂是碳酸酐酶ix(ca9)抑制剂。示例性ca9抑制剂包括slc-0111(signalchemlifesciencescorp.,richmond,britishcolumbia)及其类似物,fc13-555a。slc-0111和fc13-555a的结构如下所示:
在另一个特别适合的实施方案中,另外的治疗剂是janus激酶(jak)抑制剂,特别是干扰jak-stat信号传输途径的janus激酶(jak)抑制剂。示例性jak抑制剂包括卢索替尼(jak1/jak2抑制剂)、厄洛替尼(jak2抑制剂)、ly3009104(jak2抑制剂),托法替尼(jak3抑制剂)、巴瑞克替尼(jak1/jak2抑制剂)、cyt387(jak2抑制剂)、filgotinib(jak1抑制剂)、来他替尼(jak2抑制剂)、普瑞替尼(pacritinib)(jak2抑制剂)及其组合。
现在已经发现ape1/ref-1蛋白的去除减少了hif介导的转录和hif-1α诱导的下游靶标,包括ca9和血管生成素样4(angptl4)。特别地,hif-1α是缺氧诱导的ca9转录以及stat3中的关键因子。ca9作为对缺氧的细胞响应的一部分来调节细胞内ph以促进细胞存活。现在已经发现通过阻断ca9活性和通过ape1/ref-1的ca9转录,可以看到在缺氧条件下pdac细胞增殖减少。
虽然本文关于pdac进行了描述,但应认识到本
技术实现要素:
的方法可用于抑制缺氧介导的信号传输,从而降低除pdac外的暴露于缺氧条件下的肿瘤细胞的存活和侵袭。具体而言,所述方法可用于抑制脑癌、卵巢癌、膀胱癌、肾癌、前列腺癌、肉瘤、恶性外周神经鞘膜瘤(mpnst)等。
本发明使用实施例来公开本发明,并且还使得本领域技术人员能够实践本发明,包括制造和使用任何面板或装置以及执行任何结合的方法。本发明的可专利范围由权利要求限定,并且可以包括本领域技术人员想到的其他实施例。如果这样的其它实施例具有不与权利要求的字面语言不同的结构要素,或者如果它们包括与权利要求的字面语言无实质区别的等同结构要素,则这样的其它实施例在权利要求的范围内。
具体实施方式
实施例1
在本实施例中,分析了ape1/ref-1通过hif1α介导的转录来调节缺氧信号传输的机制。此外,还分析了ape1/ref-1抑制剂和ca9抑制剂联合治疗对肿瘤大小和增殖的作用。
方法和材料
细胞培养:将细胞维持在培养物中,如在jiang,zhou等(2010)cancerinvestigation28(9):885-895;fishel,jiang等(2011)molecularcancertherapeutics10(9):1698-1708;cardoso,jiang等(2012)plosone10:e47462;fishel,wu等(2015)jbiolchem290(5):3057-3068中所述。患者来源的肿瘤细胞和caf19细胞来自anirbanmaitra博士的实验室(约翰霍普金斯大学)(jones,zhang等,2008)。癌症相关的成纤维细胞,uh1303-02使用来自患者肿瘤组织的生长方法分离,如在walter,omura等(2008)cancerbiolther7(6):882-888中所述。所有细胞系通过str分析(idexxbioresearch)进行鉴定并常规检查支原体污染。使用ruskinninvivo2200缺氧工作站实现缺氧暴露。使用cmv-egfp-wtape1/ref-1和cmv-egfp慢病毒构建体过度表达ape1/ref-1,如在kim,guo等(2015)mutatres779:96-104中所述。为了检测细胞用于成像,使用cmv-egfp慢病毒构建体。另外,将150pfu/细胞的pcl7tdtomwo慢病毒载体与pa03c和panc10.05细胞一起培养48小时以使细胞稳定表达tdtomato。
免疫印迹法分析(westernblotanalysis):western印迹按照wang,luo等(2004)molcancerther3(6):679-686;fishel,he等(2008)dnarepair(amst)7(2):177-186;fishel,colvin等(2010)hematol38(12):1178-1188;jiang,zhou等(2010)cancerinvestigation28(9):885-895;fishel,jiang等(2011)molecularcancertherapeutics10(9):1698-1708;cardoso,jiang等(2012)plosone10:e47462;fishel,wu等(2015)jbiolchem290(5):3057-3068中描述的进行,使用用于ape1/ref-1(novusbiologicals;littleton,co)、hif1α(genetex;irvine,ca)、stat1、stat3(cellsignaling;danvers,ma)、nfκb(abcam;cambridge,ma)、ca9(santacruz;dallas,texas)和纽蛋白(sigma;st.louis,mo)的抗体。
免疫共沉淀:使用pierceco-ip试剂盒(thermoscientific)将样品与修饰物免疫共沉淀,如fishel,wu等在(2015)jbiolchem290(5):3057-3068中所述的。
转染:用ape1/ref-1sirna转染pdac细胞和caf细胞,如wang,luo等,(2004)molcancerther3(6):679-686;fishel,he等(2008)dnarepair(amst)7(2):177-186;fishel,colvin等(2010)hematol38(12):1178-1188;jiang,zhou等(2010)cancerinvestigation28(9):885-895;fishel,jiang等(2011)molecularcancertherapeutics10(9):1698-1708;cardoso,jiang等(2012)plosone10:e47462;fishel,wu等(2015)jbiolchem290(5):3057-3068中所述的。使用的sirna是:#1或混杂的对照(之前报道)和两种lifetech验证的sirna(#2,s1445和#4,s1447)(fishel,wu等(2015)jbiolchem290(5):3057-3068)。除非另有说明,使用ape1/ref-1sirna#1作为标准sirna。
瞬时萤光素酶报道测定:用含有由hif1α驱动的萤光素酶和renilla萤光素酶对照报道基因载体的构建体共转染miapaca-2细胞,如luo,delaplane等,(2008)antioxidredoxsignal10(11):1853-1867;fishel,wu等(2015)jbiolchem290(5):3057-3068中所述,使用x-tremegene9dna转染试剂(roche,indianapolis,in)和上述的sirna。使用双荧光素酶报告检测系统(promegacorp.)测定萤火虫和renilla萤光素酶活性,如之前(luo,delaplane等,(2008)antioxidredoxsignal10(11):1853-1867;cardoso,jiang等,(2012)plosone10:e47462;fishel,wu等(2015)jbiolchem290(5):3057-3068)。
qrt-pcr反应:使用qrt-pcr测量ca9的mrna表达水平,如在fishel,jiang等(2011)molecularcancertherapeutics10(9):1698-1708中所述的。在缺氧或未缺氧条件下(1%和0.2%o2)用ape1/ref-1sirna或增加量的apx3330处理细胞24小时,然后用qiagenrneasymini试剂盒(valencia,ca)从细胞中提取总rna。进行第一链cdna合成和定量pcr,如在fishel,vasko等,(2007)mutatres614(1-2):24-36;jiang,guo等,(2009)dnarepair(amst)8(11):1273-1282;fishel,jiang等(2011)molecularcancertherapeutics10(9):1698-1708中所述。使用18srrna、rplpo和b2m作为参照基因使用比较ct方法测定相对定量的mrna水平(livak和schmittgen(2001)methods25(4):402-408;fishel,vasko等人(2007)mutatres614(1-2):24-36;jiang,guo等(2009)dnarepair(amst)8(11):1273-1282)。ca9,18s,rplpo和b2m的引物为市售(appliedbiosystems)。
抑制剂:如先前所述制备和使用化合物:apx3330(luo,delaplane等(2008)antioxidredoxsignal10(11):1853-1867;fishel,colvin等(2010)exphematol38(12):1178-1188;nyland,luo等(2010)jmedchem53(3):1200-1210;su,delaplane等(2011)biochemistry50:82-92)和slc-0111(clinicaltrials.gov,nishimori,minakuchi等(2006)jmedchem49(6):2117-2126;pacchiano,aggarwal等(2010)chemcommun(camb)46(44):8371-8373;lou,mcdonald等(2011)cancerres71(9):3364-3376;pacchiano,carta等(2011)jmedchem54(6):1896-1902;mcdonald,winum等(2012)oncotarget3(1):84-97;supuran(2015)jenzymeinhibmedchem:1-16;supuranandwinum(2015)expertopindrugdiscov10(6):591-597)。另外,如下所述合成slc-0111类似物fc13-555a。
4-[3-(2-氯-5-硝基-苯基)-脲基]-苯磺酰胺fc13-555a的合成。
将1-氯-2-异氰酸基-4-硝基-苯1(1.0当量)加入到磺酰胺2(1.0当量)的acn溶液中。将该溶液在室温下搅拌3小时,形成白色沉淀,将其过滤收集,用乙醚湿磨并真空干燥,得到标题化合物,为浅黄色固体。
4-[3-(2-氯-5-硝基-苯基)-脲基]-苯磺酰胺fc13-555a:89%产率;硅胶tlcrf0.28(乙酸乙酯/正己烷30%v/v);δh(400mhz,dmso-d6)7.28(2h,brs,与d2o、so2nh2交换),7.78(2h,d,j8.8,arh),7.83(3h,m,arh),7.94(2h,d,j8.8,arh),8.82(1h,,brs,与d2o、nh交换),9.21(1h,s,arh),10.00(1h,s;arh);δc(100mhz,dmso-d6)115.6,118.5,118.8,127.8,128.9,131.3,137.7,138.6,142.9,147.5,152.7;m/z(esi-ms-正)371.01(m+h)。分析计算值:c,42.11;h,2.99;s,8.65;分析发现:c,42.15;h,3.04;s,8.62。
细胞增殖:使用alamarblue测定法测量单层中的pdac细胞增殖,如在fishel,wu等(2015)jbiolchem290(5):3057-3068中所述的。将用apx3330和slc-0111处理的细胞暴露于缺氧6天,然后加入alamarblue试剂(invitrogen),随后进行荧光分析。倍数变化是指与正常培养基中生长的细胞相比,用指定的抑制剂处理的细胞的荧光读数。
ph测定:使用phrodoredam细胞内ph指示剂(lifetech)评估细胞内ph。用apx3330和slc-0111处理的pdac细胞暴露于缺氧48小时,然后用phrodoredam染料分析。使用细胞内ph校准缓冲液(lifetech)来建立用于测定ph值的荧光强度的标准曲线。将结果标准化至mts分析以解释增殖的变化。
统计分析。使用2-δδct方法和协方差分析(ancova)模型分析混杂、siape1/ref-1和低氧处理的qpcr数据点,如在yuan,reed等(2006)bmcbioinformatics7:85;fishel,wu等(2015)jbiolchem290(5):3057-3068中所述的。使用事后多重比较检验(tukey,dunnett或sidak,酌情)分析多个治疗组的测试中的数据点。为了评估使用多种药物的数据曲线,使用额外的平方和f检验来比较各组之间共享的非线性回归曲线的拟合优度与各组的单独曲线的拟合优度。适当的bonferroni校正之后,如果p<0.05,则治疗组和对照组之间的差异被认为是显着的。使用sas(版本9.3,版权所有
hif-1-/-mef产生:使用5ng/ml聚凝胺,用ad-cmv-cre(cre腺病毒)或ad-gfp(对照)载体(vectorbiolabs;malvern,pa)转导hif-1-floxed的小鼠胚胎成纤维(mef)细胞24小时以产生hif-1缺陷细胞(attardi,lowe等(1996)emboj15(14):3693-3701;rankin,wu等(2012)cell149(1):63-74)。使用pcr验证hif的缺失(图1)。
3d共培养物:如前所述,使用超低附着的96孔板(corninginc.,lifesciences)在存在和不存在caf(75μl/孔)的情况下产生三维肿瘤球状体(sempere,gunn等(2011)cancerbiolther12(3):198-207;arpin,mac等(2015)molecularcancertherapeutics)。如所指出的,细胞用egfp(绿色)或tdtomato(红色)稳定转导以保持低传代患者细胞的遗传特征(jones,zhang等(2008)science321(5897):1801-1806)。将细胞重悬于含有3%还原生长因子基质胶(rgf,bdbiosciences)和5%fbs的无色dmem生长培养基中。平板接种(plating)后,在第4天和第8天用含有5%血清、3%rgf基质胶和所示抑制剂的培养基处理细胞。在第12天,使用thermoarrayscan高含量成像系统分析球状体(lovborg,nygren等(2004)molcancerther3(5):521-526;lindblom,berg等(2012)toxicolpathol401):18-32)。arrayscan使用tdtomato和egfp的2.5倍物镜捕获3d结构的图像;然后处理2d投影图以量化caf和肿瘤的总强度和总面积的差异。
结果
缺氧刺激ape1/ref-1与hif1α和stat3的相互作用
先前公布的数据表明,ape1/ref-1的缺失和/或用选择性抑制剂apx3330(也称为apx3330)的apx1/ref-1氧化还原信号传输的抑制之后stat3、hif1α和nfκb活性降低(fishel,jiang等(2011)molecularcancertherapeutics10(9):1698-1708;cardoso,jiang等(2012)plosone10:e47462)。类似地,发现ape1/ref-1的抑制导致细胞内主要的hif-1靶标碳酸酐酶ix(ca9)降低。为了进一步阐明ape1/ref-1在缺氧信号传输中的作用并更清楚地确定缺氧是否刺激ape1/ref-1与其氧化还原靶标之间的相互作用,在常氧和低氧(0.2%o2)条件下从两种低传代pdac细胞系(panc10.05和pa03c)的裂解物中免疫沉淀内源性ape1/ref-1。探测hif1α、stat3和nfκb的ip。在缺氧条件下在下拉组分(pull-downfraction)中检测到hif1α和stat3,但不是nfκb,但是这些相互作用在含氧量正常的条件下没有检测到(图2a和2b)。进行tnfα(nfκb)和il-6(stat3)的对照以显示ape1/ref-1与其调节的转录因子之间的相互作用确实在具有适当刺激的常氧条件下发生(图3a和3b)。缺氧条件下,ape1/ref-1与hif1α和stat3的相互作用是明显的。
暴露于缺氧后,过度表达的ape1/ref-1导致与ape1/ref-1免疫沉淀的hif1α和stat3更强的信号(图2c和2d)。在暴露于缺氧之后,来自过度表达ape1/ref-1的细胞的ip中仍未检测到nfκb,表明ape1/ref-1的量不限制上述板(panel)(图2c和2d)。探测另一个stat家族成员stat1以证明ape1/ref-1与转录因子的相互作用对于缺氧中的信号传输是特异性的。探测来自panc10.05细胞的ip的stat1,不管ape1/ref-1的水平或氧气条件如何,都未检测到stat1(图2c)。由于疾病的复杂性和胰腺肿瘤微环境中不同细胞类型之间的信号传输,研究了caf中ape1/ref-1与hif1α,stat3和nfκb的相互作用。结果与pdac细胞的结果相同:ape1/ref-1在缺氧下与hif1α和stat3相互作用,但不与nfκb相互作用(图4a-4c)。根据开始临床试验的ca9抑制剂和以前的数据证实ape1/ref-1阻塞后是ca9的转录调节(fishel等,molcancerther10(9):1698-1708),本实施例聚焦于hif1α信号传输以及通过ape1/ref-1调节下游分子ca9。
ape1/ref-1蛋白表达有助于缺氧诱导的hif1α介导的转录
为了证实ape1/ref-1和hif1α之间的相互作用在功能上是重要的,通过用hif1α驱动的萤火虫萤光素酶或pluc-mcs(载体对照)以及ape1/ref-1sirna或混杂的对照共转染miapaca-2细胞并将细胞暴露于缺氧24小时来评估ape1/ref-1对hif-1转录活性的贡献。ape1/ref-1去除导致缺氧诱导的hif1α活性显着降低
通过检查缺氧介导的hif-1靶标ca9的转录来进一步评估ape1/ref-1对hif转录活性的影响。ape1/ref-1去除并暴露于缺氧之后比较两种pdac细胞系和一种胰腺癌caf细胞系中的ca9mrna水平。在两种缺氧水平下,所有细胞系中ape1/ref-1去除均使低氧诱导的ca9mrna水平减弱(图5c-5e)。不同细胞系中诱导量的变异性可能部分归因于常氧条件下极低的基线ca9表达。ape1/ref-1去除在两种另外的初级pdac细胞系中在缺氧条件下类似地减弱ca9mrna水平(图6a和6b)。这些结果在使用另外两种ape1/ref-1靶向sirna暴露于缺氧的miapaca-2细胞中得到验证,并且获得了相似的结果(图5f-5g)。为了证实ca9的降低也发生在蛋白水平,在pdac细胞和胰腺caf细胞中ape1/ref-1去除后,通过免疫印迹法评估缺氧诱导的ca9蛋白水平。ape1/ref-1去除导致缺氧诱导的ca9蛋白水平降低
缺氧诱导的ca9转录是取决于hif-1
为了证实ape1/ref-1和缺氧对ca9转录的影响是由hif-1活性介导的,在ape1/ref-1去除之后,评估hif-1缺陷的(-/-)mef中的缺氧诱导的ca9mrna水平。正如预期的那样,在hif-1充足的mef中,与正常的氧对照相比,ca9被诱导30倍。在hif-1-/-mef中,暴露于缺氧(图7a)或受ape1/ref-1去除(图7b)不诱导ca9mrna水平,表明ca9转录是取决于hif-1,不论ape1/ref-1的表达或氧气水平。通过pcr证实这些细胞中的hif-1消耗(图1)。
ape1/ref-1氧化还原信号传输的抑制影响ca9转录
作为一种多功能蛋白,ape1/ref-1也参与dna病变的碱基切除修复(ber)、rna质量控制和还原-氧化(氧化还原)调节。去除ape1/ref-1影响所有这些功能。检测氧化还原功能以确定其使用ape1/ref-1特异性氧化还原抑制剂对ape1/ref-1介导的缺氧信号传输途径的调控的责任,所述ape1/ref-1特异性氧化还原抑制剂不影响其他ape1/ref-1功能,并且将用于2016夏天中的临床试验。之前显示,apx3330降低了暴露于缺氧的panc-1和mia-paca2细胞中的ca9mrna水平。这里将这些结果扩展到原代细胞和caf细胞,以及3d共培养物。在用apx3330处理并暴露于缺氧后,pa03c细胞和胰腺caf细胞中的ca9mrna水平以剂量依赖的方式减弱(图7c和7d)。此外,在用apx3330抑制ape1/ref-1后,在3d共培养模型中测量ca9蛋白表达。虽然ca9在常氧条件下在患者来源的单层pa03c细胞中未检测到,但当以球状体生长时,这些细胞表达ca9。在caf存在下生长的肿瘤球状体更强烈地上调ca9表达(
在三种pdac细胞系中暴露于缺氧(0.2%氧)后评估ca9和ape1/ref-1蛋白表达,发现虽然ca9水平随时间增加,ape1/ref-1水平没有显着变化图8a和8b),表明低氧诱导的ca9表达并非继发于ape1/ref-1上调。
ca9和ape1/ref-1的双重靶向使pdac细胞酸化,并在缺氧下抑制细胞增殖
ca9在缺氧条件下调节细胞内ph,并且ape1/ref-1氧化还原活性有助于缺氧诱导的ca9表达。使用phrodoredam荧光ph指示剂作为低氧下碳酸酐酶活性的功能性终点(functionalendpoint)分析用ca9抑制剂slc-0111和ape1/ref-1氧化还原抑制剂apx3330处理后的缺氧暴露的pdac细胞中的胞内ph。与单独使用任一种抑制剂的处理相比,用slc-0111和apx3330进行的双重处理导致细胞内ph更大的降低(图9a)。
用apx3330和低氧处理细胞后,ape1/ref-1氧化还原活性的抑制导致pdac细胞增殖的剂量依赖的降低。除缺氧下的apx3330处理外,通过用ca9抑制剂slc-0111处理,ape1/ref-1抑制对细胞活力的作用大大增强(图9b)。此外,还发现apx3330与slc-0111类似物fc13-555a的组合在杀死单层中的pdac细胞方面显著有效(图9c),支持低氧信号传输蛋白的阻塞将对pdac细胞有害的假设。为了支持这些结果,正在开发新的ca9抑制剂。
在3d共培养模型中,ca9和ape1/ref-1的双靶向抑制pdac肿瘤生长
为了更精确地模拟肿瘤微环境,使用pdac的三维共培养模型,其包括低传代患者来源的肿瘤细胞以及癌症相关成纤维细胞。如上所示,当用caf细胞生长时,这些肿瘤球状体中ca9的水平更高,并且用apx3330处理减弱ca9表达(图7e)。与在单层中相比,用slc-0111对ca9的抑制在3d模型中更有效,对在较低剂量下观察到的肿瘤细胞杀伤具有显着效果,如通过患者来源的细胞的面积减少所测量的(图10a和10b)。细胞杀伤在肿瘤细胞中比在caf中更显着,特别是当caf19细胞与pa03c细胞共培养时。测量荧光强度时可以看到类似的趋势(数据未显示)。重要的是,即使在caf的保护环境中,抑制ca9也能有效地杀伤肿瘤细胞。
为了确定阻塞stat3和hif介导的转录以及抑制ca9活性是否会加强pdac细胞死亡,将apx3330和slc-0111组合在3d共培养模型中。由于每种细胞类型中不同的荧光标记,可以评估双重靶向对单独肿瘤和共同培养中肿瘤和caf两者的影响。如在缺氧暴露的2d培养物中所看到的,对ape1/ref-1氧化还原抑制加上ca9抑制导致肿瘤球状体中细胞杀伤的显著增强。用apx3330和slc-0111处理患者来源的pdac细胞(pa03c或panc10.05)和caf细胞构成的球状体(图10e和10f),并且分别评价荧光的面积作为每种细胞类型的标记(图10c和10d)。通过增加ca9抑制观察到apx3330诱导的球状体生长阻塞的显著增强。在slc-0111的存在下,观察到的apx3330处理的肿瘤细胞面积的减少显著不同,验证了在低氧暴露的2d培养物中观察到的效应。当测量红色和绿色荧光强度时,可以看到类似的趋势(数据未显示)。
讨论
提高的ape1/ref-1表达与许多癌症有关,包括胰腺癌、卵巢癌、胃癌、乳腺癌、肺癌、成胶质细胞瘤、肝癌和结肠癌,并且来自癌症基因组图谱(tcga,cancergenome.nih.gov)的公开可用数据的分析揭示了具有升高的ape1/ref-1表达的pdac患者的存活率的显着降低(图11a)。在肿瘤细胞中,各种促肿瘤转录因子(tf)如通过ape1/ref-1的stat3、nfκb和hif-1中半胱氨酸硫醇的还原-氧化(氧化还原)是这些因子激活的关键步骤。这些tf都是癌症治疗的重要目标,特别是pdac,但已被证明是特别难以药物治疗的。
ape1/ref-1有助于stat3激活以及stat3在pdac细胞中的随之而来的肿瘤促进作用。stat3和hif-1的协同活性已经在各种癌症中得到证实。然而,在本发明中发现ape1/ref-1与stat3结合是通过在pdac细胞中暴露于缺氧刺激的,这表明ape1/ref-1和stat3两者作为pdac中潜在的治疗靶标的重要性。这些发现将与正在开发用于最终临床试验的临床前stat3抑制剂一起被进一步追求。此外,上述结果证明,apx3330处理降低缺氧诱导的hif-1转录活性和ca9mrna水平,这是令人兴奋的,因为ca9抑制剂正在进入或正在进行临床试验。这后一个发现是非常有趣的,不仅因为它更接近患者的适用性,而且建立在沿着受ape1/ref-1影响的途径的多个点阻断各种信号传输途径的策略上。
本发明的两点抑制hif-ca9轴的策略;用apx3330阻断ca9的hif-1产生以及使用slc-0111产生的阻断任意ca9的活性,是一种新颖的以缺氧pdac细胞为靶标的方法。这就是说,不仅缺氧的pdac细胞将对apx3330和slc-0111的组合敏感。apx3330以充分氧合的肿瘤细胞中被激活的其他信号传输途径为靶标,而slc-0111也可抑制另一种肿瘤相关碳酸酐酶ca12。上述发现建立了这种策略,导致添加的细胞酸化和抑制缺氧的pdac细胞增殖。
总之,本文提供的实施例提供了ape1/ref-1、stat3和hif-1信号传输与pdac中ca9产生之间的密切关系的连续证据以及两个小分子抑制剂的组合(每一种都显示出最小的毒性)可能是治疗pdac的重要下一步的首次证据,pdac是有效治疗仍然难以捉摸的疾病。
实施例2
在本实施例中,分析了ref-1/stat3对细胞存活和增殖的双重靶向作用。
材料和方法
三维生长分析。将96孔板用1%诺贝尔琼脂(difco)(50μl/孔)涂布。将mcherry标记的pdac细胞和egfp标记的caf以1:4的细胞比例(肿瘤:caf)重悬浮于含有3%基质胶(bdbiosciences)的正常生长培养基中,并平板接种(plate)在固化的1%诺贝尔琼脂的顶部。在细胞用含5%血清+3%基质胶+试验药物的培养基平板接种后,在第4天和第8天供给细胞。
使用apx3330、jak2抑制剂(卢索替尼(incb018424;fisherscientific)(“rux”))和前导stat3抑制剂(pg-s3-001,dr-4-89),评估在pdac低传代患者来源的细胞系(pa03c和panc10.05)中ref-1/stat3抑制的效果。使用chou-talalay方法评估应答,该应答使用基于增殖的3d共培养测定和统计分析来评估协同作用,相加作用或拮抗作用。
将本实施例设计为使相同的活共培养物在12天内以thermoarrayscan在共培养的第8天和第12天捕获的图像可视化。该模型中的癌症和基质细胞被标记有不同的荧光蛋白(mcherry用于肿瘤,egfp用于caf),从而可以分化和定量细胞群体。先前优化了能使用3d共培养物的几个因素以筛选有效组合,包括用于3d培养和成像(96孔板)的适当平板,每个孔需要以形成稳定结构的肿瘤细胞数量(1000个细胞),以及肿瘤与caf的最佳的(1:4)比例(图12a和12b)。使用thermoarrayscan开发半高通量系统,其中可以容易地处理3d结构的二维投影以量化每个细胞群的总强度和总面积的差异(图13)。以这种方式,可以评估pdac细胞在与caf共培养中的药效,caf更如实地模拟天然的体内pdac环境。
结果
已经在3d测定中测试了单一药剂apx3330、rux、pg-s3-001和dr-4-89。这些药物有效地杀死了单独的肿瘤球状体和与caf一起培养的肿瘤球状体。特别地,即使在存在caf的情况下,用先导化合物、pg-s3-001和dr-4-89抑制stat3也导致pdac细胞中的细胞死亡,并且作为单一药剂,在体内观察到一些活性(fig14)。
该模型用于测试apx3330和stat3抑制的组合。由于使用arrayscan和96孔板格式开发的系统的半高通量性质,可以实现每种药物的大量组合和剂量。使用pg-s3-001和dr-4-89这两者以及stat3通路使用rux将有助于确定直接stat3抑制是否比通过jak2对stat3的上游抑制更有效。
如图15所示,rux联合apx3330有效地杀死了单独的肿瘤球状体和与caf共培养的肿瘤球状体。
实施例3
在本实施例中,分析了apx3330和卢索替尼(rux)的组合对pdac存活的体内作用。
使用apx3330和rux,评估与caf共注射的低传代患者来源细胞系(pa03c)的体内共培养模型中ref-1/stat3抑制的效果。特别地,nsg小鼠(每个治疗组中n=5)用50mg/kgapx3330bidip处理5天,2周休息2天,和/或在每个下午处理中,以50mg/kgipsid给予rux。如图16所示,在该共培养体内模型中,apx3330+rux的共处理有效地抑制肿瘤生长。使用亚致死剂量的单一制剂(50mg/kg)以观察组合治疗的效果,并且组合治疗在小鼠中良好耐受。
基于前述,这两种蛋白质的双重靶向表示pdac细胞的合成致死事件。
实施例4
在本实施例中,分析了ref-1抑制对恶性外周神经鞘膜瘤(mpnst)细胞系中的细胞存活和增殖的影响。
方法和材料
来源于nf1患者的st8814mpnst细胞购自atcc(由lgcstandards,middlesex,uk分销)。s462mpnst细胞系(由mpnst24472建立的细胞系)是从一名19岁的女性nf1患者获取。所有提及的细胞系均在75cm2烧瓶中用补充有10%(v/v)胎牛血清(fcs)和1%(v/v)青霉素链霉素(penstrep)的dulbecco改良的eagle培养基(dmem)培养。细胞系在37℃,5%co2下孵育。
软琼脂肿瘤形成测定
在六孔板中进行两层软琼脂测定。简而言之,将103个mpnst细胞平板接种(plate)在0.6%琼脂层之上含有0.35%琼脂的完全培养基中。用完全培养基覆盖琼脂,并在37℃,5%co2下使细胞集落生长7天。培养基每周更换三次,每次更换培养基时用50μm的e3330处理平板。使用配备有奥林巴斯照相机的倒置amgevos显微镜拍摄代表性的相衬照片(图17)。
伤口愈合
将细胞接种在35-mm平板中并保持80-90%融汇。然后使细胞在1%(v/v)fbsdmem中同步24小时,并通过用移液管吸头刮擦“受伤”。用pbs洗涤去除死细胞,然后用dmem(10%(v/v)fbs)代替。用50μm的e3330处理细胞并置于培养箱(5%co2/37℃)中18小时。使用imagej测量刮痕区域。在使用配备有奥林巴斯照相机的倒置amgevos显微镜处理之前和处理18小时后拍摄照片(图18a和19a)。然后计算迁移细胞的百分比(图18b和19b)。使用prism进行t检验以确定显著性。进行了3个单独的实验。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程