奶牛金黄色葡萄球菌乳房炎亚单位疫苗的组合物及其制备方法和应用与流程
本发明涉及一种奶牛金黄色葡萄球菌乳房炎的亚单位疫苗组合物及其制备方法和应用。属于兽用疫苗技术领域。
背景技术:
奶牛乳房炎(mastitis)是成年奶牛最普遍的感染性疾病之一,主要是奶牛乳腺组织受到微生物感染后而引起的一种炎症,多发生于产后哺乳期,该病广泛存在于世界各地,为奶牛常见病、多发病,是造成乳制品业经济损失最为严重的疾病之一。引起奶牛乳房炎的病原微生物大约有150多种,主要以金黄色葡萄球菌、大肠杆菌、无乳链球菌为主,这三种细菌引起的奶牛乳房炎占总发病率的90%以上,其中尤以金黄色葡萄球菌为最。
当前奶牛乳房炎的治疗主要是抗生素治疗。抗生素用于治疗奶牛乳房炎已有50多年的历史,其在奶牛乳房炎的防治中起了一定的作用,但由于长期单一的、大剂量、不科学使用抗生素,造成了敏感性细菌消除,耐药性细菌逐渐占了主流,尤其是金黄色葡萄球菌的耐药问题日益严重,导致了抗生素治疗收效甚微;另一方面,随着生活水平的提高,牛奶中抗生素残留是一个非常严重的健康问题。
用疫苗防治奶牛乳房炎具有很好的前景,首先,疫苗可以预防奶牛感染病原菌而引起乳房炎;其次,疫苗有助于降低乳腺感染的严重程度,控制亚临床型乳房炎;第三,使用疫苗防治乳房炎不会存在乳汁中抗生素残留问题;最后是操作简便,费用低廉。当前,研制成功的疫苗很少,且大都数为弱毒活菌苗或灭活菌苗,在生产实践中,对乳房炎的防治有一定作用,然而随着大规模集约化养殖的发展,人工致弱菌株存在着同源重组、自身毒力返强等潜在可能,而灭活疫苗也存在使用剂量大、灭活不彻底等不足,为提高传统疫苗的安全性与免疫保护力,高效、廉价的新型疫苗研制极为重要。
金黄色葡萄球菌(staphylococcusaureus,简称sa),也称“金葡菌”,是一种革兰氏染色阳性的球菌,直径0.8μm,在显微镜下排列成葡萄串状,并可以产生金黄色的色素,因此而得名。金葡菌是引起慢性/隐性奶牛乳房炎的主要病原菌之一,可以极大的影响牛奶的产量和质量,给奶制品产业带来巨大的经济损失。
α-溶血素(α-hemolysin),亦称α-toxin,是由金葡菌分泌的一种外毒素,是其主要毒力因子之一,具有良好的免疫原性。α-溶血素属于中空形状的β-桶状结构细菌毒素家族,相对分子质量为33,200,由297个氨基酸组成,其结构基因为hla。α-溶血素对多种哺乳动物红细胞具有溶血作用,其机理为毒素分子插入红细胞的细胞膜疏水区,形成微孔,破坏了膜的完整性,造成细胞溶解。将α-溶血素第35位组氨酸突变为丙氨酸后,突变体就失去了溶血活性,不具有毒性,但仍然保留完好的免疫原性,可直接用来免疫动物,是金葡菌亚单位疫苗的重要候选蛋白之一。
β溶血素(亦称β-toxin)就是其毒素之一,它具有白细胞毒性、溶血活性等特性。β溶血素是由330个氨基酸组成的单链多肽,分子量为37~39kda,其等电点(pi)高于9。β溶血素是一种镁依赖神经酯酶,具有磷脂酶c(phospholipasec,plc)活性,可以分解甘油磷酸胆碱,β溶血素依靠这种酶活性,水解组成细胞膜的磷脂双分子层,从而破坏细胞膜的完整性,导致细胞裂解,引起溶血。将β溶血素进行定点突变后,突变体就失去了溶血活性,不具有毒性,但仍然保留完好的免疫原性,可直接用来免疫动物,是金葡菌亚单位疫苗的重要候选蛋白之一。
panton-valentine杀白细胞素(panton-valentineleukocidin,pvl)是由金黄色葡萄球菌产生的细胞外毒素之一,也是其主要的致病因子之一。pvl由vandeleld于1894年首先发现,并在1932年由pantonandvalentine将其从溶血素中分离出来。pvl由两种蛋白质组成,即pvl-s蛋白和pvl-f蛋白,其分子量分别为34kda和33kda,且f蛋白和s蛋白之间的氨基酸序列同源性有36%。pvl属于膜钻孔毒素家族,能诱导pmns坏死或调亡,首先是pvl-s与pmns细胞膜上的特异性高亲和力的受体结合,其次pvl-f与之结合形成二聚体,再依次pvl-s和pvl-f结台,最后形成一个环状结构的杂聚体。此杂聚体内径为3nm,外径为9nm,分子量大约200kda,其中所含的pvl-s和pvl-f的分子比为1:1,此环状结构的杂聚体插入在pmns细胞膜上,形成一个直径大约2nm的膜穿孔,其他的pvl分子通过该孔进入细胞,并在线粒体外膜上建立孔道,从而破坏线粒体的内环境,并激活caspase9、caspase3和释放杀白细胞素c,诱导细胞调亡。因此,pvl是金葡菌亚单位疫苗的重要候选蛋白之一,但是当pvl-s和pvl-f都存在时,可能会造成细胞毒性,本实验室对其做了小鼠安全性实验,结果与预期相同,在免疫同时含有pvl-s蛋白和pvl-f蛋白的疫苗时,小鼠在免疫后3-4天就死亡,但是仅免疫相同剂量的pvl-s蛋白或pvl-f蛋白,在免疫后跟踪的14天内,小鼠都正常,未出现任何异常,所以,在亚单位疫苗的选择时,仅能选择其中一种蛋白作为亚单位疫苗的候选蛋白。
本实验室从全国各地分离了40多种金黄色葡萄球菌,并对其外毒素进行了分析研究,一是发现同种金黄色葡萄球菌株不仅仅分泌一种外毒素,可能分泌2种、3种甚至更多种的外毒素;二是发现不同地区分离得到的金黄色葡萄球菌分泌的外毒素水平都不是完全一样,有的分泌的主要是α-溶血素,有的分泌的主要是β溶血素。因此,使用单一一种外毒素蛋白作为亚单位疫苗不仅可能在保护奶牛免受金黄色葡萄球菌的感染时效果不甚理想,也不能提供广谱的免疫保护效果。
技术实现要素:
本发明要解决的技术问题:一是提供一种由金黄色葡萄球菌造成的奶牛乳房炎的亚单位疫苗组合物及其制备方法;二是克服单一外毒素的亚单位疫苗在保护奶牛免受金黄色葡萄球菌感染方面广谱性差的问题;三是克服现有弱毒苗和灭活苗可能存在的同源重组、自身毒力返强等潜在风险。
本发明提供了一种奶牛金黄色葡萄球菌乳房炎亚单位疫苗组合物,该组合物包含α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白以及药学上可接受的佐剂,或α-溶血素蛋白、β-溶血素蛋白、pvl-f蛋白以及药学上可接受的佐剂。
本发明的技术方案中,优选地,所述pvl-s蛋白的编码基因如seqidno.1所示。
本发明的技术方案中,优选地,所述pvl-f蛋白的编码基因如seqidno.2所示。
本发明的技术方案中,优选地,所述α-溶血素蛋白是经过处理的丧失溶血活性但保留免疫原性的蛋白,所述处理方法有蛋白灭活和基因突变处理。优选地,所述α-溶血素蛋白是经过基因突变处理的丧失溶血活性但保留免疫原性的蛋白。
本发明的技术方案中,优选地,所述β-溶血素蛋白是经过处理的丧失溶血活性但保留免疫原性的蛋白,所述处理方法有蛋白灭活和基因突变处理。优选地,所述β-溶血素蛋白是经过突变处理的丧失溶血活性但保留免疫原性的蛋白。
本发明的技术方案中,优选地,所述α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白按照等质量比混合。
本发明的技术方案中,优选地,所述α-溶血素蛋白、β-溶血素蛋白、pvl-f蛋白按照等质量比混合。
本发明的技术方案中,优选地,所述α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白均为100μg/头份。
本发明的技术方案中,优选地,所述α-溶血素蛋白、β-溶血素蛋白、pvl-f蛋白均为100μg/头份。
本发明的技术方案中,优选地,所述药学上可接受的佐剂可以为水性佐剂(如铝胶佐剂等),也可以为水包油佐剂(如白油等),也可以为水包油包水佐剂(如isa206v等),优选地,所述药学上可接受的佐剂为isa201vg佐剂。
本发明的技术方案中,优选地,所述组合物还含有防腐剂。
本发明的技术方案中,优选地,所述的防腐剂为硫柳汞,所述硫柳汞的含量为2μg/头份。
本发明还提供了一种制备该亚单位疫苗组合物的方法,所述方法包括以下步骤:1)分别制备α-溶血素蛋白、β-溶血素蛋白、pvl-f蛋白、pvl-s蛋白;2)将步骤1)中按照等质量比混合制备的α-溶血素蛋白、β-溶血素蛋白、pvl-f蛋白,或按照等质量比混合制备的α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白制备成组合物抗原液;3)根据步骤2)中制备的组合物抗原液的体积,准备好硫柳汞,并将准备好的硫柳汞加入到步骤2)抗原液中制备成水相;4)将所述水相与isa201vg佐剂按照体积比46:55混合乳化。优选地,步骤4)中所述乳化的温度为32-35℃。
本发明再提供了一种所述组合物在制备用于预防和治疗奶牛金黄色葡萄球菌乳房炎的疫苗中的应用。
与现有技术相比,本发明第一次明确提供了一种新型的奶牛金黄色葡萄球菌乳房炎亚单位疫苗组合物及其制备方法和应用。首先该组合物不含有核酸,不会导致同源重组和自身毒力返强等潜在危险;能诱发机体产生特异性抗体,可促进细胞免疫,诱导免疫记忆和引起广泛的免疫应答,产生很好的交叉保护反应,因此该疫苗更加安全稳定、制备简单、应用方便、价格低廉,且省时省力。其次,该组合物由于含有多种金黄色葡萄球菌毒素,因此能够对不同地区分泌不同外毒素的金黄色葡萄球菌都有很好的中和作用,达到保护奶牛免受分泌不同外毒素的金黄色葡萄球菌的感染;最后,该组合物比单一外毒素制备的亚单位疫苗在保护奶牛免受金黄色葡萄球菌感染方面的能力更强。
附图说明
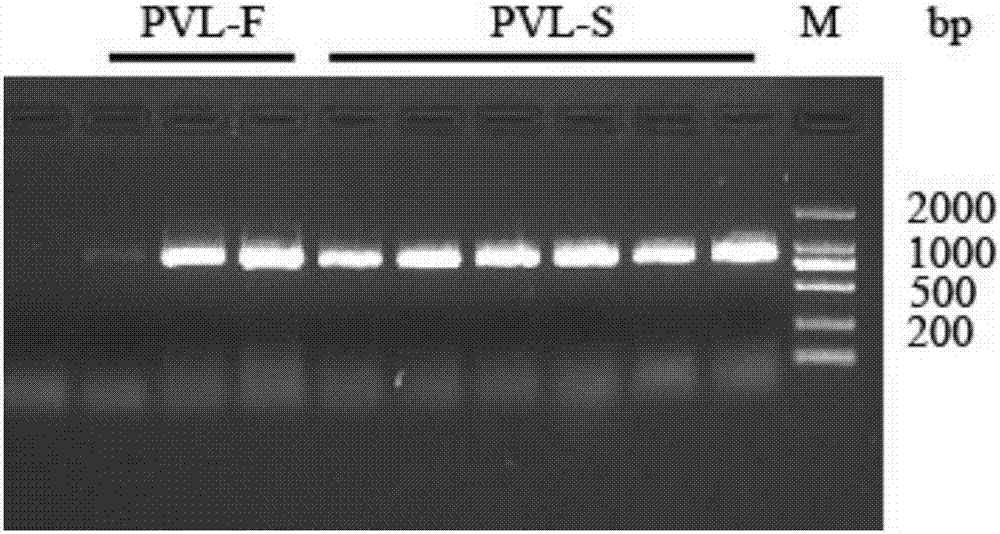
图1表示琼脂糖凝胶电泳pcr扩增pvl-f,pvl-s结果。pvl-f基因pcr结果,大小约为906bp;pvl-s基因基因pcr结果,大小约为849bp;m:dna分子量标准dl2,000。
图2表示pet28a-pvl-f,pvl-s酶切验证结果。pet28a-pvl-f:质粒pet28a-pvl-fxhoi和ndei酶切鉴定结果,酶切片段大小为5,369bp和904bp;pet28a-pvl-s:质粒pet28a-pvl-fxhoi和ndei酶切鉴定结果,酶切片段大小为5,369bp和849bp;m:dna分子量标准dl5,000。
图3表示pvl-f蛋白和pvl-s蛋白纯化结果。
图4a表示免疫后组合物中α-溶血素的效价检测结果;
图4b表示免疫后组合物中β-溶血素的效价检测结果;
图4c表示免疫后组合物中pvl-f的效价检测结果;
图4d表示免疫后组合物中pvl-s的效价检测结果。
图5免疫后攻毒实验结果。
具体实施方式
以下将结合附图和实施例对本发明做进一步说明,本发明的实施例仅用于说明本发明的技术方案,并非限定本发明。
本发明试剂及药品的来源列单如下:
化学试剂和生物试剂全部为市售产品;
防腐剂硫柳汞购自lifesciences;
isa201vg购自法国赛比克公司。
实施例1:α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白、pvl-f蛋白制备
1.1:α-溶血素蛋白制备
参照本申请人提交的专利号为201610068723.4的发明专利制备突变的α-溶血素蛋白。
1.2:β-溶血素蛋白制备
参照本申请人提交的专利号为201610068816.7的发明专利制备突变的β-溶血素蛋白。
1.3:pvl-s蛋白、pvl-f蛋白制备
1.3.1表达载体pet28a-pvl-s和pet28a-pvl-f的构建(两种载体构建方法相同)
以临床分离到的奶牛金黄色葡萄球菌基因组为模板,进行pcr,引物如下表所示,结果如图1所示:pvl-f基因pcr结果,大小约为906bp;pvl-s基因基因pcr结果,大小约为849bp;都与预期大小一致。
1.3.1.1加样体系为(50μl):
1.3.1.2pcr扩增程序:
1.3.1.3胶回收dna片段:
(1)将步骤1.3.1.2的反应液进行0.8%琼脂糖凝胶电泳(110v30min);
(2)在紫外灯下,切胶回收dna片段于1.5mlep管中;
(3)向步骤(2)中的1.5mlep管中加入500μlpcbuffer,50℃,水浴10min;
(4)将步骤(3)中溶液移至吸附柱中心,静置2min,离心,12,000rpm,30s;
(5)弃废液,向吸附柱中心加入600μlpwbuffer,静置3min,12,000rpm,30s;
(6)重复步骤(5);
(7)空吸附柱离心,12,000rpm,1min;
(8)向吸附柱中心加入30μlddh2o,静置3min,离心(12,000rpm,2min);
(9)收集步骤(8)dna样品进行电泳。
1.3.1.4双酶切反应(50μl体系):
在1.5mlep管中按照上述体系进行加样、混匀,而后将这两个50μl反应液置于37℃恒温水浴锅中,水浴3h。
1.3.1.5胶回收dna片段:
(1)将步骤1.3.1.4的反应液进行0.8%琼脂糖凝胶电泳(110v30min);
(2)在紫外灯下,切胶回收dna片段于1.5mlep管中;
(3)向步骤(2)中的1.5mlep管中加入500μlpcbuffer,50℃,水浴10min;
(4)将步骤(3)中溶液移至吸附柱中心,静置2min,离心,12,000rpm,30s;
(5)弃废液,向吸附柱中心加入600μlpwbuffer,静置3min,12,000rpm,30s;
(6)重复步骤(5);
(7)空吸附柱离心,12,000rpm,1min;
(8)向吸附柱中心加入30μlddh2o,静置3min,离心(12,000rpm,2min);
(9)收集步骤(8)dna样品进行电泳。
1.3.1.6连接反应(10μl体系):
在1.5mlep管中按照上述体系进行加样、混匀,而后将上述反应液置于16℃,水浴16h后取出,65℃,水浴15min后进行灭活,将样品4℃保存。
1.3.1.7转化实验:
(1)取出步骤1.3.1.6的连接反应液,向其中添加100μle.colidh5α感受态细胞,混匀;
(2)冰浴30min;
(3)42℃,水浴100s;
(4)冰浴2min;
(5)取出,向ep管中加入600μl液体lb培养基,37℃,水浴1h;
(6)取出样品管,离心(8,000rpm,2min),去掉600μl,剩余100μllb重悬菌体;
(7)取菌液铺板于lk平板中(kan浓度为50μg/ml),将lk平板置于生化恒温培养箱中,37℃培养12h。
1.3.1.8重组质粒提取及酶切鉴定:
(1)从转化平板中挑取单克隆至3mllk液体培养基中,37℃,260rpm摇菌过夜;
(2)取1ml菌液至1.5mlep管中,离心(12,000rpm,2min),弃上清;
(3)向步骤(2)中的ep管中加入250μlp1buffer,重悬菌体;
(4)向步骤(3)溶液中加入250μlp2buffer,温和混匀,静置2min;
(5)向步骤(4)溶液中加入350μlp3buffer,温和混匀;
(6)将步骤(5)溶液,离心(12,000rpm,10min);
(7)将步骤(6)中的上清溶液移至吸附柱中心,离心(8,000g,30s);
(8)弃废液,向吸附柱中心加入500μlwashbuffer,离心(9,000g,30s);
(9)重复步骤(8);
(10)空吸附柱离心(9,000g,1min);
(11)向吸附柱加入30μlelutionbuffer,静置2min,离心(12,000rpm,2min);
(12)收集步骤(11)dna样品进行电泳;
(13)如步骤1.3.1.4所示,对提取到的质粒进行酶切鉴定,而后进行0.8%琼脂糖凝胶电泳。
(14)重组质粒酶切鉴定结果如图2所示:pet28a-pvl-f:质粒pet28a-pvl-fxhoi和ndei酶切鉴定结果,酶切片段大小为5,369bp和904bp;pet28a-pvl-s:质粒pet28a-pvl-fxhoi和ndei酶切鉴定结果,酶切片段大小为5,369bp和849bp。
1.3.2转化大肠杆菌bl21
吸取1μl质粒加入100μlbl21感受态细胞中,冰浴30min;
42℃热激90s;
冰浴2min;
在超净台内加入900μl无抗性的lb培养液;
37℃180rpm摇1h;
吸取100μl菌液涂卡那抗性lb平板,37℃过夜培养。
1.3.3大量诱导表达
挑菌:挑取单克隆至50ml卡那抗性lb培养液中,37℃过夜培养;
转接:按1:100比例转接菌液至500ml卡那抗性lb培养液,共摇3.5l,37℃220rpm培养2-2.5h至od600值到0.6;
诱导:菌液od600值到0.6后,加入500μliptg(1m)至iptg终浓度为1mmol/l,37℃220rpm诱导培养4h;
菌体收集:菌液6,000rpm离心10min,收集菌体;用40mlpbs清洗菌体,6,000rpm离心10min,收集菌体,置于-20℃保存;
1.3.4pvl-s蛋白或pvl-f蛋白纯化(两种蛋白纯化过程相同)
(1)菌体破碎:向1.3.3中的得到的菌体中加入裂解液(8ml/g湿重)(50mmnah2po4(ph8.0),500mmnacl,20mm咪唑;使用0.8μm的滤膜过滤),用50ml注射器吹打均匀至无颗粒状菌块;将菌体样品倒入到细胞均质仪样品槽中,出样口用烧杯准备收集样品;以样品的90%流出出样口为一个循环,一个循环完成后,将出样口烧杯收集的样品倒回样品槽,继续重复5个循环。
(2)将步骤(1)中破碎完全的样品分装到250mlbeckman离心管中,12,000rpm,4℃离心30min,上清样品过0.8μm膜后作为上样样品,预留80μl样品用于sds-page检测;
(3)柱平衡:用超纯水平衡2~3柱体积(cv),排出20%的乙醇保存液;然后用裂解液平衡2~3柱体积(cv),5ml/min。控制压力小于0.5mpa。
(4)上样:2ml/min进行上样,收集流穿液(flowthrough),取80μl用于sds-page检测。
(5)冲洗1:用清洗缓冲液组分1(washingbuffer1:50mmnah2po4(ph7.4),500mmnacl,20mm咪唑,0.1%tritonx-114,使用0.8μm的滤膜过滤)洗柱,5ml/min,冲洗80个柱体积。
(6)冲洗2:用10倍柱体积(cv)的洗脱缓冲液组分1(elutionbuffer1:50mmnah2po4(ph7.4),500mmnacl,使用0.8μm的滤膜过滤)洗柱,减少tritonx-114的残留。
(7)洗脱:50%洗脱缓冲液组分2(50%elutionbuffer2:50mmnah2po4(ph7.4),500mmnacl,250mm咪唑,使用0.8μm的滤膜过滤)洗脱目的蛋白,至基线洗平,速度5ml/min,收集,混合后取80μl用于sds-page分析;100%脱缓冲液2组分清洗柱子(100%elutionbuffer2:50mmnah2po4(ph7.4),500mmnacl,500mm咪唑,使用0.8μm的滤膜过滤),至基线洗平,5ml/min,收集,混合后取80μl用于sds-page分析。
(8)hiprepdesalting脱盐柱柱平衡:用超纯水平衡2~3柱体积(cv),排出20%的乙醇保存液;然后用洗脱缓冲液组分1平衡3-4柱体积(cv),速度10ml/min。
(9)上样:速度10ml/min进行注入(inject),最大注入(inject)量为13ml。
(10)收集:停止上样后,进入load模式,10ml/min,uv上升至1mau开始收集,即蛋白样品开始出峰,10ml/管收集,待uv降至5mau以下,停止收集。
(11)平衡:流速10ml/min,平衡2-3cv。
(12)循环7.10~7.12,直至上样完成。
(13)除菌过滤:收集的蛋白溶液在4℃,12,000rpm离心15min,收集上清,移至生物安全柜,过0.2μm蛋白结合率低的针头滤器,过滤后置于-80℃冰箱保存。
(14)纯化结果如图3所示:纯化后的pvl-s蛋白和pvl-f蛋白的纯度均能达到90%以上。
实施例2:组合物制备(以制备1ml/头份为例说明)
所用制备疫苗的耗材和材料都需预先经过无菌处理,制备过程是在生物安全柜或其他可以保证整个制备过程都无菌的仪器或环境中完成。
(1)按照实验需要,计算组合物溶液各成分的量,使组合物中α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白或α-溶血素蛋白、β-溶血素蛋白、pvl-f蛋白终浓度均为100μg/ml,使组合物中硫柳汞的终浓度为2μg/ml,再将称量好的重组蛋白与称量好的硫柳汞混合作为水相,根据水相与佐剂isa201vg体积比为46:55,量取佐剂;
(2)将量好的水相和佐剂放置在恒温水浴锅内加热至33℃±1℃,待温度稳定后将抗原加入到佐剂管中,震荡器震荡10min进行预乳化;
(3)将预乳化完的疫苗放置于盛满冰的烧杯中,固定在预先处理好的超声波细胞破碎仪上进行乳化;
(4)乳化结束后,观察乳化效果:取部分疫苗置于离心管中,3,000rpm离心15min,疫苗不分层为合格;
(5)检测合格的疫苗分装到15ml离心管中,标记,封口膜封口,置于4℃保存。
实施例3:小鼠免疫攻毒实验
3.1:按照实施例2的方法制备如下疫苗及组合物
3.2:免疫实验
购买80只20g左右的balb/c雌性小鼠,将其分为8组,每组10只,其中一组作为对照组免疫pbs,另外7组作为免疫组,分别免疫3.1中制备的7种组合物;免疫时用1ml注射器吸取1ml疫苗,然后用75%酒精棉球给小鼠后腿肌肉消毒,在肌肉块中部进针,左右后腿各注射50μl疫苗,共注射100μl疫苗。
在一免后14天进行二免,二免后7天进行三免,并在一免前、二免前、三免前及三免后14天采集血清,检测抗体效价。
效价检测结果如图4a、图4b、图4c、图4d所示,其中含有α-溶血素的组合物(组合物1、组合物5、组合物6、组合物7)中的α-溶血素的相对效价在攻毒前均能达到544,000以上,但是组合物6的相对效价在4个组合物中最低,为544,000,其他3个组合物的相对效价达到928,000以上,这也与攻毒结果一致(组合物7的存活率比组合物6的存活率高10%);含有β-溶血素的组合物(组合物2、组合物5、组合物6、组合物7)中的β-溶血素的相对效价在攻毒前均能达到77,778以上;含有pvl-f的组合物(组合物3、组合物6、组合物7)中的pvl-f的相对效价在攻毒前均能达到80,000以上;含有pvl-s的组合物(组合物4、组合物6、组合物7)中的pvl-s的相对效价在攻毒前均能达到80,000以上。
3:3:攻毒实验(三免后14天进行攻毒)
(1)挑取sa单菌落(菌株为本实验室保存的cq339菌株)于5ml液体肉汤培养基中中,220rpm、37℃摇菌过夜;
(2)按百分之一的体积(1ml)将摇过夜的细菌接种于100ml新鲜液体肉汤培养基中,220rpm、37℃摇菌过夜;
(3)将100ml菌液装入到500ml离心瓶中,8,000rpm离心10min,吸去培养基,菌体用100mlpbs重悬,重复上述步骤3次,最后将所有的菌体用5mlpbs重悬混匀;
(4)将菌液做10,000倍稀释后计数。根据菌液的浓度,将原菌液稀释到1.5×108cfu/ml(2mld50);
(5)用1ml注射器吸取菌液,按照各浓度细菌对应的小鼠进行尾静脉注射,注射量为200μl/20g小鼠。
(6)连续观察小鼠的生存状况,记录每一只小鼠的死亡时间:早中晚各检查一次。
(7)攻毒后小鼠存活率结果如图2所示,攻毒后500h内对照组小鼠全部死亡;在跟踪的987.5h之内,7组免疫组存活率都高于50%,其中,组合物1-组合物4的存活率均在50%-60%,组合物5的存活率比组合物1-组合物4的高20%-30%,达到70%,组合物6的存活率达到80%,组合物7的存活率达到90%,都远远高于组合物1-组合物4的存活率,也比组合物5的存活率要高,组合物7的存活率比组合物6的存活率高10%,这与组合物中α-溶血素效价检测结果相一致(组合物7中的α-溶血素效价比组合物6中的α-溶血素的效价高一个稀释比);这说明单一组分的外毒素制备疫苗的免疫保护效果远不如多种外毒素制备疫苗的免疫保护效果。
实施例4:elisa抗体效价检测
(1)包被:用包被液(50mm碳酸盐缓冲液,ph9.5)稀释纯化的检测用蛋白(α-溶血素蛋白、β-溶血素蛋白、pvl-s蛋白或pvl-f蛋白)至0.5μg/ml,在酶标板上每孔加入100μl,封口膜封好后4℃冰箱放置过夜;
(2)洗涤:从冰箱取出酶标板后,放入洗板机中洗涤,洗涤液用pbst;
(3)封闭:每孔加入200μl封闭液(5%脱脂奶),封口膜封好后37℃孵育2h;
(4)样品准备:按已知的信息和需要用量,用封闭液将血清进行适度稀释;
(5)洗涤:同(2);
(6)加样:加入稀释血清,同时用封闭液做阴性对照,37℃孵育1h;
(7)洗涤:同(2);
(8)加二抗:每孔加入适度稀释的hrp标记的二抗100μl,37℃孵育0.5h;
(9)洗涤:同(2);
(10)显色:避光条件下每孔加入100μl的tmb显色液,37℃孵育10min;
(11)终止:每孔加入50μl终止液(2m的h2so4),终止反应;
(12)检测:于450nm波长测定样品od值,分析数据;
(13)结果分析:判断抗体阳性的标准:p/n≥2.1,od450≥0.1。
本发明通过上面的实施例进行举例说明,但是,应当理解,本发明并不限于这里所描述的特殊实例和实施方案。在这里包含这些特殊实例和实施方案的目的在于帮助本领域中的技术人员实践本发明。任何本领域中的技术人员很容易在不脱离本发明精神和范围的情况下进行进一步的改进和完善,因此本发明只受到本发明权利要求的内容和范围的限制,其意图涵盖所有包括在由附录权利要求所限定的本发明精神和范围内的备选方案和等同方案。
序列表
<110>浙江海隆生物科技有限公司
<120>奶牛金黄色葡萄球菌乳房炎亚单位疫苗及其制备方法和应用
<160>4
<170>patentinversion3.3
<210>4
<211>879
<212>dna
<213>重组金黄色葡萄球菌pvl-s蛋白编码基因序列
<400>1
atgggaaatattgagaatattggtgatggcgctgaggtagtcaaaagaacagaagataca60
agtagcgataagtggggggtcacacaaaatattcagtttgattttgttaaagataaaaag120
tataacaaagacgctttgattttaaaaatgcaaggttttatcaattcaaagactacttat180
tacaattacaaaaacacagatcatataaaagcaatgaggtggcctttccaatacaatatt240
ggtctcaaaacaaatgaccccaatgtagatttaataaattatctacctaaaaataaaata300
gattcagtaaatgttagtcaaacattaggttataacataggtggtaattttaatagtggt360
ccatcaacaggaggtaatggttcatttaattattcaaaaacaattagttataatcaacaa420
aactatatcagtgaagtagaacgtcaaaattcaaaaagtgttcaatggggaataaaagct480
aattcatttatcacatcattaggtaaaatgtctggacatgatccaaatttatttgttgga540
tataaaccatatagtcaaaatccgagagactattttgttccagacaatgaattaccccca600
ttagtacacagtggtttcaatccttcatttattgcaactgtttctcatgaaaaaggctca660
ggagatacaagtgaatttgaaataacgtatggcagaaatatggatgttactcatgctact720
agaagaacaacacactatggcaatagttatttagaaggatctagaatacacaacgcattt780
gtaaacagaaattacacagttaaatatgaagtgaactggaaaactcatgaaattaaagtg840
aaaggacataatctcgagcaccaccaccaccaccactga879
<210>4
<211>921
<212>dna
<213>重组金黄色葡萄球菌pvl-f蛋白编码基因序列
<400>2
atgggagctcaacatatcacacctgtcagcgagaaaaaagtggatgacaaaatcactttg60
tacaaaacgactgctacatcagattctgacaaattaaaaatttctcaaattctaactttt120
aattttattaaagacaaaagttatgataaagacacattaatactaaaagctgccggaaac180
atttactcaggctatacccaacccacttctgatagtagtataaattcacaattttattgg240
ggagctaagtataatgtttttgttagctcggagtccaaagattctgtaaatattgttgac300
tacgcgcctaaaaatcaaaatgaagaatttcaagttcaacaaacattaggttattcatat360
ggcggagatattaatataataaatggattaactggtggattgaacgggtcaaaatcattt420
tcagaaacgattaattataagcaagaaagctacagaactacgattgataggaaaataaat480
cacaaattaatcggctggggtgtcgaggcacataaaatcatgaataatggttggggacca540
tatggcagagatagtagtgattcattatatggaaacgaactatttttaggtggcagacag600
agtagctcgaatgctaatcaaaatttcttaccaacacatcaaatgcccatattagcacgt660
ggtaatttcaatccagaatttataagcgtactttctcacaaacaaaaggatgttaaaaaa720
tctaaaattaaagtgacttatcaaagacaaatggatcggtatgaaaatttttggaacaac780
ttgcactggataggttataatattaagaatcaaaagagagcaacacacacatcaatttat840
gaaattgattgggaaaaacacacggttaaattagtagcttcgcaatctagcgaactcgag900
caccaccaccaccaccactga921
<210>1
<211>292
<212>prt
<213>重组金黄色葡萄球菌pvl-s蛋白序列
<400>3
metglyasnilegluasnileglyaspglyalagluvalvallysarg
151015
thrgluaspthrserserasplystrpglyvalthrglnasnilegln
202530
pheaspphevallysasplyslystyrasnlysaspalaleuileleu
354045
lysmetglnglypheileasnserlysthrthrtyrtyrasntyrlys
505560
asnthrasphisilelysalametargtrppropheglntyrasnile
65707580
glyleulysthrasnaspproasnvalaspleuileasntyrleupro
859095
lysasnlysileaspservalasnvalserglnthrleuglytyrasn
100105110
ileglyglyasnpheasnserglyproserthrglyglyasnglyser
115120125
pheasntyrserlysthrilesertyrasnglnglnasntyrileser
130135140
gluvalgluargglnasnserlysservalglntrpglyilelysala
145150155160
asnserpheilethrserleuglylysmetserglyhisaspproasn
165170175
leuphevalglytyrlysprotyrserglnasnproargasptyrphe
180185190
valproaspasngluleuproproleuvalhisserglypheasnpro
195200205
serpheilealathrvalserhisglulysglyserglyaspthrser
210215220
gluphegluilethrtyrglyargasnmetaspvalthrhisalathr
225230235240
argargthrthrhistyrglyasnsertyrleugluglyserargile
245250255
hisasnalaphevalasnargasntyrthrvallystyrgluvalasn
260265270
trplysthrhisgluilelysvallysglyhisasnleugluhishis
275280285
hishishishis
290
<210>1
<211>306
<212>prt
<213>重组金黄色葡萄球菌pvl-f蛋白序列
<400>4
metglyalaglnhisilethrprovalserglulyslysvalaspasp
151015
lysilethrleutyrlysthrthralathrseraspserasplysleu
202530
lysileserglnileleuthrpheasnpheilelysasplyssertyrasp
354045
lysaspthrleuileleulysalaalaglyasniletyrserglytyr
50556065
thrglnprothrseraspserserileasnserglnphetyrtrpgly
707580
alalystyrasnvalphevalsersergluserlysaspservalasn
859095
ilevalasptyralaprolysasnglnasngluglupheglnvalgln
100105110
glnthrleuglytyrsertyrglyglyaspileasnileileasngly
115120125
leuthrglyglyleuasnglyserlysserphesergluthrileasn
130135140145
tyrlysglnglusertyrargthrthrileasparglysileasnhis
150155160
lysleuileglytrpglyvalglualahislysilemetasnasngly
165170175
trpglyprotyrglyargaspserseraspserleutyrglyasnglu
180185190
leupheleuglyglyargglnserserserasnalaasnglnasnphe
195200205
leuprothrhisglnmetproileleualaargglyasnpheasnpro
210215220225
glupheileservalleuserhislysglnlysaspvallyslysser
230235240
lysilelysvalthrtyrglnargglnmetaspargtyrgluasnphe
245250255
trpasnasnleuhistrpileglytyrasnilelysasnglnlysarg
260265270
alathrhisthrseriletyrgluileasptrpglulyshisthrvallys
275280285290
leuvalalaserglnsersergluleugluhishishishishishis
295300305
- 还没有人留言评论。精彩留言会获得点赞!