一种口服降尿酸药物的制备与应用的制作方法
本发明属于制药技术领域,尤其涉及一种口服降尿酸药物的制备方法和应用。
背景技术:
高尿酸血症和痛风已成为危害人类健康的常见病和多发病,男性多见于女性,并呈现一定的年龄相关性。高尿酸血症和痛风的机理目前清楚,主要是体内嘌呤代谢紊乱导致尿酸含量过高所致。作为难溶性物质的嘌呤类代谢终产物尿酸容易沉积在肾脏、末端关节和耳郭等部位从而产生肾损害和各种炎性反应,严重影响生活质量,甚至危及生命。为了防控痛风的发生,一般建议血清中的尿酸含量不应超过420μM(70μg/ml)。
尿酸由黄嘌呤氧化酶(也叫黄嘌呤脱氢酶)催化生成,可被尿酸酶(也叫尿酸氧化酶)降解。人以及其他灵长类体内的尿酸酶是假基因,不能表达尿酸酶,因此尿酸是人类嘌呤代谢的终产物。人体的尿酸来源可以大致分为两条:一是来自内源性嘌呤的尿酸,约占80%;另一条是来自外源性嘌呤的尿酸,约占20%。一般认为,内源性嘌呤来源的尿酸是尿酸的主要来源,而外源性嘌呤来源的尿酸是次要来源,但可能是压垮骆驼的最后一根稻草。
目前认为,尿酸的排泄途径有两条,一条是通过肾脏排泄;另一条是通过肠道排泄。前者占到2/3以上,后者不到1/3。
因此,临床防治高尿酸血症和痛风的策略主要有以下几种:
1、控制饮食,减少外源性嘌呤来源的尿酸。由于外源性嘌呤来源的尿酸不是尿酸的主要来源,这种方法往往在病情较轻时有效。
2、抑制尿酸生成,减少内源性嘌呤来源的尿酸。主要是采用别嘌呤醇等药物抑制黄嘌呤氧化酶,从而减少尿酸来源。这种方法效果明显,但显然这是一种“堵”的策略,会使体内的“嘌呤池”增加。停药可能会加重尿酸的生成而产生“反跳”现象,而嘌呤池的增加可能会干扰人体的其他生化代谢。而且,抑制黄嘌呤氧化酶的药物本身就是伪碱基,一定程度上会影响细胞周期,比如别嘌呤醇就有白细胞减少、致畸致癌等不良反应,同时也可能引起肝脏毒性。
3、减少尿酸肾脏重吸收增加排泄。主要是采用丙磺舒或苯溴马隆等药物抑制肾小管的酸性转运体,阻止尿酸重吸收而增加排泄。这是一种“疏”策略,增加肾脏排泄降低血清尿酸水平效果明显。但这种方法有两个重要的不良反应,一是增加肾小管尿酸浓度有可能加重尿酸在肾小管的沉积从而加重肾损伤;二是这类药物也要求吸收入血,也会增加肝脏负荷甚至引起肝损伤。
4、碱化尿液增加尿酸的肾脏排泄。主要采用碳酸氢钠或氨丁三醇盐碱化尿液。碱化尿液能增加尿酸在肾小管内的溶解度,对防止肾损害具有积极作用。但降血清尿酸的效果往往略差。特别地,目前尚无氨丁三醇盐药物上市,实际上无法使用该类药物,如果静脉注射氨丁三醇,不良反应较多。碳酸氢钠虽然既能口服也能静脉注射,但也存在很多不足,静脉注射的安全性虽高于氨丁三醇,但仍然给药不方便;而口服给药则产气,患者难受,同时碳酸氢钠碱化尿液降血清尿酸的能力较弱,还增加心血管负担,只能用于一般性辅助治疗。
5、静脉注射尿酸酶降低血清尿酸水平。采用重组的尿酸酶,多为黄曲霉来源的尿酸酶,制成静脉注射用药物,注入血液后可以产生立竿见影的降尿酸效果,上市的有拉布立酶(国外进口)。这是快速降尿酸的策略,然而这种策略弊端也较多。首先,注射给药不方便;其次,这种策略往往只能使用1-2次,因为给的是外源性尿酸酶,进入人体后,机体免疫系统必然会对其产生抗体,反复用药后必然使其作用下降,甚至导致严重的过敏反应!
另外痛风的对症处理有解热镇痛药或秋水仙碱等药物。
基于以上的分析,业界有人看到了尿酸酶立竿见影的降尿酸效果,针对其抗原性提出了不同策略,参见表1。
表1改进尿酸酶临床应用性的发明专利
表1中1-3均是针对尿酸酶静脉注射问题而采取的降低抗原性策略。由于人和灵长类本身不表达尿酸酶,所谓的“人源化”尿酸酶策略在理论上是存在的,但在实践中可能依然存在较高的免疫风险,而且研制成本也是高昂的。表1中的4是将尿酸酶制成肠溶制剂口服以降低血清尿酸,但该发明的说明书示例并不能充分支持该疗效的存在,比如未交待尿酸酶的来源,大鼠灌胃尿酸酶如何避开消化酶的破坏作用等。
为了将尿酸酶的作用发挥到极致,克服尿酸酶只能静脉注射,避开其抗原性,本发明将制备一种新的口服肠溶制剂以降低血清尿酸水平。
技术实现要素:
本发明的目的在于提供一种口服降尿酸的肠溶制剂,
发明一种口服降尿酸的肠溶制剂,含有尿酸酶、弱碱性添加剂和尿酸酶保护剂,其中以重量百分比计,尿酸酶为0.5-20%、弱碱性添加剂为1-50%和尿酸酶保护剂10-90%,余量为其它可接受的口服制剂制药用材料。
所述制剂最佳组合是:含尿酸酶的主药选用重组尿酸酶,弱碱性添加剂选用碳酸氢钠,尿酸酶保护剂选用熟鸡蛋蛋白粉,以重量百分比计,其中重组尿酸酶为5%、碳酸氢钠25%、熟鸡蛋蛋白粉70%。
所述的尿酸酶为重组尿酸酶、含有尿酸酶的细菌大分子提取物或含有尿酸酶的真菌大分子提取物。
所述弱碱性添加剂为碳酸氢钠、磷酸的钠盐、醋酸钠、其他医用有机弱酸盐和医用无机弱酸盐制成的弱碱性混合物以及为弱碱性的多种医用或是可食用盐类的混合物,溶解后弱碱性范围是pH大于7.0小于或等于9.0。
所述的尿酸酶保护剂为富含蛋白质且不具备蛋白酶活性或是经变性处理可食用的蛋白粉,包括鸡蛋蛋白粉、各种动物或植物蛋白粉。
所述的肠溶制剂为肠溶胶囊、肠溶纳米囊、肠溶微球、肠溶软胶囊。
在制备时可以在原配方比例不变情况下,加入适当的水溶解或混悬。
所述细菌大分子提取物中的细菌是在大分子提取前经过尿酸诱导的。
所述真菌大分子提取物中的真菌是在大分子提取前经过尿酸诱导的。
一种口服降尿酸肠溶制剂用于预防或治疗高尿酸血症和痛风。
本发明口服降尿酸药物是由含尿酸酶的主药、弱碱性添加剂和尿酸酶保护剂组成的一种口服降尿酸肠溶制剂。含尿酸酶的主药为重组尿酸酶或含天然尿酸酶的大分子提取物,弱碱性添加剂为碳酸氢钠、弱碱性磷酸盐、醋酸盐以及为弱碱性的多种医用或是可食用盐类的混合物,溶解后的pH大于7.0小于或等于9.0(虽然尿酸酶最佳活性在pH10左右,考虑到机体的接受程度,建议pH在该范围较为合适)。尿酸酶保护剂为不具备蛋白酶活性或是经变性处理可食用的蛋白制剂,包括鸡蛋蛋白粉、各种动物或植物蛋白粉等;如果是细菌或真菌的大分子提取物,因为本身含有较多蛋白,配方中的尿酸保护剂可适当减量甚至不加。制成的肠溶制剂包括肠溶胶囊、肠溶纳米囊、肠溶微球、肠溶软胶囊等。尿酸酶是蛋白质,尿酸酶保护剂也是蛋白质,由于保护剂的蛋白量远多于尿酸酶,当肠溶制剂在肠道释放时,这些蛋白质可以优先和胰蛋白酶等蛋白酶作用,减少这些蛋白酶对尿酸酶的破坏作用。
使用时,通过口服,本申请肠溶制剂能顺利通过胃进入到十二指肠,从而躲避胃酸和胃蛋白酶的破坏。进入到十二指肠后,迅速释放,制剂中的尿酸酶成分能够迅速分解肠液中的尿酸;制剂中的弱碱性物质能够为尿酸酶提供可靠的弱碱性环境;而制剂中的非尿酸酶蛋白质则对尿酸酶起到一定的保护作用,阻止或延缓消化液中的各种蛋白酶破坏尿酸酶。特别地,本发明的作用不依赖吸收就能起效,主药成分尿酸酶也是广泛分布于体内微生物的不吸收的酶类,分解后为机体的营养物质,因而避开了传统降尿酸药物的肝肾毒性(如,黄嘌呤氧化酶抑制剂、尿酸重吸收抑制剂)或心血管毒性(如,大剂量的碳酸氢钠)而具有较高的安全性。
本发明优势是利用胃肠液中尿酸总量高、超过血清尿酸总和、且十二指肠液中尿酸含量高的原创性发现,巧妙地设计出能定向在肠道内释放且能较好地维持尿酸酶活性的肠溶制剂。最重要的是,该设计在正常大鼠和血尿酸升高大鼠得到了疗效验证。
附图说明
图1重组尿酸酶的蛋白序列。大写字母是来自表达质粒上的融合多肽,下划线表示凝血酶的酶切位点,小写字母是克隆的黄曲霉来源的尿酸酶。
图2尿酸酶试表达后经10%SDS-PAGE电泳,考马斯蓝染色的结果。0为未诱导的对照菌;1为阳性BL21(DE3)菌经IPTG诱导表达后细菌裂解物;5、6、7是细菌裂解物经镍柱亲和吸附后分别经200、300和500mM咪唑快速洗涤下来的样品;9为空白对照;M为用于分子量参考的Marker。表明镍柱捕获的蛋白分子量在34kD左右(位置在白色框中),与目的分子量一致。
图3重组尿酸酶的活性及对pH的敏感性。pH7以上(7.0-10.5)均有较好的活性,酶浓度9.3μg/ml。
图4正常大鼠胃肠液中的尿酸分布,每段肠段以5cm的总量计(盲肠未测,均数±标准误,n=10)。可见在正常大鼠,小肠上端肠液中的尿酸总量处于相对较高的水平。
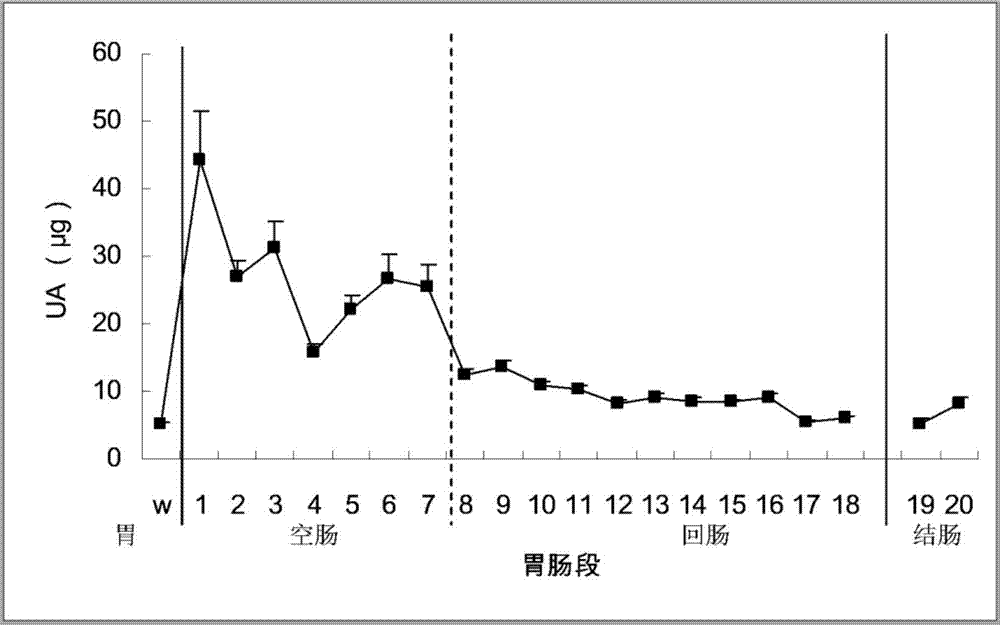
图5尿酸在不同处理组大鼠胃肠液中的分布(均数±标准误,n=10)。除盲肠外,将大鼠的肠道平均分成20段,每段约5cm。0是胃液,1相当于十二指肠肠液,2-7相当于空肠肠液,8-18为回肠肠液,19-20为结肠肠液。各组肠液的尿酸分布均以十二指肠最高,口服抗菌药组(germ-free)、尿酸钠腹腔注射液组(sodium urate-ip)、腺苷腹腔注射组(adenine-ip)和肌苷腹腔注射组(inosine-ip)的肠液尿酸分布总量高于正常组(normal)。
图6血清尿酸与肠液尿酸总量呈现正相关(r=0.227,P<0.05,n=50),即血清尿酸水平高的大鼠,肠液中的尿酸总量也高。SUA,血清尿酸;UA,尿酸。
图7尿酸酶肠溶制剂口服对大鼠血清尿酸的影响(均数±标准差,n=10)。治疗组能明显降低血清尿酸水平。对照1组早上灌胃奥美拉唑(0.4mg/ml),4小时后灌胃1号对照液10ml/kg(碳酸氢钠12mg/ml);对照2组早上灌胃奥美拉唑(0.4mg/ml),4小时后灌胃2号对照液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%);治疗2组早上同样灌胃奥美拉唑,4小时后灌胃1号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml,尿酸酶2u/ml,效价单位根据市售标准酶确定,下同);治疗2组灌胃2号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%,尿酸酶2u/ml);各组给药连续5天。UA,尿酸。
图8尿酸酶肠溶制剂口服对尿酸升高大鼠血清尿酸的影响(均数±标准差,n=10)。造模1组上午灌胃造模液混合物10ml/kg(每毫升含腺嘌呤15mg/ml、氧嗪酸钾15mgml、奥美拉唑0.4mg/ml),4小时后灌胃1号对照液10ml/kg(碳酸氢钠12mg/ml);造模2组上午灌胃造模液混合物10ml/kg(每毫升含腺嘌呤15mg/ml、氧嗪酸钾15mgml、奥美拉唑0.4mg/ml),4小时后灌胃2号对照液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%);治疗1组上午同样灌胃造模混合物,4小时后灌胃1号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml,尿酸酶2u/ml);治疗2组上午同样灌胃造模混合物,4小时后灌胃2号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%,尿酸酶2u/ml);各组给药连续5天。UA,尿酸。
具体实施方式
本发明三个成分的较佳组合是:含尿酸酶的主药选用重组尿酸酶,弱碱性添加剂选用碳酸氢钠,尿酸酶保护剂选用熟鸡蛋蛋白粉,以重量百分比计,其中尿酸酶为0.5-20%、弱碱性添加剂为1-50%和尿酸酶保护剂10-90%,余量为其它可接受的口服制剂制药用材料。
所述制剂最佳组合是:含尿酸酶的主药选用重组尿酸酶,弱碱性添加剂选用碳酸氢钠,尿酸酶保护剂选用熟鸡蛋蛋白粉,以重量百分比计,其中重组尿酸酶为5%、碳酸氢钠25%、熟鸡蛋蛋白粉70%。制作过程为正常口服药物制作工艺条件。
实施例1尿酸酶的制备及活性测定。
根据黄曲霉(Aspergillus flavus)尿酸酶的mRNA的序列(XM_002377830.1),化学合成编码序列的全长,通过引物扩增、双酶切(Bam H1,Hind II)连接到pET28a载体(具有卡拉霉素抗性),得Uricase-pET28a,将连接正确的编码有尿酸酶蛋白(见图1)的载体转染大肠杆菌DH5a以获得大量的载体,将DH5a菌大量培养后回收细菌,裂解细菌后再提取Uricase-pET28a载体。将Uricase-pET28a载体纯化后导入到BL21(DE3)大肠杆菌,经卡拉霉素抗性筛选获得阳性菌。然后用含卡拉霉素抗性(50μg/ml)的LB培养基,于摇床(160rpm)上37℃大量培养Uricase-pET28a-BL21(DE3)菌,当细菌繁殖到较高密度时(OD600≥1.0),将培养温度降低至16℃,加入诱导剂IPTG(0.3mM),振摇过夜(160rpm,12小时以上)。然后离心回收细菌(5000rpm,4℃),用磷酸缓冲盐(pH7.40)重悬细菌后用超声破碎机裂解细菌,将裂解液高速离心(10000rpm,4℃)10分钟后,取上清加入到准备好的镍离子螯合柱中,用pH为7.40磷酸缓冲盐洗涤过柱,弃去洗脱液,加入含凝血酶(1U/ml)的pH7.40的磷酸缓冲盐,室温条件下缓慢过柱,收集洗脱液。洗脱液用截留分子量为3k的超滤管于低速离心机上(4℃,3000rpm)过滤浓缩。浓缩液即为尿酸酶浓溶液,用变性聚丙烯酰胺凝胶电泳测定其含量在95%以上(图2)。
将获得的尿酸酶用蛋白质定量试剂盒(BCA法)测定其含量,将重组尿酸酶(9.3μg/ml)、尿酸(90μg/ml)、不同pH的TrisHCl溶液加入到平底透紫外96孔板中,然后用酶标仪37℃扫描290nm处波长吸收值的变化(尿酸的最大吸收波长为290nm左右,尿酸转化为尿囊素后,290nm处几乎无吸收)。发现尿酸酶能降解尿酸,活性与pH有相关性,在3.9-11.0范围内,pH越高活性越强(见图3)。
实施例2具有尿酸酶活性的枯草杆菌大分子提取物制备。
将医用或食用枯草杆菌活菌接种到1L灭菌培养基(每升含牛肉提取物3.0g、蛋白胨5.0g、pH 6.8±0.2)中,37℃振摇(160rpm),直到浑浊度OD600达到2以上,然后离心10分钟回收细菌(5000rpm,4℃),大分子提取样品来自该菌的叫纯枯草杆菌组。另平行培养一瓶细菌,方法同前,但在培养时加入10g尿酸,同样回收细菌,大分子提取样品来自该菌的叫尿酸诱导枯草杆菌组。将回收的细菌用pH7.40的磷酸盐缓冲液重悬,用超声破碎机打碎后,离心获得上清(去除细胞核等颗粒)。将上清液置于截留分子量为3k的超滤管中,于低速离心机上(4℃,3000rpm)过滤浓缩,弃去滤液,必要时加入原体积pH7.40的磷酸盐缓冲液洗涤一遍,即获得枯草杆菌大分子提取物,冻存于-40℃备用。
将获得的枯草杆菌大分子提取物用蛋白质定量试剂盒(BCA法)测定其含量,将枯草杆菌大分子提取物(1mg/ml)、尿酸(200μg/ml)、pH9.0的TrisHCl溶液加入到1.5ml试管中,至于37℃温孵20分钟,然后用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见表2。
表2枯草杆菌大分子提取物对尿酸的降解作用(n=3)
结果表明枯草杆菌大分子提取物能降解尿酸,但以尿酸诱导枯草杆菌大分子提取物降解尿酸的能力更好。
实施例3具有尿酸酶活性的酵母大分子提取物制备。
将食用啤酒酵母活菌(酵母粉)接种到1L灭菌培养基(每升培养液含酵母提取物3.0g、麦芽提取物3.0g、葡萄糖10.0g、蛋白胨5.0g,pH6.2±0.2)中,37℃振摇(160rpm),直到浑浊度OD600达到2以上,然后离心10分钟回收酵母菌(5000rpm,4℃),大分子提取样品来自该菌的叫纯酵母组。另平行培养一瓶酵母菌,方法同前,但在培养时加入10g尿酸,同样回收酵母菌,大分子提取样品来自该菌的叫尿酸诱导酵母菌组。将回收的细菌用pH7.40的磷酸盐缓冲液重悬,用高压破碎机打碎后,离心获得上清(去除细胞核等颗粒)。将上清液置于截留分子量为3k的超滤管中,于低速离心机上(4℃,3000rpm)过滤浓缩,弃去滤液,必要时加入原体积pH7.40的磷酸盐缓冲液洗涤一遍,即获得大分子提取物,冻存于-40℃备用。
将获得的大分子提取物用蛋白质定量试剂盒(BCA法)测定其含量,将大分子提取物(1mg/ml)、尿酸(200μg/ml)、pH9.0的TrisHCl溶液加入到1.5ml试管中,至于37℃温孵20分钟,然后用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见表3。
表3酵母大分子提取物对尿酸的降解作用(n=3)
结果表明酵母菌大分子提取物能降解尿酸,但以尿酸诱导酵母菌大分子提取物降解尿酸的能力更好。
实施例4该发明的口服剂制备。
配方1、尿酸酶肠溶胶囊:尿酸酶10mg、碳酸氢钠50mg、熟鸡蛋蛋白粉60mg,混匀制成肠溶胶囊1颗。每次1颗,一天三次。
配方2、纯枯草杆菌大分子提取物肠溶胶囊:枯草杆菌大分子提取物200mg、碳酸氢钠50mg,混匀制成肠溶胶囊1颗。每次1颗,一天三次。
配方3、纯酵母菌大分子提取物肠溶胶囊:酵母菌大分子提取物200mg、碳酸氢钠50mg,混匀制成肠溶胶囊1颗。每次1颗,一天三次。
配方4、尿酸诱导枯草杆菌大分子提取物肠溶胶囊:尿酸诱导枯草杆菌大分子提取物100mg、碳酸氢钠50mg,混匀制成肠溶胶囊1颗。每次1颗,一天三次。
配方5、尿酸诱导酵母菌大分子提取物肠溶胶囊:尿酸诱导酵母菌大分子提取物100mg、碳酸氢钠50mg,混匀制成肠溶胶囊1颗。每次1颗,一天三次。
实施例4正常大鼠尿酸肠道和血清尿酸的关系。
将10只体重为180-200g的雄性SD大鼠适应性饲养3天并禁食36小时后用乌拉坦麻醉(1gkg),剪开腹腔,从腹主动脉取不抗凝血标本制备血清,将消化道从胃贲门到直肠取出,收集胃液,然后将肠道摊成110cm,以5cm为单位,分段收集肠液(先挤出肠液,然后用大鼠灌胃针头取200μl生理盐水冲洗肠管),共收集20段肠段,盲肠约10cm不收集。另收集大鼠的心、肝、脾、肺、肾、脑、臀大肌、睾丸、胰腺和洗净的胃、十二指肠、回肠末端、大肠等组织匀浆收集匀浆液。
将获得的胃液和肠液标本用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,含量用每段肠液的尿酸总量表示,结果见图4;图4可见肠液中有尿酸分布,以小肠上端(十二指肠)肠液中的尿酸分布较高。将获得的组织匀浆标本先用蛋白质定量试剂盒(BCA法)测定其含量,然后用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见表4;表4可见十二指肠肠壁中的尿酸含量最高。
表4尿酸在大鼠各组织的分布(均值±标准差,n=10)
实施例5不同疾病状态大鼠血清尿酸和尿酸肠道的关系。
将50只体重为180-200g的雄性SD大鼠适应性饲养3天,分为5组,每组10只,分组和给药参见表5,人为制造疾病状态以影响大鼠体内的尿酸水平(正常组为对照)。各组按照表5要求每天给药1次,连续给药五天并禁食36小时后用乌拉坦麻醉(1gkg),剪开腹腔,从腹主动脉取不抗凝血标本制备血清,将消化道从胃贲门到直肠取出,收集胃液,然后将肠道摊成110cm,以5cm为单位,分段收集肠液(先挤出肠液,然后用大鼠灌胃针头取200μl生理盐水冲洗肠管),共收集20段肠段,盲肠约10cm不收集。
将获得的胃液和肠液标本用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,含量用每段肠液内的尿酸总量表示,结果见表5和图5。从表5可见,用不同处理方法处理大鼠,血清尿酸总量发生变化,但肠液中的尿酸总量一直比血清多,表明清除肠液中的尿酸有望产生更好的降血清尿酸作用。图5表明,不管何种原因引起的大鼠血清尿酸变化,小肠上段,特别是十二指肠的尿酸分布处于最高水平。
表5各组大鼠的血清和肠液中的尿酸(n=10)。
*与正常组相比,P<0.05(单因素方差分析);680mg肌酐与400mg腺苷摩尔数相等。
将上述5组大鼠的血清尿酸水平和肠道尿酸总量进行相关性分析,发现血清尿酸水平与肠道尿酸总量呈现正相关(r=0.227,P<0.05,n=50)。表明血清尿酸水平升高,肠道中的尿酸总量也会增多,而清除肠道的尿酸有望降低血清尿酸水平。
实施例6灌胃尿酸酶制剂降低正常大鼠血清尿酸水平。
将40只体重为180-200g的雄性SD大鼠适应性饲养3天,分为4组,每组30只,分对照组和治疗组。对照1组早上灌胃奥美拉唑(0.4mg/ml),4小时后灌胃1号对照液10ml/kg(碳酸氢钠12mg/ml);对照2组早上灌胃奥美拉唑(0.4mg/ml),4小时后灌胃2号对照液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%);治疗2组早上同样灌胃奥美拉唑,4小时后灌胃1号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml,尿酸酶2u/ml,效价单位根据市售标准酶确定,下同);治疗2组灌胃2号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%,尿酸酶2u/ml)。连续给药五天后用乌拉坦麻醉(1gkg),剪开腹腔,从腹主动脉取不抗凝血标本离心制备血清,同时检测到胃内pH为6.81±0.32。整个实验过程中,与对照比较,动物的行为活动和体重变化均未见可辨认的差异。
将获得的血清标本用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见图7。从图7可见,对照1组和对照2组大鼠的血清尿酸水平差异很小;治疗1组和2组的血清尿酸水平均有所降低,但治疗2组降低明显(与对照2组相比,P<0.05)。表明正常大鼠灌胃尿酸酶制剂后,血清尿酸水平可明显下降,但组方中最好有尿酸酶保护剂,否则降尿酸效果较差。各组使用的奥美拉唑是升高胃内pH,好让尿酸酶制剂通过胃进入十二指肠,马血清即是尿酸酶的蛋白保护剂。
实施例7灌胃尿酸酶制剂降低血清尿酸升高大鼠血清尿酸。
将40只体重为180-200g的雄性SD大鼠适应性饲养3天,分为4组,每组10只,分造模1组、造模2组、治疗1组和治疗2组。造模1组上午灌胃造模液混合物10ml/kg(每毫升含腺嘌呤15mg/ml、氧嗪酸钾15mg/ml、奥美拉唑0.4mg/ml),4小时后灌胃1号对照液10ml/kg(碳酸氢钠12mg/ml);造模2组上午灌胃造模液混合物10ml/kg(每毫升含腺嘌呤15mg/ml、氧嗪酸钾15mgml、奥美拉唑0.4mg/ml),4小时后灌胃2号对照液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%);治疗1组上午同样灌胃造模混合物,4小时后灌胃1号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml,尿酸酶2u/ml);治疗2组上午同样灌胃造模混合物,4小时后灌胃2号尿酸酶溶液10ml/kg(碳酸氢钠12mg/ml、马血清冻干粉5%,尿酸酶2u/ml)。连续给药五天后用乌拉坦麻醉(1gkg),剪开腹腔,从腹主动脉取不抗凝血标本离心制备血清,另测得所有大鼠的胃内pH值为6.79±0.33。整个实验过程中,与对照比较,动物的行为活动和体重变化均未见可辨认的差异。
将获得的血清标本用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见图8。从图8可见,造模后大鼠血清尿酸水平处于一个较高的水平,但造模1组和造模2组无明显差别;治疗组灌胃尿酸酶制剂后,血清尿酸水平下降,但治疗1组和治疗2组效果差别明显,治疗2组的疗效明显(与模型2组相比,P<0.05)。各组使用的奥美拉唑是升高胃内pH,好让尿酸酶制剂通过胃进入十二指肠,马血清即是尿酸酶的蛋白保护剂。
实施例8灌胃枯草杆菌大分子提取物降低血清尿酸升高大鼠血清尿酸水平。
将30只体重为180-200g的雄性SD大鼠适应性饲养3天,分为3组,每组10只,分造模组和枯草杆菌大分子提取物组和尿酸诱导枯草杆菌大分子提取物治疗组。造模组上午灌胃造模液混合物10ml/kg(每毫升含腺嘌呤15mg/ml、氧嗪酸钾15mg/ml、奥美拉唑0.4mg/ml),4小时后灌胃对照液10ml/kg(碳酸氢钠12mg/ml);治疗1组(枯草杆菌大分子提取物组)上午同样灌胃造模混合物,4小时后灌胃枯草杆菌大分子提取物溶液10ml/kg(碳酸氢钠12mg/ml、枯草杆菌大分子提取物10mg/ml),治疗2组(尿酸诱导枯草杆菌大分子提取物组)上午同样灌胃造模混合物,4小时后灌胃尿酸诱导枯草杆菌大分子提取物溶液10ml/kg(碳酸氢钠12mg/ml、尿酸诱导枯草杆菌大分子提取物10mg/ml)每天给药1次;连续给药五天后用乌拉坦麻醉(1g/kg),剪开腹腔,从腹主动脉取不抗凝血标本离心制备血清。
将获得的血清标本用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见表6。从表6可见,造模后大鼠血清尿酸水平处于一个较高的水平,治疗组灌胃枯草杆菌大分子提取物制剂后,血清尿酸水平明显下降,但以尿酸诱导枯草杆菌大分子提取物的效果较好(与造模组相比,P<0.05)。各组使用的奥美拉唑是升高胃内pH,好让尿酸酶制剂通过胃进入十二指肠,细菌的大分子提取物本身富含的非尿酸酶蛋白质即是尿酸酶的蛋白保护剂。
表6枯草杆菌大分子提取物灌胃对大鼠血清尿酸的影响(n=10)
实施例9灌胃酵母大分子提取物降低血清尿酸升高大鼠血清尿酸水平。
将30只体重为180-200g的雄性SD大鼠适应性饲养3天,分为3组,每组10只,分造模组和酵母大分子提取物组和尿酸诱导酵母大分子提取物治疗组。造模组上午灌胃造模液混合物10ml/kg(每毫升含腺嘌呤15mg/ml、氧嗪酸钾15mgml、奥美拉唑0.4mg/ml),4小时后灌胃对照液10ml/kg(碳酸氢钠12mg/ml);治疗1组(酵母大分子提取物组)上午同样灌胃造模混合物,4小时后灌胃酵母大分子提取物溶液10ml/kg(碳酸氢钠12mg/ml、酵母大分子提取物10mg/ml),治疗2组(尿酸诱导酵母大分子提取物组)上午同样灌胃造模混合物,4小时后灌胃尿酸诱导酵母大分子提取物溶液10ml/kg(碳酸氢钠12mg/ml、尿酸诱导酵母大分子提取物10mg/ml);每天给药1次,连续给药五天后用乌拉坦麻醉(1g/kg),剪开腹腔,从腹主动脉取不抗凝血标本离心制备血清。
将获得的血清标本用南京建成生物工程研究所的尿酸检测试剂盒(钨蓝法)检测尿酸含量,结果见表7。从表7可见,造模后大鼠血清尿酸水平处于一个较高的水平,治疗组灌胃酵母大分子提取物制剂后,血清尿酸水平明显下降,但以尿酸诱导酵母大分子提取物的效果较好(与造模组相比,P<0.05)。各组使用的奥美拉唑是升高胃内pH,好让尿酸酶制剂通过胃进入十二指肠,酵母的大分子提取物本身富含的非尿酸酶蛋白质即是尿酸酶的蛋白保护剂。
表7酵母大分子提取物灌胃对大鼠血清尿酸的影响(n=10)
尿酸酶是高效率降解尿酸的酶,很多生物均表达该酶。尿酸酶是蛋白质,能够被消化酶消化而失效,也有可能被强酸强碱等化学物质破坏结构而变性失效。因此,临床使用的尿酸酶均为注射制剂,也正因为考虑到尿酸酶可能被消化酶破坏,或考虑到消化道不是尿酸排泄的主要器官而没有该类口服制剂,或有报道但不能让业界信服其作用。
本申请先用实施例获得具有尿酸酶活性的重组尿酸酶,也获得了含有尿酸酶并能一定程度上分解尿酸的细菌和真菌大分子提取物。更重要的是本申请证明肠道是尿酸分布的重要器官,分布在肠液中的尿酸总量比全部血清中的尿酸总量还多,并呈现出良好的相关性;特别地,肠液中的尿酸主要分布在小肠上端(十二指肠)。该发现具有极大的应用价值,如果能一次清除肠道中的尿酸,那么就至少相当于将血清中的尿酸清除了一次而产生良好的降血清尿酸作用而防治高尿酸血症和痛风。很明显,清除肠液中的尿酸可以以“局部治疗”的方式实现,从而避免了吸收入血而引发的肝肾毒性,继而将高尿酸血症和痛风的降尿酸治疗转化为肠道局部治疗具有极大的进步意义。尿酸酶可用于临床注射,根据已有的知识可以判断,尿酸酶制剂口服的安全性将更高。
尿酸酶是蛋白,在酸性条件活性低,也容易变性失效;口服不吸收,容易被胃肠道中的蛋白酶降解失效。因此,尿酸酶口服降血清尿酸,要避开胃酸的破坏和消化液中蛋白酶的破坏,最好还能提供较好的弱碱性环境。在本申请中,我们创造性地将尿酸酶制成肠溶制剂,在提供较好碱性环境的基础上使用尿酸酶保护剂延缓尿酸酶在消化道降解而更好地发挥作用。在尿酸酶制剂的配方中,尿酸酶是主药(活性物质),碳酸氢钠为尿酸酶提供弱碱性环境,鸡蛋蛋白粉(考虑到变性蛋白粉不好用灌胃针头抽取,实施例6和7用水溶性好粘稠度低的马血清冻干粉代替)则是安全的尿酸酶保护剂(蛋白粉能与尿酸酶竞争消化酶的作用位点而减缓尿酸酶的破坏)。实施例证明,尿酸酶和碳酸氢钠组合只具有较弱的降血清尿酸作用,可能的解释是失去尿酸酶保护剂,很快就会被消化液破坏失效。如果加入尿酸酶保护剂,尿酸酶则能在肠道起效更久,而且十二指肠液就是尿酸分布较高的部位,因而产生明显的降血清尿酸疗效。
某些细菌(如枯草杆菌)和真菌(酵母)均能产生尿酸酶而降解尿酸。如果采用标准微生物培养方案,尿酸酶呈低表达,大分子提取物中的尿酸酶活性低,制成肠溶制剂给药后效果较差。尿酸酶本身具有可诱导性,为了提高微生物大分子提取物中的尿酸酶活性,可以在微生物培养时加入尿酸对微生物进行诱导。事实也证明,尿酸诱导的枯草杆菌大分子提取物和尿酸诱导的酵母大分子提取物能更好地实现口服降血清尿酸。理论上,微生物的全提取物也会有降解尿酸的作用,但是全提取物可能含有较多核酸小分子,核酸中嘌呤会转化为尿酸,这样的制剂有不利于降尿酸的因素,因此不建议使用全提取物而使用大分子提取物。
在本申请的动物实验中,将尿酸酶和微生物大分子提取物制备成大鼠用肠溶制剂是困难的,因此利用奥美拉唑抑制胃酸分泌来保护尿酸酶和大分子提取物溶液顺利通过胃。因为奥美拉唑能抑制胃酸生成,胃中的蛋白酶也就变得几乎没有活性。实际上实验中也观察到,用过奥美拉唑的大鼠胃液pH是非常接近7.0(6.5-7.0)。
在本申请的药物制备中,能降解尿酸活性物质的并不限于重组尿酸酶、枯草杆菌大分子提取物、酵母大分子提取物;为尿酸酶等主药提供弱碱性环境的也不限于碳酸氢钠;提到的尿酸酶保护剂也不限于熟鸡蛋蛋白粉。其他具有类似功能的医用或食用物质也可用作弱碱性添加剂或尿酸酶保护剂。
- 还没有人留言评论。精彩留言会获得点赞!