消融期间的磁共振测温法的制作方法
版权声明本专利文档的公开内容的一部分包括受版权保护的材料。版权所有者不反对任何人照专利和商标办公室专利文件或记录原样复制本专利文件或专利公开内容,但除此之外版权所有者保留所有相关的版权。相关申请的交叉引用本申请要求美国临时申请62/305,026的权益,该临时申请以引用方式并入本文。
背景技术:
:1.
技术领域:
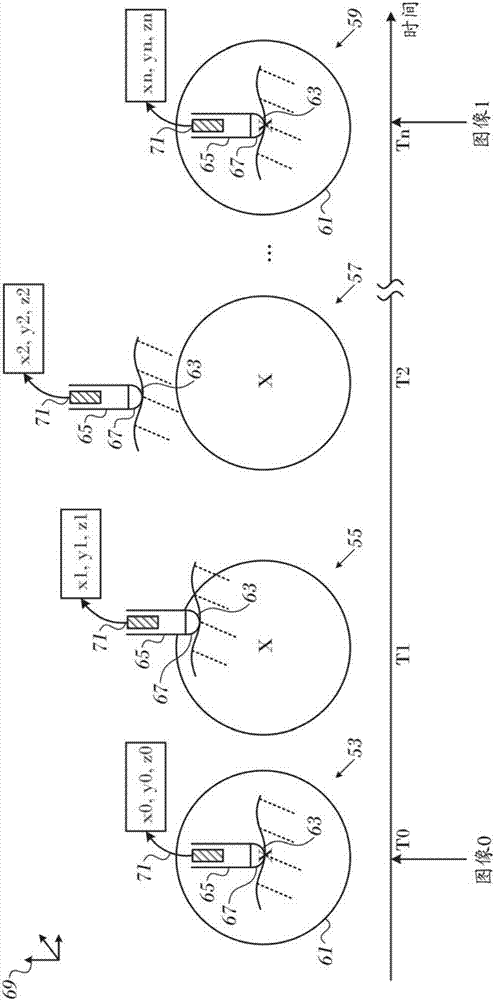
本发明涉及用于向或从身体转移非机械形式的能量的装置和方法。更具体地,本发明涉及心脏消融治疗期间的磁共振测温法。2.相关领域描述表1中给出了本文使用的某些首字母缩略词和缩写的含义。表1-首字母缩略词和缩写gre梯度回波mri磁共振成像prf质子共振频率te回波时间当心脏组织区域异常地向相邻组织传导电信号时,便会发生心率失常诸如心房纤颤,从而扰乱正常的心动周期并导致心律不齐。非所需信号的重要源位于沿左心房的肺静脉的组织区域中以及与心脏神经丛相关联的心肌组织中。在这种情况下,当肺静脉中产生无用信号后或当无用信号从其它源传导通过肺静脉后,这些无用信号传导进入左心房并可在其中引发或维持心率失常。用于治疗心律失常的规程包括通过消融来破坏造成心律失常的区域,以及破坏用于这种信号的传导路径。使用电能来消融身体组织在本领域中是已知的。通常通过以下步骤进行消融:以足以破坏目标组织的功率向一个或多个消融电极施加交流电,例如射频能量。通常,将电极安装在插入受检者体内的侵入性探针或导管的远侧末端或部分上。可使用本领域已知的多种不同方式来跟踪远侧末端,例如通过测量在远侧末端处由受检者体外的线圈生成的磁场来跟踪远侧末端。使用射频能量消融心脏组织的已知困难在于控制组织的局部加热。在期望形成足够大的消融灶以有效地消融异常组织病灶或阻断异常传导模式与过度局部加热的不期望效应之间存在权衡。如果射频装置形成太小的消融灶,则医疗规程可能不太有效,或者可能需要太多的时间。另一方面,如果过度加热组织,则可能存在因过热而引起的局部炭化效应。此类过热的区域可形成高阻抗,并且可形成对热量通道的功能性屏障。使用较慢的加热提供对消融的更好控制,但是不适当地延长规程。已经开发了各种技术来控制消融位点的局部加热。例如,以引用方式并入本文的授予govari等人的共同转让的美国专利6,997,924描述了通过下述方式来限制消融期间产生的热的技术:测定组织的测量温度和经传输的能量的测量功率电平,并且响应测量温度和测量功率电平的函数来控制功率输出电平。本专利与其它示例一样,依赖于消融位点处的温度的测量。通常,温度传感器诸如热电偶或热敏电阻器可以安装在消融电极上或附近。已经提出基于质子共振频率(prf)的磁共振测温法用于体内温度测量。prf中的相移在宽的温度范围上是线性的,并且对组织类型相对不敏感。基于prf的相位成像已经成为mri测温法的优选技术。基于prf的相位成像的原理是熟知的。简而言之,电子在水性介质中的核屏蔽效应随温度升高,导致局部磁场强度降低,因此降低prf。这能够通过选择用于在加热期间采集多个相位图像的梯度回波(gre)成像脉冲序列来利用,使得动态图像的相位差与回波时间(te)成比例。在这些条件下,可以计算温度变化δt(t):其中φ(t)和φ0分别是在时间t和初始时间的图像相位;γ是氢的旋磁比(42.58mhz/特斯拉);α是屏蔽效应的屏蔽常数的温度系数;并且b0是主磁场强度。然而,对于运动的组织,诸如跳动的心脏,序列中的mri图像通常不彼此配准。精确的测温是不可能的,因为任何观察到的相变可能至少部分地由于被成像的目标的运动。技术实现要素:本发明的公开的实施方案涉及将导管定位在组织消融位点处。该导管在其远侧末端处具有位置传感器,并且在远侧末端上的电极用于消融,消融引起期望被跟踪的温度的改变。从传感器读数获得的位置信息提供了成像系统的视场的相关部分与先前图像的视场的相关部分配准的指示。该指示触发新的图像的采集。根据本发明的实施方案提供了通过将探针插入活体受检者的心脏中来进行的方法。该探针具有设置在其远侧部分上的位置传感器和消融电极。该方法通过以下步骤来进一步进行:将探针导航成与心脏的目标组织成接触关系,激活消融电极,获得位置传感器的第一读数以获得第一位置,以及采集目标组织在第一位置处的第一磁共振测温图像。该方法通过以下步骤来进一步反复地进行:获取位置传感器的新的读数以获得第二位置,当第一位置与第二位置中的一个第二位置之间的距离小于预定距离时采集目标组织的新的磁共振测温图像,以及分析第一磁共振测温图像和新的磁共振测温图像以测定目标组织的温度。根据该方法的一个方面,采集第一磁共振测温图像和新的磁共振测温图像包括测定其间的质子共振频率的相位变化,以及根据相位变化计算目标组织的温度。根据该方法的另一方面,位置传感器是磁性定位传感器,并且以10ms的间隔获取新的读数。根据该方法的另一方面,采集第一磁共振测温图像和新的磁共振测温图像包括测量质子共振频率相移并将相移与温度相关联。根据该方法的另外的方面,第一磁共振测温图像和新的磁共振测温图像从脉冲序列获得。根据该方法的另一方面,脉冲序列是梯度回波脉冲序列。根据该方法的一个方面,以光谱方式执行质子共振频率相移的测量。根据该方法的另一方面,采集第一磁共振测温图像和新的磁共振测温图像包括测量质子密度自旋晶格弛豫时间。根据该方法的另外的方面,采集第一磁共振测温图像和新的磁共振测温图像包括测量自旋-自旋弛豫时间。根据该方法的另一方面,采集第一磁共振测温图像和新的磁共振测温图像包括测量扩散系数。根据该方法的另一方面,采集第一磁共振测温图像和新的磁共振测温图像包括测量磁化转移。根据本发明的实施方案还提供了一种设备,其包括适于插入患者的心脏中并且在其远侧部分中具有位置传感器的柔性探针。处理器连接至位置传感器并且被配置成用于向磁共振成像器发送控制信号。处理器与磁共振成像器协作以获得位置传感器的第一读数,以在远端部分与心脏的目标组织成接触关系时建立第一位置,采集心脏在第一位置处的第一磁共振测温图像,并且在消融期间,其后反复地获取位置传感器的新的读数以获得第二位置,当第一位置与第二位置中的一个第二位置之间的距离小于预定距离时,采集目标组织的新的磁共振测温图像,以及分析第一磁共振测温图像和新的磁共振测温图像以测定目标组织的温度。附图说明为了更好地理解本发明,以举例的方式引用本发明的具体实施方式,本发明的具体实施方式应结合以下附图来阅读,附图中类似的元件被赋予类似的附图标号,并且其中:图1是根据本发明的实施方案的用于执行心脏导管插入术规程的系统的立体说明图;图2是示出根据本发明的实施方案从运动的组织采集mri测温图像的一系列图;图3是根据本发明的实施方案测定消融位点的温度的方法的流程图;图4是包括根据本发明的实施方案采集的两个mri热成像图像的复合图;并且图5是适于mri热成像的两个mri图像的集合。具体实施方式在下文的具体实施方式中,示出了许多具体细节,以便提供对本发明的各种原理的全面理解。然而,对于本领域的技术人员而言将显而易见的是,并非所有这些细节都是实施本发明所必需的。在这种情况下,未详细示出熟知的电路、控制逻辑、以及用于常规算法和过程的计算机程序指令的细节,以免不必要地使一般概念模糊不清。以引用方式并入本文的文献将被视作本申请的整体部分,不同的是,就任何术语在这些并入文件中以与本说明书中明确或隐含地作出的定义矛盾的方式定义而言,应仅考虑本说明书中的定义。概述现在转到附图,首先参见图1,其为根据本发明的公开实施方案构建和操作的用于对活体受检者的心脏12执行心导管插入术规程的系统10的立体说明图。系统10通常包括用合适的软件编程以用于进行下文所述功能的通用或嵌入式计算机处理器。因此,尽管本文中的图1和其它附图所示的系统10的部分示出为包括多个单独的功能块,但这些块未必为单独的物理实体,而是可代表例如处理器可访问的存储器中存储的不同计算任务或数据对象。这些任务可在运行于单个处理器上或运行于多个处理器上的软件中进行。另选地或除此之外,系统10可包括数字信号处理器或硬连线逻辑。该系统包括导管14,由操作者16将该导管经由皮肤穿过患者的血管系统插入心脏12的心室或血管结构中。操作者16(通常为医师)使导管的远侧末端18在目标消融位点处与心脏壁接触。然后可根据美国专利6,226,542和6,301,496以及共同转让的美国专利6,892,091中公开的方法,使用位于控制台24中的处理器22制备电激活图、解剖位置信息(即,导管的远侧部分的信息)和其它功能图像,所述专利的公开内容以引用方式并入本文。实施系统10的元件的一种商业产品可以商品名3系统购自biosensewebster,inc.(3333diamondcanyonroad,diamondbar,ca91765),该产品能够根据消融需要产生心脏的电解剖标示图。此系统可由本领域的技术人员进行修改以实施本文所述的本发明的原理。可以通过施加热能对例如通过电激活图评估测定为异常的区域进行消融,例如,通过将射频电流通过导管中的线传导至远侧末端18处的一个或多个电极,这些电极将射频能量施加到心肌。能量被吸收在组织中,将组织加热(或冷却)到一定温度(通常为约50℃),在该温度下组织永久性失去其电兴奋性。在成功后,此规程在心脏组织中形成非传导性消融灶,该非传导性消融灶中断导致心律失常的异常电通路。本发明的原理可应用于不同的心脏腔室以治疗多种不同的心律失常。导管14通常包括柄部20,在该柄部上具有合适的控件,以使操作者16能够按消融所需来对导管的远侧端部进行操控、定位和取向。为了辅助操作者16,导管14的远侧部分包括位置传感器(未示出),该位置传感器向位于控制台24中的定位处理器22提供信号。可使消融能量和电信号经由缆线34穿过导管末端和/或位于远侧末端18处或附近的一个或多个消融电极32在心脏12和控制台24之间来回传送。可以通过缆线34和电极32将起搏信号和其它控制信号从控制台24传送至心脏12。还连接到控制台24的感测电极33设置在消融电极32之间,并且具有至缆线34的连接部。线连接部35将控制台24与体表电极30和定位子系统的其它部件连接。电极32和体表电极30可用于按照以引用方式并入本文的授予govari等人的美国专利7,536,218中所教导的在消融位点处测量组织阻抗。控制台24通常包括一个或多个消融功率连接部。导管14可适于利用任何已知的消融技术将消融能量例如射频能量、超声能量、冷冻技术和激光产生的光能传导至心脏。共同转让的美国专利6,814,733、6,997,924和7,156,816中公开了此类方法,所述专利以引用方式并入本文。定位处理器22为系统10中的定位子系统的元件,该元件测量导管14的位置和取向坐标。在一个实施方案中,定位子系统包括磁定位跟踪构造,该磁定位跟踪构造利用磁场生成线圈28,通过以预定的工作容积生成磁场并感测导管处的这些磁场来测定导管14的位置和取向。定位子系统可按照以引用方式并入本文的美国专利7,756,576以及上述美国专利7,536,218中所教导的采用阻抗测量。mri成像装置37连接到可位于控制台24中的控制处理器47。操作者可选择或覆盖自动操作以控制mri成像装置37的操作,例如通过修改成像参数来控制。控制处理器47可以经由缆线51与mri成像装置37通信,以启用和禁用mri成像装置37来采集图像数据。连接到控制处理器47的任选的显示监视器49允许操作者查看通过mri成像装置37产生的图像。当不包括显示监视器49时,仍然可以经由分区屏幕或与其它图像交替而在监视器29上查看图像。如上所述,导管14联接到控制台24,这使得操作者16能够观察并调控导管14的功能。处理器22通常为具有合适的信号处理电路的计算机。联接处理器22以驱动监视器29。信号处理电路通常接收、放大、过滤并数字化来自导管14和mri成像装置37的信号,这些信号包括由上述传感器和位于导管14远侧的多个位置感测电极(未示出)生成的信号。控制台24和定位系统接收并使用数字化信号,以计算导管14的位置和取向,分析来自电极的电信号以及生成期望的电解剖标示图。当在系统部件例如,组合的carto-mri系统之间共享坐标系时,上述构造工作良好。这在消融心房时特别有用,因为其壁很薄,并且有必要限定其边界。尽管在图像处理中有进步,但是心内膜壁的边缘检测仍然是挑战性的,并且常规上需要顺序切片图像的手动分析。然而,使用接触心内膜壁并测量接触力的可跟踪的mri相容的留置导管,可以避免手动分析。通常,系统10包括其它元件,但为了简洁起见未在图中示出这些元件。例如,系统10可包括心电图(ecg)监视器,该心电图(ecg)监视器被联接以接收来自一个或多个体表电极的信号,以向控制台24提供ecg同步信号。如上所述,系统10通常还包括基准位置传感器,其位于附接到受检者身体外部的外部施加的基准补片上,或者位于插入心脏12中并相对于心脏12保持在固定位置的内置导管上。提供了用于使液体循环穿过导管14以冷却消融位点的常规泵和管路。图像采集现在参见图2,其是示出根据本发明的实施方案从运动的组织采集mri测温图像的一系列图53、55、57、59。由mri成像装置37(图1)成像的区域由圆圈61指示。在图表53中,在此示为心脏的消融位点63的感兴趣点在圆圈61的中心处用“x”标记。探针65的远侧端部具有与消融位点63接触的消融电极67。圆圈61的位置是恒定的。根据读数,可以从位置传感器71的读数测定消融位点63相对于参照系69的位置,该位置传感器通常是磁性定位传感器。消融位点63在时间t0处与圆圈61的“x”对准,并且具有坐标(x0,y0,z0)。在时间t0处采集mri测温图像(image0)。然而,在时间t1、t2处,心肺运动已经相对于圆圈61移动消融位点63和探针65的位置,如图表55、59所示。在时间t1、t2处,消融位点63分别具有坐标(x1,y1,z1)、(x2,y2,z2),其不同于坐标(x0,y0,z0)。在时间tn处,消融位点63具有坐标(xn,yn,zn),其被系统识别为基本上与坐标(x0,y0,z0)相同,即,两组坐标之间的距离测量值小于预定义极限δ。例如,欧几里得距离其中(xr,yr,zr)是与参照图像上的消融位点相对应的参照点的坐标。识别触发第二mri测温图像(image1)的采集。当前可用的传感器能够每10ms报告位置。mri图像的合适参数是te40ms、切片厚度3mm和回转角60度。可以在每个心跳触发mri测温图像以在时间间隔t0<t<tn期间采集新的切片。现在参见图3,其是根据本发明的实施方案测定消融位点的温度的方法的流程图。该规程相对于示例性系统10(图1)进行描述,但是可以利用其它系统配置来执行。为了显示的清晰性,在图3中以具体的线性顺序示出了处理步骤。然而,将显而易见的是,这些步骤中的多个可并行地、异步地或以不同的顺序执行。本领域的技术人员还应当理解,另选地,过程可被表示为多个相互联系的状态或事件,例如,在状态图表中。此外,可能不需要所有示出的过程步骤来实施所述方法。在初始步骤73,心脏常规地用在其远侧部分具有位置传感器和消融电极的探针进行导管插入。使用已知的方法使消融电极与目标位置接触。接下来,在步骤75,在mri成像装置37上采集包括目标区域的参照图像。出于将参照图像中的prf相位与温度相关联的目的,假设环境体温。接下来,在步骤77,读取位置传感器71,并且在参照图像上测定传感器和目标位置的参照坐标(xr,yr,zr)。接下来,在步骤79,激活消融电极以开始目标组织的消融。在该规程期间不时地采集mri测温图像,诸如基于prf的相位图像。适合用于图像的一个脉冲序列是具有上述mri参数的梯度回波脉冲序列。在延迟步骤81发生暂停,在该步骤中确定预定延迟间隔是否已期满。如果待连续采集mri测温图像,则延迟间隔设置为零。接下来,在步骤83,从位置传感器71获得读数,并且确定其坐标(xn,yn,zn)。接下来,在决定步骤85,确定在步骤77和步骤83获得的坐标之间的距离是否小于预定值δ,即,满足以上所示的不等式(2)。如果在决定步骤85的决定是否定的,则控制返回到步骤83,并且从位置传感器71获得另一个读数。如果在决定步骤85的决定是肯定的,则控制前进至步骤87。采集新的mri测温图像。然后,在步骤89,通常通过基于prf的相位温度映射在新的图像上测定消融位点处的温度,并且使用以上给出的等式(1)的原理从频率相移得到消融位点的温度。控制然后返回到延迟步骤81以开始新的等待周期。另选实施方案可以使用与温度无关的参照物质诸如脂质以光谱方式测量prf随温度的偏移。或者,在磁共振成像中存在许多依赖于温度的特征,例如,质子密度自旋晶格弛豫时间、自旋-自旋弛豫时间、扩散系数和磁化转移。可以在步骤89(图3)中的mri图像的分析中测定这些特征的测量中的偏移。实施例现在参见图4,其为包括两个mri热成像图像91、93的复合图表,其示出了根据本发明的实施方案的预期心脏消融规程中的典型结果。与较早图像91中的温度99相比,在较后的图像93中注意到消融位点97处的温度95的升高。如本领域已知,操作者可以通过调节消融规程的功率和/或持续时间对测量的温度95、99做出反应。现在参见图5,其为根据本发明的实施方案的适于mri热成像的两个mri图像101、103的集合。图像101、103获自根据本发明的实施方案的一个切片中采集的数据。图像101、103分别是振幅和相位图像。在两个图像上指示消融位点105。本领域的技术人员应当理解,本发明并不限于上文中具体示出和描述的内容。相反,本发明的范围包括上文所述各种特征的组合与子组合两者,以及本领域的技术人员在阅读上述说明时可能想到的未在现有技术范围内的变型和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1