一种基于钙剂的表柔比星复合化疗药物及其应用的制作方法
本发明属于生物医学技术领域,更具体地,涉及一种基于钙剂的表柔比星复合化疗药物及其应用,该基于钙剂的表柔比星复合化疗药物是一种复方化疗药物。
背景技术:
癌症已成为现代人健康的第一杀手。我国已进入“癌症大爆发”时代。针对肿瘤,化疗仍是目前癌症治疗的常用方法之一,为获得良好的治疗效果,临床上已普遍采用联合多种化疗药物的方法(即综合化疗方案)。一方面,由于化疗药物普遍选择性较差,达到靶部位的有效血药浓度及肿瘤细胞摄入率并不高,加之毒副作用明显,这些常常影响到实际疗效,令患者苦不堪言,甚至出现严重的异质性反应。另一方面,化疗药物的剂量不足将会导致对肿瘤的杀灭不彻底,影响疗效,同时化疗药物作用时间往往较多,难以对肿瘤细胞实现根治,在一定程度上限制了药物疗效的发挥。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明的目的在于提供一种基于钙剂的表柔比星复合化疗药物及其应用,其中通过对配合表柔比星更有效发挥药物抗肿瘤作用的关键添加物的成分、及其添加比例等进行改进,与现有技术相比有效降低了同等抗肿瘤作用下表柔比星的使用量,或在同等表柔比星的使用量下显著提升抗癌效果,能够有效减小化疗过程中使用表柔比星的毒副作用,并且该基于钙剂的表柔比星复合化疗药物,能够选择性增强表柔比星对肿瘤细胞的杀灭作用,同时降低副作用。
为实现上述目的,按照本发明的一个方面,提供了一种基于钙剂的表柔比星复合化疗药物,其特征在于,该复合化疗药物为可溶性钙盐与表柔比星的复合制剂;其中,所述可溶性钙盐中的钙元素与所述表柔比星两者的质量之比为1320~15460:1。
作为本发明的进一步优选,所述可溶性钙盐为氯化钙、柠檬酸钙、乳酸钙、葡萄糖酸钙、乙酸钙或硝酸钙。
作为本发明的进一步优选,所述复合化疗药物的应用液中钙元素的浓度为1.8~21mmol/l,表柔比星的浓度为0.1μmol/l。
按照本发明的另一方面,本发明提供了上述基于钙剂的表柔比星复合化疗药物在制备抗肿瘤药物中的应用。
作为本发明的进一步优选,所述肿瘤为肝癌肿瘤、结肠癌肿瘤或淋巴瘤肿瘤。
通过本发明所构思的以上技术方案,与现有技术相比,由于使用可溶性钙盐配合配合表柔比星,在保证药效的前提下,可极大降低表柔比星实际用量,并可以提高其选择性,减小对正常组织细胞的副作用。本发明采用的复合钙剂,生产来源广泛,市场容易推广,拓展了胞外钙离子的应用,具有较强的实际利用价值。
钙离子是细胞信号转导过程中重要的第一、第二信使,参与调控细胞增殖、凋亡、分化等众多生理生化过程。持续性的细胞内钙浓度提升,往往与细胞凋亡坏死密切相关。发明人前期的体外预实验发现,肿瘤细胞与正常组织细胞对胞外钙离子的敏感性不同,对细胞内钙浓度提升的耐受幅度存在差异,肿瘤细胞对胞外钙离子的耐受性显著小于正常细胞。同时,化疗药物表柔比星能提升胞内钙离子的浓度,但在生理钙浓度水平,选择性不佳。而将胞外钙离子与表柔比星联合用药,可以增效后者的化疗疗效,提高靶点的选择性,国内外尚无将胞外钙离子与化疗药物表柔比星联合的报道。
本发明所用表柔比星-钙复合制剂可选择性抑制人肝癌细胞系hepg2、人肝癌细胞系smmc7721增殖,同时对人正常肝细胞l-02的增殖抑制率显著低于肝癌细胞系,经细胞质钙浓度测定发现,复合钙剂诱导hepg2钙内流的幅度显著大于l-02,钙内流峰值出现时间更早。
附图说明
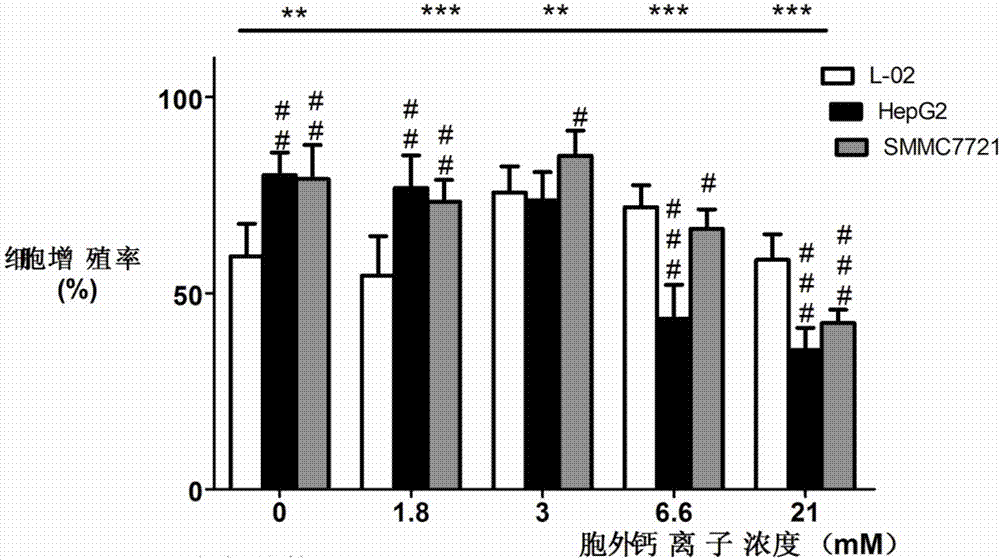
图1是胞外钙离子对hepg2、smmc7721和l-02增殖的影响图;其中,细胞增殖率通过srb方法得到,将不同浓度的氯化钙溶液加入到dmem高糖培养基中,培养48h后,计算不同细胞系在不同胞外钙浓度下的增殖率。其中组间比较“***”表示p<0.001,“**”表示p<0.01,“*”表示p<0.05;组内比较,“###”表示p<0.001,“##”表示p<0.01,“#”表示p<0.05
图2是胞外钙离子联合表柔比星对hepg2、smmc7721和l-02增殖的影响图;其中组间比较“***”表示p<0.001,“**”表示p<0.01,“*”表示p<0.05;组内比较,“###”表示p<0.001,“##”表示p<0.01,“#”表示p<0.05;该细胞增殖率通过srb方法得到,将图1中不同浓度的氯化钙溶液与0.1μm的表柔比星形成配比加入到dmem高糖培养基中,其中“0”组采用无钙培养基稀释表柔比星,培养48h后,计算不同细胞系在不同药物配比下的增殖率;
图3是hepg2细胞不同给药方案胞内钙离子提升的时间变化图;其中,10.8mm+0.1epi表示10.8mm氯化钙联合表柔比星;0.1epi表示单独使用表柔比星;横坐标4h、8h、16h、24h表示加药4h后、8h后、16h后、24h的时间点;纵坐标表示相比于不加干预(即只添加培养液)的细胞,胞内钙离子提升的幅度大小,胞内钙离子浓度测定采用fluo-3/am荧光探针,于荧光分光光度计设定激发波长为488nm,检测波长525nm;
图4是本发明实施例1中最低胞外钙离子浓度联合表柔比星对hepg2和l-02增殖的影响图;
图5是本发明实施例1中最低胞外钙浓度下hepg2细胞与l-02细胞胞内钙离子浓度提升的幅度图;处理方法同图4,是将通过fluo-3/am法得到的表柔比星组的胞内钙离子浓度值a1与对照组的胞内钙离子浓度值a0,则胞内钙离子提升的倍数n=a1/a0.其中胞内钙离子浓度值。k为荧光探针的解离常数,37℃为390nm。a为测得的各组荧光强度值,amax为采用加入triton-x100后的最大荧光强度值,amin采用加入egta后最小的荧光强度值;
图6是本发明实施例2中最高胞外钙浓度联合表柔比星对hepg2和l-02增殖的影响图;
图7是本发明实施例2中最高胞外钙浓度下hepg2细胞与l-02细胞胞内钙离子浓度提升的幅度;处理方法同图4,是将通过fluo-3/am法得到的表柔比星组的胞内钙离子浓度值a1与对照组的胞内钙离子浓度值a0,则胞内钙离子提升的倍数n=a1/a0.胞内钙离子浓度值计算公式为k(a-amin)/(amax-a),其中k为荧光探针的解离常数,37℃为390nm。a为测得的各组荧光强度值,amax为采用加入triton-x100后的最大荧光强度值,amin采用加入egta后最小的荧光强度值。
图8是本发明实施例3中最佳胞外钙浓度联合表柔比星对hepg2和l-02增殖的影响图;
图9是本发明实施例3中最佳胞外钙浓度下hepg2细胞与l-02细胞胞内钙离子浓度提升的幅度图,其中,*表示p<0.05。处理方法同图4,将通过fluo-3/am法得到的表柔比星组的胞内钙离子浓度值a1与对照组的胞内钙离子浓度值a0,则胞内钙离子提升的倍数n=a1/a0.胞内钙离子浓度值计算公式为k(a-amin)/(amax-a),其中k为荧光探针的解离常数,37℃为390nm。a为测得的各组荧光强度值,amax为采用加入triton-x100后的最大荧光强度值,amin采用加入egta后最小的荧光强度值。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明中基于钙剂的表柔比星复合化疗药物,其成分包括可溶性钙盐(如,氯化钙)及表柔比星,可用于但不限于肝癌、结肠癌、淋巴瘤等肿瘤的化疗方案中。
该复合化疗药物为可溶性钙盐与表柔比星的复合制剂;其中,重量比钙元素与表柔比星为1320~15460:1;应用液(即相应的溶液制剂)中钙元素的浓度为1.8~21mmol/l,表柔比星的浓度为0.1μmol/l。
本发明具体实验过程包括以下步骤:
(一)材料准备
1、实验所需细胞系为人肝癌细胞系hepg2、smmc7721、人胚胎肝细胞l-02,购置于中科院上海细胞库,采用dmem高糖培养基,10%胎牛血清,1%链霉素及青霉素培养,定期予以0.5μg/mlmra清除潜在的支原体污染。
2、主要试剂配制:
(1)氯化钙(分析纯)用无菌的三蒸水溶解,配制成1800mmol/l的储备液,加药前,根据需要,用含10%胎牛血清的dmem培养液稀释到工作浓度,确保三蒸水所占体积不超过0.5%;
(2)表柔比星:称取5mg固体表柔比星粉末,精确量取8.6210ml三蒸水中,溶解,0.22μm滤器过滤除菌,制成1mm储备液,使用前,用10%胎牛血清的dmem培养液稀释到工作浓度,确保三蒸水所占体积不超过0.5%;
(3)fluo-3/am钙离子探针:严格避光,于8mg粉末中精确加入44.2μl无水dmso,工作浓度确保1.5μg/ml每管,同时,加入pluronicf-127(v/w%=2.5%)以便更好让染料进入细胞。
3、主要仪器:多功能酶标仪(biotek公司,美国),tx400z型电热蒸汽压力消毒锅(上海三审医疗器械有限公司),dk-8a恒温水浴锅(上海精宏实验设备有限公司),移液器(德国eppendorf公司),自动加样器(德国eppendorf公司),超净工作台(苏州净化设备有限公司),二氧化碳细胞培养箱(日本sanyo公司),电子分析天平(sartorius公司,德国),倒置显微镜(olympus公司,日本),100ml,250ml培养瓶(corning公司,美国),6孔板,96孔板(corning公司,美国),膜针头式滤器(milipore公司,美国),低速大容量离心机dl-5型(上海安亭科学仪器厂)、荧光分光光度计(perkinelmerls5,美国)。
(二)磺酰罗丹明b法(srb)检测细胞增殖情况
1、细胞培养:l02细胞和hepg2细胞培养于含10%小牛血清(gibco,usa)的dmem培养基(hyclone,usa),置于含5%co2的37℃培养箱内培养,当细胞长满培养瓶底80~90%是传代。弃去旧的培养基,用3mlpbs缓冲液轻轻润洗2次,弃之,用0.5ml0.25%胰蛋白酶消化细胞5min后,加0.5ml小牛血清终止消化,再加入新鲜dmem培养基吹打细胞,制成细胞悬液,一瓶传三瓶。
2、细胞处理:取对数生长期的细胞,以5×103个/孔种于96孔板,每孔培养液总体积为100μl,培养24小时。然后,细胞用含不同浓度钙离子的dmem(含10%新生牛血清)(ca2+4.5mmol/l,ca2+9mmol/l,ca2+18mmol/l,培养对照组ca2+1.8mmol/l)培养48小时。
3、固定细胞:药物作用达到相应时间终点后,每孔加入50μl4℃预冷的tca溶液(终浓度10%,w/v)固定细胞,静置5min移入4℃冰箱中固定1h,取出用去离子水冲洗5遍,室温晾干。
4、染色:待96孔板室温下晾干后,每孔加入0.4%(w/v)的srb染液(1%的乙酸配制)70μl,染色30min后倒掉染液,用1%(v/v)乙酸冲洗4次,去除未结合的染料,室温晾干。
5、溶解染料:用100μl非缓冲tris-base碱液(10mm,ph=10.5)溶解与细胞蛋白结合的染料,水平摇床上振荡20min,采用酶标仪550nm处测定光吸收值。按公式计算相对光密度值以反映细胞的增殖率
增值率(%)=(a实验组—a空白组)/(a对照组—a空白组)×100%)。
a实验组代表药物处理组;a对照组代表正常对照组;a空白组代表空白对照组。结果表示为mean±sd。a为在550nm下的光密度值。
(三)细胞胞内钙离子测定
细胞培养、处理、收获细胞同上。用pbs溶液洗两次,2000rpm,5min离心。各分组细胞计数,调平至105/管,细胞用5μmfluo-3am(日本同仁)负载,37℃避光孵育60min。孵育完毕,13000rpm,10min,弃上清,加入1ml/管含1mm氯化钙的pbs缓冲液重悬,上机检测前没管加入40%丙磺舒溶液,平衡背景值,于荧光分光光度计检测荧光强度,激发波长488nm,检测波长525nm。
本发明具体采用的药物配比及其实验结果,参见以下实施例1~3。
实施例1
如图4、图5所示,本实施例1是将不做任何处理的组作为对照组,将1.8mm的钙离子加入dmem培养基中,利用srb法检测两种细胞系的增殖率。
实施例2
如图6、图7所示,本实施例2是将不做任何处理的组作为对照组,将10.8mm的钙离子加入培养体系中,利用srb法检测两种细胞系的增殖率。
实施例3
如图8、图9所示,本实施例3是将不做任何处理的组作为对照组,将6.3mm的钙离子加入培养体系中,利用srb法检测两种细胞系的增殖率。
通过上述实施例,分别分析如下:
(四)胞外钙离子提高表柔比星对hepg2增殖的抑制作用
对两种肝癌细胞系hepg2、smmc7721细胞,与对照组相比,各处理组的抑制率均显著升高(p<0.05,且呈浓度依赖关系。对于l02细胞,中高剂量组细胞的抑制率也显著升高(p<0.05,p<0.01)。各个剂量组,胞外钙离子对hepg2细胞增殖抑制作用明显高于对l02细胞增殖抑制作用(p<0.05)。而单独添加表柔比星组,不难发现,l02细胞增殖率显著低于hepg2组(p<0.05),其中,hepg2与l02的平均增殖率分别为50.67%±5.52%、65.18%±6.67%,这提示单独使用表柔比星,即使在实验剂量为0.1μm的低剂量情况下,仍对正常细胞的杀伤作用大,选择性不佳。而图2则利用无钙培养液构建无钙极端条件,表柔比星在无钙条件下对hepg2、smmc7721的杀伤作用小于生理钙浓度条件下(1.8mm),差异具有统计学意义(p<0.01)。随着不同胞外钙浓度梯度的添加,表柔比星的选择性杀灭作用液逐渐增强,但高剂量的钙(即图1中的21mm)对两者细胞的增殖均具有显著的抑制作用,提示高剂量浓度的胞外钙离子对细胞具有一定的毒性作用。经改良寇氏法,固定表阿霉素浓度为0.1μm,利用本发明给出的ic50(详见表1),选用6.3mm的钙剂,可有效抑制肝癌细胞系增殖,此剂量作用下,正常细胞系尚有65%左右的增殖率。
表1.本发明所用给药方案钙剂的半数抑制浓度
注:本发明所用的表柔比星浓度均为0.1μm,钙剂浓度范围1.8~21mm之间。ic50计算方法依据改良寇氏法,单位mm。
(五)胞外钙离子联合表柔比星诱导hepg2细胞和l02细胞胞内钙离子显著增加
由于胞内钙离子是细胞重要的第二信使,参与调控细胞增殖、凋亡、分化等众多生理生化过程。胞内钙离子的增加,可激活具有ef结构域的诸多钙调蛋白,后者可激活钙调激酶(campk)的活性,经生物级联放大效应,介导调控众多转录因子的活性,从而直接参与生命活动过程。因此,检测胞内钙离子的浓度变化,对研究细胞相关生命过程大有裨益。
图3所示,经48h加药干预后,随着胞外钙离子浓度的逐渐增高,添加表柔比星的作用下,两种细胞胞内钙离子浓度也逐渐增高,且hepg2细胞增高的幅度更大(p<0.01),在10.8mm钙离子浓度下,两种细胞的胞内钙离子达到峰值;同时,在不加入表柔比星的情况下,在10.8mm钙离子浓度下,胞内钙离子升高幅度比6.3mm浓度更少,且两种细胞胞内钙离子浓度变化尚无统计学差异。
图6反映的是,不同时间点,胞内钙离子的动态变化。在单独使用表柔比星的情况下,hepg2的胞内钙离子浓度在8h后增幅迅速,后逐步趋于平稳;而与胞外钙离子联合的情况下,前8h增幅缓慢,但在16h后增幅迅速,并超过表柔比星组,18h后,两种给药方法诱导胞内钙离子变化均逐步放缓,趋于稳定。
除上述实施例中的氯化钙外,本发明还可以采用其他可溶性钙盐,如柠檬酸钙、乳酸钙、葡萄糖酸钙、乙酸钙、硝酸钙等。
本发明中基于钙剂的表柔比星复合化疗药物,除溶解有可溶性钙盐与表柔比星外,还可包括其他对细胞无害的辅助成分,如nacl等(nacl在该复合化疗药物中的浓度可以与生理盐水的浓度保持一致)。本发明中的基于钙剂的表柔比星复合化疗药物,除了直接用作抗肿瘤(如肝癌肿瘤、结肠癌肿瘤、以及淋巴瘤肿瘤等肿瘤)的药物外,还可根据实际情况,与其他药剂配合使用(例如,向该复合化疗药物中继续加入其他药剂的有效成分等)。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!