一种调节脂代谢和肥胖的化合物PAQG在制药中的应用的制作方法
技术领域:
本发明属于药物技术领域,具体涉及一种降齐墩果酸化合物pyrocincholicacid3β‐o‐β‐d‐quinovopyranosyl‐28‐o‐β‐d‐glucopyranoside(paqg)在3t3‐l1细胞中调控脂代谢的新功能,以及其在制备改善肥胖及肥胖相关代谢性疾病的药物、食品及保健品中的应用。
技术背景:
糖尿病作为一种慢性代谢性疾病,它的并发症严重危及着人类的身体健康。尤其是与人类生活方式密切相关的2型糖尿病的研究也越来越多。研究表明,50%的肥胖人群都患有2型糖尿病,并且肥胖能够使2型糖尿病的患病率增加3倍。所以,肥胖与糖尿病的研究也越来越备受关注。
世界卫生组织(who)明确将肥胖定义为“体内过多或异常的脂肪累积”,而造成体内脂肪累积的原因可以从脂肪细胞数目和脂肪细胞中脂肪的含量两方面考虑。对脂肪累积的研究也成为一个治疗糖尿病的新靶点。虽然,市面上存在着各种各样改善肥胖的药物,但大多由于药效低、副作用大而滞销,所以,研究一种安全有效的改善肥胖、治疗糖尿病的药物或者化合物仍然是极有必要的。
paqg是一种新型的降齐墩果酸型皂苷小分子,从黄棉木中提取。黄棉木是茜草科黄棉木属中的单种属植物,广泛生长于中国西南部,越南,印度等地。目前,这一类化合物仅分离出二十多种,paqg就是其中的一种。而且,这些化合物的活性研究也比较少。本发明首次发现了paqg在3t3‐l1细胞中对脂代谢的调控作用。
技术实现要素:
:
本发明的目的在于提供一种具有显著抑制3t3‐l1细胞分化和脂肪累积的化合物paqg,以及该化合物在制备改善肥胖及肥胖相关代谢性疾病的药物、食品及保健品方面的应用。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
化合物paqg在制备对3t3‐l1前脂肪细胞分化的抑制剂中的应用,
化合物paqg在制备对成熟脂肪细胞脂肪代谢的调节剂中的应用。
化合物paqg在制备减肥药物中的应用。
化合物paqg在制备调节血脂的药物中的应用。
根据所述的化合物paqg在制备减肥药物中的应用,以及所述的化合物paqg在制备调节血脂的药物中的应用,其中paqg是通过显著抑制3t3‐l1前脂肪细胞分化,下调分化相关转录因子和蛋白pparγ,c/ebpβ,c/ebpα和fabp4的表达以及脂联素的释放,并通过抑制脂肪酸合成和促进脂氧化来抑制脂肪细胞中的脂肪累积,达到减肥和调节血脂作用。
本发明同时还提供了化合物paqg在制备改善肥胖及治疗或预防肥胖相关代谢性疾病的药物中的应用。
根据所述的化合物paqg在制备改善肥胖及治疗或预防肥胖相关代谢性疾病的药物中的应用,其中paqg是通过显著抑制3t3‐l1前脂肪细胞分化,下调分化相关转录因子和蛋白pparγ,c/ebpβ,c/ebpα和fabp4的表达以及脂联素的释放,并通过抑制脂肪酸合成和促进脂氧化来抑制脂肪细胞中的脂肪累积,达到减肥作用。
本发明另外还提供了化合物paqg在制备改善肥胖及肥胖相关代谢性疾病的食品及保健品中的应用。
经过大量多次的独立重复试验,首次发现了paqg在3t3‐l1细胞中对脂代谢的调控作用。本发明发现paqg能够显著抑制3t3‐l1前脂肪细胞分化,下调分化相关转录因子和蛋白(pparγ,c/ebpβ,c/ebpα和fabp4)的表达以及脂联素的释放。同时,通过抑制脂肪酸合成和促进脂氧化来抑制脂肪细胞中的脂肪累积。其调节脂代谢的作用可能与ampk信号通路的激活有关。在安全有效的给药剂量下,paqg从脂肪细胞数目和脂肪含量大小两方面来改善肥胖。
附图说明
图1.油红o染色。3t3‐l1前脂肪细胞诱导分化6天。实验组添加不同浓度的paqg;con组不加化合物,用0.1%dmso替代;undifferentiated组不添加诱导试剂作为空白对照。实验独立重复三次。
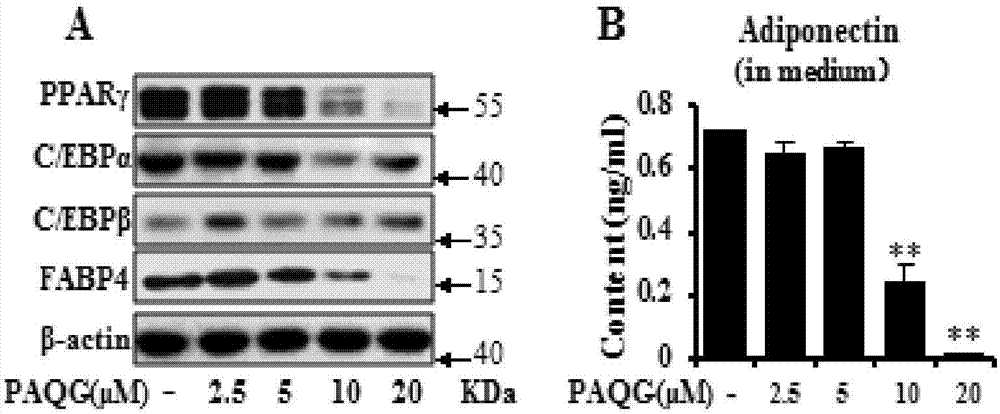
图2.3t3‐l1前脂肪细胞诱导分化6天,实验组添加不同浓度的paqg,对照组不加化合物,用0.1%dmso替代。(a)分化相关转录因子(pparγ,c/ebpβ和c/ebpα)以及蛋白fabp4的电泳结果;(b)培养基中的脂联素释放水平。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
图3.分化完成的脂肪细胞,用不同浓度paqg处理48小时,0.1%dmso作对照。(a),上图,给药方法;下图,给药48小时后,脂肪细胞中脂滴含量;(b),正常情况下,3t3‐l1脂肪细胞中的甘油三酯的时间‐浓度曲线;(c),给药处理后,3t3‐l1脂肪细胞中甘油三酯的时间‐浓度曲线;(d),给药处理后,3t3‐l1脂肪细胞中的游离脂肪酸的时间‐浓度曲线;(e),给药处理后,3t3‐l1脂肪细胞中的甘油的时间‐浓度曲线;(f),3t3‐l1脂肪细胞中甘油释放的时间‐浓度曲线。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
图4.(a),3t3‐l1前脂肪细胞在含有不同浓度paqg的诱导分化培养基中分化,6天后,用聚丙烯酰胺凝胶电泳法检测的蛋白ampk和p‐ampk的表达;(b),对(a)实验结果的量化;(c),在3t3‐l1前脂肪细胞诱导分化的全过程加入20μmpaqg,对照组添加0.1%的dmso,然后在不同的时间点收集蛋白样品检测ampk和p‐ampk的表达水平;(d),对(c)实验结果的量化(箭头表示化合物paqg开始给药处理)。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
图5.将分化好的3t3‐l1脂肪细胞用不同浓度的paqg孵育48小时(收集蛋白样品和rt‐pcr样品)。(a),p‐ampk和ampk的电泳结果;(b),对(a)蛋白电泳结果的量化;(c),rt‐pcr结果:受ampk调控的与脂肪酸合成相关的基因(srebp1c、accα、scd1、fas)的表达;(d),rt‐pcr结果:受ampk调控的与脂氧化相关的基因(pdk4、cpt1a、acox1)的表达。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
图6.在3t3‐l1细胞中,化合物paqg的细胞毒性实验。实验独立重复三次。
具体实施方式:
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1:
本发明化合物paqg,结构式如下式(i)所示,提取于黄棉木,由中国科学院西双版纳热带植物园提供,制备方法请参考如下文献中所记载的方法。
zhangy,tann,huangh,etal.triterpenoidsaponinsfrommetadinatrichotoma[j].zeitschriftfürnaturforschungb,2007,62(5):745‐748.
1、paqg抑制3t3‐l1前脂肪细胞分化:
3t3‐l1前脂肪细胞饥饿两天,用诱导试剂诱导分化三天,再用维持培养基培养一天,之后更换新鲜培养基正常培养即分化为脂肪细胞。按照该实验方法,在整个分化过程中用不同浓度(0,2.5μm,5μm,10μm,20μm)的paqg处理,对照组用0.1%的dmso替代。待细胞完全分化好后,用油红o染色的方法检测脂肪细胞中的脂肪含量。如图1所示,与正常分化的对照组细胞相比,给药组脂肪细胞的分化受到明显抑制,并且呈现浓度梯度依赖性,而20μmpaqg对脂肪细胞分化的抑制水平高达90%,此时的细胞中基本观察不到脂滴。
图1.油红o染色。3t3‐l1前脂肪细胞诱导分化6天。实验组添加不同浓度的paqg;con组不加化合物,用0.1%dmso替代;undifferentiated组不添加诱导试剂作为空白对照。实验独立重复三次。
图2.3t3‐l1前脂肪细胞诱导分化6天,实验组添加不同浓度的paqg,对照组不加化合物,用0.1%dmso替代。(a)分化相关转录因子(pparγ,c/ebpβ和c/ebpα)以及蛋白fabp4的电泳结果;(b)培养基中的脂联素释放水平。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
同时,本发明收集以上实验的蛋白样品,用琼脂糖凝胶电泳法检测,发现分化相关转录因子及蛋白(pparγ,c/ebpβ,c/ebpα和fabp4)的表达显著下降(图2a),并且,用脂联素试剂盒检测到培养基中脂联素的释放也降低如图2b所示。以上三个方面的结果均证明paqg显著抑制3t3‐l1前脂肪细胞分化。
2、paqg抑制成熟脂肪细胞中的脂肪累积
3t3‐l1前脂肪细胞正常分化结束后,分别用10μm和20μmpaqg处理48小时,对照组为0.1%dmso(如图3a上)。在显微镜下观察结果如图3a所示,与对照组细胞相比,实验组细胞中的脂含量显著降低。同时,我们用无水乙醇溶解并收集细胞中的脂,并检测其中甘油三酯(tg)的含量。如图3b所示,与镜检结果一致,paqg处理后胞内tg含量显著降低,呈浓度梯度依赖性。而不做给药处理的细胞,正常分化后,胞内的tg是不断累积的(图3b)。paqg导致脂肪细胞中tg减少,可能由于它促进了脂肪细胞中的tg水解,生成游离脂肪酸(ffa)和甘油(glycerol),释放到培养基。因此,我们用试剂盒检测了培养基中ffa和glycerol的含量,如图3d和3e所示,培养基中的ffa和glycerol含量都显著增加(与正常对照组相比),并且也呈浓度梯度依赖性。
为了动态检测paqg处理过程中,脂肪细胞中的脂肪含量变化。我们在paqg处理的48小时内,检测不同时间点培养基中的甘油含量(图3f),并以此绘制了甘油释放的时间曲线。结果显示,在对照组和实验组中,甘油的含量都是随着时间延长而逐渐增加,但是化合物处理后,甘油的含量明显高于对照组,并且呈浓度梯度依赖性。该结果提示,paqg的降脂作用与促进脂肪细胞中tg降解有关。
图3.分化完成的脂肪细胞,用不同浓度paqg处理48小时,0.1%dmso作对照。(a),上图,给药方法;下图,给药48小时后,脂肪细胞中脂滴含量;(b),正常情况下,3t3‐l1脂肪细胞中的甘油三酯的时间‐浓度曲线;(c),给药处理后,3t3‐l1脂肪细胞中甘油三酯的时间‐浓度曲线;(d),给药处理后,3t3‐l1脂肪细胞中的游离脂肪酸的时间‐浓度曲线;(e),给药处理后,3t3‐l1脂肪细胞中的甘油的时间‐浓度曲线;(f),3t3‐l1脂肪细胞中甘油释放的时间‐浓度曲线。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
3、paqg在3t3‐l1细胞中激活ampk信号通路
当观察到paqg抑制3t3‐l1前脂肪细胞分化现象的时候,我们收集该蛋白样品,并用琼脂糖凝胶电泳法检测ampk和p‐ampk的蛋白表达。如图4a和4b所示,ampk的磷酸化水平随着paqg的浓度变化呈现梯度性增加。为了进一步探究3t3‐l1前脂肪细胞分化过程中ampk磷酸化的变化情况,我们进行了如下实验。即从刚开始诱导分化时给药,对照组用0.1%dmso替代,在day1、day3、day4、day6这几个不同时间点收蛋白,检测ampk和p‐ampk的表达。结果如图4c和4d所示,paqg在3t3‐l1前脂肪细胞分化的整个过程中都能够持续激活ampk的磷酸化。
为了探究paqg抑制3t3-l1细胞脂肪累积的作用机制,我们进行了如下实验:当细胞分化结束后,分别用10μm和20μmpaqg处理细胞,用0.1%dmso作为对照。两天后,一部分收集蛋白样品检测ampk和p-ampk的表达;另一部分收集rna样品检测ampk信号通路下游与脂代谢相关的基因表达。其中,ampk信号通路与脂代谢相关的基因主要包括脂肪酸合成和脂氧化两类。而与脂肪酸合成相关的基因主要有:srebp1c、accα、scd1、fas;与脂氧化相关的基因主要有:pdk4、cpt1a、acox1。实验结果如图5a-d所示,ampk的磷酸化水平随着paqg的浓度变化呈现梯度性增加。此外,基因srebp1c、accα、scd1、fas的表达降低,而pdk4和cpt1a的表达增加,acox1的表达基本不变。由此说明,paqg可能通过激活ampk信号通路,抑制脂肪酸合成并促进脂氧化,从而发挥降脂作用。
图4.a),3t3‐l1前脂肪细胞在含有不同浓度paqg的诱导分化培养基中分化,6天后,用聚丙烯酰胺凝胶电泳法检测的蛋白ampk和p‐ampk的表达;(b),对(a)实验结果的量化;(c),在3t3‐l1前脂肪细胞诱导分化的全过程加入20μmpaqg,对照组添加0.1%的dmso,然后在不同的时间点收集蛋白样品检测ampk和p‐ampk的表达水平;(d),对(c)实验结果的量化(箭头表示化合物paqg开始给药处理)。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
图5.将分化好的3t3‐l1脂肪细胞用不同浓度的paqg孵育48小时(收集蛋白样品和rt‐pcr样品)。(a),p‐ampk和ampk的电泳结果;(b),对(a)蛋白电泳结果的量化;(c),rt‐pcr结果:受ampk调控的与脂肪酸合成相关的基因(srebp1c、accα、scd1、fas)的表达;(d),rt‐pcr结果:受ampk调控的与脂氧化相关的基因(pdk4、cpt1a、acox1)的表达。实验独立重复三次,组间比较使用独立样本t检验,误差线为标准误。与对照组比较,*p<0.05,**p<0.01。
4、paqg的细胞毒性实验
本发明检测了paqg在小鼠3t3‐l1前脂肪细胞中的细胞毒性实验(图6)。结果表明,化合物paqg在0~50μm范围内没有细胞毒性,本实验过程中用到的化合物最大浓度为20μm,此浓度在安全范围内。
图6.在3t3‐l1细胞中,化合物paqg的细胞毒性实验。实验独立重复三次。
实施例2
按实施例1所得化合物paqg,按化合物与赋形剂重量比1:1或1:2的比例加入赋形剂,制粒压片。
实施例3:
按实施例1制得化合物paqg,,按常规胶囊制剂方法制成胶囊。
实施例4:
先按实施例1制得化合物paqg,再按下述方法制成片剂。
片剂:化合物paqg100mg,淀粉适量,玉米浆适量,硬脂酸镁适量。制备方法:将化合物与助剂混合,过筛,在合适的容器中均匀混合,把得到的混合物制粒压片。
实施例5:
胶囊剂:化合物paqg100mg,淀粉适量,硬脂酸镁适量。
制备方法:将化合物paqg与助剂混合,过筛,在合适的容器中均匀混合,把得到的混合物装入硬明胶胶囊。
实施例6:
片剂:实施例1所得化合物paqg10mg,乳糖180mg,淀粉55mg,硬脂酸镁5mg;
制备方法:将化合物paqg、乳糖和淀粉混合,用水均匀湿润,把湿润后的混合物过筛并干燥,再过筛,加入硬脂酸镁,然后将混合物压片,每片重250mg,化合物含量为10mg。
实施例7:
安瓿剂:实施例1所得化合物paqg2mg,氯化钠10mg;
制备方法:将化合物paqg和氯化钠溶解于适量的注射用水中,过滤所得溶液,在无菌条件下装入安瓿瓶中。
实施例8:
胶囊剂:实施例1所得化合物paqg10mg,乳糖187mg,硬脂酸镁3mg;
制备方法:将化合物与助剂混合,过筛,均匀混合,把得到的混合物装入硬明胶胶囊,每个胶囊重200mg,活性成分含量为10mg。
实施例9:
食品的制备:
制备方法:取实施例1所得化合物paqg以1:7的比例添加到果酱中,可以增加食品香味,同时也能发挥保健功效。
实施例10:
食品的制备:
制备方法:取实施例1所得化合物paqg以1:8的比例添加到蜂蜜中,可以增加食品香味,同时也能发挥保健功效。
实施例11:
含有化合物paqg的乳酸菌饮料配方(w%):
按常规制作食品的方法制得本发明的上述饮料。
- 还没有人留言评论。精彩留言会获得点赞!