一种分析物监测与自动给药系统的制作方法
本发明涉及一种用于监测分析物(例如葡萄糖或血酮)以及相应的自动给药系统。更具体地,本发明涉及用于使用电化学传感器监测体内分析物并根据监测结果进行自动给药的系统。
背景技术:
糖尿病是我们在生活中比较常见的疾病。众所周知,糖尿病是一组以高血糖为特征的代谢性疾病,其起因在于胰腺不能产生足够量的胰岛素,从而导致身体代谢葡萄糖的能力降低,并由此导致高血糖(即血浆内存在过量的葡萄糖)。经过长期研究发现,持久性高血糖和/或低胰岛素血症与多种严重症状和危及生命的并发症相关联,诸如脱水、酮酸中毒症、心血管疾病、慢性肾衰竭、视网膜损坏和各种神经损坏。随着生活水平的提高,糖尿病的发生几率也是越来越高。尤其是近年来,我国的糖尿病流行情况呈现出快速上升和年轻化趋势。
但是,目前医学水平还不够发达,也尚未找到根治糖尿病的方法,只能通过检测方法检测糖尿病患者的血糖从而调整降血糖药物的剂量,通过这种方式来缓解患者的症状。
近些年来,血糖的主流监测方法是指尖血糖测试,即通过针头扎刺手指,采集到血液后用试纸反映出人体内的血糖水平。指尖血糖测试虽然简单方便,也为广大糖尿病患者所接受和应用。但是,大多数情况下,糖尿病患者通过指尖血糖测量只能在一个个离散时间点上完成,这种测量方式无法显示出一段时期内患者的血糖水平的变化趋势。因此,即使最积极的频繁血糖测量者,也无法发现那些时而出现的高血糖或低血糖,难以观察血糖波动的具体情况。尤其是在夜间的时候。另外,这种方法也不方便对患者进行血糖数据记录。此外,由于血糖水平监测的一致性在个体之间的变化很大。很多糖尿病患者发现定期测试很不方便,并且经常会忘记测试其血糖水平,或者没有时间进行适当的测试。此外,由于现有的血糖监测方法需要利用针头刺破手指,肯定会导致患者产生疼痛感,从而导致患者内心中对监测进行抵触,以希望避免测试引起的疼痛。
进一步,在这些年来,虽然已经研发了很多装置,用于连续或自动地监测血流或间质液中的分析物,例如葡萄糖。很多这样的装置使用电化学传感器。然而,这些装置大多需要直接植入到病人的血管中或者皮下组织内,不仅难以大规模地再现或廉价地生产,而且这些装置一般较大、笨重,和/或不灵活,并且很多不能在受控的医疗设施(例如医院或医生的办公室)之外有效地利用,这大大地限制了病人的活动自由度。
进一步,在现有的糖尿病治疗方法中,胰岛素注射是最直接的控制糖尿病病情的医学手段。近年来,患者对于自动、便携的胰岛素注射装置的需求是极大的。然而,现有的胰岛素注射装置仍有很多不足:
现有的胰岛素注射装置一般使用普通针头来进行胰岛素的注射,而针头在穿刺皮肤时有明显痛感。同时,如果患者长期佩戴现有的胰岛素注射装置,需要针头长期滞留在皮肤内,则需要时常采取消毒措施,否则会由于汗液等导致伤口感染。另外,由于针头进行胰岛素注射需要刺入真皮层,针头一般较长,长期佩戴也容易导致皮肤留下疤痕。
此外,由于现有等胰岛素注射装置使用普通针头进行胰岛素注射,注射位置集中,容易导致注射位置处产生皮下硬结,给患者带来不舒适感。进一步,由于注射位置集中,容易导致胰岛素吸收较慢,从而导致治疗效果不佳。
技术实现要素:
本发明的任务在于,提供一种分析物监测与自动给药系统,可解决现有技术中分析物监测与自动给药系统存在的使用不方便、对患者产生疼痛感以及生产成本较高、体积较大等问题,并进一步解决现有技术中药物注射装置存在的使用不方便、对患者产生疼痛感以及药物吸收慢、治疗效果不佳等问题。
为了解决上述问题,本发明提供一种分析物监测与自动给药系统,包括:检测单元,检测单元包括至少两个检测部件,每个检测部件均用于检测分析物中的分析对象;处理单元,处理单元对每个检测部件的检测结果进行分析处理,以获得与每个检测部件的检测结果相对应的处理数值;计算单元,计算单元对与每个检测部件相对应的处理数值进行比较计算,以获得即时监测结果,并且,计算单元还用于计算药物的总注射量;和注射单元,注射单元根据计算单元计算得到的药物的总注射量注射药物,并且注射单元包括至少两个注射部件,其中每个注射部件均用于注射药物;以及,控制单元,控制单元控制检测单元、处理单元、计算单元和注射单元。
根据本发明所提供的分析物监测与自动给药系统,能够利用简单的装置精确地监测分析物的(例如葡萄糖、氧、甘油三酯或酮体)浓度。进一步,能够通过至少两个注射部件同时进行药物注射,能够有效地增大药物注射面积,明显改善皮肤硬结,并且有效地增强药物吸收效果,提升治疗效果。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:计算单元根据病人的体重、腰臀比、血液中甘油三酯含量、血糖监测值以及近期血糖变化趋势计算药物的总注射量。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中,每个检测部件为电化学传感器,包括工作电极与参考电极;处理单元将每个检测部件中的工作电极与参考电极之间的电信号进行分析处理,从而对应于每个检测部件获得对应的分析结果;并且,注射单元还包括储药部件、药物分配通路以及注射泵;其中,控制单元根据计算单元计算的药物的总注射量,对注射泵进行控制,以将储药部件中的药物按照所需的量通过药物分配通路传送至注射部件。
较佳地,根据本发明的另一方面所提供的分析物监测与自动给药系统,进一步包括:基片,基片由柔性材料形成;并且,检测单元中的每个工作电极和每个参考电极均形成为一端附接于基片的一侧表面的针状构件,且每个工作电极和每个参考电极的另一端形成为尖端;注射单元中的每个注射部件形成为一端附接于基片的一侧表面的、内部形成有流体通道的针状构件,且每个注射部件的另一端形成为尖端。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:计算单元根据病人的体重、腰臀比、血液中甘油三酯含量、餐前血糖监测值以及三日内血糖变化趋势计算药物的总注射量;并且
计算单元根据以下公式计算药物的总注射量:
其中:
l1:计算单元计算的药物的总注射量(u);
k:注射对象的体重(kg);
y:注射对象的腰臀比;
x:注射对象的血液中甘油三酯(mmol/l)含量,其中:
甘油三酯含量在1.7以下时:x=1;
甘油三酯含量大于1.7且在2.5以下时:x=1.1;
甘油三酯含量大于2.5且在5以下时:x=1.2;
甘油三酯含量大于5且在10以下时:x=1.3;
甘油三酯含量大于2.5且小于5时:x=1.4;
a:注射对象的单日餐前血糖(mmol/l)均值;
a:注射对象的三日内餐前血糖变化趋势,其中:
当注射对象的三日内餐前血糖变化总体在初始测量值的±5%以内时:a=1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量在10%以内时:a=1.1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于10%且在20%以内时:a=1.2;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于20%且在30%以内时:a=1.3;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于30%且在40%以内时:a=1.4;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于40%时:a=1.5;并且
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在10%以内时:a=0.9;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于10%且在20%以内时:a=0.8;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于20%且在30%以内时:a=0.7;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在40%以内时:a=0.6。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:计算单元根据病人的体重、腰臀比、血液中甘油三酯含量、餐前血糖监测值、餐后血糖监测值、以及三日内血糖变化趋势计算药物的总注射量;并且
计算单元根据以下公式计算药物的总注射量:
其中:
l2:计算单元计算的药物的总注射量(u);
k:注射对象的体重(kg);
y:注射对象的腰臀比;
x:注射对象的血液中甘油三酯(mmol/l)含量,其中:
甘油三酯含量在1.7以下时:x=1;
甘油三酯含量大于1.7且在2.5以下时:x=1.1;
甘油三酯含量大于2.5且在5以下时:x=1.2;
甘油三酯含量大于5且在10以下时:x=1.3;
甘油三酯含量大于2.5且小于5时:x=1.4;
a:注射对象的单日餐前血糖(mmol/l)均值;
a:注射对象的三日内餐前血糖变化趋势,其中:
当注射对象的三日内餐前血糖变化总体在初始测量值的±5%以内时:a=1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量在10%以内时:a=1.1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于10%且在20%以内时:a=1.2;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于20%且在30%以内时:a=1.3;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于30%且在40%以内时:a=1.4;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于40%时:a=1.5;并且
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在10%以内时:a=0.9;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于10%且在20%以内时:a=0.8;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于20%且在30%以内时:a=0.7;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在40%以内时:a=0.6;以及
b:注射对象的单日餐后血糖(mmol/l)均值;
b:注射对象的三日内餐后血糖变化趋势,其中:
当注射对象的三日内餐后血糖变化总体在初始测量值的±5%以内时:a=1;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量在10%以内时:a=1.1;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于10%且在20%以内时:a=1.2;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于20%且在30%以内时:a=1.3;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于30%且在40%以内时:a=1.4;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于40%时:a=1.5;并且
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在10%以内时:a=0.9;
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于10%且在20%以内时:a=0.8;
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于20%且在30%以内时:a=0.7;
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在40%以内时:a=0.6;并且
早餐前的药物注射量l21=l2×0.6;
晚餐前的药物注射量l22=l2×0.4。
较佳地,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:每个工作电极的外周表面还设置有电子转移层。
较佳地,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:每个检测部件中的工作电极与参考电极由不同的材料形成。
较佳地,根据本发明的另一方面所提供的分析物监测与自动给药系统,进一步包括:输入单元,使用者可以通过输入单元将个人信息输入分析物监测与自动给药系统,并且计算单元根据使用中输入的个人信息进行计算;设定单元,使用者可以通过设定单元对分析物监测与自动给药系统进行设定;并且,输入单元、设定单元与控制单元电连接。
较佳地,根据本发明的另一方面所提供的分析物监测与自动给药系统,进一步包括:比较单元,比较单元对处理单元获得的与每个检测部件的检测结果相对应的处理数值分别进行一一比较,并将一一比较后获得的监测比较值与预先设定的监测阈值分别进行比较;并且,比较单元将计算单元计算的药物的总注射量与用药阈值进行比较;和提示单元,如果比较单元获得的监测比较值大于监测阈值和/或计算单元计算的药物的总注射量小于用药阈值,提示单元发出提示信号;并且,比较单元和提示单元分别与控制单元电连接。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,进一步包括:显示单元,显示单元用于显示计算单元的计算结果;和储存单元,储存单元对计算单元的计算结果进行储存;并且,显示单元与储存单元分别与控制单元电连接。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,进一步包括:发射单元,发射单元用于发送计算单元的计算结果和/或储存单元中储存的计算结果。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:处理单元、计算单元、显示单元、储存单元、比较单元、输入单元、设定单元、提示单元、发射单元以及控制单元封装于同一壳体中。
为让本发明的上述内容能更明显易懂,下文特举优选实施例,并结合附图,作详细说明如下。
附图说明
下面将结合附图介绍本发明。
图1是显示根据本发明的分析物监测与自动给药系统的框架示意图;
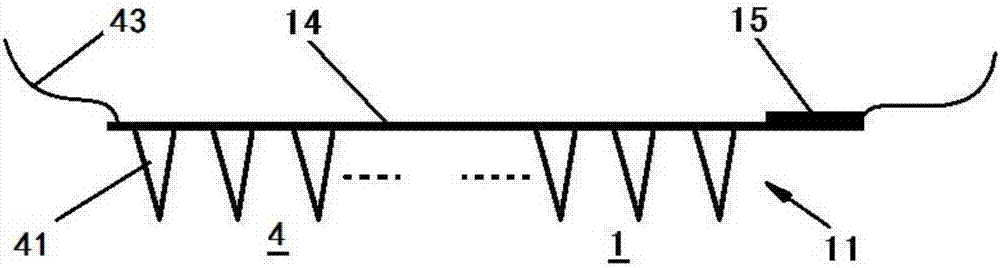
图2a是显示根据本发明的分析物监测与自动给药系统的检测单元1、注射单元4与基片14的侧视结构示意图;
图2b是显示根据本发明的分析物监测与自动给药系统的检测单元1、注射单元4与基片14的立体视结构示意图。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉本领域技术的人士可由本说明书所揭示的内容轻易地了解本发明的其他优点及功效。
如后附说明书附图1至2b所示,根据本发明提供的一种分析物监测与自动给药系统,包括:检测单元1,该检测单元1包括至少两个检测部件11,每个检测部件11均用于检测分析物中的分析对象。更为具体地,根据本发明提供的分析物监测与自动给药系统可以用于测定人体内分析物(例如,体液中的葡萄糖或血酮)的浓度。例如,连续或定期监测病人间质液中的分析物,进而可以用来指示病人血流中的葡萄糖水平。进一步,根据本发明提供的分析物监测与自动给药系统,检测部件11可以是可植入传感器,也可以使用其他的体内分析物传感器,用于插入静脉或包含体液的体内其他部位。典型地,根据本发明所提供的分析物监测与自动给药系统可以被配置成用于监测病人一段时间内的分析物水平(这段时间可以从几天到几周或更长的时间)。进一步,检测单元1还可以包括诸如安培计等电路读取部件,以获取每个检测部件11的信号,获得检测结果。
进一步,该分析物监测与自动给药系统还包括处理单元2,处理单元2对检测单元1中的每个检测部件11的检测结果进行分析处理,以获得与每个检测部件11的检测结果相对应的处理数值。进一步,对于本领域技术人员来说,来自每个检测部件11的检测结果(信号)一般具有至少一个特征,例如,随着分析物的浓度变化的电流、电压或频率的改变。例如,如果检测部件11使用安培计操作,则信号电流随着分析物浓度而变化。在本发明中,处理单元2可以对每个检测部件11的检测结果进行整流并读取,以获得与分析物浓度变化相适应的处理数值。此外,根据本发明的处理单元2也可以包括将检测结果携带的信息部分从一种特征转换成另一种特征的电路。例如,如果检测部件11使用安培计操作,则信号电流随着分析物浓度而变化,这种情况下,处理单元2可以是电流-电压或电流-频率转换器。这种转换的目的可以是提供例如更易传输的、更易被数字电路读取的信号,和/或较少地受噪声影响。
进一步,该分析物监测与自动给药系统还还包括计算单元3,计算单元3对与每个检测部件11相对应的处理数值进行比较计算,以获得计算结果。更为具体地,由于检测单元1包括至少两个检测部件11,而处理单元2会对每个检测部件11的检测结果进行分析处理,从而获得至少两个相对应的处理数值。进一步,根据本发明的计算单元2对至少两个处理数值进行比较计算,例如,对至少两个处理数值进行求平均计算,从而获得精确的计算结果。进一步,根据本发明所提供的分析物监测与自动给药系统中的计算单元3还能够用于计算药物的总注射量,例如,根据该计算单元3计算得到的计算结果,结合使用者提供的个人信息,对所需要注射的药物的总注射量进行计算。
进一步,该分析物监测与自动给药系统还还包括注射单元4,该注射单元4根据计算单元3计算得到的药物的总注射量注射药物,并且注射单元4包括至少两个注射部件41,其中每个注射部件41均用于注射药物。更为具体地,根据本发明提供的分析物监测与自动给药系统中,注射部件11可以是可植入注射器,也可以使用其他的体内注射器,用于插入静脉或包含体液的体内其他部位。
进一步,该分析物监测与自动给药系统还还包括控制单元5,该控制单元5对检测单元1、处理单元2、计算单元3、注射单元4进行控制。更为具体地,该控制单元5能够根据使用者的设定对检测单元1进行控制,和/或根据计算单元3的计算结果对注射单元4进行控制。
如上所述,根据本发明的分析物监测与自动给药系统能够用于监测病人一段时间内的分析物(例如葡萄糖、氧、甘油三酯或酮体)水平,进一步,能够通过控制单元5对注射部件4的至少两个注射部件41进行控制,以使得注射部件41同时进行药物注射,从而能够有效地增大药物注射面积,明显改善皮肤硬结,并且有效地增强药物吸收效果,提升治疗效果。因此,根据本发明的分析物监测与自动给药系统的控制单元5可以包括例如开关电路、时钟电路等控制电路,从而对检测单元1、处理单元2、计算单元3和注射单元4分别进行控制,从而能够利用检测单元1在预定时刻(例如,每隔两小时或更长的时间)对病人的分析物水平进行监测,并在每次检测单元1完成检测后利用处理单元2和计算单元3对检测结果进行分析处理和计算,获得能够精确反应病人分析物水平的计算结果,并根据计算单元3的计算结果,控制注射单元4进行精确注射。
进一步,根据本发明所提供的分析物监测与自动给药系统,检测单元1包括至少两个检测部件11,每个检测部件11均为电化学传感器,并且包括工作电极12与参考电极13。更为具体地,在本发明中,“电化学传感器”是被配置成通过在传感器上的电化学氧化和还原反应来检测样本中的分析物的存在和/或测量其水平的装置。进一步,该电化学传感器包括呈现“成对电极”形式的工作电极12与参考电极13,其中,通过工作电极12的电流与通过参考电极13的电流的电流幅值相等但符号相反。进一步,通过工作电极12与参考电极13这样的配置,分析物可以直接在工作电极12上或者经一个或多个电子转移剂发生分析物的电氧化或电还原反应,并将这些反应转换为与样本中的分析物的量、浓度或水平相关的电信号。
更为具体地,根据本发明所提供的分析物监测与自动给药系统,处理单元2将每个检测部件11中的工作电极12与参考电极13之间的电信号进行分析处理,从而对应于每个检测部件11获得对应的分析结果。例如,当电位施加到工作电极12和参考电极13之间后,将会有电流流动。电流是电氧化或电还原反应的结果,处理单元2可以直接读取电流的大小,从而将该电流的大小作为与每个检测部件11的检测结果相对应的处理数值进而反映分析物的量、浓度或水平高低。或者,该处理单元2也可以是电流-电压或电流-频率转换器,从而将检测部件11获得的电流转换为电压或者频率灯更易传输的、更易被数字电路读取的信号,和/或较少地受噪声影响。
进一步,根据本发明所提供的分析物监测与自动给药系统中:注射单元4还包括储药部件(未图示)、药物分配通路43、以及注射泵(未图示).进一步,控制单元5根据计算单元2的计算结果,对注射泵进行控制,以将储药部件中的药物按照所需的量通过药物分配通路传送至各个注射部件41。在这里需要说的是,虽然本发明附图中没有对储药部件、药物分配通路43和注射泵的结构做出图示,对于本领域技术人员来说,可以根据实际设计和使用需要,任意设置该储药部件、药物分配通路43和注射泵的具体结构,这并不需要任何附加的创造性劳动。
较佳地,根据本发明的另一方面所提供的分析物监测与自动给药系统,进一步包括:基片,基片由柔性材料形成;并且,检测单元中的每个工作电极和每个参考电极均形成为一端附接于基片的一侧表面的针状构件,且每个工作电极和每个参考电极的另一端形成为尖端;注射单元中的每个注射部件形成为一端附接于基片的一侧表面的、内部形成有流体通道的针状构件,且每个注射部件的另一端形成为尖端。
更进一步,根据本发明的较佳实施例所提供的分析物监测与自动给药系统,进一步包括:基片14,该基片14可以由柔性材料形成。更具体地,检测单元1中的每个检测部件11均设置于基片14的一侧表面。更为具体地,检测单元1中的每个工作电极12和每个参考电极13均形成为一端附接于基片14的一侧表面的针状构件;并且,每个工作电极12和每个参考电极13的另一端形成为尖端。此外,在本发明中,注射单元4中的每个注射部件41也形成为一端附接于基片14的该一侧表面的、内部形成有流体通道的针状构件。并且,每个注射部件41的另一端形成为尖端,当注射部件41插入病人皮肤时,药物通过药物分配通路43由储药部件流入每个注射部件41内部的流体通道,并通过每个注射部件41的尖端流入病人体内。也就是说,在根据本发明的较佳实施例所提供的分析物监测与自动给药系统中,检测部件11与注射部件41均形成设置于基片14的同一侧表面(即,在使用状态下朝向人体表面的一侧表面),例如,为了便于制造与控制,如后附说明书附图所示,检测部件11均形成于基片14的该一侧表面的一方,而注射部件41形成于基片14的该一侧表面的另一方。例如,后附说明书附图2b所示,检测部件11均形成于基片14的一侧表面的右方,且注射部件41均形成于基片14的一侧表面的左方。
更为具体地,在本发明的较佳实施例中,基片14是柔性的,以减少植入和/或佩带该检测部件11与注射部件41时给病人带来的疼痛和对组织的损伤。柔性的基片14通常增加病人的舒适度并允许病人有更大的活动范围。用于柔性的基片14的适当材料包括例如非导电塑料或聚合物的材料和其他非导电、柔性、可变形的材料。有用的塑料或聚合物材料的实例包括热塑性塑料,诸如聚碳酸酯、聚对苯二甲酸二乙醇酯(pet))、聚氯乙烯(pvc)、聚氨酯、聚醚、聚酰胺、聚酰亚胺,或这些热塑性塑料的共聚物,例如petg(乙二醇修改的聚对苯二甲酸二乙醇酯)。
更进一步,根据实际使用和设计需要,根据本发明的分析物监测与自动给药系统中的基片14也可以是刚性的。采用刚性的基片14可以为检测部件11和注射部件41提供结构支持,以抗弯曲或破裂。更为具体地,可以用作基片14的刚性材料的实例包括导电性差的陶瓷,例如氧化铝和二氧化硅。采用刚性的基片14的另一个优点是,有助于检测部件11和注射部件41在不需要另外插入装置的情况下被插入。
更进一步,如后附说明书附图2a与图2b所示,根据本发明所提供的分析物监测与自动给药系统的基片14还设置有电接头15,该电接头15与外部电源相连,从而为检测部件11中的工作电极12和参考电极13供电,以利用工作电极12和参考电极13对分析物进行电氧化或电还原反应。
在使用根据本发明的较佳实施例的分析物监测与自动给药系统时,使用者将设置于基片14上的检测部件11与注射部件41插入人体表面预定的位置,不仅使得每个检测部件11的工作电极12和参考电极13位于含分析物的液体(例如体液、样本液或载体液)的分析物(例如葡萄糖、氧、甘油三酯或酮体)中,以对分析物进行监测,而且使得每个注射部件41位于静脉或包含体液的部位,以便于将药物注入人体内。更进一步,例如,检测部件11和注射部件41的植入可以在静脉系统中进行,用于直接测试血液中的分析物水平,并且直接将药物注射到血液中。或者,可以将检测部件11植入到间质组织中,用于测定间质液中的分析物水平,间质液中的分析物水平可以关联和/或转换成血液或其他液体中的分析物水平。同时,将注射部件41植入到间质组织中,用于将药物注射到间质液中。在这种情况下,检测部件11与注射部件41的植入的位置和深度可影响检测部件11和注射部件41的具体形状、部件和结构。
更进一步,根据本发明的较佳实施例,设置于基片14上的检测部件11和注射部件41插入病人的间质组织中(0.3mm到5mm之间)。优选地,被插入到间质组织中,0.5mm到3mm,更优选0.5mm到1.5mm。本发明的其他实施方式可包括插入到病人的其他部分,例如静脉或器官的检测部件11和注射部件41。植入的深度根据要植入的目标而变。进一步,可以在基片14的设置有检测部件11的表面上涂覆粘性物质,从而在检测部件11和注射部件41插入病人的表皮后,通过基片14的表面上的粘性物质,将检测部件11和注射部件41固定于病人体内,从而便于病人监测一段时间内的分析物水平并对病人进行药物注射,而不需要每次测量都重新插入检测部件11和注射部件41。
进一步,从皮肤面而测量插入角度(即,垂直于皮肤插入传感器应该为90°的插入角度)。插入角度通常在10°到90°、典型地在15°到60°、更经常在30°到45°的范围内。
具有这样的结构,病人在使用本发明所提供的分析物监测与自动给药系统时,能够极大程度地减少病人的疼痛感。更进一步,可选地,将根据本发明所提供的分析物监测与自动给药系统中的基片14、检测部件11以及注射部件41制成使病人舒适的形状,其可允许隐藏在例如病人的衣服下面。对于病人来说,股部、腿部、上臂、肩膀或腹部是病人身体上的用于放置检测部件11、以保持隐藏的比较方便的部位。然而,检测部件11和注射部件41也可以放置在病人身体的其他部位。
此外,对于本领域技术人员来说,可以根据具体使用和设计需要,对于许多检测部件11和注射部件41来说,刚性的和柔性的基片都可以适当地使用,还可以通过例如改变基片14的成分和/或厚度来连续地改变其柔性。这些都可以由本领域技术人员根据具体使用和设计需要确定。
更为具体地,根据本发明的较佳实施例所提供的分析物监测与自动给药系统,每个检测部件11和注射部件41的尺寸均大大小于普通的注射器针头,从而在利用本发明所提供的检测部件11进行分析物的监测并利用注射部件41进行药物注射时,病人的疼痛感会大大减少,并且由于检测部件11和注射部件41的皮肤刺入深度很小,不会导致伤口感染,也不会由于长期佩戴而留下疤痕。
进一步,根据本发明的另一方面所提供的分析物监测与自动给药系统,其中:计算单元3根据病人的体重、腰臀比、血液中甘油三酯含量、血糖监测值以及近期血糖变化趋势计算药物的总注射量。
更为具体地,根据本发明的一个较佳实施例所提供的分析物监测与自动给药系统,其中:计算单元3根据病人的体重、腰臀比、血液中甘油三酯含量、单日餐前血糖监测均值以及三日内血糖变化趋势计算药物的总注射量。并且:
计算单元3根据以下公式计算药物的总注射量:
其中:
l1:计算单元3计算的病人单日餐前药物总注射量(u);
k:注射对象的体重(kg);
y:注射对象的腰臀比;
x:注射对象的血液中甘油三酯(mmol/l)含量,其中:
甘油三酯含量在1.7以下时:x=1;
甘油三酯含量大于1.7且在2.5以下时:x=1.1;
甘油三酯含量大于2.5且在5以下时:x=1.2;
甘油三酯含量大于5且在10以下时:x=1.3;
甘油三酯含量大于2.5且小于5时:x=1.4;
a:注射对象的单日餐前血糖(mmol/l)均值;
a:注射对象的三日内餐前血糖变化趋势,其中:
当注射对象的三日内餐前血糖变化总体在初始测量值的±5%以内时:a=1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量在10%以内时:a=1.1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于10%且在20%以内时:a=1.2;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于20%且在30%以内时:a=1.3;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于30%且在40%以内时:a=1.4;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于40%时:a=1.5;并且
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在10%以内时:a=0.9;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于10%且在20%以内时:a=0.8;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于20%且在30%以内时:a=0.7;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在40%以内时:a=0.6。
更为具体地,本发明的发明人通过大量多次采样,对20个典型病人的胰岛素注射量进行了验证计算,具体数据表格如下表1所示:
表1
根据以上表格可以看出,根据本发明所提供的计算方法,能够针对每个病人各自不同的身体情况,精确地算出病人餐前的胰岛素注射量,从而做出有个性化的治疗。更为具体地,根据本发明所提供的分析物监测与自动给药系统,依据病人的体重、腰臀比、血液中甘油三酯含量、单日餐前血糖监测均值以及三日内餐前血糖变化趋势,通过计算单元3计算胰岛素的单日餐前注射总量l1,并且由注射单元4在餐前进行注射,从而对每个病人做出有针对性、个性化的治疗。
更进一步,根据本发明的又一较佳实施例所提供的分析物监测与自动给药系统中:计算单元3根据病人的体重、腰臀比、血液中甘油三酯含量、单日餐前血糖监测均值、单日餐后血糖监测均值、以及三日内血糖变化趋势计算药物的总注射量;并且
计算单元根据以下公式计算药物的总注射量:
其中:
l2:计算单元3计算的病人单日药物总注射量(u);
k:注射对象的体重(kg);
y:注射对象的腰臀比;
x:注射对象的血液中甘油三酯(mmol/l)含量,其中:
甘油三酯含量在1.7以下时:x=1;
甘油三酯含量大于1.7且在2.5以下时:x=1.1;
甘油三酯含量大于2.5且在5以下时:x=1.2;
甘油三酯含量大于5且在10以下时:x=1.3;
甘油三酯含量大于2.5且小于5时:x=1.4;
a:注射对象的单日餐前血糖(mmol/l)均值;
a:注射对象的三日内餐前血糖变化趋势,其中:
当注射对象的三日内餐前血糖变化总体在初始测量值的±5%以内时:a=1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量在10%以内时:a=1.1;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于10%且在20%以内时:a=1.2;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于20%且在30%以内时:a=1.3;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于30%且在40%以内时:a=1.4;
当注射对象的三日内餐前血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于40%时:a=1.5;并且
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在10%以内时:a=0.9;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于10%且在20%以内时:a=0.8;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于20%且在30%以内时:a=0.7;
当注射对象的三日内餐前血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在40%以内时:a=0.6;以及
b:注射对象的单日餐后血糖(mmol/l)均值;
b:注射对象的三日内餐后血糖变化趋势,其中:
当注射对象的三日内餐后血糖变化总体在初始测量值的±5%以内时:a=1;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量在10%以内时:a=1.1;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于10%且在20%以内时:a=1.2;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于20%且在30%以内时:a=1.3;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于30%且在40%以内时:a=1.4;
当注射对象的三日内餐后血糖变化总体呈上升趋势,并且血糖最大值与血糖最小值相比上升量大于40%时:a=1.5;并且
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在10%以内时:a=0.9;
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于10%且在20%以内时:a=0.8;
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量大于20%且在30%以内时:a=0.7;
当注射对象的三日内餐后血糖变化总体呈下降趋势,并且血糖最小值与血糖最大值相比下降量在40%以内时:a=0.6;并且
单日餐前的药物注射量l21=l2×0.6;单日餐后的药物注射量l22=l2×0.4。
更为具体地,本发明的发明人对上表1中所列出的20个典型病人的胰岛素注射量进行了验证计算,具体数据表格如下表2所示:
表2
根据以上表格可以看出,根据本发明所提供的胰岛素注射总量计算方法,能够针对每个病人各自不同的身体情况,精确地算出病人的单日药物(胰岛素)注射总量。更进一步,根据该计算得到的病人单日胰岛素注射总量,进一步通过计算得到病人的单日餐前胰岛素注射量l21,以及单日餐后的胰岛素注射量l22。更为具体地,根据本发明所提供的胰岛素注射总量计算方法,针对每日需要注射两次胰岛素的病人,早餐前的药物注射量l21=l2×0.6;早餐前的药物注射量l22=l2×0.4。
更为具体地,根据本发明所提供的分析物监测与自动给药系统,依据病人的体重、腰臀比、血液中甘油三酯含量、单日餐前血糖监测均值、单日餐后血糖监测均值、以及三日内血糖变化趋势,通过计算单元3精确地计算出每个病人的胰岛素的单日注射总量l2,并且由此得到病人的早餐前药物注射量l21和早餐前药物注射量l22,并进一步由注射单元4在早餐前和晚餐前分别进行精确地注射,从而对每个病人做出有针对性、个性化的治疗。
也就是说,根据本发明所提供的分析物监测与自动给药系统,注射单元4可以根据计算单元3的计算结果,针对每个病人自身的特定情况,在早餐前和/或晚餐前进行精确定量的药物注射,从而对每个病人做出有针对性的、个性化的治疗,相比于现有的胰岛素注射装置,能够根据病人自身特点,以精确地数值进行胰岛素注射,从而避免了由于用药量不足或者用药量过多而对病人产生不适的影响。更进一步,由于注射单元4包括至少两个注射部件41,通过该至少两个注射部件41同时进行药物注射,能够有效地增大药物注射面积,明显改善皮肤硬结,并且有效地增强药物吸收效果,提升治疗效果。更进一步,根据本发明的优选实施例,注射单元4包括以阵列形式排列的多个注射部件41,从而能够最为有效地增大药物注射面积,改善皮肤硬结,增强药物吸收效果。进一步,根据本发明的注射部件41可以由二甲基硅氧烷(pdms)或其他类似材料制成,起表面可以涂覆各种防腐蚀层,以起到密封的作用。
更为具体地,根据本发明较佳实施例所提供的分析物监测与自动给药系统,通过检测单元1、处理单元2和计算单元3能够根据实际需要对使用者的身体状况(例如,葡萄糖含量、酮体含量、氧含量等)进行监测,并由计算单元3通过计算得到相应的表示身体状况的计算结果(例如,单日血糖均值,三日内血糖变化趋势等);进一步,计算单元3根据该表示身体状况的计算结果,结合病人其他的一些个人信息(例如,体重、腰臀比和血液中甘油三酯含量等),通过计算得到病人单日餐前胰岛素注射总量和/或病人单日胰岛素注射总量,并进一步通过控制单元5对注射单元4进行控制,以进行精确、定量的胰岛素注射,从而避免了由于用药量不足或者用药量过多而对病人产生不适的影响。此外,根据本发明所提供的分析物监测与自动给药系统,能够通过检测单元1的简单的结构获得精确的有关病人身体状况的监测数值,并且能够通过注射单元4的简单的结构,有效地增大药物注射面积,明显改善皮肤硬结,并且有效地增强药物吸收效果,提升治疗效果。
较佳地,根据本发明的较佳实施例提供的分析物监测与自动给药系统中:每个工作电极12的外周表面还设置有电子转移层。更为具体地,在本发明中,每个工作电极12的外周表面上设置有工作表面,该工作表面是工作电极的外周表面的一部分,其上面涂敷有或可以有电子转移剂,并且该工作表面被配置成暴露于一种含分析物的液体。进一步,在本发明中,“电子转移剂”是可以直接地或与其他电子转移剂配合地在分析物和工作电极12之间携带电子的化合物,其中,电子转移剂的一个实例是氧化还原媒介。
具体来说,一些分析物(例如氧)可以在工作电极12上被直接电氧化或电还原。其他分析物(例如葡萄糖和乳糖)需要至少一种电子转移剂和/或至少一种催化剂的存在,以利于分析物的电氧化或电还原。对于可以直接在工作电极12上电氧化或电还原的分析物(例如氧),还可以使用催化剂。对于需要电子转移剂和/或催化剂的这些分析物,每个工作电极12具有形成在工作电极12的工作表面上或其附近的电子转移剂和/或催化剂。典型地,工作表面仅仅在工作电极12的一小部分上或其附近,常常是靠近工作电极12的尖端形成,并将工作表面置于接触含分析物的液体(例如体液、样本液或载体液)的最佳位置。更为具体地,电子转移剂和/或催化剂可以形成为位于工作表面的固体组合物。这些成分优选地是不会从工作电极12浸出的,更优选地固定在工作电极12上。例如,可以将这些成分固定在工作表面上。可替换地,电子转移剂和/或催化剂可以固定在工作表面内,或者固定在沉积到工作表面上的一个或多个膜或薄膜之间,或者这些成分可以固定在聚合物或溶胶-凝胶基质中。更为具体地,工作电极12的工作表面可以包含用于催化分析物的反应并在工作电极12处产生反应物的催化剂(诸如葡萄糖氧化酶、乳糖氧化酶或漆酶)和/或用于在分析物和工作电极12之间间接或直接(或两者)转移电子的电子转移剂(例如,分别利于葡萄糖、乳糖或氧的电氧化的电子转移剂)。
更进一步,根据本发明的另一个方面提供的分析物监测与自动给药系统,每个检测部件11中的工作电极12与参考电极13由不同的材料形成。更为具体地,在本发明的较佳实施例中,每个检测部件的中的工作电极12和参考电极13使用两种不同类型的导电材料(例如,碳和银/氯化银)形成电极,具有这样的结构,能够更加精确地对分析物进行电氧化或电还原反应,从而获得精确的结果。进一步,在本发明的较佳实施例中,一种类型的导电材料应用到基片14的一侧,从而减少了制造过程中的步骤和/或容易克服过程中对准的限制。例如,如果使用碳基导电材料形成每个检测部件11的工作电极12,并且所有工作电极12位于基片14的一侧;进一步,使用银/氯化银导电材料形成每个检测部件11的参考电极13,所有的参考电极13位于基片14的另一侧。因此,为了制造方便,可以在基片14的相对两侧上分别形成阵列式排布的工作电极12和参考电极13。
更进一步,根据本发明的另一个方面提供的分析物监测与自动给药系统,进一步包括:输入单元6,使用者可以通过输入单元6将个人信息输入分析物监测与自动给药系统。更为具体地,使用者可以通过输入单元6将自己的腰臀比、体重、血液中甘油三酯含量、血糖监测数值等个人信息输入分析物监测与自动给药系统,进而计算单元3根据使用者输入的个人信息、依据本发明所提供的胰岛素注射总量计算方法进行计算,从而获得与个人信息相对应的胰岛素注射总量,并进而通过注射单元4进行注射。或者,使用者通过输入单元6将自己的个人信息(例如,腰臀比、体重、血液中甘油三酯含量)输入,并且结合计算单元3通过计算得到相应的表示身体状况的计算结果(例如,单日血糖均值,三日内血糖变化趋势等),由计算单元3依据本发明所提供的胰岛素注射总量计算方法进行计算,从而获得与个人信息相对应的胰岛素注射总量,并进而通过注射单元4进行注射。
进一步,根据本发明所提供的分析物监测与自动给药系统,进一步包括设定单元7,使用者可以通过该设定单元7对本发明所提供的分析物监测与自动给药系统进行设定。更为具体地,使用者可以通过设定单元7对本发明所提供的分析物监测与自动给药系统进行设定,例如,通过该设定单元7对该分析物监测与自动给药系统的使用条件(例如,对分析物进行监测的时间周期、时间间隔等)进行设定,或者,使用者还可以通过该设定单元7对该分析物监测与自动给药系统的使用状态(例如,病人的用餐时间、开关机时间等)进行设定,并且使用者还可以通过该设定单元7对该分析物监测与自动给药系统的显示方式等进行设定,以便于使用者根据自己的实际需要使用该分析物监测与自动给药系统。进一步,根据本发明提供的分析物监测与自动给药系统,设定单元7与控制单元5电连接,从而使用者通过设定单元7做出的各种对分析物监测与自动给药系统的设定均能够通过控制单元5对其他各个单元进行控制。
更进一步,根据本发明提供的分析物监测与自动给药系统,输入单元6与设定单元7分别与控制单元5电连接,从而通过控制单元5对输入单元6与设定单元7进行控制,同时输入单元6与设定单元7的各种反馈也可以通过控制单元5反馈到其他各个单元。
进一步,根据本发明的优选实施例提供的分析物监测与自动给药系统,进一步包括:比较单元8,该比较单元8对处理单元2获得的与每个检测部件11的检测结果相对应的处理数值分别进行一一比较,并将一一比较后获得的比较值与预先设定的监测阈值分别进行比较,以获得监测比较值。更为具体地,如上所述,在根据本发明的优选实施例所提供的分析物监测与自动给药系统中,处理单元2对每个检测部件11的检测结果进行分析处理,从而获得与每个检测部件11的检测结果相对应的处理数值。也就是说,针对至少两个检测部件11,处理单元2将获得对应地获得至少两个处理数值。进一步,通过本发明所提供的分析物监测与自动给药系统的比较单元8,对处理单元2获得的至少两个处理数值一一进行比较,从而获得至少一个监测比较值,该监测比较值可以是两个处理数值进行比较后的差值或者比值。更进一步,比较单元8对至少一个监测比较值与预先设定的监测阈值再次进行比较,该预先设定的监测阈值可以是制造者预先设定在比较单元8或者控制单元5中的特定阈值,也可以是使用者根据特定使用需要通过设定单元7设定的阈值,这都可以根据实际设计和使用需要确定。更进一步,根据本发明所提供的分析物监测与自动给药系统还包括提示单元9,如果通过比较单元8对至少一个监测比较值与预先设定的监测阈值进行比较,其中有至少一个监测比较值大于预先设定的监测阈值,该提示单元9发出提示信号。更为具体地,该提示单元9可以利用声音和/或光进行提示,该提示单元9可以是发声部件或发光部件,或两者的组合。通过这样的结构,能够很容易地获得分析物监测与自动给药系统,尤其是检测单元1的工作运行情况。更为具体地,如果检测单元1中的某一个检测部件11出现异常,则该检测部件11的检测结果与周围其他检测部件11的检测结果相比出现异常,进而该异常检测部件11的异常检测结果经处理单元2处理后也必然出现异常处理数值,并进一步通过比较单元8与其他检测部件11对应的处理数值进行比较获得的监测比较值将大于预先设定的监测阈值。在这种情况下,提示单元9发出提示,通知使用者该检测单元1中的某一个检测部件11出现工作异常,从而及时停止监测和更换检测部件11或检测单元1。
进一步,根据本发明的较佳实施例所提供的分析物监测与自动给药系统中,比较单元8还能够将计算单元3计算得到的胰岛素注射量(即,如上所述的l1或l2)与预先设定的用药阈值进行比较,并且当计算单元3计算得到的胰岛素注射量(即,胰岛素注射量)小于预先设定的用药阈值时,通过提示单元9向使用者发出提示。更为具体的,例如,根据本发明的较佳实施例,预先设定的用药阈值也可以储存在控制单元5或者比较单元8中,并且该用药阈值可以为5u(对应于计算单元2计算得到的l1)或者10u(对应于计算单元3计算得到的l2),如果计算单元3计算得到的胰岛素注射量小于预先设定的用药阈值(即,计算单元2计算得到的l1小于5u;或者,计算单元2计算得到的l2小于10u),那么提示单元9向使用者发出提示,提示使用者在这种情况下可以选择不注射胰岛素,而通过口服药物或者例如控制饮食等方式进行体内血糖的控制。更为具体地,该提示单元9可以包括通过灯或者声音对使用者做出提示的部件,例如,发声部件或者发光部件。
更进一步,根据本发明提供的分析物监测与自动给药系统,比较单元8和提示单元9分别与控制单元5电连接,从而通过控制单元5对比较单元8和提示单元9进行控制,同时比较单元8和提示单元9的各种反馈也可以通过控制单元5反馈到其他各个单元。
更进一步,对于本领域技术人员来说,提示单元9在不同情况下可以发出不同的提示信号。例如,当监测比较值大于监测阈值时,提示单元9通过发光的方式向使用者做出提示;而当用药比较值小于用药阈值时,提示单元9通过发声的方式向使用者做出提示。又或者,提示单元9在不同情况下可以发出不同颜色的提示光(例如,当监测比较值大于监测阈值时,提示单元9通过发红光的方式向使用者做出提示;而当用药比较值小于用药阈值时,提示单元9通过发其他颜色的光(例如,黄光或者绿光)的方式向使用者做出提示)或者不同效果的提示声音,从而便于使用者区分不同情况。
进一步,根据本发明的优选实施例提供的分析物监测与自动给药系统,进一步包括:显示单元10,该显示单元10用于显示计算单元3的计算结果。更为具体地,如上所述,根据本发明的优选实施例所提供的分析物监测与自动给药系统中,计算单元3对与每个检测部件11相对应的处理数值进行比较计算,从而获得精确的计算结果,而该计算结果正是能够反映病人分析物水平的数值。进一步,通过显示单元10将该计算单元3的计算结果显示出来,从而病人能够通过显示单元8直观、即时看到其分析物水平,从而了解身体状态。进一步,计算单元3还根据病人的个人信息进行计算,以获得针对病人个体的胰岛素注射量。进一步,通过显示单元10将该计算单元3的计算结果显示出来,从而病人能够通过显示单元10直观、即时看到计算单元3的计算结果,从而知道即将注射进入体内的药物总量,了解疾病治疗状态。此外,该显示单元10还可以显示病人通过输入单元6输入的诸如体重、血液中甘油三酯含量、血糖监测数值等个人信息,从而了解自身的身体状况。
进一步,本发明所提供的分析物监测与自动给药系统还包括储存单元11,该储存单元11对计算单元3的计算结果进行储存。更为具体地,该储存单元11可以设置为储存一个时间周期(例如,72小时或者更长时间)内的计算单元3的多个计算结果,从而便于使用者从该储存单元11中对该时间周期内的计算结果进行提取与分析,并进而获得该时间周期内药物的使用情况,以及自身身体的状态变化,并进一步作出各种调整。
更进一步,根据本发明提供的分析物监测与自动给药系统,显示单元10与储存单元11分别与控制单元5电连接,从而通过控制单元5对显示单元10与储存单元11进行控制,同时显示单元10与储存单元11的各种反馈也可以通过控制单元5反馈到其他各个单元。
更进一步,根据本发明的另一个方面提供的分析物监测与自动给药系统,进一步包括:发射单元12,该发射单元12用于发送计算单元3的计算结果和/或储存单元11中储存的计算结果。更为具体地,根据本发明的较佳实施例,发射单元12能够通过有线(例如,数据传输线)或无线(例如,无线网络、蓝牙传输等)的方式向外发送计算单元3的计算结果和/或储存单元11中储存的计算结果。从而使用者能够通过例如有线/无线手持设备获得计算单元3的计算结果和/或储存单元11中储存的计算结果。更进一步,如果使用者的手机中安装了与本发明所提供的分析物监测与自动给药系统适配的应用软件(手机app),可以通过与该发射单元12配对(例如,蓝牙配对、无线网络配对等),从而在手机上很容易地获取计算单元3的计算结果和/或储存单元11中储存的计算结果,随时掌握病人的身体状态。此外,对于医疗机构来说,也可以通过将多个分析物监测与自动给药系统归入同一个无线网络,从而能够对多个病人的身体状态和治疗状况进行实时监测,并能够在病人的身体状态出现异常时即时发出警告。
较佳地,根据本发明所提供的分析物监测与自动给药系统:处理单元2、计算单元3、输入单元6、设定单元7、比较单元8、提示单元9、显示单元10、储存单元11、发射单元12以及控制单元5封装于同一壳体中。更优选地,在本发明的较佳实施例中,注射单元4所包括的储药部件(未图示)以及注射泵(未图示)也可以包括于该同一壳体中,且通过药物分配通路与注射部件41流体连通。进一步,在本发明的较佳实施例中,该壳体至少是防水的,以避免液体流入而与壳体中的元件接触。在一些实施方式中,壳体形成为密封的、防水的或耐水密封,从而液体不能流入到该壳体内部,这在使用者进行诸如淋浴、洗澡或游泳这样的活动时非常有用。此外,壳体的形状可以根据实际设计和使用需要进行任意选择,例如,该壳体可以形成为截面为圆形、椭圆形或其他各种形状,只要适应使用者的身体使用即可。
进一步,在这里需要说的是,本发明的较佳实施例中仅仅介绍了治疗一种疾病(糖尿病)的监测与药物(胰岛素)注射系统。但是,对于本领域技术人员来说,很容易能够想到,本发明所提供的分析物监测与自动给药系统能够用于各种疾病的药物注射,例如,能够用于控制病人高血脂、高血压等药物的注射,这可以根据实际使用需要任意选择,这并不需要任何附加的创造性劳动。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!