用于治疗结肠癌的紫色杆菌素和/或脱氧紫色杆菌素的制作方法
本发明涉及紫色杆菌素和脱氧紫色杆菌素在制备治疗结肠癌的药物中的用途。
背景技术
紫色杆菌素(violacein,vio)是微生物的次级代谢产物,属于吲哚类衍生物,是非水溶性蓝黑色色素,微溶于水,易溶于甲醇、乙醇、丙酮、乙酸乙酯和四氢呋喃等有机溶剂,由两个色氨酸氧化缩合而成,紫色杆菌素早在19世纪就已被发现。
脱氧紫色杆菌素(deoxyviolacein,dvio)是伴随紫色杆菌素产生的一种副产物,但原始菌种中其产量很低。
紫色杆菌素最早在19世纪就被发现,随着近年来研究的深入,发现紫色杆菌素具有重要的生物活性,包括抗氧化、抗菌、抗病毒、抗肿瘤以及免疫调节等;此外,作为一种天然色素,紫色杆菌素还具有良好的着色效果,在纺织、食品和医药等领域具有广阔的应用前景,已引起研究者的广泛关注(hoshinot.violaceinandrelatedtryptophanmetabolitesproducedbychromobacteriumviolaceum:biosyntheticmechanismandpathwayforconstructionofviolaceincore[j].appliedmicrobiologyandbiotechnology,2011,91(6):1463-1475,以及
技术实现要素:
据流行病学资料统计,结肠癌列居全球女性和男性恶性肿瘤发病率的第3位和第4位,其发生率在消化道恶性肿瘤中仅次于胃癌和食管癌,死亡人数约占癌症死亡患者总数的8%(moghimi-dehkordib,safaeea.anoverviewofcolorectalcancersurvivalratesandprognosisinasia[j].worldjournalofgastrointestinaloncology,2012,4(4):71-75),在我国,随着人们膳食结构和生活方式的改变,结肠癌的发生率死亡呈现逐年上升的趋势,且趋于年轻化(王磊,宋顺心,汪建平.结直肠癌实验研究现状及展望[j].中华实验外科杂志,2013,30(3):429-430)。目前,针对结肠癌的主要治疗手段为手术切除,辅以放化疗及生物治疗等,但是由于结肠癌发病早期症状并不明显,临床上多数患者就诊时已处于中晚期,治疗效果通常不理想,辅助治疗产生的副作用大,预后也较差(
有研究者发现,紫色杆菌素可以介导人结肠腺癌细胞caco-2产生活性氧(reactiveoxygenspecies,ros),从而激活caspase-3,引起细胞色素c和ca2+释放,诱导caco-2细胞凋亡;但将细胞模型换为人结肠癌细胞ht29,却并没有发现ros水平的增加,提示紫色杆菌素在不同的细胞模型中存在特异性的机制(decarvalhodd,costaftm,durann,etal.cytotoxicactivityofviolaceininhumancoloncancercells[j].toxicologyinvitro,2006,20(8):1514-1521)。kodach等(kodachll,boscl,
虽然已经对紫色杆菌素和脱氧紫色杆菌素的多种应用进行了研究,但紫色杆菌素和脱氧紫色杆菌素对于结肠癌的抑制作用的研究还不是非常充分,本发明的发明人进行了深入地研究,研究了紫色杆菌素和/或脱氧紫色杆菌素与人结肠癌细胞(ht29细胞)的作用,研究其对ht29细胞的增殖抑制作用,并考察紫色杆菌素和/或脱氧紫色杆菌素对ht29细胞分裂周期以及细胞凋亡早、晚期变化的影响,同时检测与细胞凋亡密切相关的半胱氨酸蛋白酶(caspase)家族成员的表达状况,发现了紫色杆菌素和/或脱氧紫色杆菌素作为一种新型的肿瘤靶向治疗药物的可行性。
本发明涉及以下方面:
[1].紫色杆菌素在制备治疗结肠癌的药物中的用途。
[2].根据[1]所述的用途,其中,所述紫色杆菌素是下述式(i)所示的紫色杆菌素或下述式(ii)所示的脱氧紫色杆菌素:
[3].一种用于治疗结肠癌的药物组合物,其包含紫色杆菌素。
[4].根据[3]所述的药物组合物,其中,所述紫色杆菌素是下述式(i)所示的紫色杆菌素或下述式(ii)所示的脱氧紫色杆菌素:
[5].一种治疗结肠癌的方法,该方法包括向有此需要的哺乳动物或人中给予有效量的紫色杆菌素。
[6].根据[5]所述的方法,其中,所述紫色杆菌素是下述式(i)所示的紫色杆菌素或下述式(ii)所示的脱氧紫色杆菌素:
附图说明
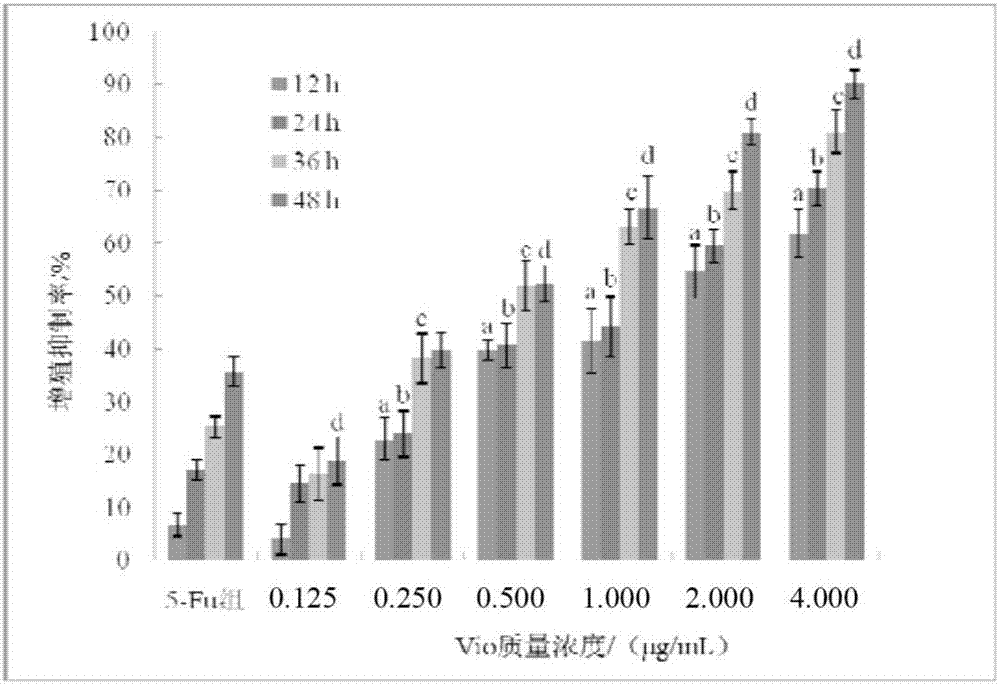
图1实施例2中测定的不同紫色杆菌素浓度与作用时间下ht29细胞增殖抑制率的比较,其中图中的a表示:与5-fu组(12h)相比,差异显著(p<0.05);b表示:与5-fu组(24h)相比,差异显著(p<0.05);c表示:与5-fu组(36h)相比,差异显著(p<0.05);d表示:与5-fu组(48h)相比,差异显著(p<0.05)。
图2实施例3中测定的不同质量浓度的紫色杆菌素对结肠癌ht29细胞周期的影响,其中图中的*表示:与对照组(g1/g0)相比,差异显著(p<0.05);#表示:与对照组(g2/m)相比,差异显著(p<0.05)。
图3实施例4中测定的不同质量浓度的紫色杆菌素对结肠癌ht29细胞凋亡程度的影响的结果。
图4实施例4中测定的不同质量浓度紫色杆菌素对结肠癌ht29细胞凋亡率的影响的结果,其中图中的*表示:与对照组(0.000μg/ml)相比,差异显著(p<0.05)。
图5实施例4中测定的不同质量浓度的脱氧紫色杆菌素对结肠癌ht20细胞凋亡程度的影响的结果,其中a1-a5分别表示阴性对照组、5fu组、0.8μg/ml、3.2μg/ml、12.8μg/ml脱氧紫色杆菌素处理组。
图6实施例5中的紫色杆菌素对ht29细胞内caspase-8蛋白表达水平的影响,其中a、b、c、d分别为0.000、0.125、0.500、2.000μg/ml紫色杆菌素处理组的结果。
图7实施例5中不同紫色杆菌素浓度对ht29细胞的caspase-8蛋白表达水平的影响的数据统计结果。
图8实施例5中的紫色杆菌素对ht29细胞内caspase-9蛋白表达水平的影响,其中,a、b、c、d、e分别为阴性对照组(也称为空白组)、5-fu组,0.125、0.500、2.000μg/ml紫色杆菌素处理组的结果。
图9实施例5中不同紫色杆菌素浓度对ht29细胞的caspase-9蛋白表达水平的影响的数据统计结果。
图10实施例5中的不同紫色杆菌素浓度对ht29细胞内caspase-3蛋白表达水平的影响,其中,a、b、c、d、e分别为阴性对照组(也称为空白组)、5-fu组,0.125、0.500、2.000μg/ml紫色杆菌素处理组的结果。
图11实施例5中不同紫色杆菌素浓度对ht29细胞的caspase-3蛋白表达水平的影响的数据统计结果。
图12实施例5中不同脱氧紫色杆菌素浓度对ht29细胞内caspase-9蛋白表达水平的影响,其中,从左到右分别表示阴性对照组(也称为空白组)、5fu组、0.8μg/ml、3.2μg/ml、12.8μg/ml。
具体实施方式
紫色杆菌素、脱氧紫色杆菌素是微生物的代谢产物,属于吲哚衍生物,由两个色氨酸分子氧化缩合而成,在过去的研究中,研究人员发现了紫色杆菌素和脱氧紫色杆菌素具有广谱的抗菌性、抗原生动物活性以及抗病毒性,但是在以往的研究中没有涉及紫色杆菌素、脱氧紫色杆菌素对于人结肠癌细胞,尤其是对于ht29结肠癌细胞的作用进行深入的研究。
本发明的一个方面涉及紫色杆菌素和/或脱氧紫色杆菌素对于结肠癌细胞的作用。
mtt法是用于检测细胞活力的一种常用方法,由mosmann于1983年首次提出,该方法灵敏度高、操作简便,能有效反映肿瘤细胞的生存状态,进而揭示药物对肿瘤细胞的影响(toshiharufurukawamd,tetsurokubotamd,akihikosutomd,etal.clinicalusefulnessofchemosensitivitytestingusingthemttassay[j].journalofsurgicaloncology,1991,48(3):188-193.)。mtt可被活细胞线粒体呼吸链中的琥珀酸脱氢酶还原,生成水不溶性蓝紫色甲瓒结晶,而死细胞则无此功能(marksdc,belovl,daveymw,etal.themttcellviabilityassayforcytotoxicitytestinginmultidrug-resistanthumanleukemiccells[j].leukemiaresearch,1992,16(12):1165-1173),以二甲基亚砜溶解细胞中的甲瓒,检测其在490nm波长处的od值,即可间接反映活细胞的数量。
本发明的发明人通过mtt法实验发现,紫色杆菌素可降低ht29细胞活力,并呈时间和浓度依赖性。利用不同浓度的紫色杆菌素处理结肠癌ht29细胞12~48h后的结果显示均可抑制该结肠癌细胞的增殖,并且随着处理时间的延长,紫色杆菌素对ht29细胞增殖的抑制作用愈加明显。随着紫色杆菌素浓度增大,ht29细胞生长受抑制的程度也逐渐增强。当紫色杆菌素浓度在0.25μg/ml及以上时,其对ht29细胞的生长抑制作用均强于5μg/ml的5-fu(经典化疗药物),除了0.25μg/ml紫色杆菌素的48h处理组之外,其他组别与5-fu处理组相比均具有统计学差异(p<0.05);以4μg/ml的紫色杆菌素作用于ht29细胞48h后,其生长抑制率可达到90%以上。可见紫色杆菌素具有良好的体外抑制肿瘤细胞增殖效果,且ht29细胞对其表现出了更强的敏感性,效果优于经典化疗药物5-fu。脱氧紫色杆菌素对ht29细胞有明显的抑制作用,随着药物浓度的增加,脱氧紫色杆菌素对ht29细胞的抑制作用上升。脱氧紫色杆菌素浓度为3.2μg/ml时,对ht29细胞的抑制率达到25.998%,随着浓度的增加,抑制率不再上升。浓度为12.8μg/ml的脱氧紫色杆菌素作用ht29细胞48h后,抑制率高达56.293%。可以看出,在对于ht29细胞的增殖抑制方面,紫色杆菌素的效果更为明显,紫色杆菌素在较低的浓度即可以实现非常高的细胞增殖抑制作用。
细胞由一次有丝分裂结束到下一次有丝分裂结束,由一个细胞分裂为两个子细胞,都要经历周而复始地相同变化阶段(g1→s→g2→m),细胞的这种生长、分裂循环即细胞周期(刘溪.吴茱萸碱诱导人肝癌细胞hepg2细胞周期阻滞机制研究[d].哈尔滨:哈尔滨商业大学,2012,以及张丽.苦豆碱抑制结肠癌细胞ht29增殖诱导细胞周期阻滞的作用及机制研究[d].广州:南方医科大学,2014)。一个细胞周期包括有丝分裂期(m)和准备阶段的分裂间期(g1、s、g2)。g1期,细胞为遗传物质dna的合成做准备,各种与dna复制有关的酶明显增多;dna和组蛋白的合成在s期完成;g2期主要完成蛋白质的合成,为细胞进入有丝分裂期做准备。m期为有丝分裂期,将已合成的染色体及细胞其他成分平均分配到两个新的子细胞中。此外,g1期的细胞也可能处于一种静息状态,即细胞既不生长也不分化,称之为g0期。期间的每一阶段都是下一阶段的准备期,真核细胞可以在启动下一个周期前监测与一个细胞周期顺利完成相关的生化事件,具有各种体内外因素威胁下游事件进行时,可逆地将细胞周期阻滞在特定的生理阶段的能力,而这种特定的生理阶段称为检定点。只有前一阶段的生理活动完成后,才能通过称为检定点的阶段,进入周期的下一步,一些突发事件引发的细胞反应会影响驱动细胞周期前进的因子,从而使细胞周期停滞在检定点,这被称为细胞周期阻滞。
本发明的发明人发现采用一定浓度的紫色杆菌素(例如0.5μg/ml和2μg/ml)作用ht29细胞24h后,g0/g1期的ht29细胞所占比例与对照组相比明显增多,而s期的细胞数减少,且g2/m期细胞虽有减少。可见一定浓度条件下的紫色杆菌素可将ht29细胞阻滞在g0/g1期,即扰乱dna复制的准备工作,使ht29细胞不能进入分裂期,从而阻止了结肠癌细胞的无限增殖。脱氧紫色杆菌素同样可以获得类似地效果,即,使ht29细胞阻滞在g0/g1期,使得细胞不能进行dna合成。可以看出,在对于ht29细胞的细胞周期的影响,紫色杆菌素和脱氧紫色杆菌素的作用是类似地,均是使ht29细胞阻滞在g0/g1期,使得细胞不能进行dna合成。但同样地,脱氧紫色杆菌素的作用浓度要高于紫色杆菌素的作用浓度。
细胞凋亡又称ⅰ型程序性细胞死亡,是细胞有机体为调控发育、维护内环境稳定而主动采取的结束细胞生命的过程,是正常死亡过程(elmores.apoptosis:areviewofprogrammedcelldeath[j].toxicologicpathology,2007,35(4):495-516)。所谓程序性细胞死亡是指有机体在漫长的进化过程中发展起来的细胞自杀机制,是细胞主动采取的结束生命的活动,在清除无用的、多余的或癌变的细胞,维持机体内环境稳态方面发挥重要作用(engelberg-kulkah,shaharamitai,kolodkin-gali,etal.bacterialprogrammedcelldeathandmulticellularbehaviorinbacteria[j].plosgenetics,2006,2(10):1518-1526,以及fuchsy,stellerh.programmedcelldeathinanimaldevelopmentanddisease[j].cell,2011,147(4):742-758)。细胞凋亡由基因决定,是一个细胞主动结束生命的过程,当抑制凋亡的致癌基因过度或持续高表达,而促进凋亡的抑癌基因失活时,两者间的平衡被打破,会使机体内癌变的细胞逃脱免疫系统的控制,进而形成肿瘤。因此,通过特定机制重新诱导恢复肿瘤细胞的自主性程序死亡能力成为了当前治疗恶性肿瘤的新兴研究热点。本发明的发明人通过annexinv/pi双染色法检测紫色杆菌素对ht29细胞凋亡的影响,发现当紫色杆菌素质量浓度达到2μg/ml时,早期凋亡以及和中晚期凋亡的ht29细胞数量明显增多,甚至出现了少部分坏死细胞,这提示紫色杆菌素在抑制ht29细胞增殖的同时,还具有诱导ht29细胞凋亡的能力。同样本发明的发明人利用annexinv/pi双染色检测脱氧紫色杆菌素对ht29细胞的凋亡程度影响的结果显示随着脱氧紫色杆菌素浓度增,流式图中早期凋亡细胞(q4)和中晚期凋亡细胞(q2)均明显增多,甚至出现坏死细胞(q1),其趋势与用作阳性对照的5fu组的结果类似。0.8μg/ml的脱氧紫色杆菌素与5μg/ml的5fu对ht29细胞的凋亡促凋亡比例相当。此外紫色杆菌素和/或脱氧紫色杆菌素对于ht29细胞凋亡率的影响也基本相当。
启动细胞凋亡的凋亡方式主要包括死亡受体介导的外源性通路和线粒体介导的内源性通路。外源性凋亡通路是细胞膜表面特定的死亡受体接受胞外的信号刺激而启动的细胞凋亡过程。目前研究的比较清楚的死亡受体主要是fas,其配体即为fasl。fas受到fasl激活后,3个fas受体分子相互交联形成三聚体,同时它们各自的死亡结构域也相互交联成簇,进而募集细胞质中的接头蛋白,接头蛋白进一步与caspase-8前体(pro-caspase-8)结合,形成死亡诱导信号传导复合体。pro-caspase-8没有活性,但形成复合物后,其自身会裂解成为有催化活性的caspase-8,caspase-8可激活下游的caspase-3,从而启动caspase级联反应,诱导细胞凋亡(seabornt,masmoudi-koulio,fourniera,etal.protectiveeffectsofpituitaryadenylatecyclase-activatingpolypeptide(pacap)againstapoptosis[j].currentpharmaceuticaldesign,2011,17(3):204-214)。而在某些细胞中,caspase-8活化水平不高,但其可以将bcl-2家族中的促凋亡蛋白bid剪切成两个片段,即15kd的t-bid和另一13kd的片段,并使t-bid从细胞质中转移到线粒体,影响bcl-2/bax的表达(llambif,greendr.apoptosisandoncogenesis:giveandtakeinthebcl-2family[j].currentopinioningenetics&development,2011,21(1):12-20,以及leberb,gengf,kalej,etal.drugstargetingbcl-2familymembersasanemergingstrategyincancer[j].expertreviewsinmolecularmedicine,2010,12:e28.doi:http://dx.doi.org/10.1017/s1462399410001572,以及farkasr,pozsgaie,bellyeisz,etal.correlationbetweentumor-associatedproteinsandresponsetoneoadjuvanttreatmentinpatientswithadvancedsquamous-cellesophagealcancer[j].anticancerresearch,2011,31(5):1769-1775),从而改变线粒体膜电势,促进细胞色素c释放到细胞质中,激活caspase-9,进而触发下游的caspase-3,激活caspase级联反应,最终诱导细胞凋亡,这就是线粒体介导的内源性通路。由此可以看出,caspase家族蛋白作为细胞凋亡信号的接受者和传导者,在细胞凋亡的外源性通路和内源性通路中起到了至关重要的作用,即可将其作为检测细胞是否启动了凋亡信号通路的关键标志物之一(jesenbergerv,jentschs.deadlyencounter:ubiquitinmeetsapoptosis[j].naturereviewsmolecularcellbiology,2002,3(2):112-121,以及adamsjm.waysofdying:multiplepathwaystoapoptosis[j].genes&development,2003,17(17):2481-95.)。
本发明的发明人通过westernblotting法检测紫色杆菌素对ht29细胞内caspase-8、caspase-9以及蛋白caspase-3的表达水平的影响,发现以上3种蛋白的表达水平随着紫色杆菌素质量浓度的增大呈上升趋势,并且当紫色杆菌素质量浓度达到2μg/ml时,caspase-8、caspase-9相对表达量显著升高,这提示紫色杆菌素作为一种外源性的刺激信号,使得死亡受体和配体依次被激活,进而导致无活性的caspase-8前体转化为具有催化活性的caspase-8,触发caspase级联反应,诱导ht29细胞凋亡。此外还表明紫色杆菌素可通过内源性的线粒体凋亡通路激活caspase-9,启动caspase级联反应,使ht29细胞进入程序性死亡状态。此外发现随着紫色杆菌素质量浓度的增大,caspase-3的表达水平逐渐升高,并呈现质量浓度依赖性。这说明紫色杆菌素可激活外源性或内源性凋亡通路,表现为两条通路的共同下游效应因子caspase-3表达量增加,即紫色杆菌素激发了caspase级联反应,最终诱导ht29细胞凋亡。
此外,本发明的发明人还发现随着脱氧紫色杆菌素浓度的增加,结肠癌ht29细胞中caspase9蛋白的表达升高,当脱氧紫色杆菌素浓度达到12.8μg/ml时,caspase9的蛋白表达与空白对照组相比具有显著性差异(p<0.05)。这一结果表明脱氧紫色杆菌素可通过内源性的线粒体凋亡通路激活caspase-9,启动caspase级联反应,使ht29细胞进入程序性死亡状态。而脱氧紫色杆菌素对于caspase3蛋白的表达没有显著影响。
前人的研究已表明,紫色杆菌素对成纤维细胞系v79有较强的细胞毒性,而这种细胞毒性是通过诱导v79细胞程序性死亡而起作用的(haunm,pereiramf,hoffmannme,etal.bacterialchemistry.vi.biologicalactivitiesandcytotoxicityof1,3-dihydro-2h-indol-2-onederivatives[j].biologicalresearch,1992,25(1):21-25,以及blosserrs,graykm.extractionofviolaceinfromchromobacteriumviolaceumprovidesanewquantitativebioassayforn-acylhomoserinelactoneautoinducers[j].journalofmicrobiologicalmethods,2000,40(1):47-55)。随后亦有研究表明,紫色杆菌素对白血病细胞、淋巴瘤细胞以及由艾滋病毒引起的淋巴瘤都有较强的毒性作用,诱导了细胞凋亡(
含有本发明涉及的紫色杆菌素和/或脱氧紫色杆菌的药物可以单独使用,或以组合物的形式使用。
本发明的还另一个方面涉及治疗结肠癌的药物组合物。该药物组合物可以如下制备:将紫色杆菌素和/或脱氧紫色杆菌素和药学上可接受的载体混合,例如得到口服制剂,诸如片剂(包括糖衣片剂、薄膜包衣片剂、舌下片剂、口腔崩解片剂)、胶囊剂(包括软胶囊剂、微囊剂)、颗粒剂、粉末剂、锭剂、糖浆剂、乳剂、混悬剂、薄膜(例如、口服崩解性的薄膜)等、肠胃外制剂如注射剂(例如皮下注射剂、静脉内注射剂、肌内注射剂、腹腔注射剂、滴注剂)、外用制剂(例如皮肤制剂、软膏剂)、栓剂(例如直肠栓剂、阴道栓剂)、丸剂、滴鼻剂、呼吸制剂(吸入剂)、眼药水等。除此之外,这些制剂可作为控释制剂(例如持续释放微囊剂)、诸如立即释放制剂、持续释放制剂等。这样的制剂可通过本技术领域中常规使用的制备方法获得。
上述药学上可接受的载体的例子包括赋形剂(例如,淀粉,乳糖,蔗糖,碳酸钙,磷酸钙等等),粘合剂(例如,淀粉,阿拉伯胶,羧甲纤维素,羟丙基纤维素,结晶纤维素,海藻酸,凝胶,聚乙烯吡咯烷酮等等),润滑剂(例如,硬脂酸镁,硬脂酸钙,滑石粉等等),崩解剂(例如,羧甲纤维素钙,滑石粉等等),稀释剂(例如,注射用水,盐水等等),添加剂(例如,稳定剂,防腐剂,着色剂,调味剂,溶解助剂,乳化剂,缓冲剂,等渗剂等等),等等。
含有紫色杆菌素和/或脱氧紫色杆菌素的药物或药物组合物可以给药于哺乳动物(例如人、小鼠、大鼠、兔、狗、猫、牛、马、猪、猴)。给药方式可以是口服或肠胃外给药(例如,静脉内、肌内、皮下、器官内、鼻内、皮内、滴注、脑内、直肠、阴道、腹膜内等等)。
在本发明的制剂中,紫色杆菌素和/或脱氧紫色杆菌素的含量根据制剂形式不同而不同,但相对于每个制剂(或药物组合物)的总重量,紫色杆菌素和/或脱氧紫色杆菌素的含量通常占0.01至100重量%,0.1至50重量%或0.5至20%重量。
本发明的紫色杆菌素和/或脱氧紫色杆菌素的给药量根据给药途径、症状、患者年龄等等而不同,临床医生可以实际确定。
本发明中涉及的药物或药物组合物也可以与其他现有已知的治疗结肠癌的药物一起使用,在一起使用时,对于各自药物的给药时间没有限制,可以同时给药两种或多种不同的药物,可以在不同的时间给药各个药物。可以按照临床上使用的给药数量来确定已知药物的剂量,并根据给药患者、给药途径等来适当地选择。
实施例。
1实验中使用的材料和仪器
人结肠癌细胞株ht29,来自上海拜力生物科技公司;噻唑蓝(mtt),来自sigma公司;二甲基亚砜(dmso)、周期检测试剂盒、凋亡试剂盒,来自凯基生物技术股份有限公司;5-氟尿嘧啶(5-fu),来自上海阿拉丁生化科技股份有限公司;胰蛋白酶溶液,来自上海源培生物科技股份有限公司;mccoy’s5a培养基、胎牛血清,来自美国gibco公司;磷酸缓冲液(pbs),来自美国hyclone公司;anti-betaactin(abcam,ab6276)、1mol/ltris-hcl(ph8.0),来自上海碧云天生物技术公司;辣根过氧化酶标记的山羊抗兔lgg(zb-2301),来自北京中杉金桥生物技术有限公司;temed(t8133),来自sigma公司;增强化学发光反应试剂盒(eclkit,170-5060),来自美国bio-rad公司。
centrifude5424r小型台式高速冷冻离心机,来自德国eppendorf公司;tdl-4台式离心机,来自上海安亭科学仪器厂;ix51倒置显微镜,来自日本olympus公司;rt-6000酶标分析仪,来自美国雷杜公司;facscantoⅱ流式细胞仪,来自美国bd(becton,dickinson)公司;电泳仪、电泳槽、水平摇床,来自北京六一厂;旋涡混匀器,来自江苏海门其林贝尔公司;半干转膜仪,来自美国bio-rad公司;imagemastervds凝胶自动成像仪,来自瑞典pharmacia公司。
2细胞培养方法
将ht29细胞复苏后置于含10%胎牛血清的mccoy’s5a培养液、100u/ml青霉素、100u/ml链霉素的培养基中,并于37℃、5%co2细胞培养箱内培养。
实施例1紫色杆菌素和脱氧紫色杆菌素的制备
紫色杆菌素采用发酵菌株为弗氏柠檬酸杆菌(citrobacterfreundii)(该菌株公众可从清华大学获得),该菌株中带有pcom10vio质粒(记载该质粒构件方法的非专利文献是jiang,p.x.,wangh.s.,zhangc.,etal.,reconstructionoftheviolaceinbiosyntheticpathwayfromduganellasp.b2indifferentheterologoushosts.appliedmicrobiologyandbiotechnology,2009,86(4):1077-88),该带有pcom10vio质粒的弗氏柠檬酸杆菌(citrobacterfreundii)构建可以参见张瑞萍,蒋培霞,李春,等.重组柠檬酸杆菌合成紫色杆菌素的工艺条件优化[j].化工学报,2010,61(6):1495-1505中的描述。
将上述带有pcom10vio质粒的弗氏柠檬酸杆菌按5%接种量接种于含200ml发酵培养基(牛肉膏蛋白胨培养基(na,成分为牛肉膏3g、蛋白胨10g,nacl5g,琼脂15-20g,水1000ml,ph7.0-8.0),并在na原始配方基础上添加0.7g/l的l-色氨酸)的1000ml三角瓶中,37℃、200r/min振荡发酵48小时。
脱氧紫色杆菌素采用发酵菌株为escherichiacoli(b8/ptrph1-pdvio-l1)(关于该菌株的构建可参考:fangm,wangt,chongz,etal.intermediate-sensorassistedpush–pullstrategyanditsapplicationinheterologousdeoxyviolaceinproductioninescherichiacoli[j].metabolicengineering,2016,33:41-51.ming-yuefang,chongzhang,songyang,jin-yucui,pei-xiajiang,kailou,masaakiwachiandxin-huixing.highcrudeviolaceinproductionfromglucosebyescherichiacoliengineeredwithinteractivecontroloftryptophanpathwayandviolaceinbiosyntheticpathway.microbialcellfactories14:8),按5%接种量接种于发酵培养基(m9-ye培养基(17.1g/lna2hpo4,3g/lkh2po4,0.5g/lnacl,1g/lnh4cl,1g/l酵母提取物,1mmol/lmgso4和0.1mmol/lcacl2),并向m9-ye培养基中添加10g/l的葡萄糖)的1000ml三角瓶中,37℃、200r/min振荡发酵48h。
将上述两种发酵后得到的发酵液分别在10000r/min的条件下离心30min,得到色素和菌体的混合物,向离心后的沉淀加入去离子水重悬、洗涤、再离心,并且重复上述重悬、洗涤以及离心的步骤3次,以去除可能含有的可溶性杂质。
向离心收集的沉淀中加入30ml色谱级乙醇萃取紫色杆菌素或脱氧紫色杆菌素;于95℃水浴中充分重悬混合,以使色素充分溶解,离心(10000rpm30min)取上清液即为色素粗提物。
将色素粗提物0.22μm过滤器过滤,用制备型液相色谱纯化(色谱条件:色谱柱:ods-sp5μm20×150mm;甲醇(a):水(d)梯度洗脱(0-3min2%a3-30min,2-100%a30-40min,100%a40-50min,100%-2%a50-60min2%a;上样量4ml/次,检测波长570nm)。将分别收集的紫色杆菌素及脱氧紫色杆菌素于60℃干燥至恒重,即得两种色素纯品,并用于下述实验。
在下述实施例中分别采用上述实施例1得到的紫色杆菌素和脱氧紫色杆菌素进行针对ht29细胞的实验。
实施例2紫色杆菌素和/或脱氧紫色杆菌素对ht29细胞增殖抑制的影响
采用的检测指标及方法如下所述。利用mtt法测定ht29细胞的生长抑制率,其中实验按照以下分组进行。
阴性对照组:用mccoy’s5a培养基常规培养ht29细胞;
阳性对照组:含5-氟尿嘧啶(5-fu)质量浓度为5.000μg/ml的mccoy’s5a培养基培养细胞(也称为5fu组);
实验组1(紫色杆菌素组(也称为vio组)):含紫色杆菌素质量浓度为0.125、0.250、0.500、1.000、2.000、4.000μg/ml的mccoy’s5a培养基培养细胞。
实验组2(脱氧紫色杆菌素组(也称为dvio组)):含脱氧紫色杆菌素质量浓度为0.4、0.8、1.6、3.2、6.4、1.28μg/ml的mccoy’s5a培养基培养细胞。
取对数生长期ht29细胞,用mccoy’s5a培养基调整细胞浓度为2×104个/ml,接种于96孔板,每孔接种150μl细胞悬液,细胞培养24h后吸去培养液,按照不同组别处理加入上述不同组别中描述的培养基150μl,以培养12、24、36和48h的时间点作为检测点,每孔加入mtt溶液20μl继续培养4h后吸去孔内培养液,每孔加入二甲基亚砜(dmso)150μl,振荡10min。在酶标仪上读取各孔490nm处od值,根据以下公式计算细胞增殖抑制率。实验所得数据均用均数±标准差(-x±s)表示,各组间均数比较采用单因素方差分析(onewayanova),应用spss16.0统计软件进行分析,以p<0.05为差异有统计学意义。
抑制率/%=(1-od实验/od对照)×100
针对实验组1的结果如图1所示,紫色杆菌素可降低ht29细胞活力,并呈时间和浓度依赖性。不同浓度的紫色杆菌素处理结肠癌ht29细胞12~48h后均可抑制细胞增殖,并且随着处理时间的延长,紫色杆菌素对ht29细胞增殖的抑制作用愈加明显。随着紫色杆菌素浓度增大,ht29细胞生长受抑制的程度也逐渐增强。当紫色杆菌素浓度在0.25μg/ml及以上时,其对ht29细胞的生长抑制作用均强于5μg/ml的5-fu,除了0.25μg/ml紫色杆菌素的48h处理组之外,其他组别与5-fu处理组相比均具有统计学差异(p<0.05);以4μg/ml的紫色杆菌素作用于ht29细胞48h后,其生长抑制率可达到90%以上。以上结果表明,紫色杆菌素具有良好的体外抑制肿瘤细胞增殖效果,且ht29细胞对其表现出了更强的敏感性,效果优于经典化疗药物5-fu。
针对实验组2的结果如下表1和2所示,
表1实验组2中的各dvio浓度下的od值(均值±标准差)
*表示跟阴性对照组有显著性差异(p<0.05)。
表2实验组2中的各dvio浓度下的抑制率(%)
从上述表1和表2的结果可以看出,脱氧紫色杆菌素对ht29细胞有明显的抑制作用,随着药物浓度的增加,脱氧紫色杆菌素对ht29细胞的抑制作用上升。脱氧紫色杆菌素浓度为3.2μg/ml时,对ht29细胞的抑制率达到25.998%,随着浓度的增加,抑制率不再上升。浓度为12.8μg/ml的脱氧紫色杆菌素作用ht29细胞48h后,抑制率高达56.293%。
从上述结果可以看出,紫色杆菌素和脱氧紫色杆菌素均可以有效地抑制ht20细胞的增殖,其中紫色杆菌素的抑制作用更为明显,以4μg/ml的紫色杆菌素作用于ht29细胞48h后,其生长抑制率可达到90%以上。
实施例3紫色杆菌素和/或脱氧紫色杆菌素对ht29细胞周期的影响
利用上述流式细胞仪检测细胞周期,取对数生长期ht29细胞调整细胞浓度为105个/ml,接种于6孔板,每孔接种2ml细胞悬液。细胞培养24h后弃去培养液,加入含紫色杆菌素质量浓度为0.000(阴性对照组)、0.125、0.500、2.000μg/ml的培养基继续培养24h后去培养液,或者加入含脱氧紫色杆菌素质量浓度为0(阴性对照组),0.8、3.2、12.8μg/ml的培养基继续培养48h后去培养液(除此之外,还利用含有5-氟尿嘧啶(5-fu)质量浓度为5.000μg/ml的mccoy’s5a培养基继续培养48h后去培养液,作为阳性对照),上述培养结束后用pbs洗2次,每孔加入0.5ml胰酶(胰酶浓度为0.25重量%)消化后加入培养液终止消化,收集细胞后离心;弃上清加pbs洗涤离心2遍(2000r/min,5min),调整细胞浓度为106个/ml,取1ml单细胞悬液离心;去除上清,在细胞中加入体积分数为70%冷乙醇500μl固定过夜,4℃保存,染色前用pbs洗去固定液;加100μlrnasea混匀细胞37℃水浴30min,用200目筛网过滤一次后加400μlpi染色混匀,4℃避光30min;利用上述流式细胞仪检测,记录激发波长488nm处红色荧光。
在本实施例中,除非有明确指明,培养基均采用mccoy’s5a培养基。实验所得数据均用均数±标准差
紫色杆菌素组的流式细胞仪结果如图2所示,可以看出随着紫色杆菌素浓度的增加,处于g0/g1期的ht29细胞比例增加,而s期和g2/m期的ht29细胞比例减少。与对照组相比,以0.125μg/ml的紫色杆菌素处理ht29细胞后,其细胞周期未发生明显变化,结果无统计学意义(p>0.05)。而以0.5μg/ml和2μg/ml的紫色杆菌素作用ht29细胞24h后,g0/g1期的ht29细胞所占比例与对照组相比明显增多,而s期的细胞数减少,差异具有统计学意义(p<0.05);g2/m期细胞虽有减少,但与对照组相比差异不具有统计学意义(p>0.05)。以上结果说明,紫色杆菌素可使细胞发生g0/g1期阻滞,阻止dna复制,细胞不能进入分裂期,从而抑制ht29细胞的体外增殖。
脱氧紫色杆菌组的流式细胞仪结果如下表3所示。根据下表3的结果显示,脱氧紫色杆菌素使ht29细胞阻滞在g0/g1期,使得细胞不能进行dna合成。显然,随着脱氧紫色杆菌素的浓度从0.8μg/ml增加到12.8μg/ml,处于g1期的细胞的比例显著增加。而经典的化疗药物5fu组的结果则更为明显,利用5-fu处理后的细胞基本都处于g1期和s期。
表3各dvio浓度作用48h后对ht29细胞周期的影响(均值±标准差)
*表示跟阴性对照组有显著性差异(p<0.05)。
实施例4紫色杆菌素和/或脱氧紫色杆菌素对ht29细胞凋亡率的影响
取对数生长期ht29细胞,用mccoy’s5a培养基调整细胞浓度为105个/ml,接种于6孔板,每孔2ml;
培养24h后吸去培养液,以含紫色杆菌素浓度为0.000(阴性对照组)、0.125、0.500、2.000μg/ml的培养基继续培养24h后吸去培养液,或者以含脱氧紫色杆菌素浓度为0(阴性对照组)、0.8、3.2、12.8μg/ml的培养基继续培养48h,然后吸去培养液(除此之外,还利用含有5-氟尿嘧啶(5-fu)质量浓度为5.000μg/ml的mccoy’s5a培养基继续培养24h后去培养液,作为阳性对照),用pbs洗2次,每孔加入0.5ml不含edta的胰酶(浓度为0.25重量%)消化收集细胞后离心;弃上清加pbs洗涤离心2遍(1200r/min,5min),收集2×105个细胞;加入500μl的bindingbuffer悬浮细胞,再加入5μl的annexinv-fitc混匀后室温避光反应10min;加入5μl的pi混匀,室温、避光、反应10min;采用上述流式细胞仪定量检测,计算细胞凋亡率。
实验所得数据均用均数±标准差
通过annexinv/pi双染色检测的紫色杆菌素对ht29细胞的凋亡程度影响的结果如图3所示。可见与阴性对照组相比,0.125μg/ml紫色杆菌素处理组流式图中的细胞分布无明显变化,而随着紫色杆菌素浓度增大至2μg/ml,流式图中早期凋亡细胞(q4)和中晚期凋亡细胞(q2)均明显增多,甚至出现坏死细胞(q1)。同样由图4定量结果可知,与对照组相比,以0.125μg/ml紫色杆菌素干预24h后,ht29细胞凋亡率未发生显著变化,差异不具有统计学意义(p>0.05);而0.5μg/ml和2μg/ml的紫色杆菌素可显著增加ht29细胞的凋亡率(p<0.05)。以上结果表明,紫色杆菌素可以增加早、中晚期凋亡细胞比例,诱导ht29细胞发生程序性死亡。
同样annexinv/pi双染色检测的脱氧紫色杆菌素对ht29细胞的凋亡程度影响的结果如图5所示。随着脱氧紫色杆菌素浓度增,流式图中早期凋亡细胞(q4)和中晚期凋亡细胞(q2)均明显增多,甚至出现坏死细胞(q1),其趋势与用作阳性对照的5fu组的结果类似。将其定量结果总结于下表4中。可见,0.8μg/ml的脱氧紫色杆菌素与5μg/ml的5fu对ht29细胞的凋亡促凋亡比例相当。
表4各浓度脱氧紫色杆菌素下的ht29细胞的凋亡率(均值±标准差)
*表示跟阴性对照组有显著性差异(p<0.05)。
实施例5紫色杆菌素和/或脱氧紫色杆菌素对ht29细胞凋亡蛋白的影响
利用westernblotting法检测caspase家族蛋白的表达水平。细胞收集:取对数生长期ht29细胞调整浓度为105个/ml,接种于6孔板,每孔2ml,培养24h后吸去培养液,加入含紫色杆菌素质量浓度为0.000(阴性对照组)、0.125、0.500、2.000μg/ml的培养基继续培养24h后去培养液,或者以含脱氧紫色杆菌素浓度为0(阴性对照组)、0.8、3.2、12.8μg/ml的培养基继续培养48h后吸去培养液(除此之外,还利用含有5-氟尿嘧啶(5-fu)质量浓度为5.000μg/ml的mccoy’s5a培养基继续培养24h后去培养液,作为阳性对照),然后用预冷pbs洗2次,每孔加入0.5ml胰酶(胰酶浓度为0.25重量%)消化后加入培养液终止消化,收集细胞后离心。弃上清,用1ml预冷的pbs清洗细胞2次,弃上清,于-80℃冻存。
蛋白提取方法:加入200μlripa裂解液,4℃,12000r/min离心10min收集上清,采用考马斯亮蓝测定蛋白浓度,并将各组蛋白浓度调为一致。
sds-page电泳液制备:配制12%分离胶(30.8%聚丙烯酰胺溶液4ml,1.5mol/ltris(ph8.8)2.6ml,ddh2o3.2ml,10%sds100μl,10%aps100μl,temed4μl)和5%浓缩胶(30.8%聚丙烯酰胺溶液0.67ml,0.5mol/ltris(ph6.8)500μl,ddh2o2.7ml,10%sds40μl,10%aps40μl,temed4μl),涡旋混匀后用大号枪头缓慢加入1.5mm玻璃板间隙,胶液面高度适宜。胶面上方中枪头缓慢加入100μl饱和正丁醇,压平液面,减少气泡。静置,待胶凝固后,倒去正丁醇。用ddh2o洗1~2次,末次水不倒掉,防止配浓缩胶期间分离胶干掉。浓缩胶中插入上样齿梳,避免气泡产生。
凝胶过程中配制电泳缓冲液及转膜缓冲液备用。
电泳缓冲液:tris3.02g,甘氨酸14.4g,sds1g,ddh2o加至1000ml。
转膜缓冲液:tris1.93g,甘氨酸14.4g,甲醇200ml,ddh2o加至1000ml。
上样:将蛋白质标本中加入2×loadingbuffer煮沸5~10min,离心后加样。
电泳:浓缩胶80v恒压电泳,分离胶100v恒压电泳至溴酚蓝跑出胶面。
半干转膜仪转膜:用甲醇激活30s,ddh2o洗2min,pvdf膜、滤纸同时浸于转膜缓冲液中,按厚滤饼-滤纸-pvd膜-胶-滤纸-厚滤饼的顺序逐层置于转膜仪上,用滚轮逐层轻柔赶尽气泡,尽量排放整齐,按照0.8~1ma/cm2的功率恒流转膜2~2.5h。
封闭:将pvdf膜放入含5%脱脂奶粉的tbs中封闭2h。
加入5%脱脂奶粉稀释的一抗(1:1000),4℃摇床孵育过夜。次日用tbs洗3次,每次10min。加入hrp-conjugatedgoatanti-rabbit二抗(1:1000稀释),37℃,1h。tbs洗3次,每次10min。
利用增强化学发光反应(eclkit)显色,imagemastervds凝胶成像系统检测杂交信号。
实验所得westernblotting条带,由photoshop软件处理后,在bandscan分析软件中测得各自的总灰度值,进行定量比较分析,并且均采用自身β-actin灰度值校正。实验数据录入excel数据库后,采用excel软件进行作图。
采用上述westernblotting法对ht29细胞内caspase-8蛋白的表达水平进行分析,结果发现,随着紫色杆菌素浓度的增大,caspase-8的表达水平呈上升趋势(图6),紫色杆菌素浓度达到2μg/ml时,caspase-8相对表达量(caspase-8/β-actin)与对照组相比显著升高(p<0.05)(图7)。以上结果说明紫色杆菌素作为一种外源性的刺激信号,使得死亡受体和配体依次被激活,进而导致无活性的caspase-8前体转化为具有催化活性的caspase-8,触发caspase级联反应,诱导ht29细胞凋亡。
经westernblotting对ht29细胞内caspase-9蛋白的表达水平分析,结果发现,随着紫色杆菌素浓度的增大,caspase-9的表达水平升高(图8),紫色杆菌素浓度达到2μg/ml时,caspase-9相对表达量(caspase-9/β-actin)与空白组相比显著升高(p<0.05)(图9)。这一结果表明紫色杆菌素可通过内源性的线粒体凋亡通路激活caspase-9,启动caspase级联反应,使ht29细胞进入程序性死亡状态。
经westernblotting分析ht29细胞内caspase-3蛋白的表达水平,发现随着紫色杆菌素质量浓度的增大,caspase-3的表达水平逐渐升高(图10),并呈现质量浓度依赖性(图11)。这说明紫色杆菌素可激活外源性或内源性凋亡通路,表现为两条通路的共同下游效应因子caspase-3表达量增加,即紫色杆菌素激发了caspase级联反应,最终诱导ht29细胞凋亡。
经westernblotting对ht29细胞内caspase-9蛋白的表达水平分析,随着脱氧紫色杆菌素浓度的增加,结肠癌ht29细胞中caspase9蛋白的表达升高,当脱氧紫色杆菌素浓度达到12.8μg/ml时,caspase9的蛋白表达与空白对照组相比具有显著性差异(p<0.05)。其数据的结果总结在下表5中。而进一步的实验显示,脱氧紫色杆菌素对于caspase3蛋白的表达没有显著影响。
表5各浓度脱氧紫色杆菌素对ht29细胞凋亡蛋白caspase9的影响(均值±标准差)
*表示跟阴性对照组有显著性差异(p<0.05)。
工业实用性
紫色杆菌素和脱氧紫色杆菌素可以有效地用于制备治疗结肠癌的药物。
- 还没有人留言评论。精彩留言会获得点赞!