AMD3100在制备治疗和/或预防恶液质的药物中的应用的制作方法
本发明涉及医药领域,特别是涉及amd3100或其药学上可接受的盐在制备治疗和/或预防肿瘤恶液质的药物中的应用,以及用于治疗和/或预防肿瘤恶液质的药物。
背景技术:
肿瘤恶液质是肿瘤患者常见的一种伴发症状,主要表现为非意愿性的体重下降和厌食。至少有30%癌症患者死于恶液质,而且至少50%癌症患者死亡时伴有恶液质。英国爱丁堡大学临床科学和社区健康学院fearon教授等起草的肿瘤恶液质定义,目前基本达成共识:恶液质是一种多因素综合征,表现为患者正在丢失骨骼肌质量(伴或不伴有脂肪质量丢失),而传统营养支持不能完全逆转,继而引起功能损伤持续恶化。肿瘤恶液质不仅仅使病人生活质量明显降低,而且导致肿瘤治疗耐受性,减弱肿瘤治疗效果。因此,针对肿瘤恶液质的治疗对于治疗肿瘤和提高病人生活质量都有着十分重要的作用。
随着大量研究的开展,关于肿瘤恶液质的发生机制也有了更深入的了解。肿瘤恶液质的病理生理特征为蛋白质和能量呈负性平衡,这一负性平衡由食物摄入减少和异常代谢综合因素造成。尽管目前有许多临床前研究在发生肿瘤恶液质的动物模型中取得不错进展,临床上却仍没有药物被批准应用于肿瘤恶液质的预防和治疗。临床上主要还是通过营养支持和锻炼的手段来延缓肿瘤恶液质的发生。
因此,急需要深入了解肿瘤恶液质的发生机理,在其发生的早期进行靶向干预,以达到更好的治疗效果。
间充质干细胞(mesenchymalstemcells,msc),是最早从骨髓中发现的一种非造血类的干细胞(friedenstein,a.j.,etal,1974),参与构成骨髓造血微环境,对造血干细胞的增殖与分化具有明显支持作用。msc广泛分布于全身各个组织和器官,除骨髓外,还存在于牙龈,骨骼肌、脂肪等组织中,参与组织的损伤修复及稳态维持。msc缺乏特异性标志物,主要表达cd29、cd44、cd73、cd90、cd105和cd166等间质标志物,不表达cd11b、cd14、cd19、cd34、cd45等造血相关标志物。
巢蛋白nestin是一种中间丝蛋白。在胚胎发育时期,nestin最早表达在具有多向分化潜能的神经上皮干细胞中。而在成体组织内,中间丝蛋白nestin仅在未完全分化、保持一定增殖能力的成体干/祖细胞群体中表达。因此,这类nestin+细胞是成体干细胞池重要的组成部分,在维持机体干细胞的稳态中发挥重要作用。近期,mendez-ferrer等人利用nestin-gfp转基因小鼠首次证实了骨髓中存在一群nestin+细胞,并可在体外成克隆生长,具备成骨、成脂、成软骨方向分化特性,提示中间丝蛋白nestin是骨髓间质干细胞(msc)的重要标志。本申请发明人前期利用nestin-gfp转基因小鼠研究显示,从睾丸、肾脏、心脏等组织分选得到的gfp阳性细胞具有自我更新和多向分化潜能,并具备了修复病损组织的能力。这些结果表明nestin+msc对于组织稳态的维持具有十分重要的作用。
综上可见,成体干细胞伴随着不同器官的终生,具有自我更新以及替代或修复损伤组织的功能。msc作为成体干细胞的一员,是维持机体组织内部稳态的重要成分。在肿瘤的发生过程中,肿瘤具有招募nestin+msc进入肿瘤微环境的能力。nestin+msc被肿瘤招募走以后,组织稳态被破坏,引起器官组织功能紊乱,成为诱发肿瘤恶液质的重要因素。
msc表达多种趋化因子和粘附分子受体,在配体存在的条件下,可以介导msc向损伤或炎症部位发生迁移。在肿瘤的发生过程当中,msc被招募进入肿瘤微环境多次被报道。2011年,michaelquante及其同事发现,在胃幽门螺旋杆菌诱导的慢性胃癌小鼠模型中,病变组织会从骨髓中招募nestin+细胞;2014年,dianaklein及其同事发现,小鼠b16f10和llc肿瘤可以招募骨髓以外组织的nestin+细胞参与血管的形成。这些结果提示,肿瘤具备有招募机体以nestin为标志物的msc的能力。但是,肿瘤招募msc的机制尚未完全研究清楚。
amd3100,又叫普乐沙福(plerixafor),化学名为:1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷,其结构式如下所示:
amd3100在1994年首次合成,目前已知其治疗潜能包括hiv感染、炎症性疾病、干细胞动员、白血病和固体肿瘤。至今未发现有关于amd3100在恶液质预防和治疗方面的报道。
技术实现要素:
经本申请发明人长期研究发现,化合物1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷或其药学上可接受的盐可以有效地治疗和/或预防恶液质,尤其为肿瘤恶液质的治疗提供了新的思路,有利于延缓或减轻肿瘤患者的恶液质症状,改善肿瘤治疗效果,提高生活质量,延长生存预期。
本发明提供化合物1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷或其药学上可接受的盐在制备用于治疗和/或预防恶液质的药物中的应用。
本发明的药物可用作哺乳动物(例如人、小鼠、大鼠、兔、狗、猫、牛、马、猪、猴等)中的恶液质的治疗和/或预防。
本发明另一方面还提供一种治疗和/或预防恶液质的方法,所述方法包括向需要治疗和/或预防的受试者施予有效量化合物1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷或其药学上可接受的盐。
本发明所述的受试者可以指任何动物,包括但不限于人、小鼠、大鼠、兔、狗、猫、牛、马、猪、猴等哺乳动物。
本发明的药物可经由任何生理上可接受途径施药,施药途径例如口服、注射等。在本发明提供的实施例中,amd3100的剂型优选为注射剂。
当用于上述治疗和/或预防或其他治疗和/或预防时,本发明化合物的总日用量须由主诊医师在可靠的医学判断范围内作出决定。对于任何具体的患者,具体的治疗有效剂量水平须根据多种因素而定,所述因素包括所治疗的障碍和该障碍的严重程度;所采用的具体化合物的活性;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体化合物的给药时间、给药途径和排泄率;治疗持续时间;及医疗领域公知的类似因素。例如,本领域的做法是,化合物的剂量从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。
本发明所述药物可制成药学上可接受的剂型,一般来说,药物有效成分占治疗给药总质量的1-95%。药物的剂型要适合不同给药方式,例如口服制剂(如片剂、胶囊剂、溶液或混悬液);可注射的制剂(如可注射的溶液或混悬液,或者是可注射的干燥粉末,可在临用前溶解或分散于无菌水或其他无菌可注射介质可立即使用)等。制剂的制备可采用传统工艺。
本发明所述药物还可以含有药学上允许的辅料或载体。可根据需要任选使用药学上可接受的辅料或载体。这些辅料或载体是我们广泛熟知的,包括:口服制剂使用的粘合剂(如淀粉、明胶、甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮),稀释剂(如乳糖、右旋糖、蔗糖、甘露醇、山梨醇、纤维素,和/或甘油),润滑剂(如二氧化硅、滑石、硬脂酸或其盐,通常是硬脂酸镁或硬脂酸钙,和/或聚乙二醇),以及如果需要,还含有崩解剂,如淀粉、琼脂、海藻酸或其盐,通常是藻酸钠,和/或泡腾混合物、助溶剂、稳定剂、悬浮剂、色素、矫味剂等、可注射的制剂使用的防腐剂、加溶剂、稳定剂等;局部制剂用的基质、稀释剂、润滑剂、防腐剂等。
本发明所述“药学上允许”是指该辅料或载体可与药效成分兼容,较佳为能稳定药效成分且对被治疗的个体无害。
本发明所述的恶液质包含在恶性肿瘤、结核、糖尿病、血液疾病、内分泌疾病、感染症、获得性免疫缺陷综合症等的慢性疾病中,以显著的体重减少、食欲不振等为主症状的全身性的综合症。例如癌症恶液质、结核性恶液质、糖尿病性恶液质、血液疾病性恶液质、内分泌疾病性恶液质、感染症性恶液质、由获得性免疫缺陷综合症导致的恶液质。
优选地,所述恶液质为肿瘤恶液质(即由肿瘤所导致的恶液质)。
优选地,所述治疗和/或预防恶液质包括能减轻或改善肿瘤恶液质的症状。
优选地,所述治疗和/或预防恶液质包括能减轻或改善肌肉、脂肪耗损的恶液质病征。
本文使用的治疗和/或预防恶液质,包括减轻或改善患者的恶液质症状,进一步的,所述症状包括但不限于肌肉、脂肪耗损。
本文使用的短语“药学上可接受的盐”是指能保持原有生物活性并且适合于医药用途的某些盐类。化合物1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷能够与不同的无机酸和有机酸生成许多不同的盐。可以制备所述盐的酸为生成无毒性酸加成盐的酸,所述盐包括但不限于柠檬酸盐、马来酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、丁二酸盐、马来酸盐、龙胆酸盐、延胡索酸盐、甲酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐等。
本文使用的术语“治疗”是指减轻或改善病症,即延缓或抑制病症或至少一种临床症状的发展。
本文使用的术语“预防”是指所述病症的症状出现之前向受试者施用本发明化合物。
如本文使用,如果受试者将在生物学上、医学上或生活质量上受益于治疗,则受试者“需要”此类治疗。
本申请发明人提出机体间充质干细胞的缺失是导致肿瘤恶液质发生的原因,并经过长期研究发现,化合物1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷或其药学上可接受的盐可以有效地治疗和/或预防恶液质,为恶液质的治疗提供新的思路。不仅是理论上,而且经由实验结果验证,它们主要通过阻断肿瘤对肌肉、脂肪等全身多种组织的间充质干细胞的招募,从而有利于维持机体组织的稳态,延缓恶液质的发生,而且还有利于减轻或缓解患者的恶液质症状,改善治疗效果,提高生活质量以及延长患者的生存预期。
附图说明
图1中的图a-图d分别是c57bl/6恶液质组小鼠皮下移植llc肿瘤细胞后及对照组:(a)小鼠进食检测;(b)小鼠体重监测;(c)和(d)分别是对脂肪组织和肌肉组织的重量检测。
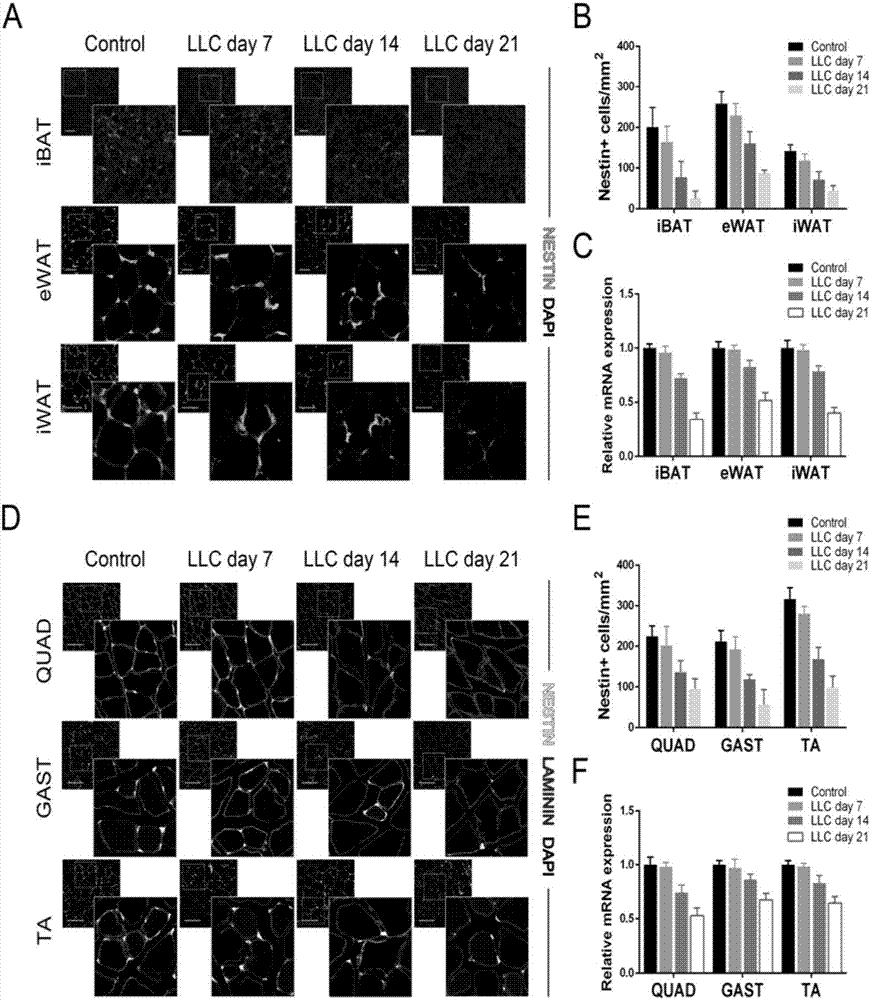
图2中的图a-图d分别是nestin-gfp转基因小鼠对照组和恶液质组:(a)和(b)分别是小鼠脂肪组织切片免疫荧光染色、对切片中nestin-gfp+细胞统计;(c)荧光定量pcr检测脂肪组织中nestin表达;(d)和(e)分别是小鼠肌肉组织切片免疫荧光染色、对切片中nestin-gfp+细胞统计;(f)荧光定量pcr检测肌肉组织中nestin表达。
图3是nestin-gfp转基因小鼠皮下移植llc肿瘤细胞后:(a)小鼠肿瘤组织切片免疫荧光染色,以及对切片中nestin-gfp+细胞统计;(b)荧光定量pcr检测肿瘤组织中gfp表达;(c)和(d)是利用流式细胞术检测外周血中nestin-gfp+细胞。
图4是肿瘤趋化因子表达荧光定量pcr检测结果。
图5是小鼠msc趋化受体表达检测结果。
图6是cxcl12促进小鼠nestin+细胞迁移实验结果。
图7是amd3100体内抑制msc迁移实验结果。
图8是体内使用amd3100后,小鼠肿瘤恶液质症状监测结果。
图9是体内使用amd3100的荷瘤小鼠生存期实验结果。
具体实施方式
下面结合附图对本发明的技术方案做进一步说明。
amd3100从美国apexbio公司购买,药物货号为a2025。
实施例中所用试剂若非特别说明,均为本领域现有常规试剂,均可通过商业渠道购买获得。实施例中未特别说明的实验操作,均为本领域常规操作或是本领域技术人员根据其掌握的现有技术或公知常识所能理解或知晓的。
实施例1路易斯肺癌llc的培养,以及小鼠nestin+细胞的分离和培养
1.1llc细胞培养:利用dmem基础培养基(含10%胎牛血清)培养llc细胞(atcc#crl-1642),备用。
1.2小鼠肌肉nestin+细胞的分离
取成年nestin-gfp转基因雄性小鼠(由drmasahiroyamaguchi提供,也可通过商业渠道获得),在无菌条件下,完整切取双侧腓肠肌,迅速置于盛有pbs的培养皿中。将肌肉块以pbs冲洗3遍,剪成小块肌组织,尽可能剔除血管、神经、结缔组织。采用i型胶原酶消化分离肌细胞:将肌组织转移至离心管,加入i型胶原酶,置于37℃恒温振荡水浴箱消化30分钟。加入血清中止消化,将消化液1,100rpm离心4分钟,吸除上清液,沉淀以pbs重悬,滤过200目滤网。收集滤液,离心4分钟,去除上清,沉淀加入pbs重悬,利用流式细胞仪分选nestin+细胞。
1.3小鼠脂肪nestin+细胞的分离
选取6周左右的雄性nestin-gfp转基因小鼠,在无菌条件下分离小鼠腹股沟处的脂肪组织,pbs充分清洗(至少洗6遍)后,用剪刀将脂肪组织充分剪碎;加入10ml0.1%胶原酶iv+0.05%胰酶+0.1%dispaseⅱ混合液,在37℃搅拌60min;然后加入含10%fbs的α-mem培养基终止消化,用100目及200目筛网过滤,以800g离心5min,弃去上清液,加入培养基轻轻吹打混匀制备细胞悬液;利用流式细胞仪分选nestin+细胞。
1.4小鼠肌肉、脂肪来源nestin+细胞的培养
上述1.2、1.3中从肌肉、脂肪组织获得的nestin+细胞,用dmem/低糖(10%胎牛血清)培养基贴壁培养。
实施例2小鼠饲养及肿瘤恶液质模型的构建
2.1小鼠饲养方法:用常规小鼠饲料(蛋白质含量在20-25wt%,脂肪含量在5%-10wt%,粗纤维含量在3-5wt%)饲养小鼠。
2.2小鼠肿瘤恶液质模型的构建
取8周龄体重相差不超过2g的雄性c57bl/6小鼠(从南京大学模式动物研究所购买)或nestin-gfp转基因小鼠,将小鼠随机分为对照组和恶液质组。每只恶液质组小鼠腹股沟皮下注射约4*10^6个路易斯肺癌llc细胞,实验过程在超净台中进行,注意无菌操作。接种当天计为day0,然后为day1、day2,依次类推。在肿瘤接种第7天检测到荷瘤小鼠体重开始下降,肿瘤恶液质已经开始发生;到第21天,小鼠体重明显下降,恶液质体征明显。
实施例3小鼠肿瘤恶液质的评价
实施例2中恶液质组小鼠接种肿瘤后每天同一时间点观察小鼠毛色和活动情况、体重、摄食量和肿瘤大小,并与对照组对比。接种肿瘤后每隔2天直至21天,或取第7天、第14天、第21天,采用过量麻醉法处死小鼠,去除肿瘤组织,并称量所有动物去瘤体重;分离股四头肌(quad)、腓肠肌(gast)、胫骨前肌(ta)、附睾脂肪组织(ewat)、腹股沟脂肪组织(iwat)、背肩胛间棕色脂肪组织(ibat),分别进行称重。
图1中图a所示为对照组和恶液质组c57bl/6小鼠每天进食检测结果,图b是对照组和恶液质组小鼠的体重监测结果;图c和图d分别是脂肪组织和肌肉组织的重量检测。由图1可知:c57bl/6小鼠皮下移植llc肿瘤细胞后,小鼠发生了肿瘤恶液质。
实施例4小鼠骨骼肌、脂肪组织、肿瘤中nestin-gfp+细胞的检测
4.1免疫荧光染色
对照组和恶液质组的nestin-gfp转基因小鼠分别分离股四头肌(quad)、腓肠肌(gast)、胫骨前肌(ta),用4%pfa固定8h后,换30%浓度(质量)蔗糖脱水48小时,采用冰冻切片。利用laminin抗体标示基底膜后,孵育荧光二抗,利用0.2%1g/mldapi复染细胞核5min,0.01mpbs洗2次,显微镜下观察。
对照组和恶液质组的c57bl/6小鼠分别分离附睾脂肪组织(ewat)、腹股沟脂肪组织(iwat)、背肩胛间棕色脂肪组织(ibat),用4%pfa固定8h后,利用酒精梯度脱水,采用石蜡切片。利用二甲苯、酒精梯度脱蜡后,参考前文中骨骼肌染色方法利用nestin抗体染色,并在显微镜下观察。
恶液质组nestin-gfp转基因小鼠的肿瘤组织的处理同肌肉组织,冰冻切片后,利用0.2%1g/mldapi复染细胞核5min,0.01mpbs洗2次,显微镜下观察。
图2中的图a为nestin-gfp转基因小鼠恶液质组在皮下移植llc肿瘤细胞后7天、14天、21天,以及对照组的小鼠脂肪组织切片免疫荧光染色观察结果;图2中的图b是nestin-gfp转基因小鼠恶液质组在皮下移植llc肿瘤细胞后7天、14天、21天的小鼠脂肪组织切片中nestin-gfp+细胞统计和对照组的nestin-gfp+细胞统计结果。
图2中的图d是nestin-gfp转基因小鼠恶液质组在皮下移植llc肿瘤细胞后7天、14天、21天,以及对照组培养21天的小鼠肌肉组织切片免疫荧光染色观察结果;图2中的图e是nestin-gfp转基因小鼠恶液质组在皮下移植llc肿瘤细胞后7天、14天、21天,以及对照组培养21天的小鼠肌肉组织切片中nestin-gfp+细胞统计结果。
图3中的图a是nestin-gfp转基因小鼠恶液质组在皮下移植llc肿瘤细胞后7天、14天、21天的肿瘤组织切片免疫荧光染色观察结果;图3中的图c和图d是利用流式细胞术检测对照组和恶液质组的小鼠外周血中nestin-gfp+细胞的结果图。
4.2荧光定量pcr
用定量pcr对nestin基因表达进行分析的具体步骤如下:从实施例2每个实验组中小鼠取肌肉(quad、gast、ta)和脂肪(ewat、iwat、ibat)、以及恶液质组中小鼠取肿瘤组织,液氮研磨组织后,使用trizol法提取总rna。对rna进行逆转录,得到单链cdna,然后利用roche公司lc480系统进行荧光定量pcr检测nestin或gfp基因表达状况,所用的nestin引物为5’-ggctacatacaggattctgctgg-3’(f)和5’-caggaaagccaagagaagcct-3’(r),所用的gfp引物为5’-ggagctgcacacaacccattgcc-3’(f)和5’-gatcactctcggcatggacgagc-3’(f)。
检测结果见图2中的图c、f。其中,图2中的图c是nestin-gfp转基因小鼠皮下移植llc肿瘤细胞后荧光定量pcr检测脂肪组织中的nestin表达;图2中的图f是nestin-gfp转基因小鼠皮下移植llc肿瘤细胞后荧光定量pcr检测肌肉组织中的nestin表达。
图3中的图b是nestin-gfp转基因小鼠皮下移植llc肿瘤细胞后荧光定量pcr检测肿瘤组织中gfp表达。
由实施例4的检测结果可见:nestin-gfp转基因小鼠皮下移植llc肿瘤细胞后,骨骼肌和脂肪组织中nestin-gfp+细胞不断减少,肿瘤中nestin-gfp+细胞不断增加。
实施例5肿瘤趋化因子表达检测,与小鼠msc趋化受体表达检测
5.1肿瘤趋化因子表达利用荧光定量pcr检测
利用4.2提到的肿瘤组织处理方法得到单链cdna,然后利用roche公司lc480系统进行荧光定量pcr检测各趋化因子基因表达状况。
荧光定量pcr所用的各引物如下:
(1)小鼠ccl2引物为:
5’-tgtcatgcttctgggcctgct-3’(f);和
5’-ttcactgtcacactggtcact-3’(r);
(2)小鼠ccl3引物为:
5’-ggtctccacactgccctt-3’(f);和
5’-tcaggcattcagttccaggtc-3’(r),
(3)ccl5引物为:
5’-atatggctcggacaccactc-3’(f);和
5’-tccttcgagtgacaaacacg-3’(r),
(4)ccl7引物为:
5’-gtgtccctgggaagctgtta-3’(f);和
5’-ctttggagttggggttttca-3’(r),
(5)ccl8引物为:
5’-cgcagtgcttctttgcctg-3’(f);和
5’-tctggcccagtcagcttctc-3’(r),(6)cxcl1引物为:
5’-gctgggattcacctcaagaa-3’(f);和
5’-aagggagcttcagggtcaag-3’(r),
(7)cxcl2引物为:
5’-gccaagggttgacttcaaga-3’(f);和
5’-ttcagggtcaaggcaaactt-3’(r),
(8)cxcl3引物为:
5’-ttctaaatcagagaaaagcgat-3’(f);和
5’-tagatgcaattatacccgtag-3’(r),
(9)cxcl11引物为:
5’-tgtaatttacccgagtaacggc-3’(f);和
5’-cacctttgtcgtttatgagcctt-3’(r),
(10)cxcl12引物为:
5’-tgcatcagtgacggtaaacca-3’(f);和
5’-ttcttcagccgtgcaacaatc-3’(r),
(11)hgf引物为:
5’-tcttgccagaaagatatccc-3’(f);和
5’-ttttaattgcacaatactccc-3’(r)。
荧光定量pcr结果如图4所示,从图4可见,小鼠肿瘤中高表达趋化因子cxcl12。
5.2小鼠msc趋化受体cxcr4表达检测
将小鼠脂肪和肌肉来源的细胞利用4%pfa固定15min后,利用0.2%triton穿透15min,再利用1%bsa封闭30min。4℃孵育1:100稀释的nestin抗体(小鼠来源)和1:100稀释的cxcr4抗体(兔来源)14h。pbs洗10min,3遍,再37℃孵育绿色小鼠荧光二抗(1:500)和红色兔荧光二抗(1:500)30min。pbs洗10min,3遍,利用0.2%1g/mldapi复染细胞核5min,0.01mpbs洗2次,显微镜下观察。可见,从小鼠肌肉和脂肪组织分离得来的nestin+细胞表达cxcr4。
实施例6cxcl12促进小鼠nestin+细胞迁移实验
将corningtranswell小室(8μm孔径)架在24孔板上,接种体外培养的肌肉和脂肪来源的nestin+细胞(见实施例1)于transwell的小室中,2x104个/孔,置5%co2、37℃培养箱中培养。每孔分别加入500μldmem/低糖到transwell下室,实验组含1μmol/mlcxcl12因子,对照组不添加cxcl12因子。24小时后取出小室,用棉签擦去小室内侧的细胞,轻柔冲洗;无水乙醇固定漂洗两遍;将各组小室做好标记,分别架在废弃的孔板上,每孔中加入结晶紫染色液,室温孵育15分钟;洗去多余染液。在倒置显微镜下检测各组迁移的细胞数量,随机取个5视野(400倍),计算每组迁移细胞镜下数目,每组3个复孔,将所得结果取平均值。结果见图6所示,从图6可见,cxcl12可促进小鼠nestin+细胞的迁移。
实施例7amd3100体内抑制msc迁移实验实施例
取8周龄体重相差不超过2g的雄性c57bl/6小鼠,设对照组(control)、恶液质组(llc)、及amd3100组(llc+amd3100)。
对照组:不处理。
恶液质组:将4x106llc移植至小鼠腹股沟皮下。7天后,使用100μl10%水合氯醛麻醉小鼠,在其背部皮下植入alzet缓释泵(型号:1004),泵内含有生理盐水。
amd3100组:将4x106llc移植至小鼠腹股沟皮下。7天后,使用100μl10%水合氯醛麻醉小鼠,在其背部皮下植入alzet缓释泵(型号:1004),泵内含有amd3100。小鼠amd3100的使用量为0.15mg/kg体重/天。安装缓释泵14天后,处死小鼠,取肌肉和脂肪组织切片进行免疫荧光染色或提取rna逆转录进行荧光定量pcr,检测nestin的表达。
免疫荧光染色结果参见图7中图a、图b。图7中的图a为nestin-gfp转基因小鼠恶液质组、amd3100组在皮下移植llc肿瘤细胞后21天后,以及对照组小鼠培养21天后小鼠脂肪组织切片免疫荧光染色观察结果;图7中的图b是nestin-gfp转基因小鼠恶液质组、amd3100组在皮下移植llc肿瘤细胞后21天后,以及对照组小鼠培养21天后的小鼠脂肪组织切片中nestin-gfp+细胞统计结果。
图7中图c、图d。图7中的图c为nestin-gfp转基因小鼠恶液质组、amd3100组在皮下移植llc肿瘤细胞后21天后,及对照组小鼠培养21天后小鼠肌肉组织切片免疫荧光染色观察结果;图7中的图d是nestin-gfp转基因小鼠恶液质组、amd3100组在皮下移植llc肿瘤细胞后21天后,及对照组小鼠培养21天后的小鼠肌肉组织切片中nestin-gfp+细胞统计结果。
由实验结果可见,体内使用amd3100后,荷瘤小鼠骨骼肌和脂肪组织中nestin-gfp+细胞增加。
实施例8amd3100延长荷瘤小鼠生存期实施例
取8周龄体重相差不超过2g的雄性c57bl/6小鼠。设对照组(control)、恶液质组(llc)、及amd3100组(llc+amd3100)。
对照组:不处理。
恶液质组:将4x106llc移植至小鼠腹股沟皮下。7天后,使用100μl10%水合氯醛麻醉小鼠,在其背部皮下植入alzet缓释泵(型号:1004),泵内含有生理盐水。
amd3100组:将4x106llc移植至小鼠腹股沟皮下7天后,使用100μl10%水合氯醛麻醉小鼠,在其背部皮下植入alzet缓释泵(型号:1004),泵内含有amd3100。小鼠amd3100的使用量为0.15mg/kg体重/天。连续观察小鼠状态至肿瘤细胞接种后35天。
实验结果参见图8、图9。
其中,图8中的图a是各实验组小鼠体重情况,图8中的图b是各实验组小鼠脂肪和肌肉组织发生萎缩情况。图8中的图c是各实验组小鼠的脂肪和肌肉重量情况。由图8的实验结果可见,体内使用amd3100后,小鼠肿瘤恶液质症状得到缓解。
图9是各实验组小鼠生存期对比图,可见,体内使用amd3100,能够延长荷瘤小鼠生存期。
本发明通过上述实验,证实了肿瘤恶液质的发生与间充质干细胞有关,并评估了nestin+间充质干细胞在发生肿瘤恶液质的小鼠肌肉和脂肪组织中的含量。对小鼠肌肉和脂肪进行切片和免疫荧光染色,统计nestin+细胞数量,发现发生肿瘤恶液质小鼠相对正常小鼠具有更少的nestin+细胞。同时,荧光定量pcr也提示,发生肿瘤恶液质小鼠肌肉和脂肪中nestin表达下降。以上结果提示,肿瘤恶液质的发生,伴随着肌肉和组织中间充质干细胞的减少。
本申请发明人利用nestin-gfp转基因小鼠,给小鼠荷瘤后,在肿瘤切片中发现了nestin-gfp+细胞。并且随着肿瘤恶液质的发生,nestin-gfp+细胞的数目会越来越多。以上结果提示,机体nestin+细胞减少,是因为向肿瘤发生了迁移,证明了机体间充质干细胞的减少是因为向肿瘤发生了迁移。
本申请发明人首先利用荧光定量pcr在肿瘤中检测到了cxcl12的高表达,而通过免疫荧光染色,发现从小鼠肌肉和脂肪组织分离得来的nestin+细胞表达cxcr4。在体外,发明人使用cxcl12发现可以促进肌肉和脂肪来源nestin+细胞的transwell迁移。在小鼠体内,利用alzet缓释泵给荷瘤小鼠使用0.15mg/kg体重/天的amd3100,可以成功抑制肌肉和脂肪nestin+细胞向肿瘤的迁移,使肌肉脂肪中nestin+细胞相对不给amd3100组有明显恢复。以上结果证实在肿瘤恶液质的情况下,cxcl12-cxcr4趋化轴介导小鼠肌肉和脂肪来源nestin+细胞的迁移。
本申请发明人通过对小鼠体重以及肌肉、脂肪的重量的称量,发现在荷瘤同等天数,使用amd3100的小鼠比不使用的小鼠恶液质症状更轻。另外,对荷瘤小鼠的生存期观察发现,amd3100的小鼠比不使用的小鼠生存期更长。
以上实验结果显示,amd3100对于肿瘤恶液质的预防和治疗有着明显的疗效,对肿瘤患者使用amd3100,可以阻断肿瘤对肌肉、脂肪、骨髓等全身多种组织的间充质干细胞的招募,有利于维持机体组织的稳态,延缓肿瘤恶液质的发生,并有利于减轻肿瘤患者的恶液质症状,改善肿瘤治疗效果,提高生活质量,延长生存预期。
以上所述,仅是本发明的较佳实施例而已,并非对本发明做任何形式上的限制,故凡未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
序列表
<110>中山大学
<120>amd3100在制备治疗和/或预防恶液质的药物中的应用
<160>26
<210>1
<211>23
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>1
ggctacatacaggattctgctgg23
<210>2
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>2
caggaaagccaagagaagcct21
<210>3
<211>23
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>3
ggagctgcacacaacccattgcc23
<210>4
<211>23
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>4
gatcactctcggcatggacgagc23
<210>5
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>5
tgtcatgcttctgggcctgct21
<210>6
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>6
ttcactgtcacactggtcact21
<210>7
<211>18
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>7
ggtctccacactgccctt18
<210>8
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>8
tcaggcattcagttccaggtc21
<210>9
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>9
atatggctcggacaccactc20
<210>10
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>10
tccttcgagtgacaaacacg20
<210>11
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>11
gtgtccctgggaagctgtta20
<210>12
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>12
ctttggagttggggttttca20
<210>13
<211>19
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>13
cgcagtgcttctttgcctg19
<210>14
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>14
tctggcccagtcagcttctc20
<210>15
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>15
gctgggattcacctcaagaa20
<210>16
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>16
aagggagcttcagggtcaag20
<210>17
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>17
gccaagggttgacttcaaga20
<210>18
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>18
ttcagggtcaaggcaaactt20
<210>19
<211>22
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>19
ttctaaatcagagaaaagcgat22
<210>20
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>20
tagatgcaattatacccgtag21
<210>21
<211>22
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>21
tgtaatttacccgagtaacggc22
<210>22
<211>23
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>22
cacctttgtcgtttatgagcctt23
<210>23
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>23
tgcatcagtgacggtaaacca21
<210>24
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>24
ttcttcagccgtgcaacaatc21
<210>25
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>25
tcttgccagaaagatatccc20
<210>26
<211>21
<212>dna
<213>人工序列
<220>
<221>misc_feature
<400>26
ttttaattgcacaatactccc21
- 还没有人留言评论。精彩留言会获得点赞!